Method Article
Uma maneira não invasiva de isolar e células de fenótipo da Conjuntiva
Neste Artigo
Resumo
A superfície ocular normal exposta consiste em córnea e conjuntiva. As células epiteliais, as células caliciformes e as células imunes estão presentes na conjuntiva. Aqui, uma técnica não invasiva de citologia de impressão é descrita usando um dispositivo de citação de impressão e citometria de fluxo para analisar células imunes na conjuntiva.
Resumo
Tradicionalmente, a citologia de superfície ocular é estudada com técnicas como tecnologia de espátula e tecnologia de escova. O problema com estas técnicas é que eles podem induzir lesões traumáticas na superfície do olho, que podem progredir para cicatrizes, deformidades das pálpebras, deficiência de células estaminais e, em alguns casos, causar grande desconforto ao sujeito. Para evitar esses problemas clínicos, a citologia de impressão (IC) foi desenvolvida para diagnosticar doença ocular seca e posterior neoplasia, doença atópica, ceratoconjuntivite vernal e ceratoconjuntivite sicca. Normalmente, os clínicos cortaram manualmente os papéis de filtro em formas necessárias e aplicam-nas na superfície ocular. Aqui, descrevemos como realizar IC usando um dispositivo médico comercialmente disponível. Esta técnica é explicada aqui seguida pela imunofenotipagem por citometria de fluxo. Esta técnica requer menos manuseio manual e causa menor prejuízo para a superfície ocular.
Introdução
A citologia de impressão (IC) foi realizada pela primeira vez em 1977 por Thatcher et al . 1 . Eles usaram um disco de impressão plástica para coletar células conjuntivais de pacientes em vez de outras técnicas disponíveis naquela época, como raspagem, esfregaço ou pipetagem 1 . A técnica atual de IC usa um papel de filtro absorvente 2 para imprimir a conjuntiva bulbar e palpebral e coletar a camada mais superficial de células conjuntivais. Essas células, tendo alcançado seu estágio final de diferenciação, são continuamente lançadas em lágrimas 3 . Três grandes populações de células são encontradas em espécimes de IC: células epiteliais 4 , células de cálice 3 , 5 e tecido linfóide associado à mucosa, por exemplo, células T efectoras associadas ao epitélio ou células dendríticas 6 . Células de superfície ocular em IC samAs células podem ser analisadas por microscopia, imunocomposição e reação em cadeia da polimerase de transcriptase reversa (RT-PCR) 7 . A citometria de fluxo foi recentemente usada para analisar células imunes coletadas por raspagem da membrana IC 8 . Curiosamente, IC 6 , 9 tem sido usado para avaliar muitas doenças da superfície ocular, incluindo sicca de ceratoconjuntivite, deficiência de vitamina A, penfigóto cicatricial, doença atópica, ceratoconjuntivite limbica superior, ceratoconjuntivite vernal e metaplasia escamosa epitelial. O IC também tem sido utilizado para avaliar o impacto do uso de lentes de contato, a detecção de micróbios de superfície ocular e o teste de eficácia terapêutica e tolerância de intervenções terapêuticas em estudos longitudinais 10 , 11 , 12 .
O dispositivo médico (EyePrim) é suportado por um tipo de poliA membrana de ethersulfona (PES) de 0,2 μm, que foi previamente validada para a técnica de citologia de impressão ocular com citometria de fluxo (fluxo de OSIC) e abre oportunidades para usar amostras longitudinais para monitorar a progressão da doença e a resposta ao tratamento ( por exemplo , a detalhada Análise de leucócitos intraepiteliais definidos como marcadores de doença putativos para fibrose conjuntival progressiva em penfigóide de mucosas) 13 . Os primeiros pesquisadores usaram filtros de PES autoclavados que exigiam impressão manual. Como resultado, o rendimento era variável e dependente do usuário. A vantagem deste dispositivo médico é a facilidade de uso, a pressão padronizada (Pa ou N / m 2 ), e permite a repetibilidade, reprodutibilidade e recuperação celular constante. Esta técnica é útil em uma clínica ambulatorial porque não é cirúrgica, fácil de executar e rápida. Este é um dispositivo médico Classe I (estéril) de acordo com a diretiva 93/42 / CEE, CE 0499 (SNCH). Exige apenasS anestesia tópica durante o procedimento, o que garante a manutenção da integridade da superfície ocular. Após IC, as células podem ser processadas imediatamente para citometria de fluxo. Além disso, é possível que técnicos e enfermeiros que não sejam oftalmologistas sejam treinados para provar a superfície ocular.
Apesar da melhoria do IC sobre outras técnicas, ainda existem vários desafios. Por exemplo, pode haver variação devido à área da amostragem e diferenças regionais na conjuntiva bulbar dependendo da posição do IC. Outra fonte de variação é devido à aplicação de diferentes quantidades de pressão durante IC. Outras questões metodológicas envolvem a padronização do processamento celular: envolvem duração e método de fixação e as condições de armazenamento possível, o que pode afetar a estabilidade do material amostrado.
O objetivo geral desta técnica é desenvolver um método de isolamento das amostras de impressão ocular queT é fácil de usar, não invasivo e pode ser aplicado à caracterização imunológica das amostras clínicas.
Protocolo
Todas as amostras oculares utilizadas neste estudo foram coletadas da Dry Eye Clinic no Singapore National Eye Center, aprovado pelo SingHealth Centralized Institutional Review Board e o Nanyang Technological University Institutional Review Board, em Cingapura.
NOTA: Os indivíduos foram submetidos a testes clínicos para avaliar a extensão da inflamação e a gravidade da disfunção lacrimal antes da IC. Os testes clínicos incluíram o tempo de ruptura de lágrima não-invasivo (NI-TBUT) 14 e a vermelhidão conjuntival (hiperemia) 15 , 16 avaliados com um instrumento de diagnóstico, teste de Schirmer 17 , questionário padrão de avaliação de pacientes com secura (SPEED) 18 e córnea Manchas 19 .
1. Coleta de amostras oculares por IC
- Após a determinação do estado clínico, anestesiarOs olhos do participante aplicando 1 a 2 gotas de anestesia tópica, cloridrato de proparacaina, a conjuntiva bulbar superior e fórnix inferior. Aguarde 4 a 5 minutos para que a sensação de ardência do anestésico se desgaste.
- Coletar amostras de conjuntiva bulbar nasal e temporal com dois dispositivos de citologia de impressão.
NOTA: Um dispositivo é usado para a coleta de duas amostras de impressão. Aqui, foram utilizados dois dispositivos para a coleta de quatro membranas de impressão.- Posicione o dispositivo de citação de impressão tangencialmente na conjuntiva. Pressione o botão suavemente e segure por 2 a 3 s.
NOTA: O dispositivo vem com a membrana. A pressão é liberada automaticamente depois de pressionar o botão. Demora apenas alguns segundos para liberar a pressão e remover o dispositivo.
- Posicione o dispositivo de citação de impressão tangencialmente na conjuntiva. Pressione o botão suavemente e segure por 2 a 3 s.
- Libere a membrana para um tubo de microcentrífuga contendo 1 mL de meio de cultura (meio do Instituto Roswell Park Memorial Institute (RPMI) + 10% de soro bovino fetal(FBS) + 1% de penicilina-estreptomicina (Pen Strep)) por um bisturi.
- Isolar células da membrana do dispositivo por raspagem contínua durante cerca de 1 min com uma ponta de pipeta de 10 μL.
NOTA: A raspagem é completada quando a superfície da membrana se torna desigual. Os números das células de cada membrana são variáveis (100 a 500 células / membrana). Processe as amostras dentro de 2 a 3 horas de coleta.
2. Imunophenotyping Cells por Citometria de Fluxo
- Centrifugue as células a 400 xg durante 5 minutos à temperatura ambiente para remover a mídia. Ressuspender o sedimento celular com 50 μL de tampão de coloração por citometria de fluxo (solução salina tamponada com fosfato (PBS) + 0,05% de albumina de soro bovino (BSA)).
- As células manchadas com um painel de anticorpos ( p . Ex. , Violeta brilhante CD3 (BV) 510 (UCHT1), CD4 aloficocianina-H7 (APC-H7) (SK3), CCR7 ficoeritrina (PE) -A, CD45RO PE-cianina 7 (PE- Cy7) -A e marca de célula viva / morte 7-ADD) à temperatura ambiente durante 20 a 30 minutos noSombrio. Use anticorpos diretamente do estoque de acordo com o protocolo do fabricante.
NOTA: Para a concentração de anticorpos, use 2,5 μL de CD3-BV510, 1,25 μL de CD4-APC-H7, CD45RO-PE-Cy7, 7-AAD e 10 μL de CCR7-PE. Use células mononucleares de sangue periférico (PBMCs) para avaliar as diferentes concentrações de anticorpos. Para a titulação, tome a concentração de anticorpos mencionada no protocolo do fabricante e use metade e um quarto da concentração recomendada. Use a concentração mínima de anticorpos para evitar o derramamento em outros canais de fluoroquromo. Foram observados sinais claros com as mencionadas concentrações de anticorpos. A compensação foi realizada testando PBMC inicialmente de acordo com o protocolo mencionado em Williams et al . 20 Para o teste, as PBMCs foram incubadas com o mesmo conjunto de anticorpos usados aqui e compensados pela comparação de manchas de anticorpos únicos e múltiplos. - Após a incubação periOd, adicione 1 mL de tampão de coloração ao tubo, misture bem e centrifugue a 450 xg durante 5 minutos à temperatura ambiente. Ressuspender células em 200 μL de tampão de coloração.
- Execute amostras em uma máquina de citometria de fluxo.
- Antes de adquirir os dados, calibre as tensões do canal do citometro de fluxo com os conjuntos de configuração e rastreamento (CS & T) do citómetro para normalizar a aquisição de dados em dias diferentes de acordo com as instruções do fabricante.
- Abra o software de coleta de dados de citometria de fluxo, clique no botão "Configurar e QC", escolha o número correto do lote de notas CS & T, carregue as contas e clique no botão "Iniciar".
- Ressuspenda as células com um toque suave no tubo antes de colocar as amostras na máquina. Abra o software de coleta de dados e clique em "Visualizar". Quando a taxa de limiar é estável, clique em "Adquirir". Monitorize o nível da amostra e clique em "Parar" quando as amostras estiverem esgotadas.
NOTA: Adquira 10.000 eventos por amostra. - Depois de adquirir 10.000 eventos, gere um traço de pontos SSC-A e FSC-A na planilha.
- Clique no botão "Polygon Gate" e desenhe um gate (este é P1) em todos os eventos com um valor FSC-A> 5 x 10 4 para excluir detritos. Clique no botão "Criar gráfico de pontos" para gerar um novo gráfico de pontos, clique com o botão direito do mouse no ponto, escolha "Propriedades" para abrir a janela "Plot Editor" e, em seguida, escolha "P1". Clique no FSC-A no eixo x do gráfico de ponto P1, altere-o para CD3-BV510. Desenhe um '' Portão de polígono '' para escolher a população de CD3 + e nomeie-o '' P2 ''.
- Clique no botão "Criar gráfico de pontos" para gerar um novo gráfico de pontos, clique com o botão direito do mouse, selecione "Propriedades" para abrir a janela "Plot Editor". Clique no FSC-A no eixo x do gráfico de pontos P2 e altere-o para 7-AAD. Desenhe um '' Portão de polígono '' para 7-AAD - população e escolha '' P3 ''. P3 aqui é CD3 +Células vivas.
- Clique no botão "Criar gráfico de pontos" para gerar um novo gráfico de pontos, clique com o botão direito do mouse, selecione "Propriedades" para abrir a janela "Plot Editor". Clique no CD3-BV510 no eixo x e CD4-APCH7 no eixo y do gráfico de pontos P3. Desenhe retângulo Gates nos lados superior e inferior do quadrante e escolha '' P4 '' e '' P5 '', respectivamente. P4 é CD3 + CD4 + ao vivo e P5 são células CD4 + CD4 CD ao vivo.
- Clique no botão "Criar gráfico de pontos" para gerar um novo gráfico de pontos, clique com o botão direito do mouse, selecione "Propriedades" para abrir a janela "Plot Editor". Clique no CD45RO PE-Cy7 no eixo dos x e no CCR7-PE no eixo y das parcelas P4 e P5. Desenhe '' Quad Gate '' neste gráfico de pontos.
NOTA: o lado superior esquerdo, o lado superior direito, o lado inferior direito e os quadrantes inferiores do lado esquerdo aqui são ingênuos, memória central (T CM ), eMemória de ffector (T EM ), células T de efetores diferenciadas (T EMRA ), respectivamente.
- Antes de adquirir os dados, calibre as tensões do canal do citometro de fluxo com os conjuntos de configuração e rastreamento (CS & T) do citómetro para normalizar a aquisição de dados em dias diferentes de acordo com as instruções do fabricante.
Resultados
IC por este dispositivo clínico nos permitiu isolar células imunes superficiais oculares, mantendo a superfície ocular intacta. A Figura 1 descreve como o IC foi realizado. Os diferentes locais do olho de onde as amostras foram coletadas são marcados. A Figura 2 mostra o resultado representativo da citometria de fluxo coletada de 10 controles saudáveis. Para o bloqueio, use SSC e 7-AAD para distinguir entre células vivas e células mortas. As células 7-AAD são identificadas como células vivas. Essas células vivas são ainda caracterizadas por marcadores CD3 + e CD4 + . Além disso, as populações CD4 + e CD4 foram ainda mais caracterizadas como Naïve, T EM , T CM e T EMRA com os marcadores CCR7 e CD45RO. Entre as células T CD3 +, as células T de memória efector predominam na superfície ocular humana. No anterior eXperimentos, também foi demonstrado que as células de memória CD8 + são as principais populações nas células T epiteliais conjuntivais entre os indivíduos saudáveis 20 . A Figura 3 mostra que as células T de memória efetora CD4 + e CD8 + (T EM e T EMRA ) são o subconjunto principal na superfície ocular humana em 10 controles saudáveis estudados. Cada população mencionada na figura é notificada com seu marcador fenotípico e nomes (Naïve, T CM , T EM , T EMRA ). Os números em vermelho indicam a porcentagem da população. Os dados nesta figura são representados como média ± SEM
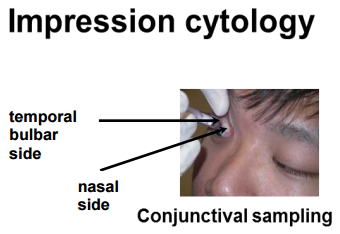
Figura 1: Recolha de amostras de IC da superfície ocular pelo dispositivo de citologia de impressão. As amostras foram coletadas da lâmpada temporalComo é mostrado.
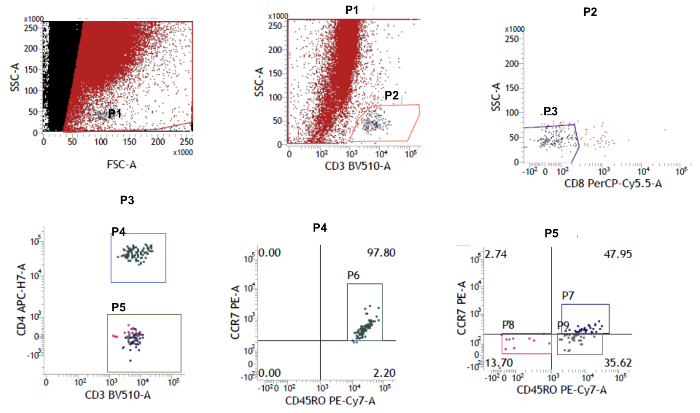
Figura 2: Dot Plot Graph usando Citometria de Fluxo. As células Live 7-AAD foram selecionadas. As células CD3 + foram primeiro fechadas e, em seguida, esta população foi fechada em subconjuntos CD4 + e CD4. As proporções de subconjuntos naïve (CCR7 + CD45RO - ), memória central (CCR7 + CD45RO + ) e efector memory (CCR7 - CD45RO + ; CCR7 - CD45RO - ) foram determinadas com a ajuda dos marcadores CCR7 e CD45RO. Clique aqui para ver uma versão maior dessa figura.
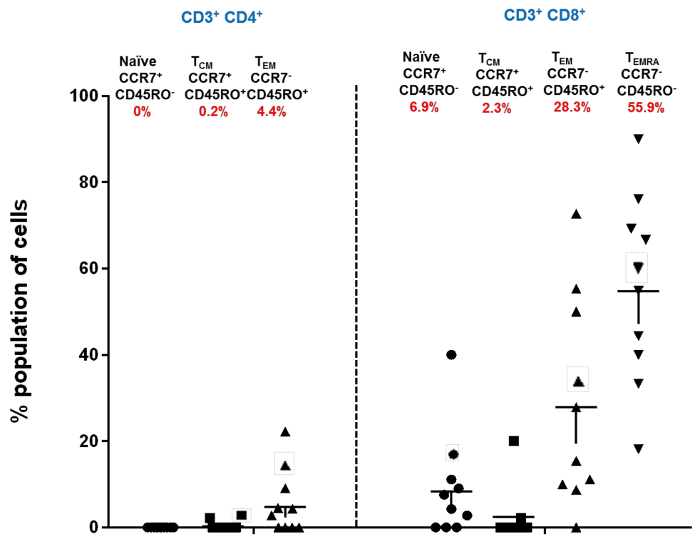
FFigura 3: Sub-tipos de células imunes em células T CD4 + e CD8 + de Superfície Ocular Humana Saudável. Distribuição de subconjuntos conjuntivais CD4 + e CD8 + naïve, memória central (T CM ) e efetor (T EM e T EMRA ) em controles humanos saudáveis; Cada ponto de dados representa uma média individual separada ± SEM mostrada. A porcentagem da população é marcada como vermelha abaixo do nome de cada uma das populações. A porcentagem total da população é de 98%, porque a população de CD4 + T EMRA não foi incluída no diagrama de dispersão mencionado (modificado de Bose et al., 21 ). Clique aqui para ver uma versão maior dessa figura.
Discussão
Esta é uma técnica fácil, rápida e menos invasiva que pode ser usada nas clínicas ambulatoriais para o perfil imune relativamente rápido, em contraste com as técnicas convencionais, como raspagem, esfregão, pipetagem ou papel filtrante absorvente 1 , 2 . Uma variante desta técnica já está sendo usada em configurações de pesquisa 22 . A aplicação futura da metodologia proposta é para a estratificação do paciente em ensaios clínicos com doenças oculares, especialmente aqueles que requerem imunofenotipagem.
Um grande desafio com esta técnica é o número relativamente pequeno de células imunes recuperadas após a coleta e raspagem de impressões. O número total de células T CD3 + recuperadas de quatro impressões por indivíduo variou de ~ 500 a 1000 células. As amostras oculares foram lavadas antes da análise de citometria de fluxo por um número mínimo de vezes para evitar uma perda adicional de célulasS. Os passos críticos e os desafios que permanecem dentro do protocolo são a coleta eficiente de amostras oculares e a raspagem adequada da membrana para atingir números celulares mais elevados. No entanto, é improvável que esta limitação se incline em direção a qualquer fenótipo imune específico. A solução de problemas realizada aqui para maximizar o rendimento das células foi reduzir o número de etapas de lavagem após e antes da incubação de anticorpos.
Existem outras limitações para o uso de IC. Em pacientes com superfície ocular gravemente queratinizada ou fibrosa, como na síndrome de Steven Johnson, o rendimento celular pode ser ainda menor que no presente estudo. A proporção de células imunes pode mudar se as amostras forem armazenadas em vez de analisadas no mesmo dia. É difícil prever se determinados tipos de células são mais resistentes ao armazenamento do que outros. Estudos anteriores relataram níveis elevados de expressão de HLA-DR nas células epiteliais conjuntivais 23 , por isso seria interPara avaliar a correlação entre HLA-DR e níveis de células imunes específicas. As células imunes também podem estar associadas ao nível de expressão das quimiocinas. Essas questões devem ser abordadas em estudos futuros.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem a Nandini Nallappan e a Sharon Yeo por ajudar com as etapas técnicas. O estudo foi financiado por um Subsídio de Início para KGC da Escola de Medicina Lee Kong Chian, da Universidade Tecnológica de Nanyang e por um Prêmio de Cientista de Clínicos Sênior do Conselho Nacional de Pesquisa Médica do Ministério da Saúde de Singapura (NMRC) para LT (NMRC / CSA / 045/2012) e por uma doação do NMRC e administrado pelo Centro Nacional de Inovação da Saúde para KGC e LT (NHIC-12D-1409007).
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| anti-human CD3 BV510 | BD Biosciences | 563109 | |
| anti-human CD4 APCH7 | BD Biosciences | 641398 | |
| anti-human CD45RO PECy7 | BD Biosciences | 337168 | |
| 7-AAD solution | BD Biosciences | 555816 | |
| anti-human CCR7 PE | BD Biosciences | 552176 | |
| Pippetes | Eppendorf | NA | |
| Local Anaesthesia | Alcaine | NA | |
| Fluorescein sodium solution | Bausch & Lomb U.K Limited | NA | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Keratograph 5M | Oculus | NA | |
| Slit lamp BioMicroscope | Haag Streit | BM900 | |
| EyePrim | Opia Technologies | NA | |
| FACS Verse | BD BioSciences | NA | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| GraphPad 6.0 | Prism | NA | |
| FACSVerse analysis software | BD | NA |
Referências
- Thatcher, R. W., Darougar, S., Jones, B. R. Conjunctival impression cytology. Arch Ophthalmol. 95 (4), 678-681 (1977).
- Egbert, P. R., Lauber, S., Maurice, D. M. A simple conjunctival biopsy. Am J Ophthalmol. 84 (6), 798-801 (1977).
- Baudouin, C. The pathology of dry eye. Surv Ophthalmol. 45, S211-S220 (2001).
- Nelson, J. D., Wright, J. C. Conjunctival goblet cell densities in ocular surface disease. Arch Ophthalmol. 102 (7), 1049-1051 (1984).
- Brignole, F., et al. Expression of Fas-Fas ligand antigens and apoptotic marker APO2.7 by the human conjunctival epithelium. Positive correlation with class II HLA DR expression in inflammatory ocular surface disorders. Exp Eye Res. 67 (6), 687-697 (1998).
- Knop, E., Knop, N. The role of eye-associated lymphoid tissue in corneal immune protection. J Anat. 206 (3), 271-285 (2005).
- Lopez-Miguel, A., Gutierrez-Gutierrez, S., Garcia-Vazquez, C., Enriquez-de-Salamanca, A. RNA Collection From Human Conjunctival Epithelial Cells Obtained With a New Device for Impression Cytology. Cornea. 36 (1), 59-63 (2017).
- Tomlins, P., Roy, P., Cunow, J., Rauz, S. Assessment of the EyePRIM Device for Conjunctival impression for Flow Cytometry. Invest Opthalm Vis Sci. 54, 5430-5430 (2013).
- Barros Jde, N., Almeida, S. R., Lowen, M. S., Cunha, M. C., Gomes, J. A. Impression cytology in the evaluation of ocular surface tumors: review article. Arq Bras Oftalmol. 78 (2), 126-132 (2015).
- Calonge, M., et al. Impression cytology of the ocular surface: a review. Exp Eye Res. 78 (3), 457-472 (2004).
- Haller-Schober, E. M., et al. Evaluating an impression cytology grading system (IC score) in patients with dry eye syndrome. Eye (Lond). 20 (8), 927-933 (2006).
- Singh, R., Joseph, A., Umapathy, T., Tint, N. L., Dua, H. S. Impression cytology of the ocular surface. Br J Ophthalmol. 89 (12), 1655-1659 (2005).
- Williams, G. P., et al. Conjunctival Neutrophils Predict Progressive Scarring in Ocular Mucous Membrane Pemphigoid. Invest Ophthalmol Vis Sci. 57 (13), 5457-5469 (2016).
- Best, N., Drury, L., Wolffsohn, J. S. Clinical evaluation of the Oculus Keratograph. Cont Lens Anterior Eye. 35 (4), 171-174 (2012).
- Downie, L. E., Keller, P. R., Vingrys, A. J. Assessing ocular bulbar redness: a comparison of methods. Ophthalmic Physiol Opt. 36 (2), 132-139 (2016).
- Amparo, F., Wang, H., Emami-Naeini, P., Karimian, P., Dana, R. The Ocular Redness Index: a novel automated method for measuring ocular injection. Investigative ophthalmology & visual science. 54 (7), 4821-4826 (2013).
- Shapiro, A., Merin, S. Schirmer test and break-up time of tear film in normal subjects. American journal of ophthalmology. 88 (4), 752-757 (1979).
- Finis, D., Pischel, N., Konig, C., Hayajneh, J., Borrelli, M., Schrader, S., Geerling, G. Comparison of the OSDI and SPEED questionnaires for the evaluation of dry eye disease in clinical routine. Ophthalmologe. 111 (11), 1050-1056 (2014).
- Behrens, A. Dysfunctional tear syndrome: a Delphi approach to treatment recommendations. Cornea. 25 (8), 900-907 (2006).
- Williams, G. P., Pachino, A., Long, H. M., Rauz, S., Curnow, S. J. Cytokine production and antigen recognition by human mucosal homing conjunctival effector memory CD8+ T cells. Invest Opthalmol Vis Sci. 55 (12), 8523-8530 (2014).
- Bose, T., Lee, R., Hou, A., Louis, T., Chandy, K. G. Tissue resident memory T cells in the human conjunctiva and immune signatures in human dry eye disease. Sci Rep. 7, 45312 (2017).
- Williams, G. P., et al. The dominant human conjunctival epithelial CD8alphabeta+ T cell population is maintained with age but the number of CD4+ T cells increases. Age (Dordr). 34 (6), 1517-1528 (2012).
- Mrugacz, M., Zak, J., Bakunowicz-Lazarczyk, A., Wysocka, J., Minarowska, A. Flow cytometric analysis of HLA-DR antigen in conjunctival epithelial cells of patients with cystic fibrosis. Eye (Lond). 21 (8), 1062-1066 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados