Method Article
Неинвазивный способ выделения и фенотипических клеток из конъюнктивы
В этой статье
Резюме
Открытая нормальная окулярная поверхность состоит из роговицы и конъюнктивы. В конъюнктиве присутствуют эпителиальные клетки, бокаловидные клетки и иммунные клетки. Здесь описывается неинвазивная методика цитологии слепоты с использованием устройства для слепочной цитологии и проточной цитометрии для анализа иммунных клеток в конъюнктиве.
Аннотация
Традиционно клеточная поверхностная цитология изучается с помощью таких технологий, как технология шпателя и технология кисти. Проблема с этими методами заключается в том, что они могут вызывать травматические поражения на поверхности глаза, которые могут прогрессировать до рубцевания, деформации век, дефицита лимба стволовых клеток и в некоторых случаях вызывать большой дискомфорт у субъекта. Чтобы избежать этих клинических проблем, была разработана цитология (IC) для диагностики болезни сухого глаза, а затем неоплазия, атопическая болезнь, крапивный кератоконъюнктивит и кератоконъюнктивит сикка. Как правило, клиницисты вручную разрезают фильтровальную бумагу в требуемые формы и наносят их на глазную поверхность. Здесь мы описываем, как выполнять ИС с использованием коммерчески доступного медицинского устройства. Этот метод объясняется здесь с последующим иммунофенотипированием проточной цитометрией. Этот метод требует меньшего количества ручного обращения и вызывает меньшие повреждения глазной поверхности.
Введение
Впечатляющая цитология (IC) была впервые выполнена в 1977 году компанией Thcher et al. 1 . Они использовали пластиковый оттиск для сбора конъюнктивальных клеток у пациентов вместо других доступных в то время техник, таких как очистка, валидация или пипетирование 1 . Текущая методика IC использует абсорбирующую фильтровальную бумагу 2 для отпечатка бульбарной и ладонной конъюнктивы и сбора наиболее поверхностного слоя конъюнктивальных клеток. Эти клетки, достигшие своей конечной стадии дифференциации, постоянно теряются в слезах 3 . Три основных популяции клеток обнаружены в образцах IC: эпителиальные клетки 4 , бокаловидные клетки 3 , 5 и связанные с слизистой оболочкой лимфоидные ткани, связанные с эпителием эффекторными Т-клетками или дендритными клетками 6 . Окулярные поверхностные клетки в IC samPles могут быть проанализированы с помощью микроскопии, иммуноблоттинга и полимеразной цепной реакции обратной транскриптазы (RT-PCR) 7 . Недавно была использована проточная цитометрия для анализа иммунных клеток, собранных путем скрещивания IC-мембраны 8 . Интересно отметить, что IC 6 , 9 был использован для оценки многих заболеваний глазной поверхности, включая кератоконъюнктивит сикка, дефицит витамина А, рубцовый пемфигоид, атопическое заболевание, верхний лимбический кератоконъюнктивит, весенний кератоконъюнктивит и эпителиальную плоскоклеточную метаплазию. IC также используется для оценки влияния ношения контактных линз, обнаружения микробов на поверхности глаз и проверки терапевтической эффективности и толерантности терапевтических вмешательств в продольных исследованиях 10 , 11 , 12 .
Медицинское устройство (EyePrim) поддерживается типом поли(PES) 0,2 мкм мембраны, которая ранее была проверена на метод цитологии с глазной цитологией с проточной цитометрией (поток ОСИК) и открывает возможности для использования продольного отбора проб для мониторинга прогрессирования заболевания и реакции на лечение ( например , подробный Анализ интраэпителиальных лейкоцитов, определяемых как предполагаемые маркеры болезни для прогрессирующего конъюнктивального фиброза в пемфигоиде слизистой оболочки) 13 . Ранние исследователи использовали автоклавированные фильтры PES, которые требовали ручного отображения. В результате доходность была переменной и зависящей от пользователя. Преимуществом этого медицинского устройства является простота использования, стандартизированное давление (Па или Н / м 2 ) и обеспечивает повторяемость, воспроизводимость и последовательное восстановление клеток. Этот метод полезен в амбулаторной клинике, потому что он нехирургичен, прост в применении и быстро. Это медицинское устройство класса I (стерильное) в соответствии с директивой 93/42 / CEE, CE 0499 (SNCH). Это требует толькоВ ходе процедуры, которая обеспечивает поддержание целостности глазной поверхности. После IC клетки могут быть немедленно обработаны для проточной цитометрии. Кроме того, специалистам и медсестрам, не относящимся к офтальмологии, можно обучить пробы поверхности глаз.
Несмотря на улучшение IC по другим методам, остается несколько проблем. Например, могут быть изменения из-за площади выборки и региональных различий в бульбарной конъюнктуре в зависимости от положения IC. Другим источником изменения является применение различного количества давления во время IC. Другие методологические проблемы включают стандартизацию обработки клеток: они включают продолжительность и способ фиксации, а также условия возможного хранения, которые могут влиять на стабильность отбираемого материала.
Общая цель этого метода заключается в разработке метода выделения образцов окулярного оттиска thaT проста в использовании, неинвазивна и может быть применена к иммунологической характеристике клинических образцов.
протокол
Все окулярные образцы, использованные в этом исследовании, были собраны в клинике сухих глаз в Сингапурском национальном центре глаз, одобренном Центром централизованного институционального обзора SingHealth и Техническим советом по изучению технологического университета Наньян, Сингапур.
ПРИМЕЧАНИЕ. Субъектам были подвергнуты клинические испытания для оценки степени воспаления и тяжести дисфункции слеза до проведения IC. Клинические испытания включали неинвазивное время разрыва разрывов (NI-TBUT) 14 и конъюнктивальное покраснение (гиперемия) 15 , 16, оцениваемое с помощью диагностического прибора, тест Ширмера 17 , стандартная анкетирование 18 для оценки сухости лица (SPEED) и роговица Окрашивание 19 .
1. Сбор окулярных образцов IC
- После определения клинического статуса анестезируйтеГлаза участника, применяя 1 - 2 капли актуальной анестезии, пропаракаина гидрохлорида, к превосходной бульбарной конъюнктиве и нижнему своду. Подождите 4 - 5 минут, чтобы ощущение жжения анестетика исчезло.
- Собирайте образцы как из носовой, так и во временной бульварной конъюнктивы с двумя устройствами для слепочной цитологии.
ПРИМЕЧАНИЕ. Для сбора двух образцов оттиска используется одно устройство. Здесь для сбора четырех слепых мембран использовалось два устройства.- Поместите изображение цитологического устройства тангенциально на конъюнктиву. Аккуратно нажмите кнопку и удерживайте ее в течение 2 - 3 с.
ПРИМЕЧАНИЕ. Устройство оснащено мембраной. Давление автоматически отпускается после нажатия кнопки. Для снятия давления и снятия устройства требуется всего несколько секунд.
- Поместите изображение цитологического устройства тангенциально на конъюнктиву. Аккуратно нажмите кнопку и удерживайте ее в течение 2 - 3 с.
- Отпустите мембрану в микроцентрифужную пробирку, содержащую 1 мл культуральной среды (среда для среды Мемориала Розуэлла (RPMI) + 10% фетальная бычья сыворотка(FBS) + 1% пенициллин-стрептомицин (Pen Strep)) с помощью скальпеля.
- Изолируйте клетки из мембраны устройства путем непрерывного очищения в течение приблизительно 1 мин с наконечником пипетки 10 мкл.
ПРИМЕЧАНИЕ. Скребок завершается, когда поверхность мембраны становится неровной. Количество клеток из каждой мембраны варьируется (100 - 500 клеток / мембрана). Обработать образцы в течение 2 - 3 часов сбора.
2. Иммунофенотипирование клеток методом проточной цитометрии
- Центрифугируйте клетки при 400 × g в течение 5 мин при комнатной температуре для удаления среды. Ресуспендируют клеточный осадок с 50 мкл буфера для окрашивания проточной цитометрии (фосфатно-буферный солевой раствор (PBS) + 0,05% бычьего сывороточного альбумина (BSA)).
- Ячейки с пятнами с панелью антител ( например , CD3-бриллиантовый фиолетовый (BV) 510 (UCHT1), CD4-аллоцикоцианин-H7 (APC-H7) (SK3), CCR7-фикоэритрин (PE) -A, CD45RO PE-цианин 7 (PE- Cy7) -A, а живая / мертвая ячейка 7-ADD) при комнатной температуре в течение 20-30 мин втемно. Используйте антитела непосредственно из запаса в соответствии с протоколом изготовителя.
ПРИМЕЧАНИЕ. Для концентрации антитела используйте 2,5 мкл CD3-BV510, 1,25 мкл CD4-APC-H7, CD45RO-PE-Cy7, 7-AAD и 10 мкл CCR7-PE. Используйте мононуклеарные клетки периферической крови (РВМС) для титрования различных концентраций антител. Для титрования возьмите концентрацию антител, указанную в протоколе изготовителя, и используйте половину и одну четвертую рекомендуемой концентрации. Используйте минимальную концентрацию антител, чтобы избежать утечки на другие каналы флуорохрома. Наблюдались четкие сигналы с указанными концентрациями антител. Компенсация была выполнена путем тестирования РВМС первоначально в соответствии с протоколом, упомянутым в Williams et al . 20 Для тестирования РВМС инкубировали с тем же набором антител, используемых здесь, и компенсировали путем сравнения одиночных и множественных пятен антител. - После инкубации periДобавьте 1 мл окрашивающего буфера в пробирку, хорошо перемешайте и центрифугируйте при 450 × g в течение 5 мин при комнатной температуре. Ресуспендируют клетки в 200 мкл окрашивающего буфера.
- Запустите образцы на проточной цитометрической машине.
- Прежде чем получать данные, откалибруйте напряжение канала канала цитометра с помощью буферов настройки и отслеживания цитометров (CS & T) для нормализации сбора данных в разные дни в соответствии с инструкциями производителя.
- Откройте программное обеспечение для сбора данных о цитометрии потока, нажмите кнопку «Настройка и QC», выберите правильный номер партии шарика CS & T, загрузите бусины и нажмите кнопку «Пуск».
- Повторно суспендируйте клетки, аккуратно постукивая по трубке перед загрузкой образцов в машину. Откройте программное обеспечение для сбора данных и нажмите «Предварительный просмотр». Когда пороговая скорость стабильна, нажмите «Приобрести». Контролируйте уровень выборки и нажмите «Остановить», когда образцы закончились.
ПРИМЕЧАНИЕ. Приобретите 10 000 событий на выборку. - После того, как вы приобрели 10 000 событий, создайте на листе SSC-A и FSC-A.
- Нажмите кнопку «Многоугольник» и нарисуйте затворы (это P1) по всем событиям с помощью значения FSC-A> 5 x 10 4, чтобы исключить обломки. Нажмите кнопку «Создать точку», чтобы создать новую точку, щелкните правой кнопкой мыши по блоку точек, выберите «Свойства», чтобы открыть окно «Редактор графиков», а затем выберите «P1». Нажмите FSC-A на оси X участка точки P1, измените его на CD3-BV510. Нарисуйте «Полигональные ворота», чтобы выбрать популяцию CD3 + и назовите ее «P2».
- Нажмите кнопку «Создать точку», чтобы создать новую точку, щелкните правой кнопкой мыши по блоку точек, выберите «Свойства», чтобы открыть окно «Редактор графиков». Нажмите FSC-A по оси x участка P2 и измените его на 7-AAD. Нарисуйте «Полигональные ворота» для 7-AAD-популяции и выберите «P3». P3 здесь представляет собой CD3 +Живые клетки.
- Нажмите кнопку «Создать точку», чтобы создать новую точку, щелкните правой кнопкой мыши по блоку точек, выберите «Свойства», чтобы открыть окно «Редактор графиков». Нажмите CD3-BV510 по оси x и CD4-APCH7 на оси Y участка P3. Нарисуйте Rectangle Gates на верхней и нижней сторонах квадранта и выберите «P4» и «P5» соответственно. P4 является живым CD3 + CD4 +, а P5 представляет собой живые CD3 + CD4-Т-клетки.
- Нажмите кнопку «Создать точку», чтобы создать новую точку, щелкните правой кнопкой мыши по блоку точек, выберите «Свойства», чтобы открыть окно «Редактор графиков». Щелкните CD45RO PE-Cy7 по оси x и CCR7-PE по оси Y графиков P4 и P5. Нарисуйте «Quad Gate» на этом графике.
ПРИМЕЧАНИЕ. Верхняя левая сторона, верхняя правая сторона, нижняя правая сторона и нижние квадранты левой стороны - наивная центральная память (T CM ), eFfector memory (T EM ), терминально дифференцированные ТФ-ячейки эффекторной памяти (T EMRA ), соответственно.
- Прежде чем получать данные, откалибруйте напряжение канала канала цитометра с помощью буферов настройки и отслеживания цитометров (CS & T) для нормализации сбора данных в разные дни в соответствии с инструкциями производителя.
Результаты
IC благодаря этому клиническому устройству позволил нам изолировать иммунные клетки окулярной поверхности, сохраняя неповрежденную поверхность глаз. На рисунке 1 показано, как выполняется IC. Отмечаются разные участки глаза, из которых были собраны образцы. На рисунке 2 показан репрезентативный результат проточной цитометрии, собранной из 10 здоровых контролей. Для стробирования используйте SSC и 7-AAD для различения живых и мертвых ячеек. 7-AAD - клетки идентифицируются как живые клетки. Эти живые клетки дополнительно характеризуются маркерами CD3 + и CD4 + . Кроме того, популяции CD4 + и CD4 были дополнительно охарактеризованы как Naïve, T EM , T CM и T EMRA с маркерами CCR7 и CD45RO. Среди CD3 + Т-клеток на поверхности глаза человека преобладают тканевые клетки эффекторной памяти. В предыдущем eКроме того, было показано, что клетки CD8 + памяти являются основными популяциями в эпителиальных Т-клетках конъюнктивы среди здоровых лиц 20 . На рисунке 3 показано, что Т-клетки CD4 + и CD8 + эффекторной памяти (T EM и T EMRA ) являются основным подмножеством поверхности человеческого глаза в 10 здоровых контролируемых исследованиях. Каждая популяция, указанная на рисунке, уведомляется о своем маркерном фенотипе и именах (Naïve, T CM , T EM , T EMRA ). Цифры в красном обозначают процент населения. Данные на этом рисунке представлены как среднее ± SEM
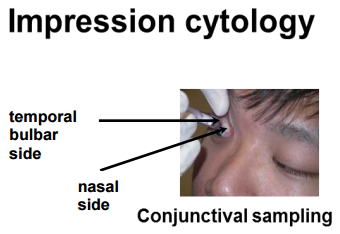
Рисунок 1: Сбор образцов ИС из глазной поверхности с помощью имитационного цитологического устройства. Образцы собирали из временной лампыAr, как показано.
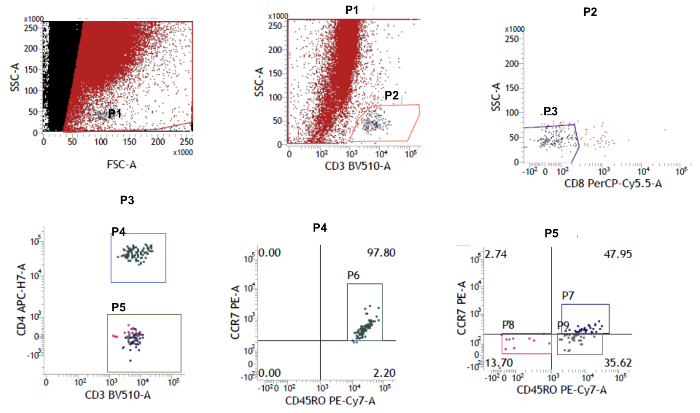
Рисунок 2: График точки с использованием проточной цитометрии. Были выбраны ячейки Live 7-AAD. Сначала клетки CD3 + были закрыты, и затем эта популяция была включена в CD4 + и CD4-подмножества. Сопоставлениями наивных (CCR7 + CD45RO - ), центральной памяти (CCR7 + CD45RO + ) и эффекторной памяти (CCR7 - CD45RO + ; CCR7 - CD45RO - ) были определены с помощью маркеров CCR7 и CD45RO. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
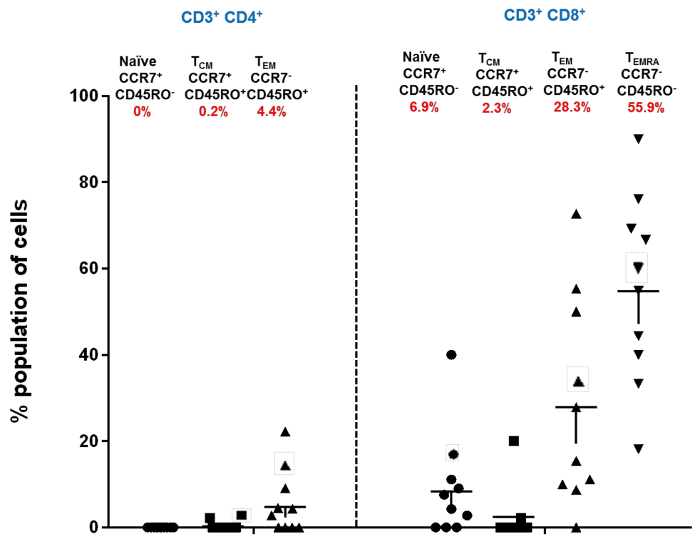
FРисунок 3: Подтипы иммунных клеток в CD4 + и CD8 + Т-клетках здоровой глазной поверхности человека. Распределение конъюнктивальных CD4 + и CD8 + наивных, центральной памяти (T CM ) и функциональной памяти (T EM и T EMRA ) подмножеств в здоровом человеческом контроле; Каждая точка данных представляет собой отдельное индивидуальное среднее ± SEM. Процент населения отмечен красным цветом ниже названия каждой из популяций. Общий процент населения составляет 98%, поскольку популяция CD4 + T EMRA не была включена в упомянутый график рассеяния (измененный от Bose et al., 21 ). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Это простой, быстрый и менее инвазивный метод, который можно использовать в амбулаторных клиниках для относительно быстрого иммунного профилирования в отличие от обычных методов, таких как скребковые, свабирующие, пипетирующие или абсорбирующие фильтровальные бумаги 1 , 2 . Вариант этого метода уже используется в настройках исследований 22 . Будущее применение предлагаемой методологии заключается в стратификации стратификации в клинических испытаниях с глазными заболеваниями, особенно в тех, которые требуют иммунофенотипирования.
Основная проблема с этим методом заключается в относительно небольшом количестве иммунных клеток, полученных после слепочного сбора и скребков. Общее количество CD3 + Т-клеток, выделенных из четырех показов на отдельного человека, варьировало от ~ 500-1000 клеток. Окулярные образцы промывали перед анализом проточной цитометрии в течение минимального количества раз, чтобы избежать дальнейшей потери клетокs. Критические шаги и проблемы, которые остаются в протоколе, - это эффективный сбор окулярных образцов и правильное очищение мембраны для достижения большего числа клеток. Тем не менее, это ограничение вряд ли приведет к смещению к любому конкретному иммуногенному фенотипу. Устранение неисправностей, выполняемое здесь для максимизации выхода клеток, заключалось в уменьшении количества этапов промывки после и до инкубации антител.
Существуют и другие ограничения использования IC. У пациентов с сильно ороговевшей или фиброзированной глазной поверхностью, такой как синдром Стивена Джонсона, клеточный выход может быть даже меньше, чем в этом исследовании. Доля иммунных клеток может измениться, если образцы хранятся вместо анализа в тот же день. Трудно предсказать, являются ли некоторые типы клеток более устойчивыми к хранению, чем другие. Предыдущие исследования показали повышенный уровень экспрессии HLA-DR в эпителиальных клетках конъюнктивы 12, поэтому он будетДля оценки корреляции между HLA-DR и уровнями конкретных иммунных клеток. Иммунные клетки также могут быть связаны с уровнем экспрессии хемокинов. Эти вопросы следует решать в будущих исследованиях.
Раскрытие информации
Авторы не заявляют никаких конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы поблагодарить Нандини Наллаппана и Шарона Йо за помощь в технических шагах. Исследование было профинансировано грантом Start-Up для KGC из Школы медицины Lee Kong Chian, Технологическим университетом Наньяна и премией старшего врача-клинициста из Национального совета медицинских исследований Сингапура (NMRC) до LT (NMRC / CSA / 045/2012) и грантом от NMRC и администрируется Национальным центром инноваций в области здравоохранения для KGC и LT (NHIC-12D-1409007).
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| anti-human CD3 BV510 | BD Biosciences | 563109 | |
| anti-human CD4 APCH7 | BD Biosciences | 641398 | |
| anti-human CD45RO PECy7 | BD Biosciences | 337168 | |
| 7-AAD solution | BD Biosciences | 555816 | |
| anti-human CCR7 PE | BD Biosciences | 552176 | |
| Pippetes | Eppendorf | NA | |
| Local Anaesthesia | Alcaine | NA | |
| Fluorescein sodium solution | Bausch & Lomb U.K Limited | NA | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Keratograph 5M | Oculus | NA | |
| Slit lamp BioMicroscope | Haag Streit | BM900 | |
| EyePrim | Opia Technologies | NA | |
| FACS Verse | BD BioSciences | NA | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| GraphPad 6.0 | Prism | NA | |
| FACSVerse analysis software | BD | NA |
Ссылки
- Thatcher, R. W., Darougar, S., Jones, B. R. Conjunctival impression cytology. Arch Ophthalmol. 95 (4), 678-681 (1977).
- Egbert, P. R., Lauber, S., Maurice, D. M. A simple conjunctival biopsy. Am J Ophthalmol. 84 (6), 798-801 (1977).
- Baudouin, C. The pathology of dry eye. Surv Ophthalmol. 45, S211-S220 (2001).
- Nelson, J. D., Wright, J. C. Conjunctival goblet cell densities in ocular surface disease. Arch Ophthalmol. 102 (7), 1049-1051 (1984).
- Brignole, F., et al. Expression of Fas-Fas ligand antigens and apoptotic marker APO2.7 by the human conjunctival epithelium. Positive correlation with class II HLA DR expression in inflammatory ocular surface disorders. Exp Eye Res. 67 (6), 687-697 (1998).
- Knop, E., Knop, N. The role of eye-associated lymphoid tissue in corneal immune protection. J Anat. 206 (3), 271-285 (2005).
- Lopez-Miguel, A., Gutierrez-Gutierrez, S., Garcia-Vazquez, C., Enriquez-de-Salamanca, A. RNA Collection From Human Conjunctival Epithelial Cells Obtained With a New Device for Impression Cytology. Cornea. 36 (1), 59-63 (2017).
- Tomlins, P., Roy, P., Cunow, J., Rauz, S. Assessment of the EyePRIM Device for Conjunctival impression for Flow Cytometry. Invest Opthalm Vis Sci. 54, 5430-5430 (2013).
- Barros Jde, N., Almeida, S. R., Lowen, M. S., Cunha, M. C., Gomes, J. A. Impression cytology in the evaluation of ocular surface tumors: review article. Arq Bras Oftalmol. 78 (2), 126-132 (2015).
- Calonge, M., et al. Impression cytology of the ocular surface: a review. Exp Eye Res. 78 (3), 457-472 (2004).
- Haller-Schober, E. M., et al. Evaluating an impression cytology grading system (IC score) in patients with dry eye syndrome. Eye (Lond). 20 (8), 927-933 (2006).
- Singh, R., Joseph, A., Umapathy, T., Tint, N. L., Dua, H. S. Impression cytology of the ocular surface. Br J Ophthalmol. 89 (12), 1655-1659 (2005).
- Williams, G. P., et al. Conjunctival Neutrophils Predict Progressive Scarring in Ocular Mucous Membrane Pemphigoid. Invest Ophthalmol Vis Sci. 57 (13), 5457-5469 (2016).
- Best, N., Drury, L., Wolffsohn, J. S. Clinical evaluation of the Oculus Keratograph. Cont Lens Anterior Eye. 35 (4), 171-174 (2012).
- Downie, L. E., Keller, P. R., Vingrys, A. J. Assessing ocular bulbar redness: a comparison of methods. Ophthalmic Physiol Opt. 36 (2), 132-139 (2016).
- Amparo, F., Wang, H., Emami-Naeini, P., Karimian, P., Dana, R. The Ocular Redness Index: a novel automated method for measuring ocular injection. Investigative ophthalmology & visual science. 54 (7), 4821-4826 (2013).
- Shapiro, A., Merin, S. Schirmer test and break-up time of tear film in normal subjects. American journal of ophthalmology. 88 (4), 752-757 (1979).
- Finis, D., Pischel, N., Konig, C., Hayajneh, J., Borrelli, M., Schrader, S., Geerling, G. Comparison of the OSDI and SPEED questionnaires for the evaluation of dry eye disease in clinical routine. Ophthalmologe. 111 (11), 1050-1056 (2014).
- Behrens, A. Dysfunctional tear syndrome: a Delphi approach to treatment recommendations. Cornea. 25 (8), 900-907 (2006).
- Williams, G. P., Pachino, A., Long, H. M., Rauz, S., Curnow, S. J. Cytokine production and antigen recognition by human mucosal homing conjunctival effector memory CD8+ T cells. Invest Opthalmol Vis Sci. 55 (12), 8523-8530 (2014).
- Bose, T., Lee, R., Hou, A., Louis, T., Chandy, K. G. Tissue resident memory T cells in the human conjunctiva and immune signatures in human dry eye disease. Sci Rep. 7, 45312 (2017).
- Williams, G. P., et al. The dominant human conjunctival epithelial CD8alphabeta+ T cell population is maintained with age but the number of CD4+ T cells increases. Age (Dordr). 34 (6), 1517-1528 (2012).
- Mrugacz, M., Zak, J., Bakunowicz-Lazarczyk, A., Wysocka, J., Minarowska, A. Flow cytometric analysis of HLA-DR antigen in conjunctival epithelial cells of patients with cystic fibrosis. Eye (Lond). 21 (8), 1062-1066 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены