Method Article
Viver a imagem, seguida por uma única célula de rastreamento para biologia celular de Monitor e a progressão da linhagem de várias populações neurais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
É descrito um protocolo robusto para monitorar as populações neurais por vídeo-microscopia de lapso de tempo seguido baseado em software de pós-processamento. Este método representa uma ferramenta poderosa para identificar os eventos biológicos em uma população selecionada durante as experiências de imagens ao vivo.
Resumo
Compreender os mecanismos que controlam eventos biológicos críticos das populações de células nervosas, como proliferação, diferenciação ou decisões de célula destino, será crucial para a concepção de estratégias terapêuticas para muitas doenças que afetam o sistema nervoso. Métodos atuais para controlar populações de células dependem de seus resultados finais em imagens estáticas e eles geralmente não fornecem resolução temporal suficiente para identificar características comportamentais em células únicas. Além disso, variações na morte celular, comportamental heterogeneidade dentro de uma população celular, diluição, espalhando ou baixa eficiência dos marcadores usados para analisar as células são todas desvantagens importantes que levarão a leituras incompletas ou incorretas dos resultados. Por outro lado, realizando a imagem ao vivo e única célula, em condições adequadas de controle representa uma ferramenta poderosa para monitorar cada um desses eventos. Aqui, um protocolo de vídeo-microscopia de lapso de tempo, seguido de pós-processamento, é descrito para controlar populações neurais com resolução de célula única, utilizando software específico. Os métodos descritos permitem que pesquisadores de abordar questões essenciais sobre a progressão de biologia e linhagem de célula de distintas populações neurais.
Introdução
A fim de desenvolver novas e mais eficazes estratégias terapêuticas para regenerar populações neurais, devemos primeiro entender os mecanismos básicos que mantêm as células com um potencial de regeneração neural. Prossecução deste objectivo exige um conhecimento abrangente dos fatores que regulam o equilíbrio entre a quiescência, proliferação/diferenciação, o modo e o tempo de divisão de comprimento de ciclo celular, capacidades migratórias, viabilidade, etc. Embora seja uma abordagem técnica que tem sido utilizada por muitos anos1, ao vivo de imagem e observação direta continuam a ser a melhor opção para monitorar os eventos listados acima. Ao contrário de muitas outras abordagens centradas em leituras de ponto de extremidade, vivem de imagem e única célula de rastreamento fornecer informações em todo o comprimento de um experimento2,3,4,5, 6. assim, a adição de resolução temporal permite que decisões do destino de célula, comportamento celular heterogênea ou morte celular, assim como muitos outros eventos críticos para ser identificado que outra forma podem passar despercebido. Idealmente, essas características de células melhor devem ser monitoradas para a única célula nível in vivo onde ambos (célula intrínsecas autónoma) e extrínsecos pistas (nicho de célula) são levadas em conta.
No entanto, embora no em vitro da situação de eventos ocorre em um ambiente que não reproduz o meio natural, as condições de cultura de baixa densidade, normalmente usadas nestes protocolos são mais adequadas para revelar as características intrínsecas do células. Além disso, um controle mais simplista do meio circundante, simplesmente modificando o meio de crescimento, pode constituir uma valiosa ferramenta para investigar o papel individual de cada fator extrínsecos que define o nicho neural, bem como os fatores ambientais que podem ser induzida em situações patológicas,7,8,9,10,11,12,13. Portanto, quando configurado corretamente, como o protocolo proposto aqui, imagens ao vivo fornece uma solução viável em vitro para resolver a maioria das questões anteriormente enumeradas.
Em breve, este protocolo descreve o hardware, software, condições de cultura e as principais etapas necessárias para executar com êxito um experimento de imagens ao vivo, seguido de uma única célula de rastreamento. Essa abordagem oferece informações valiosas que ajuda a revelar aspectos fundamentais da biologia e da progressão linhagem, de várias populações neurais.
Protocolo
As seções a seguir descrevem as etapas necessárias para executar a imagem ao vivo seguida de rastreamento única célula de várias populações neurais (Figura 1). Todos os procedimentos que envolvem animais descritos no presente protocolo devem ser realizadas em conformidade com as diretrizes do Conselho Internacional para Laboratory Animal Science (ICLAS).
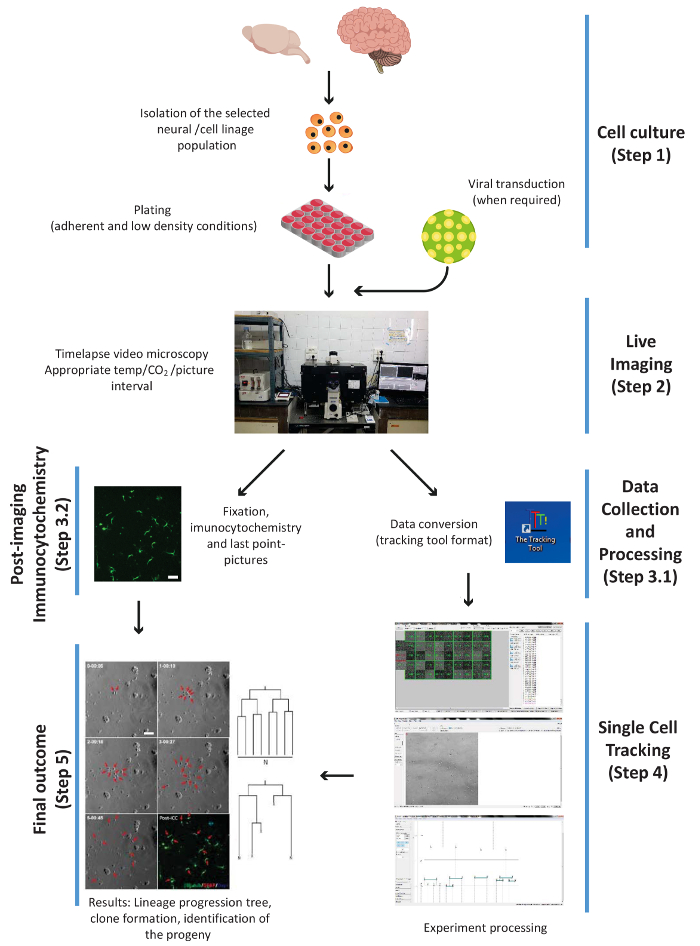
Figura 1. Esquema ilustrando os principais passos experimentais do procedimento, ou seja: celular, cultura, imagem ao vivo, PICC e recolha de dados, única célula de rastreamento e o resultado final. Os passos são numerados de acordo com o fluxo de trabalho do protocolo. Clique aqui para ver uma versão maior desta figura.
1. celular cultura: Isolamento e chapeamento de selecionados população Neural ou linhagem de células
Nota: Em conjunto com este protocolo, exemplos de sua aplicação para populações de células distintas são dadas para validar a sua utilidade para analisar a biologia das células neurais. Estes incluem: células-tronco neurais adultas (aNSCs), derivado do mouse subependimal zona (SEZ) (para um isolamento detalhado protocolo ver14); Astrócitos corticais pós-natal para estudar a reprogramação neuronal (para um isolamento detalhado protocolo ver15); Pós-natal astrócitos Cerebelares (para um isolamento detalhado método ver16); e linha de Mouse Neuro-2a célula de Neuroblastoma (N2a).
- Propagar as células diretamente em placas de 24 poços revestidas poli-D-lisina. Use 1 mL de meio de cultura por bem. Incube as placas a 37 ° C e 8% de CO2 para aNSCs, ou a 37 ° C e 5% CO2 para a linha de astrócitos/celular para 2 h antes da imagem ao vivo. Evite o uso de lamelas para impedir a movimentação indesejada como o estágio de microscópio motorizado é deslocado que torna única célula de rastreamento inviável.
Nota: As densidades de célula e meios de cultura utilizados nos experimentos são: 30-40.000 células/poço para aNSCs em Dulbecco modificada do meio da águia (meio de DMEM:F12 mistura de nutrientes); 20.000 células/poço para as células N2a em meio DMEM glicose alta, 80.000 células/poço para astrócitos Cerebelares em meio DMEM alta glicose; e 55-65.000 células/poço para astrócitos pós-natal no meio de DMEM:F12 mistura de nutrientes. - Padronize o protocolo de cultura, ajustando a densidade de células da cultura para o menor número de células viáveis. No entanto, a densidade celular deve ser suficientemente elevada para manter a viabilidade da cultura.
Nota: Se a densidade celular é muito alta, os excessos de detritos ou pobre dissociação (grupos) possam prejudicar rastreamento de células únicas.
2. viver de imagem por vídeo-microscopia de lapso de tempo
- Liga os sistemas de microscópio, câmera, hardware e incubação. Definir a temperatura e pressão a 37 ° C e 8% CO2 para aNSCs, ou a 37 ° C e 5% CO2 para a linha de astrócitos/célula de ar. Permitir que a temperatura e os níveis de CO2 para estabilizar para 1-2 h.
Nota: Equipamento específico é necessário para executar a análise de vídeo lapso de tempo, incluindo: microscópios de fluorescência de contraste/campo/fase brilhante com componentes motorizados; dispositivos de incubação que controlam a temperatura, o CO2 e a umidade; e finalmente, confiável e suficientemente poderoso hardware e software de aquisição e tratamento do volume de fotos obtidas durante as experiências de imagens ao vivo (por favor verifique a Tabela de materiais). - Uma vez que as células estão bem fixas para a placa (2 h após chapeamento), use uma caneta de tinta permanente para fazer uma pequena marca no fundo de um poço que não será usado para o acompanhamento, ou seja, um poço que não contenha células.
Nota: Esta marca será usada como referência para as coordenadas xyz de zero, e pode ser usado a qualquer momento durante ou após o experimento ou entre as mudanças do meio, para retornar à posição zero. - Coloque a placa dentro da incubadora do microscópio e fixar firmemente a placa ao palco para evitar qualquer movimento indesejado durante o deslocamento de fase motorizada do microscópio.
- Permitir que a temperatura do meio de cultura celular para equilibrar na câmara por aproximadamente 20 min. Esta etapa irá evitar uma perda de foco durante a gravação devido a dilatação dos componentes.
- Inicie o software de geração de imagens ao vivo e selecione o módulo de lapso de tempo para configurar o experimento.
- Defina a duração total do experimento e os ciclos de aquisição de imagem no menu"calendário guia". Devido a fototoxicidade inerente do transmitidos ou luz de fluorescência usada, defina um intervalo adequado equilíbrio entre a resolução temporal das análises e a potencial morte celular.
Nota: por exemplo, um total de 120 h foi selecionado para culturas aNSC, adquirindo brightfield fotos cada 5 min. considere que a aquisição de 120 h de um único filme nesta configuração exigirá 120-150 gigabytes de espaço de armazenamento gratuito no dispositivo de computador. - Selecione as posições de imagem definidas por x e y coordenadas e a distância focal (a coordenada z) em "a xyz pontos tab menu". Inclua o ponto de referência (coordenadas xyz zero) como a posição inicial a fim de recuperar as coordenadas em qualquer momento.
- Selecione o tipo de aquisição no "comprimento de onda guia menu de selecção", brightfield só ou em combinação com epifluorescência excitação quando necessário. Selecione o tempo de exposição. Tenha em mente que a exposição excessiva a transmitida, e especialmente fluorescente luz, pode comprometer a viabilidade celular (como indicado acima).
- Para aNSCs, Cerebelares astrócitos e células N2a, selecione brightfield (tempo de exposição de 10-50 ms).
- Para astrócitos corticais transduzidos selecionam brightfield (tempo de exposição de 10-50 ms) em combinação com fluorescência vermelha/verde, dependendo do repórter utilizado para o experimento (comprimento de onda de excitação vermelho: 550 nm e 400 ms de tempo de exposição; excitação verde comprimento de onda: 460-500 nm e tempo de exposição de 100 ms).
- Defina o nome do experimento e a pasta onde as imagens serão armazenadas. Salvar a lista de cargos para recarregar o experimento a qualquer momento e uma vez que todas as condições definidas, executar o experimento, clicando no botão "executar agora".
- Pausar a experiência e re-ajustar as condições de foco clicando o botão z "substituir" uma vez por dia até que o experimento seja concluído. Se as alterações no meio são necessárias durante a imagem ao vivo, pausa o experimento e recuperar a placa da câmara de lapso de tempo.
Nota: As mudanças no pH do meio devido à morte celular ou excessiva proliferação, bem como as variações na temperatura ambiente, podem afetar o foco correto do microscópio nas células. Para culturas sensíveis (como aNSCs), recomendamos o uso de meio suplementado com 4-(2-hydroxyethyl)-1-piperazineethanesulfonic ácido (HEPES) (concentração final: 1 mM).
3. pós-imaging imunocitoquímica (PICC), recolha de dados e processamento
- Uma vez concluído o experimento, pausar o software e recuperar a placa para fixação e PICC, conforme descrito nas próximas etapas.
- Executar a fixação da pilha: lavar as células uma vez com soro fisiológico 1 mL tamponado fosfato (PBS) e adicione 500 µ l de paraformaldeído (PFA) (4% em PBS), incubando 10 min à temperatura ambiente (RT).
Cuidado: Paraformaldehyde é um fixador forte e deve ser manuseado com cuidado para evitar o contacto com a pele ou olhos. O mesmo deve ser manipulado somente dentro de uma coifa. - Lavar as células três vezes com 1 mL de PBS e adicione 500 µ l da solução de bloqueio (PBS contendo 2% (wt/vol) de albumina de soro bovino (BSA) e 0,2% (vol/vol) do tensoativo não-iônico). Incubar a 1 h no RT.
- Remover a solução de bloqueio e adicione 250-400 µ l da solução de anticorpos primários. Incubar a 2 h em RT. A solução de anticorpos primários contém anticorpos primários diluídos em PBS contendo 2% (wt/vol) de BSA e 0,2% (vol/vol) do tensoativo não-iônico. Anticorpos utilizados nos experimentos descritos aqui: GFAP (1: 500), βIII-tubulina (1:1, 000) e α-tubulina (1:1, 000). Como isto é realizado diretamente no poço, volumes maiores das soluções são necessários (250-400 µ l) para cobrir todas as células.
- Lavar três vezes com 1 mL de PBS e adicione 250-400 µ l da solução de anticorpos secundários (diluída conforme descrito no passo 3.4). Anticorpos secundários utilizados nos experimentos descritos aqui: anti-rato fluoresceína (FITC) (1:800), anticoelho Cy3 (1: 500). Incube a 1h no RT no escuro.
- Lavar três vezes em 1 mL de PBS. Manter as células em 1 mL de PBS para as etapas posteriores do protocolo.
- Coloque a placa de volta ao palco do microscópio e firmemente, anexá-lo ao palco para evitar movimento indesejado durante o deslocamento de fase de microscópio motorizado.
- Recuperar o xyz posição zero usando a marca feita no passo 2.2 e re-definir as posições para esse ponto de referência, premindo o botão "Compensar todos X, Y, Z". Re-defina a distância focal para cada posição.
- Adquirir uma rodada final de imagens, configurando as condições necessárias para a emissão de fluorescência no "comprimento de onda guia menu de selecção" a fim de detectar os antígenos alvejados previamente o PICC.
- Brevemente, além de brightfield, ativar FITC (excitação: 495 nm) e Cy3 (excitação: 550 nm) opções de aquisição do software. Use 10-50 ms para a exposição de 400 ms brightfield para detectar o fluorophores e pressione o botão "1 time loop", para adquirir uma rodada final de fotos.
Nota: A intensidade da fluorescência pode diferir dependendo do resultado PICC. Ajuste o tempo de exposição a fim de obter a qualidade de imagem ideal.
- Brevemente, além de brightfield, ativar FITC (excitação: 495 nm) e Cy3 (excitação: 550 nm) opções de aquisição do software. Use 10-50 ms para a exposição de 400 ms brightfield para detectar o fluorophores e pressione o botão "1 time loop", para adquirir uma rodada final de fotos.
- Selecione a opção de arquivo/exportar do software e exportar as imagens no formato Joint Photographic Experts Group (Jpeg) ou Tagged Image File Format (Tiff) para uma pasta de destino pré-definido.
- Converter as imagens exportadas para o formato exigido pelo software de rastreamento: A ferramenta de controle17 (tTt). Para conseguir isso, definir a entrada e saída pasta a ferramenta de conversor"tTt" operando a janela, bem como os marcadores usados para posições (xy), canais (c) e pontos de tempo (t) e pressione o botão "converter imagens".
Nota: As imagens devem ser renomeadas de acordo com as configurações específicas e eles devem ser armazenados em pastas individuais para cada posição usada no experimento. Instruções para a instalação, requisitos, renomeação de posições/images e a utilização da ferramenta de rastreamento estão disponíveis para download em: https://www.bsse.ethz.ch/csd/software/tTt-and-qtfy.html.
4. única célula Tracking
- Depois de renomear os dados, execute o software tTt. Selecione uma pasta de trabalho de usuário nome e tTt.
Nota: O acompanhamento de pasta de trabalho ferramenta manterá todos os dados analisados e os resultados exportados. A pasta de trabalho deve ser nomeada tTtexport, que contém as subpastas chamadas "AVIexport", "Configs", "TreeExport" e "tTtfiles". - Selecione o experimento a ser carregado no "experimento selecione janela de pasta", indicando o caminho da pasta onde o experimento é armazenado, e, em seguida, clique no botão "Carregar o experimento".
- Executar o conversor de arquivo de log para transformar as imagens carregadas em um formato que pode ser lido pelo software de rastreamento (para experiências carregadas pela primeira vez, esta será solicitada automaticamente pelo software).
- Selecione uma posição de controle clicando no seu símbolo (após a conversão, uma visão geral das posições gravadas durante os experimentos será exibida a janela de layout"posição"). Cada posição será representada por um símbolo que consiste em uma foto a posição e o seu número correspondente (ver Figura 1).
- Uma vez que a posição foi seleccionada e sobre o direito do "janela de layout de posição", é exibida uma lista das imagens disponíveis, selecione-os e clique no botão "Carregar imagens".
- Uma vez que a carga está completa e aparece a janela de"célula Editor", selecione a comprimentos de onda e o intervalo de imagem a ser rastreado na janela do Editor"célula". Comprimento de onda 0 corresponde brightfield, 1 corresponde a FITC, 2 para Cy3 e 3 a DAPI. Nos experimentos descritos aqui, utilizou-se o intervalo de 1, ou seja, todas as imagens carregadas. Para esclarecer, o intervalo de 2 significa carregamento de cada segunda imagem.
- Uma vez que as imagens foram carregadas, volte para a janela de layout"posição" e clique duas vezes no ícone que representa a posição anteriormente carregada. A janela de"filme" aparecerá que permite o rastreamento de única célula a ser executada.
- Seguindo as instruções da ferramenta de rastreamento, proceder ao acompanhamento. Selecione o canal 0 (correspondente a brightfield) e ajustar o brilho e contraste ("ajustar o botão de gama"). Inicie o rastreamento, pressionando a tecla F2.
Nota: Durante o rastreamento, a célula controlada se seguirão, colocando o ponteiro do mouse sobre ele e pressionando a tecla "0". A divisão celular, apoptose celular e celular perdido botões estão disponíveis para monitorar esses eventos de célula específica.
5. desfecho
- Uma vez que a única célula de rastreamento foi concluída e a progenitura identificada, salvar o experimento (guia celular Editor janela/arquivo / salvar a árvore atual como) e prossiga para exportar os resultados.
- Exporte as árvores de linhagem e dados de célula no "menu exportação" localizado na janela do"Editor de célula". Da mesma forma, exportar o celular imagens e filmes através do menu de"exportação" acessível através da janela de"filme". As imagens, árvores de linhagem, dados e filmes serão exportados para a pasta de trabalho do tTt.
Resultados
O método descrito permite que questões críticas sobre a biologia celular de várias populações neurais para ser resolvido. Por exemplo, foi possível monitorar a progressão da linhagem neurogênica e oligodendrogliogenic de aNSCs7,8,14,18. Seguindo o único aNSCs e seus descendentes (Fig. 2A, B), foi possível demonstrar que aNSCs isolado em vitro manter sua natureza neurogênica, gerando principalmente neuroblastos, e que eles seguem uma sequência proposta em vivo19 mas não previamente demonstrado no nível da célula única. Além disso, este sistema de cultura permitiu assimétricas divisões celulares ser visualizado pela primeira vez na linhagem aNSC da SEZ (Figura 2B), fornecendo um modelo exclusivo para estudar o NSC auto-renovação8,14. Da mesma forma e independentemente da linhagem analisados, foi possível obter dados valiosos sobre o crescimento da pilha, as rodadas de divisão, viabilidade celular ou o comprimento do ciclo celular.
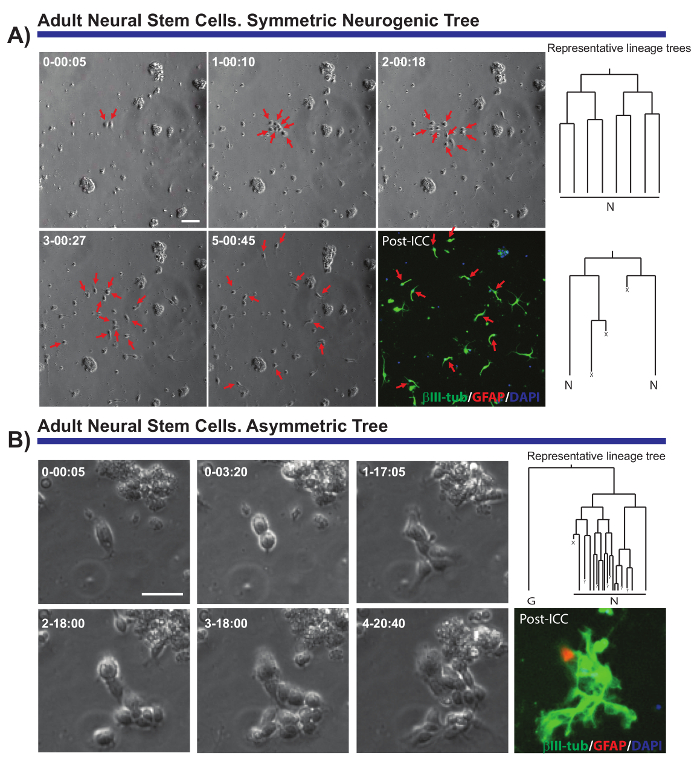
Figura 2. Exemplo de aNSCs isoladas da SEZ e analisadas por imagens ao vivo e única célula de rastreamento. Imagens de contraste de fase retratam a progressão do clone em pontos diferentes de tempo (dia-h: min). A imagem final corresponde a imunocitoquímica pós-imagem latente (PICC) para proteína ácida fibrilar Glial (GFAP, vermelho), βIII-tubulina (verde) e 4' 6-diamidino-2-phenylindole (DAPI, azul). (A) análise de árvores neurogênicos simétricas, através de diferentes rodadas amplificando as divisões para gerar neuroblastos pós-mitóticos. Setas vermelhas apontam para as células incluídas nas árvores simétricas. À direita, as árvores de linhagem correspondente aos clones e gerada pelo software tTt são exibidas. (B) exemplo de um progenitor gerando uma árvore neurogênica assimétrica, com um ramo, passando por amplificação divisões para produzir neuroblastos enquanto o outro dá origem a quiescente GFAP positivo as células através de um evento potencial de auto-renovação. À direita, a árvore de linhagem gerada pelo software tTt é exibida. Em todas as árvores de linhagem: "N" retrata neuroblastos pós mitóticos; "G", células quiescentes de GFAP positivo; "X", a morte celular; e "?" um celular perdido. Barra de escala representa 50 µm. clique aqui para ver uma versão maior desta figura.
Viver a imagem e única célula para análise de controle também fornece uma leitura precisa das capacidades de migratórias uma população neural. Tal informação foi Obtida de astrócitos Cerebelares pós-natal, submetidos a um risco de ferimento do ensaio20, gerando informações sobre a distância média percorrida pelos astrócitos, ao fechar a ferida (Figura 3). Além disso, era possível ver que alguns dos astrócitos dividida durante o processo de cicatrização, enquanto outros permanecem inalterados durante todo o experimento. Surpreendentemente, aqueles que divididos parecem apresentar comportamento migratório mais prolífico do que suas contrapartes não-dividindo (viajando duas vezes mais distante em média). Este fenómeno sugere uma heterogeneidade muito interessante na capacidade de formar uma cicatriz após a lesão, o que seria ter sido diluída na leitura de um experimento de análise de ponto de extremidade clássica astrócitos.
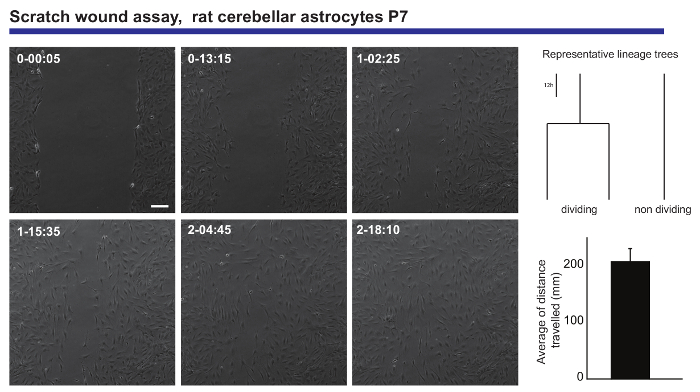
Figura 3. Análise do comportamento migratório de astrócitos Cerebelares pós-natal em um arranhão ferida do ensaio. Imagens de contraste de fase retratam a ferida em pontos diferentes de tempo (dia-h: min). Árvores de linhagem, geradas pelo software tTt, ilustram o comportamento representativo, em termos de divisão celular, dos astrócitos ao fechar a ferida. Histograma mostra a distância média percorrida pelos astrócitos analisados pela única célula de rastreamento (média ± no MEV mostrou). Barra de escala representa 50 µm. clique aqui para ver uma versão maior desta figura.
Outra característica interessante dos experimentos do vídeo-microscopia de lapso de tempo é a capacidade de comparar a proliferação e diferenciação em uma população celular. Nós testamos as células N2a chapeadas em condições que promovem a proliferação (na presença de 10% soro fetal bovino (FBS)) ou diferenciação (na presença de 0,5% FBS + ácido araquidônico de 10 µM). Foi possível acompanhar a progressão da linhagem dessas células sob condições proliferativas (Figura 4A), Considerando que a diferenciação de células não se proliferam e formam neuritos (Figura 4B). Notavelmente, única célula de rastreamento permitiu colônias com diferentes proliferação capacidades para ser distinto e alongamento do axônio (e retração) a ser avaliada, fornecendo dados precisos e quantitativos que posteriormente podem ser exportados.
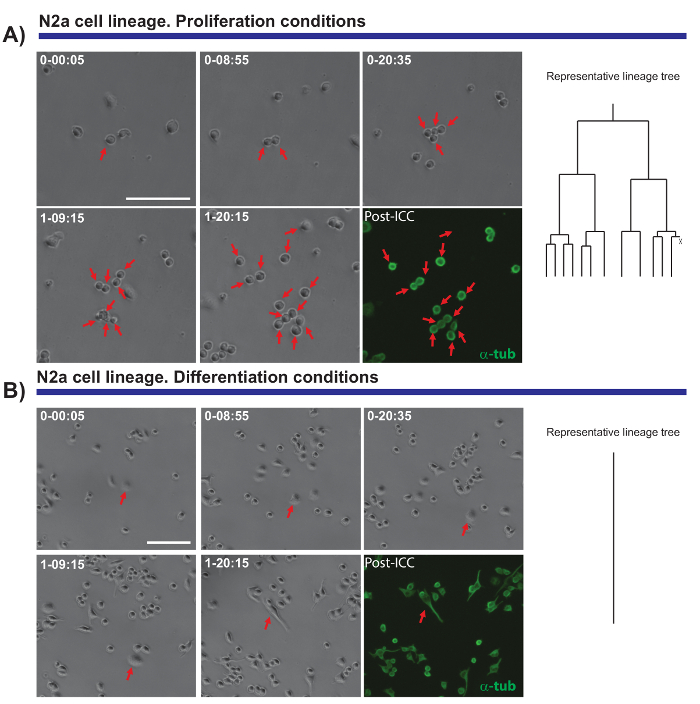
Figura 4. O monitoramento N2a da biologia das células em proliferação (A) ou condições de diferenciação (B). Imagens de contraste de fase retratando a progressão do clone em pontos diferentes de tempo (dia-h: min). A imagem final corresponde a imunocitoquímica pós-imagem latente (PICC) para α-tubulina (verde). (A) única célula de rastreamento permite que as rodadas de divisão a serem monitorados, bem como a heterogeneidade na resposta proliferativa de células diferentes. À direita, a árvore de linhagem gerada pelo software tTt ilustra o comportamento proliferativo de células N2a. (B) células sob condições de diferenciação a saída do ciclo celular e geram neuritos, um processo que pode efetivamente ser medido por análise de pós imagem. Rastreamento de celular o único, representada pela árvore de linhagem, à direita, ilustra como as células de N2a sair do ciclo celular e parem a divisão celular, em condições de diferenciação. Barra de escala representa 50 µm.Por favor clique aqui para ver uma versão maior desta figura.
Finalmente, viver de imagem e única célula de rastreamento é extremamente útil para monitorar alterações morfológicas e moleculares, quando as células são submetidas a reprogramação. Imagens ao vivo de astrócitos pós-natal transfectadas com homólogo Achaete-scute 1 (Ascl1) fornece dados valiosos sobre as alterações morfológicas que ocorrem durante a reprogramação ou o bloqueio da divisão celular quando astrócitos são ser reprogramada (consulte Figura 5). Além disso, quando Ascl1 transdução é combinada com a transdução de um construto de codificação para proteína de fluorescência verde (GFP) sob o controle do promotor Cortin duplo (DCX), é possível definir o ponto de hora exacta quando neuronal marcadores específicos começam a ser expressas nas células reprogramadas (Figura 5). Vídeo-microscopia de lapso de tempo também permite que o número de células que concluir com êxito a reprogramação de ser quantificado e comparado com as células que morrem durante este processo. Monitoramento de tais eventos levou à identificação de crítica "controle" nas células que foram reprogramadas com sucesso9.
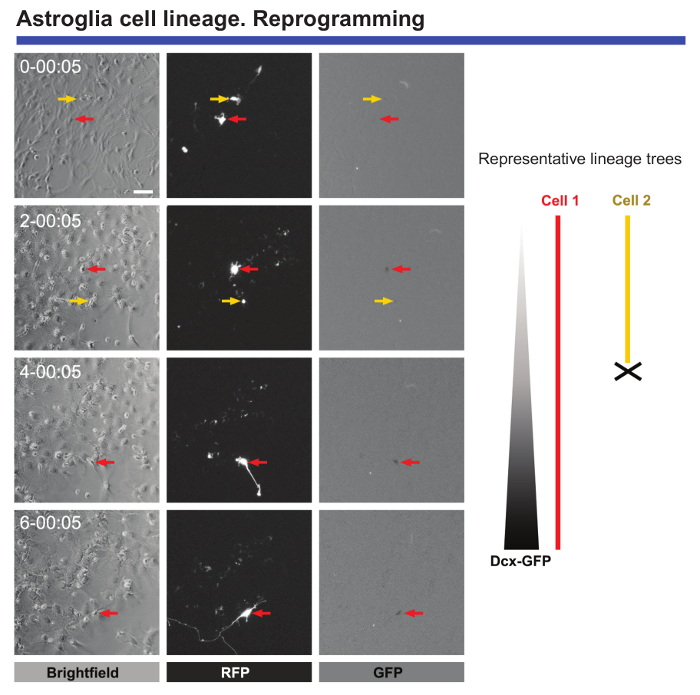
Figura 5. Análise de pós-natal astrócitos corticais submetidos a reprogramação neuronal. Reprogramação foi induzido por transdução com vetores de proteína (RFP) pro-neurogênica fluorescência vermelho-Ascl1. Neuronal conversão foi monitorado por transdução co com um vetor de codificação GFP sob o controle de um promotor DCX. Imagens de contraste de fase mostram a progressão da reprogramação em pontos diferentes de tempo (dia-h: min). Imagens de fluorescência de expressão RFP e GFP, respectivamente. Viver a imagem e única célula de rastreamento permitido eventos cruciais a serem seguidas, tais como alterações morfológicas, a ausência de divisão celular durante a reprogramação, morte celular, e a hora exacta quando células reprogramadas começam a expressar marcadores neuronais pode ser definida . Barra de escala representa 80 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Um dos valores mais importantes da imagem ao vivo é a possibilidade de realizar o rastreamento de linhagem precisos, elucidar aspectos críticos da progressão da linhagem em uma população neural. Rastreamento de linhagem é definido como a identificação e monitoramento de todos os descendentes de um único progenitor, do fundador do clone para o clone subsequente formou21. Notavelmente, métodos alternativos utilizados para linhagem de rastreamento (por exemplo, transdução viral ou repórter multicolor construções21) têm uma desvantagem crítica, segundo a qual o resultado final baseia-se ainda fotos e não necessariamente constituem a sequência inteira. Isto significa que a morte celular, heterogeneidade no comportamento da população celular, diluição, espalha ou pobre eficiência dos marcadores, juntamente com outras desvantagens importantes, levar a leituras incompletas ou incorretas dos resultados2. Além disso, a imagem ao vivo permite que o pesquisador analisar características importantes da biologia das populações neurais, como o modo e o momento da divisão celular, crescimento celular, migração, proliferação e diferenciação, o comprimento do ciclo celular, o axônio formação, complexidade e duração, célula de seleção de destino (diferenciação), ou conversão (reprogramação).
Além disso, imagens ao vivo podem ser facilmente complementada com outras análises se destina a obter dados de células únicas, tais como, por exemplo, a sequenciação do ARN. No entanto alcançar benefícios combinados de imagens ao vivo e outras técnicas requer que essas células anteriormente monitoradas nos filmes são mais tarde re-identificadas e recolhidas individualmente para a análise secundária. Isto pode ser conseguido por meio de microscópios que incluem coordenadas posicionais, aplicando repórteres fluorescentes para células específicas ou analisando a distribuição dos grupos de células como referências. Com efeito, a combinação do transcriptoma perfil e comportamento de células individuais podem representar um caminho poderoso para elucidar novas pistas moleculares envolvidos na biologia das células.
Um dos principais problemas que podem comprometer um experimento de imagem ao vivo é uma densidade de cultura celular inadequada. Como foi mencionado anteriormente, no alto densidade o excesso de detritos ou dissociação pobre (formação de moita) pode afetar a qualidade e a resolução espacial das imagens, tornando a única célula de rastreamento inviável. Portanto, as condições das populações celulares distintas em estudo devem ser ajustadas para o menor número de células possíveis sem comprometer a viabilidade da cultura de pilha.
A frequência de aquisição de imagem também é crucial e deve ser cuidadosamente ajustada, especialmente quando é usada a iluminação de fluorescência. Excesso de exposição ao transmitidos e especialmente luz de fluorescência pode comprometer a viabilidade celular. Alternativamente, um atraso excessivo entre a captura das imagens pode interferir com a resolução temporal da análise.
Outro passo crítico durante o experimento de imagens ao vivo é o periódico ajuste da focagem. Falha na correta configuração/re-setting da distância focal pode impedir que o controle de célula única. Além disso, é necessário verificar cuidadosamente que a câmara de incubação preserva a temperatura adequada, umidade e CO2 níveis, que altera as variações indesejadas que podem induzir a morte celular.
Finalmente, uma vez que o PICC tem sido realizado, é importante recuperar adequadamente a posição xyz zero antes da última rodada de aquisição de imagem. Re-configuração incorreta do XYZ zero posição tornará difícil combinar as imagens de contraste de fase e imunofluorescência, impedindo a identificação de descendência celular.
Embora essa abordagem tem muitas facetas positivas, algumas limitações para a geração de imagens ao vivo das populações neurais ainda persistem. Por exemplo, a densidade celular baixa necessária para executar o rastreamento de sucesso única célula de aNSCs torna impossível empregar ensaios bioquímicos, tais como a mancha14ocidental. Além disso, monitoramento rápido dividindo as populações como astrócitos Cerebelares ou células N2a é temporalmente restrito, como muitas vezes é muito difícil de rastrear as células como as culturas perto de confluência. Além disso, muitos métodos de cultura, bem como as restrições biológicas inerentes associadas com o isolamento de células, muitas vezes comprometem a viabilidade celular durante longos períodos, limitando a duração das experiências de imagens ao vivo. Finalmente, isolar as células do seu ambiente natural tem efeitos positivos e negativos. Células isoladas de seu nicho fisiológico podem falhar ao receber sinais importantes que modulam o comportamento deles, enquanto ao mesmo tempo, representa um poderoso meio para testar o efeito daqueles sinais individualmente na progressão da neural específico linhagem populações.
Dada as limitações descritas acima, é claro que seria o cenário perfeito metodológico para executar ao vivo de imagens e único experiências de rastreamento de pilha sob condições fisiológicas normais em vivo. No entanto, as técnicas atuais são incapazes de seguir células únicas por longos períodos de tempo em regiões profundas do cérebro2. Portanto, o futuro das imagens ao vivo deve centrar-se em superar essa limitação, com o objetivo de analisar totalmente a biologia celular de células únicas na vivo com a mais pequena possível interferência do ambiente fisiológico3.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos o trabalho de assistência e arte na Figura 1-Beatriz Gascon. Agradecemos também o Dr. C. Norris por sua assistência. O trabalho aqui apresentado foi apoiado por bolsas de investigação, "vermelho de excelencia iniciativa consolidar-Ingenio espanhol Ion Channel" (BFU2015-70067REDC), MEC (BFU2014-53654-P), CM (S2013/ICE-2958) BRADE, UCM-Santander (PR26/16-18B-3) e Fundación Ramon Programa de Areces Grant (PR2018/16-02). Felipe Ortega reconhece o Ramon y Cajal do programa do Ministério da economia espanhola e competitividade (MEC: RYC-2013-13290).
Materiais
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P0899 | Working solution 0.02 mg mL-1 |
| 24 wells plate | Falcon | 352047 | |
| Dulbecco’s modified Eagle’s medium (DMEM): F12 Nutrient Mixture medium (-L Glutamine) | Invitrogen | 21331-020 | |
| DMEM High Glucose medium | Sigma | D6546 | |
| Bovine Serum Albumin | Sigma | A6003 | |
| Triton X-100 | Merck | 11869 | non-ionic surfactant |
| Mouse anti-β III Tubulin | Sigma | T8660 | |
| Rabbit anti-GFAP | DakoCytomation | Z0334 | |
| Mouse anti-α Tubulin | Sigma | T5168 | |
| Anti-Mouse FITC | Jackson Laboratories | 715-095-150 | |
| Anti-Rabbit Cy3 | Jackson Laboratories | 711-165-152 | |
| Brightfield/Phase contrast/fluoresence microscope | Nikon | TE-2000-E | |
| CFI PLAN FLUOR DLLL 10X objetives | Nikon | Ref 280MRH10101 | |
| CFI SUPER PLAN FLUOR ELWD AMD 20X objetives | Nikon | Ref 280MRH48230 | |
| pE-300 LED fluorescence | Cool LED | Ref Number 1981 | |
| 310M-201 Incubation system (temperature) | OKO-Lab | Serial Nº VOF007307 | |
| Pro-ScanII Motorized stage system | Prior | Serial Nº 60018 | |
| High precision microscope camera version 4.2 | ANDOR Zyla | VSC-03650 | |
| Specifc software for live imaging with timelapse module: NIS-Elements AR4.5 | Nikon | NIS-Elements AR4.5 -Hasp ID: 13CE819E | |
| OKO touch Incubation system (CO2) | OKO-lab | Serial number 1716 | |
| Murine Neuro-2a Neuroblastoma Cell line | ATCC | ATCCCCL131 | |
| HEPES buffer solution 1 M | Invitrogen | 15630-056 |
Referências
- Conklin, E. G. The Mutation Theory From the Standpoint of Cytology. Science. 21 (536), 525-529 (1905).
- Ortega, F., Costa, M. R. Live Imaging of Adult Neural Stem Cells in Rodents. Front Neurosci. 10, 78 (2016).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nat Biotechnol. 34 (11), 1137-1144 (2016).
- Schroeder, T. Tracking hematopoiesis at the single cell level. Ann N Y Acad Sci. 1044, 201-209 (2005).
- Schroeder, T. Imaging stem-cell-driven regeneration in mammals. Nature. 453 (7193), 345-351 (2008).
- Etzrodt, M., Endele, M., Schroeder, T. Quantitative single-cell approaches to stem cell research. Cell Stem Cell. 15 (5), 546-558 (2014).
- Ortega, F., et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat Cell Biol. 15 (6), 602-613 (2013).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138 (6), 1057-1068 (2011).
- Gascon, S., et al. Identification and Successful Negotiation of a Metabolic Checkpoint in Direct Neuronal Reprogramming. Cell Stem Cell. 18 (3), 396-409 (2016).
- Karow, M., et al. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11 (4), 471-476 (2012).
- Kleiderman, S., et al. Conversion of Nonproliferating Astrocytes into Neurogenic Neural Stem Cells: Control by FGF2 and Interferon-gamma. Stem Cells. 34 (12), 2861-2874 (2016).
- Bunk, E. C., et al. Prox1 Is Required for Oligodendrocyte Cell Identity in Adult Neural Stem Cells of the Subventricular Zone. Stem Cells. 34 (8), 2115-2129 (2016).
- Aravantinou-Fatorou, K., et al. CEND1 and NEUROGENIN2 Reprogram Mouse Astrocytes and Embryonic Fibroblasts to Induced Neural Precursors and Differentiated Neurons. Stem Cell Reports. 5 (3), 405-418 (2015).
- Ortega, F., et al. Using an adherent cell culture of the mouse subependymal zone to study the behavior of adult neural stem cells on a single-cell level. Nat Protoc. 6 (12), 1847-1859 (2011).
- Heinrich, C., et al. Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nat Protoc. 6 (2), 214-228 (2011).
- Jimenez, A. I., et al. Potentiation of ATP calcium responses by A2B receptor stimulation and other signals coupled to Gs proteins in type-1 cerebellar astrocytes. Glia. 26 (2), 119-128 (1999).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotechnol. 34 (7), 703-706 (2016).
- Ortega, F., Berninger, B., Costa, M. R. Primary culture and live imaging of adult neural stem cells and their progeny. Methods Mol Biol. 1052, 1-11 (2013).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Yu, A. C., Lee, Y. L., Eng, L. F. Astrogliosis in culture: I. The model and the effect of antisense oligonucleotides on glial fibrillary acidic protein synthesis. J Neurosci Res. 34 (3), 295-303 (1993).
- Kretzschmar, K., Watt, F. M. Lineage tracing. Cell. 148 (1-2), 33-45 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados