Method Article
Isolamento de células endoteliais humanas do cólon Normal e Carcinoma colorrectal - um protocolo melhorado
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Células endoteliais de tumor são importantes determinantes do microambiente do tumor e o curso da doença. Aqui, um protocolo para o isolamento de células endoteliais puras e viáveis de carcinoma colorectal humana e cólon normal para ser usado em pesquisa de teste e patogênese da droga é descrito.
Resumo
As células primárias isoladas de carcinomas humanos são ferramentas valiosas para identificar mecanismos patogénicos, contribuindo para a progressão e desenvolvimento da doença. Em particular, células endoteliais (CE), que constituem a superfície interna dos vasos, diretamente participar na entrega de oxigênio, fornecimento de nutrientes e remoção de resíduos de produtos para e de tumores e desse modo proeminentemente envolvidos na constituição do tumor microambiente (TME). Células endoteliais de tumor (TECs) podem ser usadas como celulares biossensores do microambiente intratumoral estabelecido pela comunicação entre o tumor e as células do estroma. TECs também servem como alvos da terapia. Nesse sentido, na cultura destas células permitam estudos sobre os mecanismos de resposta ou resistência ao tratamento antiangiogênico. Recentemente, verificou-se que TECs isolaram de carcinoma colorectal humana (CRC) exposição memória-como efeitos baseados o TME específico, eles foram derivados. Além disso, estes TECs contribuam activamente para a criação de um TME específico pela secreção de fatores diferentes. Por exemplo, TECs em um prognóstico favorável TME-Th1 secretam a proteína supressora de tumor fator secretado de antiangiogênico, ácida e rica em cisteína, como 1 (SPARCL1). SPARCL1 regula a homeostase do navio e inibe a migração e proliferação de células do tumor. Portanto, culturas de TECs puros, viáveis, isolados de humanos tumores sólidos são uma ferramenta valiosa para estudos funcionais sobre o papel do sistema vascular na tumorigênese. Aqui, um novo protocolo atualizado para o isolamento de CE primário do cólon normal, bem como CRC é descrito. A técnica baseia-se na digestão enzimática e mecânica do tecido, immunolabeling e célula de fluorescência ativada (FACS) de classificação-classificação de células de tripla-positivo (CD31, VE-caderina, CD105). Com este protocolo, TEC viável ou culturas de células endoteliais normais (NEC) podem ser isoladas de tecidos do cólon, com uma taxa de sucesso de 62.12% quando submetido a ordenação de FACS (culturas CE puras 41 de 66 amostras de tecido). Por conseguinte, este protocolo fornece uma abordagem robusta para isolar as culturas humanas do CE de normal do cólon e CRC.
Introdução
O microambiente do tumor (TME) é definido como uma forte interação entre as células do tumor com o estroma do tumor, que é composta de células, como células endoteliais (CE), pericitos, fibroblastos, células musculares lisas ou células do sistema imunológico. A comunicação entre estes compartimentos celulares pode ser impulsionada por fatores parácrina (por exemplo, os fatores de crescimento angiogênico, citocinas), pela matriz extracelular ou contato direto de célula-célula. O compartimento do estroma pode promover ou neutralizar a iniciação do tumor ou progressão, dependendo o TME específico estabelecido.
A capacidade de um tumor para se conectar com o sistema de embarcação é a chave para a progressão e a metástase da doença. O sistema de embarcação permite o tumor predominantemente obter acesso para a entrega de oxigênio e nutrientes, bem como a remoção de resíduos de produtos1,2,3. CE constituem a superfície interna dos vasos e, portanto, são importantes componentes celulares que participam ativamente neste processo. É sabido que células endoteliais do tumor (TEC) são diferentes de suas células endoteliais normais (NEC) correspondentes por muitas características tais como perturbada hierarquia da árvore vascular, leakiness do navio, ou reduziram a maturação, como exemplificado por um número reduzido de células de pericitos/mural que são fracamente ligadas ao CE4.
Daí, TECs são ferramentas valiosas de celulares para estudar a carcinogênese. TECs foram considerados principalmente para promover o tumor de crescimento e progressão3. Assim, TECs podem ser usados como biosensores que permitem o monitoramento e identificação de processos patogênicos que iniciar, favorecer ou contrariar a tumorigênese. Além disso, eles são alvos terapêuticos na clínica5. Consequentemente, TECs isolados e CNE correspondente pode também ser usados como ferramentas para compreender os mecanismos de resposta ou resistência ao tratamento antiangiogênico.
No passado, nós desenvolvemos um protocolo para isolar essas células6,7 e identificado que TECs não são apenas diferentes do CNE, mas também diferem entre si dependendo da TME eles foram derivados de8. Através desta abordagem, foi mostrado que TECs em certos TMEs ativamente podem neutralizar o crescimento do tumor e progressão pela secreção de antiangiogênico supressora de tumor proteínas tais como SPARCL1. Isto indicou que TECs ativamente contribuindo para o estabelecimento de um prognóstico favorável TME em carcinoma colorectal humana (CRC)8.
Estudos anteriores tentaram isolar humanas TECs de tumores sólidos. Era um objetivo importante desses estudos, por exemplo, a identificação do novo tumor célula endotelial marcadores (TEMs)9. Uma estratégia de uso imediato de TECs depois do laser microdissection foi aplicado para evitar a alteração ou perda do fenótipo TEC em cultura. No entanto, estudos de seguimento identificaram uma população contaminante das células murais como uma séria desvantagem esta abordagem10. Nosso laboratório foi o primeiro a desenvolver um protocolo que permitiu o isolamento de TECs puros, viáveis de humano CRC pacientes6,7. Uma abordagem com várias rodadas de seleção (MACS) célula magnética de TECs que garantiu alta pureza das culturas isoladas CE foi escolhida. No entanto, esta abordagem exigido um período relativamente longo período de cultivo (6 semanas em média), que aumentou o risco de artefactos induzida pela cultura. Portanto, na próxima etapa, o objetivo era reduzir o tempo de cultivo entre a cirurgia e a colheita da primeira cultura pura. Para atingir este objetivo, um protocolo melhorado empregando uma dissociação de tecido combinado de mecânicos e enzimáticos baseados do tumor inicial, seguido por célula de fluorescência ativada (FACS) de classificação-classificação da triplo-rotulado CE, foi desenvolvido. Isso reduziu o tempo de isolamento em média de três semanas, resultando em culturas puras de TEC e NEC com maior viabilidade para estudos funcionais. Isolamento de culturas puras viáveis de TEC e NEC de tecidos humanos com altas taxas de sucesso pode abrir novas vias para testes durante o desenvolvimento de regimes de terapia individualizada de drogas específicas do paciente. A abordagem de isolamento é detalhada nos parágrafos seguintes.
Protocolo
O processo de isolamento foi aprovado pelo Comitê de ética local da Universidade Medical Center Erlangen (#159_15 B, TuMiC-estudo). Critérios de inclusão do paciente foram: CRC, UICC estágio I a IV, sem história de doença inflamatória intestinal e nenhum tratamento neoadjuvante.
1. cirurgia e preparação do tecido para isolamento de célula única
- Obter a amostra através de cirurgia de um paciente CRC (tecido de carcinoma > 0,5 g, tumor não-necrótico central; tecido normal do cólon > 10 cm distante do local do tumor).
- As peças de tecido obtidos são na sua maioria < 1 g para o carcinoma, mas > 1 g para o cólon normal. Se peças > 1G são obtidos, dividi-los em vários pedaços de 1g usando um bisturi fresco para subsequente transformação de tecido.
Nota: Se o pedaço de tecido do tumor for inferior a 0,5 g desde o início, o isolamento geralmente falha. - Coletar fresco unfixed pedaços de tecido, usando Pinças esterilizadas em 40 mL de gelo frios Hanks equilibrada solução salina (HBSS) suplementada com penicilina/estreptomicina/amphothericin B (1% HBSS-caneta/estreptococos/anfotericina) em tubos de centrífuga de 50 mL e transferi-los rapidamente para o laboratório.
Nota: Tecido do cólon é frequentemente altamente contaminado com bactérias/fungos, desde o início. Durante todo o processo de isolamento, caneta/estreptococos/anfotericina deve ser adicionada à todas soluções para eliminar organismos contaminantes. - Lave cada pedaço de tecido pelo menos 4 vezes com gelo 40 mL fria HBSS-caneta/estreptococos/anfotericina (consulte a etapa 1.3) em tubos de centrífuga de 50 mL por transferir as peças de tecido sequencialmente de um tubo para o próximo tubo usando Pinças esterilizadas.
- Pinça limpa após cada etapa com etanol a 70%.
- Use pinça separada para o carcinoma e pedaços de tecido normal do cólon.
- Pese todas as peças de tecido.
Nota: Não coloque pedaços de tecido diretamente sobre uma balança para pesagem. Após a lavagem, pese o último tubo de centrífuga contendo o tecido antes e depois de introduzir as peças de tecido. Calcule o peso das peças de tecido individuais por subtração.
2. geração de célula única suspensão
Nota: É recomendável manter o tecido hidratado em todos os momentos.
- Se ele existir, remova gordura anexada, outro tecido não-tumoral ou partes de tecido necrótico potencialmente do espécime cirurgia transferindo os pedaços de tecido em um prato de petri de cultura celular estéril usando Pinças esterilizadas.
- Manter as peças de tecido hidratadas em todos os tempos pela adição de 3-5 mL de HBSS-caneta/estreptococos/anfotericina.
- Corte os pedaços de tecido, usando um bisturi estéril fresco (Figura 1). No caso de identificação de tecido é clara, consulte uma patologista.
- Pique o restante tecido em pedaços pequenos (aproximadamente de 2 × 2 × 2 milímetros3) usando um bisturi fresco com uma lâmina curvada. Transfira os pedaços de tecido com Pinças esterilizadas para tubos de dissociação do tecido (por exemplo, tubos de gentleMACS C) pré-preenchido com pré-aquecido (37 ° C) meio de cultura celular (modificado de Dulbecco´s médio médio de basal [DMEM] águia) de acordo com as indicações do fabricante instruções.
Nota: Tente usar o bisturi como uma ferramenta de balanço. Não esprema as células a fim de evitar danos aos tecidos. - Digest/dissociar pedaços de tecido usando um Dissociador de tecido (como gentleMACS Octo dissociador) em combinação com o kit de dissociação de tumor de tecido humano, usando as instruções do programa "37C_h_TDK_1" o manufacturer´s a seguir.
- Centrifugar tubos de dissociação para 1 min a 300 x g, à temperatura ambiente (RT).
- Adicionar 10 mL de pré-aquecido (37 ° C) DMEM suplementado com 0,5% soro bovino fetal (FBS) (DMEM-Low) para cada tubo utilizando uma pipeta sorológica e filtrar a suspensão de células usando um coador de célula (tamanho de poro de 100 µm) em cima de um tubo de centrífuga de 50 mL por pipetagem da célula suspensão em cima do filtro.
- Adicionar 10 mL de DMEM-Low novo para cada tubo de MACS por uma pipeta sorológica e transferir células restantes para o filtro de célula na parte superior do tubo de centrífuga de 50 mL.
- Lave o filtro célula uma vez com um adicional 10 mL de meio DMEM-Low com uma pipeta sorológica.
- Centrifugar a suspensão de eritrócitos para 7 min a 300 x g em RT e descartar o sobrenadante.
- Ressuspender as células em 5 mL de meio basal endotelial pré-aquecido (EBM) -2-microvascular (MV) suplementado (Lonza) com anfotericina/caneta/estreptococos do mesmo tubo de centrífuga de 50 mL.
- Suspensão de células de placa num balão de cultura de células T-25 pré-revestido durante a noite com 1,5% salino de gelatina-tamponado fosfato (PBS) a 37 ° C com 5% de CO2.
- Incubar as células por 24 h a 37 ° C e 5% de CO2, lavar as células duas vezes cuidadosamente com aproximadamente 5 mL de PBS e adicionar 5 mL de meio fresco.
- Cultive as células em 37 ° C e 5% de CO2 até 80-90% confluência (geralmente 5-7 dias), com intervalos de 48 h de renovação médio.
3. FACS-classificação das células endoteliais
Nota: Tente evitar a perda de células em qualquer ponto, por exemplo, limitando o processo de coloração para incubação das células em um tubo único reagente.
- Separar células com 1 mL de accutase (aproximadamente 10 min) e adicionar 4 mL de meio de EBM-2-MV pré-aquecido (37 ° C).
- Determine a contagem de células usando uma célula automatizada contando dispositivo (faixa 10-25 µm).
- Centrifugar a suspensão de células para 4 min com 250 g de x no RT e descartar o sobrenadante.
- Ressuspender as células em pré-aquecido FACS-buffer (1X PBS, 2,5% albumina de soro bovino [BSA], pH de 5 mM EDTA 8.0, 10 µM Y-27632) de acordo com a contagem de células (5 x 106/mL).
- Acrescente os anticorpos FACS-coloração de acordo com o volume das células contagem/FACS-tampão: CD31-FITC (100 µ l/mL = 1/10), CD144/vascular endotelial (VE) - caderina - PE (100 µ l/mL = 1/10), CD105-APC (25 µ l/mL = 1/40), misturar e incubar durante 7 min na RT, protegido da luz; delicadamente, flick e incube por mais 8 minutos (para um tempo de incubação no total de 15 min).
- Adicione 2 mL de tampão de FACS à suspensão rotulado de células usando uma pipeta sorológica.
- Centrifugar durante 4 min com 250 g de x no RT e descartar o sobrenadante.
- Lave duas vezes com a adição de 2 mL de tampão-FACS e conduzir uma subsequente centrifugação durante 4 min em x 250g em RT e descartar o sobrenadante.
- Ressuspender as células em 500 µ l de pré-aquecido EBM-2-MV-caneta/estreptococos/anfotericina e células de transferência do instrumento de ordenação de FACS.
- Células endoteliais morrerá rapidamente durante o processo de classificação, se o instrumento-FACS é resfriado. Portanto, realizar triagem das células endoteliais no RT e transferir imediatamente as células coletadas para incubadora a 37 ° C depois.
Nota: O FACS-instrumento é geralmente não esterilizado!
- Células endoteliais morrerá rapidamente durante o processo de classificação, se o instrumento-FACS é resfriado. Portanto, realizar triagem das células endoteliais no RT e transferir imediatamente as células coletadas para incubadora a 37 ° C depois.
- Células de tripla-positivo tipo/coletar diretamente em uma placa de cultura de células (por exemplo, 24-placa pré-revestido durante a noite com 1,5% gelatina-PBS) preenchidas com 0,5 mL de meio fresco pré-aquecido (EBM-2-MV-caneta/estreptococos/anfotericina).
Nota: Verifique a suspensão de células após a classificação usando um microscópio. Se as células de cluster juntos, tente obter uma distribuição de célula até a placa de cultura de células misturá-los lentamente ou adicionando médio. - Cultivar as células até a confluência de 90-100% com intervalos de 48 h de renovação médio e expandir as células para o tamanho do prato de cultura desejada (placa 24 → 12-placa → 3,5 cm prato → T-25 → T-75).
4. colheita e caracterização de células endoteliais puras
- Células na confluência de 90-100% da colheita e caracterizá-las por um método adequado (por exemplo, FACS, Citoquímica, reação em cadeia da polimerase quantitativa (qPCR) ou célula endotelial função ensaios7,8).
- Analise células isoladas com qualquer método de caracterização é escolhido.
Resultados
O isolamento da NEC e TEC de CRC humana por uma dissociação de tecido combinado de mecânica/enzymatical, seguida por subsequentes CD31/CD105/VE-caderina-driven FACS-classificação é descrito aqui (Figura 1A). Este protocolo representa um protocolo melhorado com uma janela de tempo reduzido até a primeira colheita de células endoteliais puras, viáveis em comparação com o anterior protocolo baseado em MACS7.
NEC e TEC foram isoladas de CRC humano usando as seguintes etapas: (1) geração de uma suspensão de célula única por dissociação de tecido combinado de mecânicos e enzimáticos e crescimento destas células a confluência de 80-90% (Figura 1), (2) o triplo de rotulagem da CE por anticorpos acoplados fluorocromo do CD31/CD105/VE-caderina e FACS (3)-classificação das respectivas células triplo-positivo(Figura 2). Digno de nota, um passo crítico para o sucesso do processo de isolamento e a viabilidade das células são rapidamente submeter a amostra de cirurgia para o procedimento de isolamento (geração de suspensão única célula < 1 hora após a ressecção). Usando FACS-classificação, média de 12.500 TEC (n = 12) e 17.800 NEC (n = 12, Figura 2B, à esquerda) que representa uma média de 3,6 e 5,6% da população total da célula (Figura 2B, direita) pode ser isolado. Posteriormente, as células foram expandidas até T-75 (denominado passagem 1) e colhida ou mais processada para análise. Digno de nota, usando o protocolo anterior baseado em MACS, foi alcançado um sucesso de isolamento média de 49,6% (n = 58 TECs puros de n = 117 pacientes8) com CE puro culturas disponíveis em média 6 semanas após a cirurgia. Usando o protocolo de FACS-baseado novo descrito aqui, as primeiras culturas puras de CE foram obtidas em média 3 semanas após a cirurgia com uma taxa de sucesso de isolamento de 62,1% (n = 41 culturas puras de CE obtidas de n = 66 único células suspensões submetidas a ordenação de FACS). Portanto, um aumento de 12,5% a taxa de isolamento foi alcançado em paralelo com uma diminuição do tempo de cultivo de 6 para 3 semanas. Esta redução do tempo de cultivo levou a viabilidade celular melhorada e prolongada vida útil, acompanhado de menos exposição para a indução de potenciais artefatos de cultura dependente das culturas estabelecidas.
Caracterização da pureza de CE foi conduzida primeiramente por CD31-Citoquímica(Figura 3). Se as culturas eram desprovidas de células CD31-negativo (Figura 3A, TEC e NEC), eles foram submetidos a uma célula mais detalhada digitando por transcrição reversa quantitativa cadeia da polimerase (RT-qPCR) (Figura 3B). Utilizaram-se primers específicos de tipo de célula para CE (CD31, CD105, VE-caderina e von Willebrand factor [vWF]), leucócitos (CD45), células epiteliais (citoqueratinas [CK] -20) e células de músculo liso/fibroblastos (desmin) (Figura 3B). Usando este celular baseado em qPCR digitando, uma potencial contaminação das culturas CE por outras células na faixa de 0,1 - 2%, dependendo do tipo de célula, pode ser detectado8.
Notavelmente, relatamos anteriormente uma perda preferencial de expressão de proteínas vWF em culturas TEC em comparação com sua correspondente NEC culturas7. Esses achados podem ser confirmados com o protocolo de isolamento recém-criada (Figura 3C, significa perda de Ct NEC-TEC = 0,687, p = 0.173, emparelhado o teste-t). Culturas com êxito passando esses controles de qualidade foram testadas para a infecção do mycoplasma e posteriormente usadas para novas experiências.
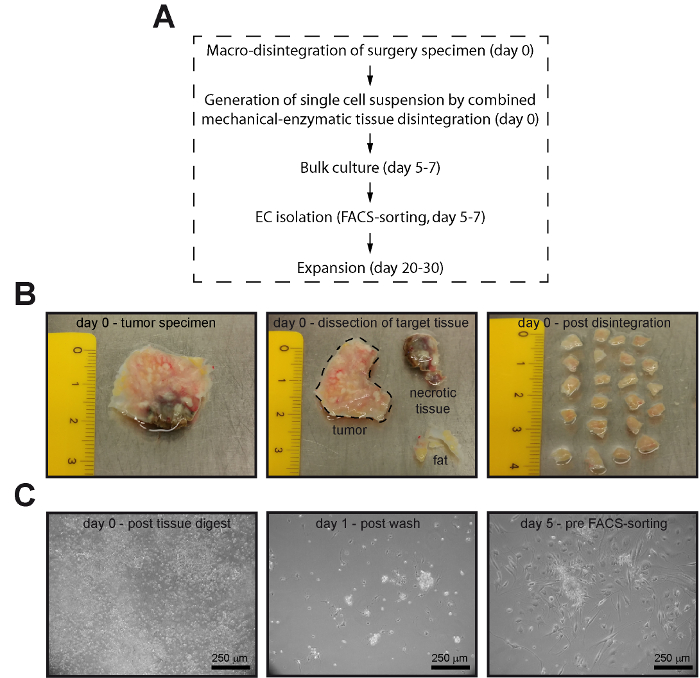
Figura 1 : Células endoteliais puras podem ser isoladas do cólon normal humano e CRC classificando FACS. (A) fluxograma das etapas essenciais do processo de isolamento de CE. (B) tecido adiposo (amarelo), outras partes não-tumoral, ou partes de tecido necrótico potencialmente (marrom) foram retirados da amostra de cirurgia (painel esquerdo e meio) e o tumor foi desintegrado em cubos de 2-3 mm de comprimento de lado antes de tecido (de dissociação painel direito). (C), a única célula suspensão obtida após dissociação de tecido (painel esquerdo) foi incubada durante 24 h em pratos de cultura de células. Posteriormente, as células não-aderentes foram removidas por lavagem suave usando PBS (painel central) e as células foram cultivadas a confluência de 80-90% antes da ordenação de FACS (painel direito). Imagens do painel inferior (C) foram adquiridas pela microscopia de contraste de fase. Clique aqui para ver uma versão maior desta figura.
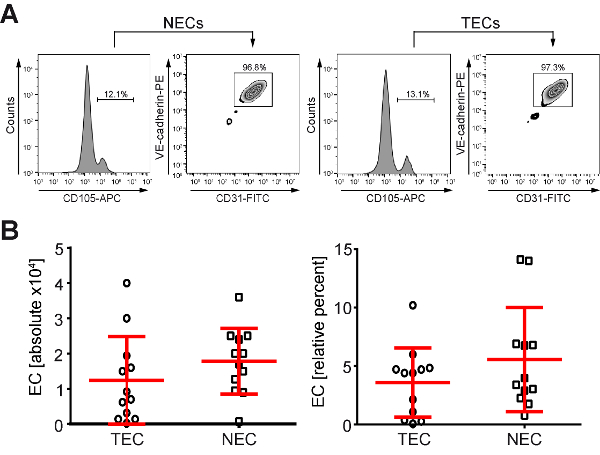
Figura 2 : Uma média de 3.6-5.6% de suspensão de célula única isolados de pacientes humanos CRC e classificados por FACS foram triple-positivo EC. (A) NEC e TEC foram FACS-classificados usando um triplo rotulagem das células com anticorpos anti-CD31, - CD105 e caderina - VE. (B), uma média de 12.500 TECs (n = 12) e 17.800 CNE (n = 12) pode ser isolada do cólon normal humano ou CRC usando FACS-classificação (CD31 CD105 células e VE-caderina-positivo, deixada o painel), que representa, em média, 3,6 e 5,6% (painel direito) da célula total população empregada. Clique aqui para ver uma versão maior desta figura.
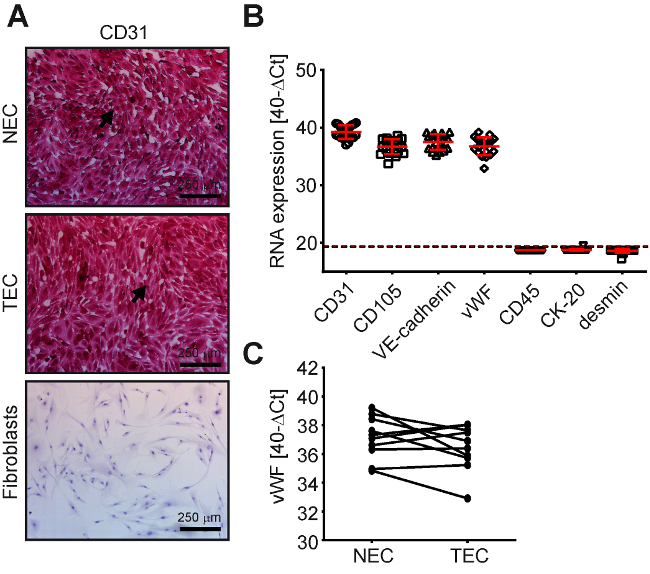
Figura 3 : NEC e TEC de CRC humana expressam marcadores de células endoteliais típicas. Células endoteliais normais do cólon (NEC, n = 10) e tumor de células endoteliais (TEC, n = 10) de CRC humana são CD31 (marcador de CE)-, CD105 (marcador de CE)-, VE-caderina (marcador de CE)-, vWF (marcador de CE) - positivo e CK20 (marcador de célula CRC)-, desmin (marcador de fibroblasto/SMC)-, CD45 ( marcador de leucócitos)-negativo conforme determinado pelo (A) CD31-imunocitoquímica (células positivas = vermelho) e (B) RT-qPCR (pontos de dados abaixo da linha tracejada são amostras detectadas ser negativo). (C) expressão de vWF conforme determinado pelo RT-qPCR para amostras TEC/NEC correspondentes dos mesmos pacientes. Clique aqui para ver uma versão maior desta figura.
Discussão
Principalmente, três métodos diferentes têm sido empregados até agora para isolar pura e viável CNE e TECs de tecidos sólidos humanos, ou seja (1) Fima enriquecimento microdissection do laser (2) e (3) FACS-classificação da fração CE. Na maioria das publicações, Fima enriquecimento das células após a geração de uma suspensão de célula única por desintegração mecânica foi usado11,12,13. Por exemplo, Fima purificação de humano dérmica microvascular CE (HDMEC) por anticorpos E-selectina depois de fator de necrose tumoral (TNF)-tratamento de α de prepúcios neonatal13 tem sido relatado para o isolamento da CE humana de glioma por tecido digerir, gradiente de percoll e seleção usando anti-CD31/CD105 e VE-caderina-anticorpos12, ou por anticorpos anti-CD105 do humano peito carcinoma11. Protocolos que empregados do laser microdissection ou FACS-classificação têm sido relatados com menos frequência. Microdissection do laser foi usado, por exemplo, para identificar potencial pan-tumor marcadores de células endoteliais (TEMs) na CE derivada de carcinoma colorectal humana com a análise das células imediatamente após dissecação9. FACS-classificação usando anticorpos-anti-CD31 foi demonstrou com sucesso para o isolamento da fração CE embrionárias indiferenciadas humano tronco células14.
Estas abordagens têm diferentes vantagens e desvantagens que devem ser considerados. As vantagens para a abordagem baseada em Fima são que nenhum equipamento elaborado é necessário, a seleção pode ser realizada a qualquer momento, e o enriquecimento de célula é rápida (aproximadamente 15 min) em comparação com ordenação de FACS (cerca de 1 h). A falta de matriz por um longo período de tempo pode induzir a morte celular da CE por anoikis. Portanto, a adição do inibidor quinase rho Y-27632 para o buffer de FACS foi contratada para impedir a célula anoikis15.
As desvantagens de enriquecimento Fima são que várias rodadas de seleção são necessárias para alcançar a pureza acima de 99%. Além disso, cultivo celular entre avanços é necessário para recuperação de célula, o que aumenta a idade das culturas induzida pela cultura artefatos de apoio. Microdissection do laser tem a vantagem de que as células podem ser usados imediatamente que reduz artefatos induzida pela cultura, mas inclui o risco de contaminação pelas células do tecido adjacente áreas10. Além disso, microdissection não é estabelecido em cada laboratório. As desvantagens da abordagem FACS-classificação-baseado incluem, semelhante ao laser microdissection, que o equipamento é elaborado e onerosos. Por conseguinte, este equipamento não pode ser acessado a qualquer momento. Em um ambiente clínico, onde a disponibilidade do tecido de interesse não pode ser exatamente planejada, isto pode adicionar uma outra desvantagem.
No entanto, as vantagens principais de FACS-classificação são que a fração de CE pode ser etiquetada por vários anticorpos em paralelo. Assim, pode ser empregada uma estratégia associada rigorosa que assegure um elevado grau de pureza. Com base na experiência, nenhuma re-classificação da fração CE foi exigido, em contraste com o anterior protocolo baseado em MACS onde várias rodadas de seleção tinham que ser empregado. Isto levou a um tempo de cultivo significativamente reduzida até pureza de seis semanas (abordagem de MACS) para três semanas na abordagem FACS, resultando em uma viabilidade celular melhorado permitindo uma janela de tempo prolongado da análise. Finalmente, usando a estratégia de FACS-classificação-baseado, uma melhoria da taxa de sucesso de isolamento total poderia ser alcançado (um aumento de 12,5%). Em conclusão, a ordenação de FACS baseados 3 anticorpos empregando de estratégia em paralelo após digerir tecido por digestão combinada tecidos mecânicos e enzimáticos tinha inúmeras vantagens que estabeleceram este protocolo como o método de escolha para o isolamento de TECs e a CNE de carcinoma colorectal humana e cólon.
Divulgações
Os autores declaram que eles têm não tem interesses concorrente.
Agradecimentos
Agradecemos Christian Flierl, Katja Petter, Christina Schnürer (toda divisão de Molecular e Cirurgia Experimental), Uwe Appelt, Michael Mroz (núcleo unidade FACS-classificação) e Simon Völkl (núcleo unidade FACS-Immunomonitoring) para obter assistência técnica excelente. Este trabalho foi financiado por doações ao pt/MS do centro interdisciplinar para pesquisa clínica (IZKF) da Universidade Medical Center Erlangen, Fundação de pesquisa alemã (DFG: para 2438, SP2) e o Lutz-Stiftung, por uma concessão da Robert-Pfleger-Stiftung para VSS, bem como por subvenções concedidas a MS da Fundação de pesquisa alemã [DFG: KFO257 (sub-projeto 4), SFB 796 (sub-projeto B9)].
Materiais
| Name | Company | Catalog Number | Comments |
| HBSS 1x | Gibco by Life Technologies | 14175-053 | |
| Penicillin-streptomycin | Gibco by Life Technologies | 15140-122 | |
| amphotericin B | Gibco by Life Technologies | 15290-026 | |
| Scalpels, disposable | Feather | No. 23 | |
| gentleMACS octo dissociator | Miltenyi Biotec | 130-095-937 | |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | |
| human tumor dissociation kit | Miltenyi Biotec | 130-095-929 | |
| DMEM | Gibco by Life Technologies | 21969-035 | |
| EGM-2-MV BulletKit | Lonza | CC-3202 | |
| Cell strainer, 100 µm | Falcon | 352360 | |
| StemPro Accutase | Gibco by Life Technologies | A11105-01 | |
| Cell counter, automated | Coulter Counter | Z1 | |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| CD31-FITC | BD Pharmingen | 555445 | |
| CD144/VE-cadherin-PE | BD Pharmingen | 560410 | |
| CD105-APC | BD Pharmingen | 562408 | |
| gelatin from bovine skin | Sigma-Aldrich | G9391 | |
| FACS-Sorting device | Beckman Coulter | MoFlo XDP |
Referências
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9 (6), 713-725 (2003).
- Hurwitz, H., et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 350 (23), 2335-2342 (2004).
- Naschberger, E., Schellerer, V. S., Rau, T. T., Croner, R. S., Stürzl, M. Isolation of endothelial cells from human tumors. Methods Mol Biol. 731, 209-218 (2011).
- Schellerer, V. S., et al. Endothelial cells of human colorectal cancer and healthy colon reveal phenotypic differences in culture. Lab Invest. 87 (11), 1159-1170 (2007).
- Naschberger, E., et al. Matricellular protein SPARCL1 regulates tumor microenvironment-dependent endothelial cell heterogeneity in colorectal carcinoma. J Clin Invest. 126 (11), 4187-4204 (2016).
- St Croix, B., et al. Genes expressed in human tumor endothelium. Science. 289 (5482), 1197-1202 (2000).
- Christian, S., et al. Endosialin (Tem1) is a marker of tumor-associated myofibroblasts and tumor vessel-associated mural cells. Am J Pathol. 172 (2), 486-494 (2008).
- Grange, C., et al. Isolation and characterization of human breast tumor-derived endothelial cells. Oncol Rep. 15 (2), 381-386 (2006).
- Miebach, S., et al. Isolation and culture of microvascular endothelial cells from gliomas of different WHO grades. J Neurooncol. 76 (1), 39-48 (2006).
- Richard, L., Velasco, P., Detmar, M. A simple immunomagnetic protocol for the selective isolation and long-term culture of human dermal microvascular endothelial cells. Exp Cell Res. 240 (1), 1-6 (1998).
- Nourse, M. B., et al. VEGF induces differentiation of functional endothelium from human embryonic stem cells: implications for tissue engineering. Arterioscler Thromb Vasc Biol. 30 (1), 80-89 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados