Method Article
정상적인 대 장 암과 대 장 암-향상 된 프로토콜에서 인간의 내 피 세포의 고립
* 이 저자들은 동등하게 기여했습니다
요약
종양 내 피 세포는 종양 microenvironment의 중요 한 결정 요인 및 질병의 과정. 여기, 인간 대 장 암 및 마약 테스트 및 병 인 연구에 사용 될 일반 콜론에서 순수 하 고 가능한 내 피 세포의 고립에 대 한 프로토콜을 설명 합니다.
초록
1 차 셀 인간의 carcinomas에서 격리는 질병 개발 및 진행에 기여 하는 병원 성 메커니즘을 식별 귀중 한 도구입니다. 내 피 세포 (EC), 혈관의 안쪽 표면을 구성 직접 종양, 산소 공급, 영양 공급, 및 폐기물을 제거에 참여 하 고 그로 인하여 눈에 띄게 종양의 헌법에 관련 된 특히, microenvironment (TME)입니다. 종양 내 피 세포 (TECs) 종양 및 stromal 세포 간의 통신에 의해 설립 intratumoral microenvironment의 바이오 세포 센서로 사용할 수 있습니다. TECs 또한 치료의 대상으로 제공합니다. 따라서, 문화 이러한 세포 응답 또는 안티-신생 치료에 저항 메커니즘에 연구 수 있습니다. 최근, TECs 인간 대 장 암 (CRC)에서 전시 메모리 효과에서 파생 된 그들은 특정 TME에 따라 절연 발견 했다. 또한, 이러한 TECs 적극적으로 기여할 특정 TME의 설립에 다른 요인의 분 비에 의해. 예를 들어 prognostically 유리한 Th1 TME에 TECs 안티 신생 종양 진압 인자 분 비 단백질, 시스테인 같은 1 (SPARCL1)에서 풍부 하 고 산 성 분 비. SPARCL1 선박 항상성 조절 하 고 억제 하는 종양 세포 증식 및 마이그레이션. 따라서, 순수 하 고, 가능한 TECs 인간의 단단한 종양에서 고립의 문화 tumorigenesis에 혈관 시스템의 역할에 대 한 기능 연구를 위한 유용한 도구가 있습니다. 여기, CRC로 서 정상적인 콜론에서 기본 EC의 격리에 대 한 새로운 최신 프로토콜을 설명 합니다. 소화 기계 및 효소 조직, immunolabeling, 및 형광 활성화 셀 정렬 (FACS)를 기반으로 하는 기술-트리플-긍정적인 세포 (CD31, VE cadherin CD105)의 정렬. 이 프로토콜을 가능한 TEC 또는 정상적인 내 피 세포 (NEC) 문화 수 FACS 정렬 대상이 62.12%의 성공률와 함께 결 조직 으로부터 분리 (41 순수 EC 문화 66 조직 샘플에서). 따라서,이 프로토콜 정상적인 결 장 및 CRC에서 인간의 EC 문화를 분리 하는 강력한 접근 방식을 제공 합니다.
서문
종양 microenvironment (TME)와 내 피 세포 (EC), pericytes, 섬유 아 세포, 평활 근 세포, 면역 세포 등 세포의 구성 된 종양 기질 종양 세포의 가까운 상호 작용으로 정의 됩니다. 이러한 세포 구획 간의 통신 기질, 또는 직접 셀 접촉 paracrine 요인 (예, 신생 성장 인자, cytokines)에 의해 구동 수 있습니다. Stromal 구획 육성 하거나 중화 종양 개시 또는 특정 TME 설립에 따라 진행.
선박 시스템으로 연결 하는 종양의 능력 진행 및 질병의 전이 핵심입니다. 선박 시스템 종양을 주로 산소와 영양소의 공급 뿐만 아니라 폐기물1,2,3의 제거에 액세스할 수 있습니다. EC, 혈관의 안쪽 표면 구성 되며 따라서이 과정에 적극적으로 참여 하는 중요 한 세포 구성 성분. 그것은 잘 알려진 종양 내 피 세포 (TEC) 그들의 해당 정상 내 피 세포 (NEC) 혈관 트리, 선박 시키는 방해 계층 등의 많은 기능에 의해 다른 또는 성숙의 감소 된 수에 의해 exemplified 감소 pericytes/벽화 EC4에 느슨하게 연결 된 셀입니다.
따라서, TECs 발암 연구에 귀중 한 셀룰러 도구입니다. TECs 주로 종양 성장과 진행3육성로 간주 됐다. 따라서, TECs 모니터링을 허용 하는 바이오 센서 및 시작, 포스터, 또는 tumorigenesis 중화 하는 병원 성 프로세스의 id로 사용할 수 있습니다. 또한, 그들은5클리닉 치료 대상입니다. 따라서, 격리 TECs 및 해당 자문위도 사용할 수 있습니다 도구로 응답 또는 안티-신생 치료에 저항을의 메커니즘을 이해 하.
과거에는, 우리가 이러한 셀6,7 을 프로토콜 개발과 TECs는 뿐만 아니라 다른 자문위, 하지만 또한 그들은8에서 파생 했다 TME 다릅니다 서로 확인. 이 접근 방식을 통해 보였다 TECs 특정 TMEs에 종양 성장과 진행에 적극적으로 중화 수 있습니다 SPARCL1 같은 안티-신생 종양 진압 단백질의 분 비에 의해. 이 TECs 인간 대 장 암 (CRC)8에서 prognostically 유리한 TME의 설립에 적극적으로 기여 하는 것을 나타냅니다.
이전 연구 단단한 종양에서 인간의 TECs 격리 하려고 했습니다. 이러한 연구의 중요 한 목표를 했다, 예를 들어, 새로운 종양 내 피 세포 마커 (대금)9의 식별. TECs 레이저 서 변경 피하기 위하여 적용 된 후의 즉각적인 사용 또는 문화에 TEC 표현 형의 손실의 전략. 그러나, 후속 연구 식별이 접근10의 심각한 단점으로 벽 세포의 오염 인구. 연구소는 순수 하 고, 가능한 TECs 인간의 CRC 환자6,7에서 격리를 허용 하는 프로토콜 개발 처음 이다. 격리 된 EC 문화의 순도 보장 TECs의 여러 자기 셀 선택 (MAC) 라운드와 접근 선정 되었다. 그러나,이 방법은 비교적 긴 재배 기간 평균 (6 주), 문화 유도의 위험을 증가 하는 필요 합니다. 따라서, 다음 단계에서 목표는 수술과 수확의 첫 번째 순수 문화 사이 재배 시간을 줄이기 위해 이었다. 이 목표를 달성 하기 위해, 초기 종양의 결합 된 기계 및 효소 기반 조직 분리를 채용 하는 향상 된 프로토콜 다음 형광 활성화 된 세포 (FACS) 정렬-개발 되었다 트리플 레이블 EC의 정렬. 이 감소 격리 시간 평균 3 주, 순수 TEC와 NEC 문화 증가 생존 기능 연구와 결과. 높은 성공률을 인간의 조직에서 실행 가능한 순수 TEC와 NEC 문화의 격리 환자가 특정 약물 개별된 치료 regimens의 개발 하는 동안 테스트에 대 한 새로운도 열 수 있습니다. 격리 접근은 다음 단락에서 상세 하다.
프로토콜
격리 프로세스 대학 의료 센터 에를랑겐 (#159_15, B TuMiC 연구)의 로컬 윤리 위원회에 의해 승인 되었습니다. 환자 포함 기준을 다음과 같이 했다: CRC, UICC 무대-4, 선 동적인 장 질병의 역사 없이 그리고 neoadjuvant 치료.
1. 수술 및 단일 셀 격리에 대 한 조직의 준비
- CRC 환자에서 수술으로 견본을 얻기 (암 조직 > 0.5 g, 중앙 비 괴 사 성 종양, 정상적인 대 장 조직 > 종양 사이트에서 먼 10 cm).
- 얻은 조직 조각은 대부분 < 1 g, 암에 대 한 하지만 > 일반 콜론에 대 한 1 g. 경우 조각 > 1 g 얻을 수 있습니다, 조직 처리에 대 한 신선한 메스를 사용 하 여 여러 개의 1 g 조각으로 그들을 분할.
참고: 종양 조직 조각 발병에서 0.5 g이 하 있는 경우에, 고립 일반적으로 실패 합니다. - 수집 신선한 떼어낸 조직 조각 얼음 차가운 행 크 균형 소금물 (HBSS) 페니실린/스/amphothericin B 보충의 40 mL에 메 마른 집게를 사용 하 여 (1 %HBSS-펜/strep/ampho) 50 mL 원심 분리기 튜브에 신속 하 게 그들을 전송 하 고는 실험실입니다.
참고: 콜론 조직은 매우 자주 발병에서 박테리아/곰 팡이로 오염 됩니다. 절연의 전체 절차 동안 펜/strep/ampho 오염 유기 체를 없애기 위해 모든 솔루션에 추가 합니다. - 4 회 이상 40 mL 얼음으로 각 조직 조각 씻어 감기 HBSS-펜/strep/ampho (단계 1.3 참조) 소독 집게를 사용 하 여 다음 튜브를 한 원심 분리기 튜브에서 순차적으로 조직 조각을 전송 하 여 50 mL 원심 분리기 튜브에.
- 70% 에탄올과 각 단계 후 깨끗 한 겸 자.
- 별도 집게를 사용 하 여 암 및 정상적인 결 장 조직 조각.
- 모든 조직 조각 무게.
참고: 조직 조각 무게에 대 한 규모에 직접 넣지 마십시오. 세척, 후 포함 하는 조직 전에 조직 조각을 입력 한 후 마지막 원심 분리기 튜브 무게. 개별 조직 조각의 무게 빼기 계산 합니다.
2입니다. 단일 셀 서 스 펜 션의 생성
참고: 그것은 항상 습기를 공급 하는 조직 유지를 권장.
- 그것은 존재 하는 경우 연결 된 지방, 다른 비 tumorous 조직, 또는 잠재적으로 괴 사 성 조직 부분에서에서 제거 수술 표본 소독 집게를 사용 하 여 살 균 세포 문화 배양 접시에서 조직 조각을 전송 하 여 합니다.
- 조직 조각 HBSS-펜/strep/ampho의 3-5 mL을 추가 하 여 항상에 moisturized 유지.
- 신선한 멸 균 메스 (그림 1)를 사용 하 여 조직 조각을 정돈 한다. 조직 식별 명확 하지 않습니다 경우에 병리학을 참조 하십시오.
- 작은 조각으로 남은 티슈를 말하다 (약 2 × 2 × 2 mm3) 곡선된 블레이드와 신선한 메스를 사용 하 여. 조직 조각 조직 분리 튜브 (예를 들어 gentleMACS C 관)로 살 균 겸 미리 미리 따뜻하게 (37 ° C) 세포 배양 매체 (Dulbecco´s 수정이 글 중간 [DMEM] 기저 매체) 제조 업체의에 따르면 가득 전송 지침입니다.
참고: 락 도구 처럼 메스를 사용 하려고 합니다. 조직 손상을 방지 하기 위해 셀을 짠 다 하지 않습니다. - 인간의 조직 프로그램 "37C_h_TDK_1"는 manufacturer´s 다음 지침을 사용 하 여 종양 분리 키트와 함께에서 (gentleMACS Octo Dissociator)와 같은 조직 dissociator를 사용 하 여 다이제스트/해리 조직 조각
- 실 온 (RT)에서 300 x g에서 1 분 동안 분리 튜브 원심
- 미리 데워 진된 (37 ° C) 0.5% 태아 둔감 한 혈 청 (FBS) (DMEM 로우) 혈 청 학적인 피 펫을 사용 하 여 각 튜브를 보충 DMEM의 10 mL을 추가 하 고 세포 현 탁 액 셀 pipetting으로 50 mL 원심 분리기 튜브 위에 셀 스 트레이너 (100 µ m 기 공 크기)를 사용 하 여 필터링 필터 위에 현 탁 액입니다.
- 혈 청 학적인 피 펫에 의해 각 맥 관을 다시 DMEM 로우의 10 mL를 추가 하 고 나머지 50 mL 원심 분리기 튜브 위에 셀 스 트레이너를 전송.
- 혈 청 학적인 피 펫을 사용 하 여 낮은 DMEM 매체의 추가적인 10 mL와 한 번 셀 여과기를 세척.
- RT에 300g x 7 분 세포 현 탁 액을 원심 하 고 상쾌한 삭제.
- 미리 데워 진된 내 피 기저 매체 (EBM)-2의 5 mL에 셀 resuspend-microvascular (MV) 매체 (Lonza) 펜/strep/ampho 같은 50 mL 원심 분리기 튜브에 보충.
- 플레이트 세포 현 탁 액 중 1.5% 젤라틴 인산 염 버퍼 식 염 수 (PBS) 5% CO2와 37 ° C에서 하룻밤 코팅 T-25 셀 문화 술병에.
- 37 ° C, 5% CO2에서 24 h에 대 한 셀을 품 어, 약 5 mL PBS의 신중 하 게 두 번 셀을 세척 하 고 신선한 매체의 5 mL을 추가.
- 중간 갱신의 48 h 간격으로 80-90 %confluency (일반적으로 5-7 일)까지 37 ° C, 5% CO2 에서 세포를 배양.
3입니다. FACS 정렬 내 피 세포의
참고: 어떤 시점에서 예를 들어 단일 시 관에 있는 세포의 외피에 얼룩 절차를 제한 하 여 세포 손실을 방지 하려고.
- Accutase (약 10 분)의 1 mL로 세포를 분리 하 고 미리 따뜻하게 (37 ° C) EBM-2-MV 매체의 4 개 mL를 추가.
- 장치 (범위 10-25 µ m)를 계산 하는 자동화 된 셀을 사용 하 여 셀 수를 결정 합니다.
- RT에서 250 x g 4 분에 대 한 세포 현 탁 액을 원심 하 고 상쾌한 삭제.
- 미리 따뜻하게 FACS-버퍼에 셀 resuspend (1x PBS, 2.5% 소 혈 청 알 부 민 [BSA], 5 mM EDTA pH 8.0, 10 µ M Y-27632) 세포 수 (5 x 106/mL)에 따르면.
- 추가 셀 수/FACS-버퍼 볼륨에 따라 항 체 FACS 얼룩: CD31 FITC (100 µ L/mL = 1/10), CD144/혈관 내 피 (VE)-cadherin-PE (100 µ L/mL = 1/10), CD105 APC (25 µ L/mL = 1/40), 혼합 및 빛;에서 보호 하는 RT에 7 분 동안 품 어 부드럽게 터치 하 고 (총 보육 시간 15 분)에 대 한 또 다른 8 분 동안 품 어.
- 혈 청 학적인 피 펫을 사용 하 여 레이블이 지정 된 셀 서 스 펜 션에 FACS 버퍼의 2 개 mL를 추가 합니다.
- RT에서 250 x g 4 분 centrifuge 고 상쾌한 삭제.
- FACS 버퍼의 2 개 mL를 추가 하 여 두 번 씻어 RT에 250g x 4 분에 대 한 후속 원심 분리를 실시 하 고 상쾌한 삭제.
- 미리 따뜻하게 EBM-2-MV-펜/strep/ampho의 500 µ L 셀 및 FACS 정렬 악기에 전송 셀 resuspend.
- FACS 장비 냉각 하는 경우 내 피 세포 신속 하 게 정렬 과정에서 죽을 것 이다. 따라서, RT에서 내 피 세포의 분류를 수행 하 고 즉시 전송 수집된 셀 37 ° C 배양 기에 나중.
참고: FACS 장비는 일반적으로 살 균!
- FACS 장비 냉각 하는 경우 내 피 세포 신속 하 게 정렬 과정에서 죽을 것 이다. 따라서, RT에서 내 피 세포의 분류를 수행 하 고 즉시 전송 수집된 셀 37 ° C 배양 기에 나중.
- 정렬/수집 트리플-긍정적인 세포 세포 문화 요리 (예를 들어, 미리 코팅 하룻밤 1.5% 젤라틴-PBS는 24-잘 접시)에 직접 미리 데워 진된 신선한 매체 (EBM-2-MV-펜/strep/ampho)의 0.5 mL으로 가득 합니다.
참고: 현미경을 사용 하 여 정렬 한 후 세포 현 탁 액을 확인 합니다. 경우 셀 클러스터 함께, 천천히 그들을 혼합 하거나 매체를 추가 하 여 셀 문화 접시에도 세포 분포를 얻을 하려고 합니다. - 48 h 간격 중간 갱신의 90-100 %confluency 세포를 배양 하 고 원하는 문화 접시 크기를 셀 확장 (24-잘 접시 → 12 잘 판 → 3.5 cm 접시 → T-25 → T-75).
4. 수확 및 순수 내 피 세포의 특성
- 90-100 %confluency 세포를 수확 하 고 적절 한 방법 (예를 들어, FACS, cytochemistry, 정량적 중 합 효소 연쇄 반응 (정량), 또는 내 피 세포 기능 분석 실험7,8) 특징.
- 격리 된 셀 중 특성화 방법 선택을 분석 합니다.
결과
NEC와 결합 된 기계/enzymatical 조직 분리, 뒤에 후속 CD31/CD105/VE cadherin-기반 FACS-정렬에 의해 인간의 CRC에서 TEC의 절연 설명 여기 (그림 1A). 이 프로토콜을 이전 맥 기반 프로토콜7에 비해 순수 하 고, 가능한 내 피 세포의 첫 번째 수확까지 시간 단축된 창으로 향상 된 프로토콜을 나타냅니다.
NEC와 TEC 다음 단계를 사용 하 여 인간의 CRC에서 고립 되었다: (1) 결합 된 기계 및 효소 조직 분리 하 여 단일 세포 현 탁 액의 생성 및 80-90 %confluency (그림 1), 이러한 세포의 성장 (2) 트리플 EC의 라벨 CD31/CD105/VE-cadherin 형광 색소 결합 항 체, 고 (3) FACS 각각 트리플-긍정적인 세포 (그림 2A)의 정렬. 메모의 중요 한 단계 격리 절차의 성공과 세포의 생존을 위해 신속 하 게 절차의 대상이 수술 표본은 격리 (단일 세포 현 탁 액의 세대 < 절제 후 1 시간). FACS 정렬, 12500 TEC의 평균을 사용 하 여 (n = 12) 및 17800 NEC (n = 12, 그림 2B, 왼쪽) 3.6의 평균 및 총 세포 인구 (그림 2B, 오른쪽)의 5.6%를 대표 하는 격리 될 수. 그 후, 셀 T-75 (통로 1 나) 및 수확 하거나 추가 처리에 대 한 분석까지 확장 했다. 이전 맥 기반 프로토콜을 사용 하 여 메모의 49.6%의 평균 절연 성공을 달성 했다 (n = n에서 58 순수 TECs = 117 환자8) 순수 EC와 문화 사용할 수 평균 수술 후 6 주. 여기 설명 새로운 FACS 기반 프로토콜을 사용 하 여, 최초의 순수 EC 문화 가져온 평균는 격리 62.1%의 성공률와 함께 수술 후 3 주 (n = n에서 얻은 순수한 41 EC 문화 = 66 단일 세포 FACS 정렬 대상이 정지). 따라서, 12.5%에 의해 격리 율의 증가 3 주에 6에서의 재배 시간 감소와 동시에 달성 했다. 재배 시간이 감소 향상 된 세포 생존 능력을 지도 하 고 덜 노출 설립 문화의 잠재적인 문화 종속의 유도에 의해 동반 하는 수명 연장.
EC 순도 CD31-cytochemistry(그림 3)에 의해 처음 실시 됐다. 문화 CD31-부정적인 세포 (그림 3A, TEC와 NEC) 없는 경우에, 그들은 반전 녹음 방송 정량적 중 합 효소 연쇄 반응 (실시간 정량 Pcr) (그림 3B) 입력 자세한 셀을 받게 했다. EC (CD31, CD105, VE cadherin 및 폰 Willebrand 요인 [vWF]), 백혈구 (CD45), 상피 세포 (cytokeratin [CK]-20), 그리고 부드러운 근육 세포/섬유 아 세포 (desmin)에 대 한 셀 형 특정 뇌관 사용 되었다 (그림 3B). 입력, 0.1-의 범위에서 다른 셀으로 EC 문화의 잠재적인 오염 2%, 셀 유형에 따라이 정량 기반 셀을 사용 하 여 검색 된8될 수 있습니다.
특히, 우리는 이전 그들의 해당 선관위 문화7에 비해 TEC 문화에 vWF 단백질 식의 특혜 손실 보고. 이러한 연구 결과 새로 설립된 된 격리 프로토콜 확인 수 (그림 3C, 의미 Ct 손실 NEC-TEC 0.687, p = = 0.173, t-검정 한 쌍). 성공적으로 이러한 품질 컨트롤을 전달 하는 문화 mycoplasma 감염에 대 한 테스트 하 고 이후 추가 실험을 위해 사용 했다.
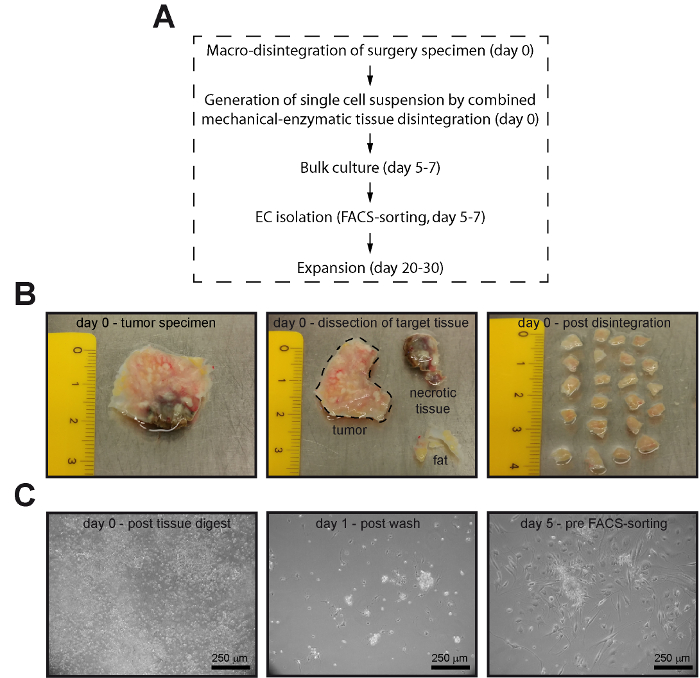
그림 1 : 순수한 내 피 세포 FACS 정렬 하 여 인간의 정상적인 결 장 및 CRC에서 격리 될 수 있습니다. (A) 흐름 차트 EC 격리 프로세스의 필수 단계. (B) 지방 조직 (노란색), 다른 비 tumorous 부분, 또는 잠재적으로 괴 사 성 조직 부분 (브라운) 수술 표본 (왼쪽 및 가운데 패널)에서 제거 되었습니다 및 종양 조직 분리 (이전 2-3 m m 옆 길이의 조각으로 분해 했다 오른쪽 패널)입니다. (C) 단일 셀 서 스 펜 션 검색 후 조직 분리 (왼쪽된 패널) 셀 문화 요리에서 24 h에 대 한 알을 품는. 그 후, 비 부착 한 세포는 PBS (중간 패널)을 사용 하 여 부드러운 세탁에 의해 제거 되었다 및 셀 FACS 정렬 전에 80-90 %confluency 성장 했다 (오른쪽 패널). 하단 패널 (C)의 이미지는 단계 대조 현미경 검사 법에 의해 인수 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
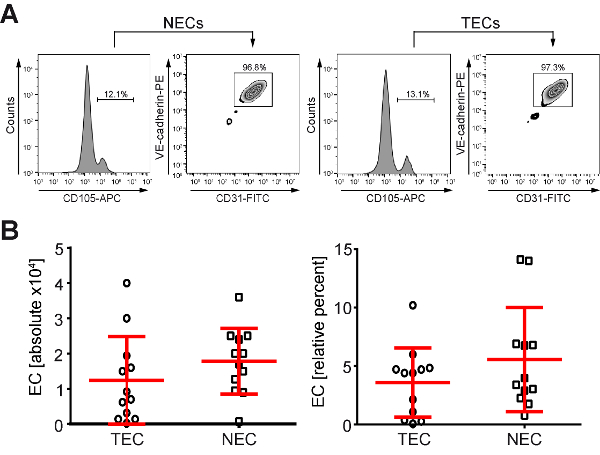
그림 2 : 단일 세포 현 탁 액의 3.6-5.6%의 평균 인간의 CRC 환자에서 분리 된 그리고 트리플 긍정 적 FACS에 의해 정렬 (A) 선관위와 TEC FACS 정렬 안티 CD31-CD105,-VE cadherin 항 체와 세포의 트리플 라벨을 사용 하 여 했다. 12500 TECs의 (B) 평균 (n = 12) 및 17800 자문위 (n = 12) 인간의 정상적인 결 장 또는 CRC FACS 정렬 (CD31, CD105 및 VE cadherin 양성 세포, 왼쪽 패널), 나타내는 평균 3.6 5.6% (오른쪽 패널)의 요약 셀을 사용 하 여에서 고립 될 수 있다 고용 인구입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
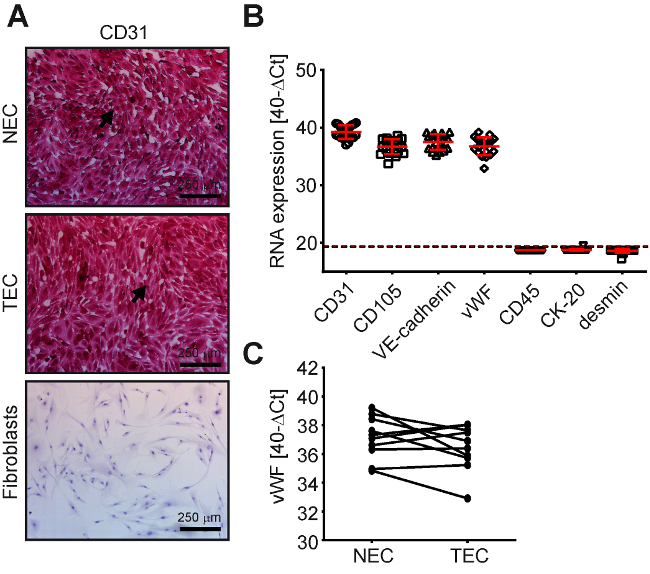
그림 3 : 전형적인 내 피 세포 마커를 표현 하는 NEC와 인간의 CRC에서 TEC. 정상적인 결 장 내 피 세포 (NEC, n = 10)와 종양 내 피 세포 (TEC, n = 10) 인간 CRC는 CD31 (EC 마커)-, CD105 (EC 마커)-, VE cadherin (EC 마커)-, vWF (EC 마커)-긍정적인 및 CK20 (CRC 셀 표식)-, desmin (섬유/SMC 마커)-, CD45 ( 백혈구 마커)-(A) CD31-immunocytochemistry에 의해 결정으로 부정적인 (긍정적인 세포 = 빨강) 및 (B) 실시간 정량 (점선 아래 데이터 포인트는 부정적인 것을 감지 하는 샘플). (C) vWF 식으로 같은 환자에서 해당 TEC/NEC 샘플에 대 한 실시간 정량 Pcr에 의해 결정. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
주로, 세 가지 다른 방법 인간의 단단한 조직, 즉 (1) immunomagnetic 농축, (2) 레이저 기정, 및 (3) FACS-정렬 EC 분수의 순수 하 고 유력한 자문위와 TECs 격리 하기 위해 지금까지 고용 되었다 있다. 대부분의 출판물에서 기계 해체에 의해 단일 세포 현 탁 액의 세대 후의 세포 immunomagnetic 농축 사용된11,,1213이었다. 예를 들어 immunomagnetic 정화의 인간의 피부 microvascular EC (HDMEC) 전자 selectin 항 체에 의해 후에 종양 괴 사 인자 (TNF)-신생아 속하고13 에서 α 치료 glioma에서 인간의 EC의 격리에 대 한 조직에 의해 보고 되었습니다 소화, percoll 그라데이션, 그리고 안티-CD31/CD105 VE cadherin 항 체12를 사용 하 여 선택 또는 인간에서 안티 CD105 항 체에 의해 유 방 암11. 프로토콜을 레이저 서 또는 FACS 정렬 고용 덜 자주 보고 되었습니다. 레이저 기정 사용 되었다, 예를 들어 잠재적인 팬-종양을 식별 하기 위해 EC에서 내 피 세포 마커 (대금)에서 파생 된 인간 대 장 암 세포의 분석 해 부9후 즉시. FACS 정렬 안티-CD31-항 체를 사용 하 여 성공적으로 시연 했다 EC 분수의 격리에 대 한 미 분화 인간 배아에서 줄기 세포14.
이러한 접근 방법은 서로 다른 장점과 단점을 고려해 야 할 수 있다. Immunomagnetic 기반 접근 방식에 대 한 장점은 정교한 장비는 필수, 선택 언제 든 지 수행할 수 있습니다 및 셀 농축은 FACS 정렬에 비해 빠른 (약 15 분) (약 1 시간). 시간이 더 긴 기간에 대 한 매트릭스의 부족 anoikis에 의해 EC의 세포 죽음을 유도 수 있습니다. 따라서, FACS 버퍼에로 키 니 아 제 억제 물 Y-27632의 추가 셀 anoikis15를 방지 하기 위해 고용 되었다.
Immunomagnetic 농축의 단점은 선택의 여러 라운드는 순도 99% 이상 달성 하는 데 필요한입니다. 또한, 풍부 사이 세포 배양이 세포 복구, 문화 유물 문화 유도 지원의 나이 증가 필요 합니다. 서 레이저는 셀 수 있는 이점 사용 즉시 문화 유도 유물 감소 하지만 인접 조직 영역10에서 세포에 의해 오염 위험을 포함. 또한, 기정 하지 모든 실험실에서 설정 됩니다. FACS 정렬-기반 접근 방법의 단점 포함, 레이저 서, 장비는 정교 하 고 비용 많이 비슷합니다. 따라서,이 장비 하지 액세스할 수 있습니다 언제 든 지. 임상 설정에서 어디 관심의 조직 가용성은 정확 하 게 계획 될 수 없습니다,이 더 불리를 추가할 수 있습니다.
그러나, FACS 정렬의 주요 장점은 EC 분수 병렬로 여러 항 체에 의해 표시 될 수 있습니다. 따라서, 엄격한 제어 전략을 사용할 수 있습니다 고 순도 보장 합니다. 경험을 바탕으로, 이전 맥 기반 프로토콜 선택의 여러 라운드를 고용 했다 달리 필요 했다 아니 다시는 EC 분수의 정렬. 이 결과 향상 된 세포 생존 능력 분석의 연장된 시간 창 활성화에 FACS 접근에 3 주를 6 주 (맥 접근)에서 순도까지 크게 감소 재배 시간 이끌어 냈다. 마지막으로, FACS 정렬-기반 전략을 사용 하 여, 전반적인 절연 성공률의 개선 될 수 (12.5% 증가)를 달성. 결론적으로, FACS 정렬 기준 동시에 전략 고용 3 항 체 결합된 기계 및 효소 조직 소화에 의해 조직 다이제스트 TECs의 격리에 대 한 선택의 방법으로이 프로토콜에 설정 된 수많은 장점을 했다 그리고 인간의 대 장 암 및 콜론에서 자문위입니다.
공개
저자 들은 아무 경쟁 관심사를 선언 합니다.
감사의 말
우리는 기독교 Flierl, Katja Petter, 크리스티나 Schnürer (모든 사단의 분자 및 실험적인 수술), Uwe Appelt, 감사 (코어 단위 FACS 정렬) 마이클 Mroz와 우수한 기술 지원에 대 한 사이먼 Völkl (코어 단위 FACS-Immunomonitoring). 이 작품은 EN/ms 협 센터의 교부 금에 의해 임상 연구 (IZKF) 대학 의료 센터 에를랑겐, 독일 연구 재단의 지원 되었다 (DFG: 2438, s p 2에 대 한)와 루 츠 재단, 로버트 Pfleger 재단의 권한을 부여 하 여 독일 연구 재단에서 MS에 게 수 여 교부 금에 의해 뿐만 아니라 VSS [DFG: KFO257 (하위 프로젝트 4), SFB 796 (하위 프로젝트 B9)].
자료
| Name | Company | Catalog Number | Comments |
| HBSS 1x | Gibco by Life Technologies | 14175-053 | |
| Penicillin-streptomycin | Gibco by Life Technologies | 15140-122 | |
| amphotericin B | Gibco by Life Technologies | 15290-026 | |
| Scalpels, disposable | Feather | No. 23 | |
| gentleMACS octo dissociator | Miltenyi Biotec | 130-095-937 | |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | |
| human tumor dissociation kit | Miltenyi Biotec | 130-095-929 | |
| DMEM | Gibco by Life Technologies | 21969-035 | |
| EGM-2-MV BulletKit | Lonza | CC-3202 | |
| Cell strainer, 100 µm | Falcon | 352360 | |
| StemPro Accutase | Gibco by Life Technologies | A11105-01 | |
| Cell counter, automated | Coulter Counter | Z1 | |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| CD31-FITC | BD Pharmingen | 555445 | |
| CD144/VE-cadherin-PE | BD Pharmingen | 560410 | |
| CD105-APC | BD Pharmingen | 562408 | |
| gelatin from bovine skin | Sigma-Aldrich | G9391 | |
| FACS-Sorting device | Beckman Coulter | MoFlo XDP |
참고문헌
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9 (6), 713-725 (2003).
- Hurwitz, H., et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 350 (23), 2335-2342 (2004).
- Naschberger, E., Schellerer, V. S., Rau, T. T., Croner, R. S., Stürzl, M. Isolation of endothelial cells from human tumors. Methods Mol Biol. 731, 209-218 (2011).
- Schellerer, V. S., et al. Endothelial cells of human colorectal cancer and healthy colon reveal phenotypic differences in culture. Lab Invest. 87 (11), 1159-1170 (2007).
- Naschberger, E., et al. Matricellular protein SPARCL1 regulates tumor microenvironment-dependent endothelial cell heterogeneity in colorectal carcinoma. J Clin Invest. 126 (11), 4187-4204 (2016).
- St Croix, B., et al. Genes expressed in human tumor endothelium. Science. 289 (5482), 1197-1202 (2000).
- Christian, S., et al. Endosialin (Tem1) is a marker of tumor-associated myofibroblasts and tumor vessel-associated mural cells. Am J Pathol. 172 (2), 486-494 (2008).
- Grange, C., et al. Isolation and characterization of human breast tumor-derived endothelial cells. Oncol Rep. 15 (2), 381-386 (2006).
- Miebach, S., et al. Isolation and culture of microvascular endothelial cells from gliomas of different WHO grades. J Neurooncol. 76 (1), 39-48 (2006).
- Richard, L., Velasco, P., Detmar, M. A simple immunomagnetic protocol for the selective isolation and long-term culture of human dermal microvascular endothelial cells. Exp Cell Res. 240 (1), 1-6 (1998).
- Nourse, M. B., et al. VEGF induces differentiation of functional endothelium from human embryonic stem cells: implications for tissue engineering. Arterioscler Thromb Vasc Biol. 30 (1), 80-89 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유