É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estimulação simultânea de elétrica e mecânica para aumentar o potencial de Cardiomyogenic das células
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para a formação de uma população celular usando estímulos elétricos e mecânicos, emulando a fisiologia cardíaca. Esta estimulação eletromecânica aumenta o potencial de cardiomyogenic das células tratadas e é uma estratégia promissora para mais terapia celular, modelagem de doença e despistagem de drogas.
Resumo
Doenças cardiovasculares são a principal causa de morte nos países desenvolvidos. Consequentemente, a procura de terapias com células cardíacas eficaz tem motivado pesquisadores nos campos da bioengenharia e células-tronco para desenvolver em vitro alta fidelidade humana miocárdio para investigação fundamental e aplicações clínicas. No entanto, o fenótipo imaturo de células cardíacas é uma limitação na obtenção de tecidos que imitam funcionalmente o miocárdio adulto, que se caracteriza principalmente por sinais mecânicos e elétricos. Assim, o propósito do presente protocolo é preparar e amadurecer o populacao de celula alvo através da estimulação de Eletromecânica, recapitulando parâmetros fisiológicos. Engenharia de tecido cardíaco está evoluindo em direção a abordagens mais biológicas e estratégias baseadas em estímulos biofísicos, assim, estão ganhando impulso. O dispositivo desenvolvido para esta finalidade é único e permite individual ou simultânea elétrica e mecânica estimulação, cuidadosamente caracterizada e validado. Além disso, embora a metodologia foi otimizada para este estimulador e uma população de células específicas, facilmente pode ser adaptado para outros dispositivos e linhas celulares. Os resultados aqui oferecem evidências do compromisso cardíaco aumento da população celular após estimulação eletromecânica. Industrial estimulado as células apresentam um aumento da expressão de marcadores cardíacos principais, incluindo início, estruturais e cálcio-regulação de genes. Este condicionamento celular poderia ser útil para mais longe da terapia com células regenerativas, modelagem de doença e triagem de drogas de alto rendimento.
Introdução
Função do coração é baseada no acoplamento da excitação elétrica e a contração mecânica. Brevemente, junções intercelulares casos permitem a propagação do sinal elétrico para produzir quase síncronas contrações do coração bombear o sangue sistemicamente e através do sistema pulmonar. Células cardíacas, assim, passam por forças elétricas e mecânicas que regulam a função celular e a expressão dos genes. Nesse sentido, muitos grupos têm tentado desenvolver plataformas de cultura que imitam o ambiente fisiológico cardíaco para compreender o papel da estimulação mecânica e elétrica em desenvolvimento cardíaco, função e maturação. Em vitro estímulos elétricos e mecânicos individualmente foram aplicados extensivamente em engenharia de tecido cardíaco para melhorar propriedades funcionais, aumentar a maturação celular ou melhorar o acoplamento de célula-célula e cálcio manipulação1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. no entanto, condicionado eletromecânico síncrono permanece inexplorado devido o desafio de desenvolver um estimulador e protocolo e devido a otimização obrigatório22.
Trabalho preliminar dirigida estimulação eletromecânica como uma combinação de estimulação elétrica e perfusão de mídia; no entanto, o fluxo não envolve a deformação baseados em tensão típica de enchimento ventricular23,24,25. Mais tarde, abordagens mais fisiológicas combinados estímulos elétricos com deformação física ou estiramento para imitar o tempo contração26,,27,28,29,30 ,31. Feng et al. descreveram a primeira demonstração de estimulação Eletromecânica em 2005, comunicação aprimorada casos propriedades contráteis e tamanho26. Wang et al. pré-tratados com células-tronco mesenquimais com 5 azacytidine e aplicado simultâneo condicionado elétrico e mecânico, melhorando recellularization, viabilidade celular, diferenciação cardíaca e tecido remodelação27. Desde aquelas publicações, mais grupos têm relatado na estimulação eletromecânica de monocamadas de células ou engenharia de tecidos (por exemplo, preto28,29,de Vunjak-Novakovic31e nosso grupo30) com o primeiras células condicionadas testaram in vivo30. Brevemente, Morgan e preto testaram várias combinações de estímulos elétricos e mecânicos, relatando que o sincronismo entre estímulos foi crucial porque atrasada combinada eletromecânica estimulação rendeu os melhores resultados de28. Em seguida, Godier-Furnémont e colaboradores otimizado um protocolo de estimulação Eletromecânica para construções de músculo coração engenharia de células de coração de rato neonatal e alcançado, pela primeira vez, uma relação de força positiva-frequência29. Depois disso, nosso grupo relatou que células precondicionadas industrial aumentaram a expressão de marcadores cardíacos principais em vitro e ampla benéfica efeitos in vivo, tais como melhorar a função cardíaca ou aumentou a densidade do navio no infarto região de fronteira30. A publicação mais recente demonstrou que os tecidos cardíacos de haste-pilha-derivado cardiomyocytes sujeitos a eletromecânico condicionado alcançado uma maturação nível mais próximo ao ser humano adulto cardíaca estrutura e função de31. Além disso, plataformas alternativas estimulação tridimensional compreendem eletroativos andaimes que fornecem elétrico, mecânico, e topográficas pistas para as células anexado32. Além disso, a deformação mecânica (célula monocamada alongamento e compressão) pode também ser induzida com eletrodos stretchable, simulando as condições fisiológicas normais, bem como condições extremas33.
Portanto, a lógica é que estímulos eletromecânicos in-vitro, com base em condições fisiológicas poderiam aumentar o potencial de cardiomyogenic de uma célula. Na verdade, este estímulo poderia beneficiar ainda mais integrações de células terapêuticas para o miocárdio em um cenário clínico ou aumentar a maturação do tecido para aplicações de despistagem de drogas.
Além disso, estamos isolados e caracteriza-se uma população de células progenitoras derivadas de tecido adiposo humano de cardíaco de origem (ATDPCs cardíacas)34. Estas células estão localizadas na gordura Epicárdica. Estas células exibir efeitos benéficos de histopatológicos e funcionais no tratamento de infarto do miocárdio e também mantenham a diferenciação cardíaca e endotelial potenciais. 30 , 35. formulamos a hipótese que estes benefícios aumentaria após estimulação Biofísica.
Consequentemente, desenvolvemos um dispositivo e um regime de estimulação para a população de células de interesse e investigou os efeitos. Este protocolo eletromecânico é uma nova estratégia para induzir a célula ativa, estendendo-se de forma estéril e canaliza em comparação com anteriores Publicações36, em combinação com a estimulação do campo elétrico. A técnica aqui relatada explica em detalhe o dispositivo e o método utilizado para a estimulação elétrica, mecânica e eletromecânica de células.
Este dispositivo pode fornecer estimulação elétrica e mecânica, isoladamente ou em simultâneo. A estimulação é realizada com uma abordagem de romance não-invasiva e asséptica que inclui suporte a célula presterilized, eletrodos colocados dentro de uma placa de cultura padrão e uma plataforma que induz as forças mecânicas e elétricas (Figura 1).
A plataforma pode conter até seis cultura placas e consiste de uma estrutura de sanduíche de poly(methyl methacrylate) cortados a laser e peças de placa de circuito impresso. O protótipo de plataforma se baseia em uma combinação de um monofásico programáveis controlados por computador estimulador elétrico, uma placa de circuito impresso para a robusta conexão dos eletrodos e seis 10 x 10 mm x 5 mm niquelado fixo de neodímio ímans colocados perto de um dos lados das placas de cultura. Há também uma barra de alumínio com seis ímãs condução (mesmo modelo) colocado na frente do outro lado das placas de cultura e mudou-se com um servomotor linear. O motor é impulsionado por um controlador do motor, operado através de uma porta RS-232 por software comercial (veja a Tabela de materiais). Através da interface do usuário e estimulador programável, é possível programar a intensidade elétrica e frequência, a duração do pulso, a frequência de estimulação mecânica, seu ciclo de trabalho, o número de pulsos, a amplitude de pulso (excursão do ímã), e a inclinação.
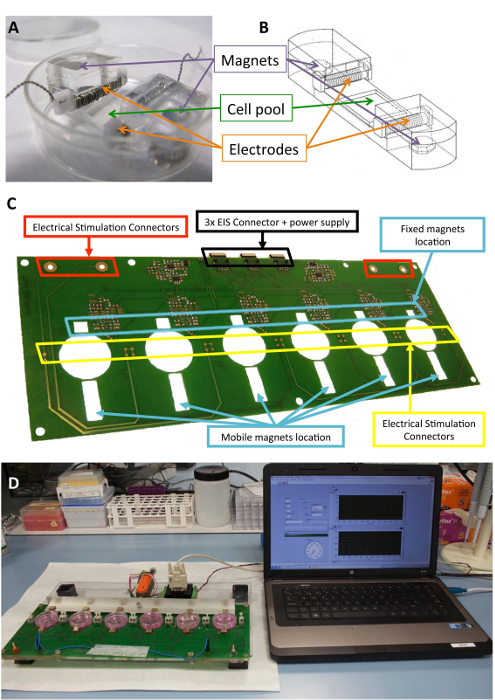
Figura 1 : Estimulador eletromecânica. (A) PDMS construção utilizada para o acondicionamento da célula. (B) desenho de construção de PDMS, incluindo eletrodos e ímãs. (C) detalhe da placa de circuito impresso (plataforma), usada para realizar o condicionamento eletromecânico. Este painel foi modificado de Llucià-vedi et al.30. (D) imagens da estimulação eletromecânica plataforma e usuário interface (computador). Clique aqui para ver uma versão maior desta figura.
Tanto o estimulador e o método para o condicionamento de eletromecânico são totalmente descritos em duas patentes internacionais, WO-2013185818-A137 e WO-2017125159-A138.
O silicone biocompatível construções projetadas para fornecer suporte estrutural para as células, eletrodos e ímãs têm sido descritos anteriormente10,21. Resumidamente, eles consistem de polidimetilsiloxano (PDMS), moldado e curado à temperatura ambiente, com um módulo de Young de 1,3 MPa, perto de níveis fisiológicos. A construção contém um pool de cultura de células em uma área de flexível (10 x 10 x 2 mm), dois slots transversais internas para manter os eletrodos e dois incorporado 6 x 2 mm x 4 mm niquelado os ímãs do neodymium. Os eletrodos são construídos com 0,2 platina fio torcido em torno de uma 2 x 3 mm x 12 mm politetrafluoretileno core bar (21 cm por eletrodo, aproximadamente 23 voltas) e colocados em lados opostos da área flexível para criar um campo elétrico por indução estimulação elétrica. Alongamento mecânico é alcançado através da atração magnética entre ímãs encaixados no suporte e externos ímãs colocados ao lado da placa de cultura e o braço de alumínio em movimento. Desta forma, o suporte do celular pode ser estendido sem quebrar a barreira estéril. Esta abordagem é adequada para uma monocamada de células, mas pode ser adaptada para construções tridimensionais, bem como.
Além disso, um padrão regular poderia ser imprimido onde as células são semeadas, usando uma grade de difração regrada (1.250 grooves/mm). A visualização direta das células cultivadas na construção de PDMS sob brightfield e microscópios fluorescentes é possível devido à sua transparência e 0,5 mm de espessura. No presente caso, a piscina de cultura PDMS tem um padrão de superfície vertical, perpendicular à força de alongamento, para alinhar as células perpendicularmente ao campo elétrico, o que minimiza o gradiente do campo elétrico através da célula.
A Figura 1 mostra uma descrição detalhada da construção e o dispositivo usado para a estimulação. Construir os PDMS e características são otimizadas para celular alongamento (figura 1A, B). O estimulador é desenvolvido e validado para a aplicação efectiva da estimulação elétrica e mecânica desejada para células anexado para a construção PDMS. Este processo inclui garantir boa operabilidade de conectividade e usuário através da interface de software (Figura 1, D).
O procedimento para a estimulação de células usando este dispositivo feito por medida é descrito na seção de protocolo.
Protocolo
Este estudo utiliza ATDPCs cardíacos humanos de amostras de pacientes. Seu uso foi aprovado pelo Comitê de ética local, e todos os pacientes deram consentimento informado. O protocolo do estudo está em conformidade com os princípios delineados na declaração de Helsinque.
1. preparações
- Autoclave de duas pinças, 12 eletrodos platina de PTFE para estimulação elétrica e toalhas de papel, a 121 ° C por 20 min.
-
Esterilize 12 construções sob medidas de PDMS (Figura 1A).
- Lave cada construção com 5 mL de água destilada estéril com agitação magnética em temperatura ambiente por 15 min.
- Lave 1x com 5 mL de etanol a 70% com agitação magnética em temperatura ambiente por 5 min.
- Lave 5x com 5 mL de água destilada estéril com agitação magnética em temperatura ambiente por 10 min por lavagem, para remover resíduos de bebidas alcoólicos.
- Seque as construções em toalhas de papel estéril dentro o pernoite do armário de fluxo.
- Armazená-los em tubos de centrífuga de 50ml estéril até o uso.
2. célula de semeadura (dia -1)
- Antes célula semeadura, transferir as construções de PDMS limpas para placas estéreis e expô-los à luz ultravioleta por 5 min garantir a esterilização completa.
- Transferi cada construção para uma placa de cultura de células de 35 mm, ou placa de 6, para a propagação de célula imediata.
-
Trypsinize balão T75 confluente de ATDPCs cardíacas.
- Lave o balão T75 com 5 mL de tampão fosfato salino (PBS) de 1x.
- Adicione 1 mL de 0,05% do trypsin-EDTA e incubar a 37 ° C por 5 min separar as células.
- Adicione 5 mL de meio completo para inactivar o tripsina-EDTA.
- Recolher todas as células em um tubo de 15 mL e lavar o frasco 2 x com 5 mL de PBS para coletar as células restantes.
- Centrifugar a 230 x g por 5 min a 22 ° C, remover o sobrenadante e ressuspender as células em 2 mL de meio completo para contá-los com a câmara de hemocytometer.
- Propagar a 200 µ l de ATDPCs cardíacos (2,5 x 105 células/mL) na piscina da célula das construções de PDMS 12 (Figura 1A, B) ter ~ 80% da superfície da semeadura coberta pelas células no dia seguinte e incubar a 37 ° C e 5% de CO2.
Nota: Após 2 – 4 h, devem ser anexadas as células. Inóculo de célula é preparado de acordo com o tamanho da célula e crescimento. Para células menores, a densidade de semeadura deve ser aumentada. - Delicadamente, adicione 2 mL de meio completo escaldado (α-MEM suplementado com 10% fetal bovino soro 1% L-glutamina e 1% penicilina-estreptomicina) por placa.
- Incube as construções em condições de cultura (geralmente 37 ° C e 5% CO2) durante a noite.
3. Eletromecânica estimulação Setup (dia 0)
- Antes de iniciar o procedimento, pegue seis construções para estimulação eletromecânica e seis como controles nonstimulated. Com menos de seis placas por estimulação, use construções vazias com o mesmo volume médio para garantir estimulação adequada de campo elétrico.
- Limpe a unidade de estimulação com 70% de etanol e coloque-o no fluxo do armário.
- Trazer o estéril eléctrodos e pinças para dentro do gabinete de fluxo.
- Remova 90% dos meios de comunicação da placa de cultura facilmente manipular a eletrodos e construções. Primeiro, coloque as construções de PDMS na posição certa para garantir a atração magnética (deslocamento de PDMS dentro da placa de cultura em direção do ímã) entre ímãs fixos e móveis. Em seguida, ligue o fio de platina para os conectores de eletrodo e a parte PTFE em seu espaço designado na construção de PDMS.
- Adicione 2,5 mL de meio fresco de completo escaldado para cada construção.
Nota: Manter a esterilidade durante todo o procedimento e operar em uma construção de cada vez. Manter o resto das construções na incubadora a 37 ° C e 5% de CO2 até o uso. - Uma vez que todas as construções PDMS são colocadas e eletricamente ligadas à plataforma, trazer a plataforma de volta para a incubadora a 37 ° C e 5% de CO2.
- Ligue a fonte de elétrica e mecânica.
-
Configure o programa de estimulação. Especifica a regimes de estimulação elétrica e mecânica, por meio de interfaces de usuário do estimulador elétrico e o aplicativo, que controla a estimulação mecânica. Defina o sincronismo da seguinte forma.
- Ligue o estimulador elétrico. Espere para o menu principal aparecer no display.
- Em seguida, selecione opção 2: editar sequência + Enter.
- A sequência do Menu edite como segue.
- Use a guia de modo selecionar tensão ou corrente. Selecione atual clicando + e pressione Enter.
- Para o guia de Amplitude , selecione 1 (mA) com + /- e pressione Enter.
- Durante o Período (T), selecione 1000 (ms) , com + /- e pressione Enter.
- Definir a duração do pulso (Tw) para 2 (ms) com + /- e pressione Enter.
- Para o modo de gatilho guia, selecione externo pelo software e pressione Enter.
- Volta no menu principal, selecione opção 4: gerar sequência e pressione Enter.
Nota: O estimulador elétrico baseia-se no modo de espera até que ele recebe um comando de gatilho do aplicativo estimulador mecânico através da porta serial.
- Execute as seguintes etapas na seção de estimulação mecânica, a aplicação do painel de controle (Figura 2C).
- Escreva 1.000 (ms) no Período de pulso controle de texto.
- Escreva 500 (ms) no controle de texto no tempo (Tw) para definir a duração do pulso mecânico.
- Gravação 2.000 (AU) no controle de texto de excursão para entregar um alongamento de construção de 10%. Este é o número de passos do motor de controle linear.
Nota: O protocolo de estimulação aplicado aqui consiste em pulsos de onda quadrada 2 ms de corrente alternada monofásica de 50 mV/cm em 1 Hz e 10%, se estendendo por 7 dias. Os tempos de ascensão e queda do pulso mecânico situam-se a 100 ms para imitar mais ou menos a forma do pulso da pressão a lareira. Além disso, o modo de repetição é definido como contínuo e há um contador exibindo o número de pulsos.
- Ligue o estimulador elétrico. Espere para o menu principal aparecer no display.
- Mude a mídia 2 x por semana (segunda e quinta à tarde). Primeiro, remova a mídia velha; em seguida, adicione a mídia quente nas laterais do suporte PDMS, nunca diretamente sobre o pool de células.
Nota: Se as células têm uma alta taxa de crescimento, a mídia deve ser alterado de 3 x por semana (por exemplo, segunda, quarta e sexta-feira). É necessário desconecte e reconecte todos os cabos, mas não há nenhuma necessidade de remover as placas de cultura e eletrodos de seu lugar. - Colete as amostras após a experimentação é executada.
4. amostra coleta no final da experimentação (dia 7)
-
Para análises de RNA
- Lave a construção 2x com 3 mL de 1X PBS durante 5 min à temperatura ambiente.
- Adicionar 3 mL de 0,05% do trypsin-EDTA para cada placa (suficiente para cobrir a construção inteira) e espere por 5 min a 37 ° C.
- Depois que as células são desanexadas, adicione 2 mL de meio completo para inactivar o tripsina-EDTA.
- Recolher todas as células em um 15 mL do tubo e lavar a construção 2x com 3 mL de PBS para coletar as células restantes.
- Centrifugar a 230 x g por 5 min a 22 ° C.
- Remover o sobrenadante e ressuspender o precipitado em 1 mL de PBS.
- Transferi a solução de célula para um tubo de 1,5 mL e centrifugar 230 x g por 5 min.
- Remover o sobrenadante e armazenar a pelota a-80 ° C em 700 µ l de reagente de Lise para isolamento de RNA ainda mais.
- Isole o RNA usando um kit comercial, seguindo as instruções do fabricante.
- Reverso-transcrever o RNA isolado usando o kit e hexâmeros aleatórios, de acordo com o protocolo do fabricante.
- Para pequenas concentrações de RNA, preamplify e, em seguida, diluir 1:5 com água livre de RNase antes subsequente transcrição reversa em tempo real reação em cadeia da polimerase (RT-PCR) é executada. Continuar com o protocolo padrão para o RT-PCR em tempo real e verificar os principais marcadores cardíacos.
Nota: Marcadores cardíacos típicos abrangem marcadores de início e finais de categorias diferentes, tais como fatores de transcrição cardíaca (2A de factor potenciador miócito específicos [MEF2A], proteína GATA-4 [GATA-4]) e estruturais (troponina cardíaca eu [cTnI], cardíaca troponina T [miocardite], α-actinin) e regulamento de cálcio (Connexin43 [Cx43], sarco-/ retículo endoplasmático Ca2 +-ATPase [SERCA2])30. Isolamento da proteína também pode ser realizado se necessário. Isolamento de RNA e proteína simultâneo pode ser executado com a mesma amostra, usando reagentes disponíveis comercialmente e kits (Tabela de materiais), se a quantidade de amostra é menor.
-
Por immunostainings
Nota: Isso é executado diretamente sobre as células anexadas para o pool de células da construção de PDMS. Portanto, recomendamos a colocação, cada vez, 1 x 1 cm da película de parafina no topo da piscina de celular, além da placa da tampa, para minimizar a evaporação das soluções de incubação.- Lave a construção 2x com 3 mL de PBS durante 5 min à temperatura ambiente.
- Conserte as células anexadas ao construção com 2 mL de formol a 10% por 15 min à temperatura ambiente.
- Lavar as células 3 x com 3 mL de PBS durante 5 min à temperatura ambiente. Para armazenamento a longo prazo, deixar as amostras em PBS com 0,1% de azida de sódio a 4 ° C.
- Permeabilize as células com 3 mL de PBS + 0,5% de detergente (3x, cada um tempo de 5 a 10 min, à temperatura ambiente).
- Incube as células com 100 µ l de PBS + 0,2% de detergente + 10% de soro de cavalo, albumina de soro bovino 1% à temperatura ambiente durante 1 h, para bloquear a ligação de anticorpos inespecíficos.
- Incube as células com 100 µ l de PBS + 10% de soro de cavalo + 0,2% de detergente + 1% albumina de soro bovino, anticorpo primário à temperatura ambiente durante 1 h. Por exemplo, os anticorpos primários contra Cx43 (1: 100), sarcomero α-actinin (1: 100), GATA-4 (01:50), MEF2 (01:25) e SERCA2 (01:50).
- Lave 3x com 3 mL de PBS em temperatura ambiente por 5 min.
- Incube as células com 100 µ l de PBS + anticorpo secundário à temperatura ambiente no escuro durante 1 h.
Nota: Anticorpos secundarios conjugados com diferente fluorophores e um agente counterstaining foram usados. - Lave-os 3 x com 3 mL de PBS em temperatura ambiente no escuro por 5 min.
- Incube as células com 100 µ l de nuclear de coloração (0,1 µ g/mL) em PBS a temperatura ambiente no escuro por 15 min.
- Lave-os 3 x com 3 mL de PBS em temperatura ambiente no escuro por 5 min.
- Armazene as amostras em 3 mL de PBS com 0,1% de azida de sódio a 4 ° C até a aquisição.
Nota: Aquisição de microscópio é possível em microscópios invertidos fluorescentes e confocal com objectivos de distância longa-trabalho porque a espessura da construção é de cerca de 0,5 mm.
Resultados
A Figura 2 representa o esquema geral seguido para a estimulação da célula. Brevemente, as células foram semeadas na construção de PDMS e submetidas à estimulação eletromecânica, com uma mudança de mídia realizada duas vezes por semana. Células nonstimulated foram usadas como um controle para o condicionamento eletromecânico. Além disso, nós adicionamos um controle extra para o experimento, e ATDPCs subcutâneas foram usados como um controle p...
Discussão
Estimulação eletromecânica parece ser uma alternativa segura para preparar células para um ambiente hostil e cardíaco e reforçar seu compromisso cardíaco. Aqui, um protocolo descrito para as células progenitoras cardíacas aumentou a expressão de marcadores cardíacos principais e foi relatado para ser benéfico para a sua próxima implantação no miocárdio murino enfartado30. Em geral, industrial estimulados ATDPCs cardíacas aumentaram a expressão de genes relacionados a cedo, estrut...
Divulgações
Os autores têm nada divulgar, exceto que o dispositivo de estimulação e protocolo anteriormente foram patenteados (WO-2013185818-A1, WO-2017125159-A1).
Agradecimentos
Os autores querem agradecer aos membros do programa de pesquisa ICREC (IGTP, Badalona) e grupo de instrumentação biomédica (UPC, Barcelona), especialmente Prof J. Rosell-Ferrer e eletrônica. Além disso, os autores reconhecem diário de medicina translacional de células-tronco e AlphaMed Press para permitir a adaptação das figuras previamente publicadas (Llucià-vedi, et al 30). o desenvolvimento deste protótipo e o design do protocolo foram apoiadas pelo Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y competitividade (SAF 2014-59892), a Comissão Europeia 7º programa-quadro ( RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330, 201516, 201502) e Fundación para la Innovación y la Prospectiva en de Salud en España (FIPSE; 06-00001396-15).
Materiais
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Referências
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados