È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Simultanea stimolazione elettrica e meccanica per migliorare il potenziale di cardiomiogenici delle cellule
In questo articolo
Riepilogo
Qui presentiamo un protocollo per la formazione di una popolazione delle cellule usando stimoli elettrici e meccanici, emulando la fisiologia cardiaca. Questa stimolazione elettromeccanica migliora il potenziale di cardiomiogenici delle cellule trattate ed è una strategia promettente per ulteriore terapia cellulare, la modellazione di malattia e lo screening di stupefacenti.
Abstract
Le malattie cardiovascolari sono la principale causa di morte nei paesi sviluppati. Di conseguenza, la domanda di terapie efficaci cellula cardiaca ha motivato i ricercatori nei campi di Bioingegneria e cellule staminali a sviluppare in vitro ad alta fedeltà miocardio umano per la ricerca di base e applicazioni cliniche. Tuttavia, il fenotipo immaturo delle cellule cardiache è una limitazione sull'ottenere tessuti che imitano funzionalmente il miocardio adulto, che è principalmente caratterizzato da segnali meccanici ed elettrici. Così, lo scopo del presente protocollo è di preparare e maturare la popolazione delle cellule di destinazione attraverso la stimolazione elettromeccanica, ricapitolare i parametri fisiologici. Ingegneria del tessuto cardiaco si sta evolvendo verso approcci più biologici e strategie basate sugli stimoli biofisici, così, stanno guadagnando slancio. Il dispositivo sviluppato per questo scopo è unico e permette individuo o simultanea stimolazione elettrica e meccanica, accuratamente caratterizzata e convalidato. Inoltre, anche se la metodologia è stata ottimizzata per questo stimolatore e una popolazione di cellule specifiche, può facilmente essere adattato ad altri dispositivi e linee cellulari. Qui i risultati offrono la prova dell'impegno cardiaco aumentato della popolazione cellulare dopo stimolazione elettromeccanica. Elettromeccanico stimolato le cellule mostrano un incremento dell'espressione dei principali marcatori cardiaci, compreso i geni precoce, strutturali e diregolamento. Questo condizionamento cella potrebbe essere utile per ulteriormente la terapia rigenerativa cellulare, la modellazione di malattia e screening di farmaci di alto-rendimento.
Introduzione
Funzione del cuore è basata sull'accoppiamento di eccitazione elettrica e meccanica contrazione. Brevemente, le giunzioni intercellulari del cardiomyocyte permettono di propagazione del segnale elettrico per produrre quasi sincrone contrazioni del cuore quel sangue pompa sistemica e attraverso il sistema polmonare. Le cellule cardiache, subiscono così sia elettriche che meccaniche forze che regolano la funzione cellulare e l'espressione del gene. Di conseguenza, molti gruppi hanno tentato di sviluppare piattaforme di cultura che simulano l'ambiente fisiologico cardiaco per comprendere il ruolo della stimolazione elettrica e meccanica sullo sviluppo cardiaco, la funzione e la maturazione. In vitro stimolazioni elettriche e meccaniche individualmente sono stati applicati estesamente in ingegneria del tessuto cardiaco per migliorare proprietà funzionali, aumentare la maturazione delle cellule o accoppiamento cellula-cellula e calcio manipolazione1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. Tuttavia, sincrono condizionata elettromeccanico rimane inutilizzato a causa la sfida di sviluppare un protocollo e stimolatore e per l' obbligatorio ottimizzazione22.
Lavoro preliminare indirizzata stimolazione elettromeccanica come una combinazione di stimolazione elettrica e l'aspersione di media; Tuttavia, il flusso non comporta la deformazione basati su ceppo tipica del riempimento ventricolare23,24,25. Più tardi, più fisiologici approcci combinati stimoli elettrici con deformazione fisica o tratto di imitare le isovolumetrico contrazione26,27,28,29,30 ,31. Feng et al. descritto la prima dimostrazione di stimolazione elettromeccanica nel 2005, segnalazione migliorata dei cardiomiociti le proprietà size e contrattili26. Wang et al. pretrattato le cellule staminali mesenchimali con 5-azacitidina e applicato simultanea condizionata elettrica e meccanica, migliorare ricellularizzazione, vitalità cellulare, differenziamento cardiaco ed il tessuto che ritocca27. Poiché tali pubblicazioni, altri gruppi hanno segnalato sulla stimolazione elettromeccanica di monostrati di cellule umane o progettato tessuti (ad es., nero28, Vunjak-Novakovic29,31e il nostro gruppo30) con la prime condizionate cellule testate in vivo30. Brevemente, Morgan e nero testato diverse combinazioni di stimoli elettrici e meccanici, segnalare che la tempistica tra stimolazioni era cruciale perché in ritardo stimolazione combinata elettromeccanica ha prodotto i migliori risultati28. Successivamente, Godier-Furnémont e collaboratori ottimizzato un protocollo di stimolazione elettromeccanici per i costrutti di muscolo cardiaco ingegnerizzato da cellule del cuore neonatale del ratto e raggiunto, per la prima volta, un rapporto di forza-frequenza positiva29. In seguito, il nostro gruppo ha riferito che cellule elettromeccanico precondizionate ha aumentato l'espressione di marcatori cardiaci principale in vitro e generica benefica effetti in vivo, come ha migliorato la funzione cardiaca o aumentato la densità del vaso in infarto regione di confine30. La pubblicazione più recente ha dimostrato che i tessuti cardiaci da cardiomiociti derivati da cellule staminali sottoposti a elettromeccanico condizionata ha raggiunto una maturazione livello più vicino all'essere umano adulto cardiaca struttura e funzione31. Inoltre, piattaforme di stimolazione tridimensionale alternativi comprendono elettroattivi impalcature che forniscono elettrici, meccanici e topografiche segnali alle cellule allegato32. Inoltre, la deformazione meccanica (cellulare dello strato monomolecolare stretching e compressione) possa anche essere indotti con elettrodi estensibili che imita condizioni fisiologiche normali, come pure le condizioni estreme33.
Di conseguenza, la logica è che stimoli elettromeccanici in vitro basati su condizioni fisiologiche potrebbero migliorare il potenziale di cardiomiogenici di una cella. Infatti, questa stimolazione potrebbe beneficiare di ulteriori integrazioni di cellule terapeutiche nel miocardio in uno scenario clinico o aumentare la maturazione del tessuto per applicazioni di screening di stupefacenti.
Inoltre, abbiamo isolato e caratterizzato una popolazione di cellule progenitrici derivate dal tessuto adiposo umano di cardiaco di origine (ATDPCs cardiaca)34. Queste cellule si trovano nel grasso dell'epicardio. Queste cellule visualizzare effetti istopatologici e funzionali benefici nel trattamento di infarto miocardico e anche mantengono la differenziazione cardiaca ed endoteliale potenziali. 30 , 35. abbiamo supposto che questi benefici aumenterebbero dopo stimolazione biofisica.
Di conseguenza, abbiamo sviluppato un dispositivo e un regime di stimolazione per la popolazione delle cellule di interesse e studiato gli effetti. Questo protocollo elettromeccanico è una nuova strategia per indurre la cella attiva, che si estende in modo sterile e non invadente rispetto a precedenti pubblicazioni36, in combinazione con la stimolazione del campo elettrico. La tecnica segnalata qui spiega in dettaglio il dispositivo e il metodo utilizzato per la stimolazione elettrica, meccanica ed elettromeccanica delle cellule.
Questo dispositivo può fornire stimolazione sia elettrica che meccanica, singolarmente o contemporaneamente. La stimolazione viene eseguita con un metodo novello non invadente e asettico che include il supporto di cella presterilizzati, elettrodi posizionati all'interno di una piastra di coltura standard e una piattaforma che induce le forze meccaniche ed elettriche (Figura 1).
La piattaforma può contenere fino a sei cultura piastre ed è costituito da una struttura a sandwich del taglio laser poly(methyl methacrylate) e pezzi di bordo del circuito stampato. Il prototipo di piattaforma si basa su una combinazione di una monofasica programmabile computerizzato stimolatore elettrico, scheda a circuiti stampati per la potente connessione degli elettrodi e magneti al neodimio-fisso nichelato sei 10 x 10 mm x 5 mm disposti vicino a un lato delle piastre di coltura. C'è anche una barra di alluminio con sei magneti guida (stesso modello) posta di fronte l'altro lato delle piastre cultura e spostato con un servomotore lineare. Il motore è comandato da un controllore motore, operato attraverso una porta RS-232 da software commerciale (Vedi la Tabella materiali). Attraverso l'interfaccia utente e stimolatore programmabile, è possibile programmare l'intensità elettrica, la durata dell'impulso e frequenza, la frequenza di stimolazione meccanica, ciclo di dovere, il numero di impulsi, l'ampiezza di impulso (escursione magnete), e la pendenza.
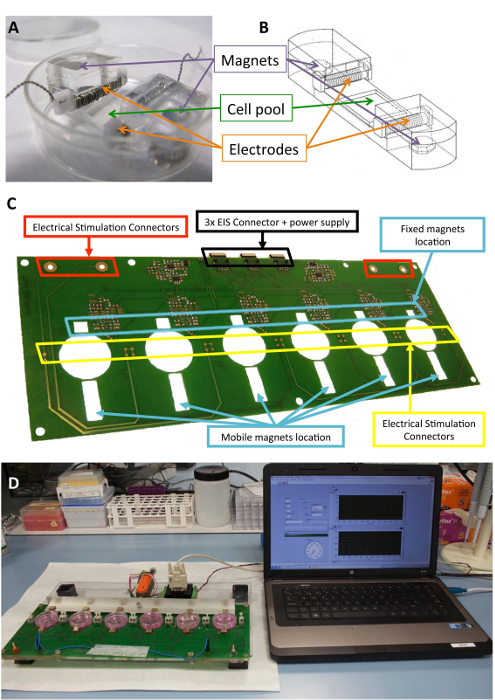
Figura 1 : Stimolatore elettromeccanico. (A) PDMS costrutto utilizzato per il condizionamento delle cellule. (B) disegno del costrutto PDMS, compresi elettrodi e magneti. (C) particolare del bordo del circuito stampato (piattaforma) utilizzato per eseguire il condizionamento elettromeccanico. Questo pannello è stato modificato da Llucià-Valldeperas et al.30. (D) foto della stimolazione elettromeccanici piattaforma e l'interfaccia utente (computer). Clicca qui per visualizzare una versione più grande di questa figura.
Lo stimolatore sia il metodo per il condizionamento elettromeccanico sono descritti in due brevetti internazionali, WO-2013185818-A137 e WO-2017125159-A138.
Il silicone biocompatibile costrutti progettati per fornire un sostegno strutturale a cellule, elettrodi e magneti sono stati descritti precedentemente10,21. Brevemente, si tratta di polidimetilsilossano (PDMS), modellato e curato a temperatura ambiente, con un modulo di Young di 1,3 MPa, vicino ai livelli fisiologici. Il costrutto contiene un pool di cultura delle cellule in un'area flessibile (10 x 10 x 2 mm), due slot trasversale interna per tenere gli elettrodi e due incorporato 6 x 2 mm x 4 mm nichelato del neodimio. Gli elettrodi sono costruiti con 0.2 mm platino filo attorcigliato un 2 x 3 mm x 12 di politetrafluoroetilene (PTFE) di mm core (21 cm per elettrodo, circa 23 giri) e collocati ai lati opposti della zona flessibile per creare un campo elettrico per l'induzione stimolazione elettrica. Stiramento meccanico avviene attraverso l'attrazione magnetica tra magneti incorporati nel supporto e magneti esterni collocati accanto la piastra di coltura e sul movimento braccio in alluminio. In questo modo, il supporto di cella può essere esteso senza rompere la barriera sterile. Questo approccio è adatto per un monostrato di cellule ma potrebbe essere adattato ai costrutti tridimensionali, pure.
Inoltre, uno schema regolare potrebbe essere impresso dove le cellule sono seminate, utilizzando un reticolo di diffrazione governato (1.250 scanalature/mm). La visualizzazione diretta delle cellule coltivate sul costrutto di PDMS sotto campo chiaro e microscopi fluorescenti è possibile grazie alla sua trasparenza e 0,5 mm di spessore. Nel caso attuale, la piscina di cultura PDMS ha un modello di superficie verticale, perpendicolare alla forza di stiramento, per allineare le cellule perpendicolarmente al campo elettrico, che minimizza il gradiente di campo elettrico attraverso la cella.
La figura 1 Mostra una descrizione dettagliata del costrutto e del dispositivo utilizzato per la stimolazione. Costruire il PDMS e caratteristiche sono ottimizzate per la cella che si estende (Figura 1A, B). Lo stimolatore è sviluppato e validato per l'efficace applicazione della stimolazione elettrica e meccanica desiderata a cellule allegate al costrutto di PDMS. Questo processo include la garanzia buona operabilità connettività e utente tramite l'interfaccia software (Figura 1, D).
La procedura per la stimolazione di cellule utilizzando questo dispositivo su misura è descritta nella sezione protocollo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questo studio utilizza ATDPCs cardiaco umano da campioni di pazienti. Loro uso è stato approvato dal comitato etico locale, e tutti i pazienti hanno dato il consenso informato. Il protocollo di studio è conforme ai principi delineati nella dichiarazione di Helsinki.
1. preparati
- Autoclave due pinzette, 12 elettrodi di platino PTFE per la stimolazione elettrica e alcuni asciugamani di carta, a 121 ° C per 20 min.
-
Sterilizzare 12 costrutti su ordine di PDMS (Figura 1A).
- Lavare ogni costrutto con 5 mL di acqua distillata sterile con agitazione magnetica a temperatura ambiente per 15 min.
- Lavare 1 x 5 ml di etanolo al 70% con agitazione magnetica a temperatura ambiente per 5 min.
- Lavare 5 volte con 5 mL di acqua distillata sterile con agitazione magnetica a temperatura ambiente per 10 min per lavaggio, per rimuovere i residui alcolici.
- Asciugare i costrutti su carta sterile assorbente all'interno il pernottamento del gabinetto di flusso.
- Memorizzarli in provette da centrifuga sterile 50ml fino all'utilizzo.
2. cellula semina (giorno -1)
- Prima semina cellulare, trasferire i costrutti PDMS puliti a piastre sterili ed esporli alla luce ultravioletta per 5 min garantire una sterilizzazione completa.
- Trasferire ogni costrutto a una piastra di coltura cellulare di 35 mm o 6 pozzetti, per il seeding cellulare immediato.
-
Tripsinizzano un pallone T75 confluente di ATDPCs cardiaca.
- Lavare il matraccio T75 con 5 mL di tampone fosfato salino (PBS): 1x.
- Aggiungere 1 mL di tripsina-EDTA 0,05% e incubare a 37 ° C per 5 min staccare le cellule.
- Aggiungere 5 mL di terreno completo per inattivare la tripsina-EDTA.
- Raccogliere tutte le celle in un tubo da 15 mL e lavare la beuta 2 volte con 5 mL di PBS per raccogliere tutte le cellule rimanenti.
- Centrifugare a 230 x g per 5 min a 22 ° C, eliminare il surnatante e risospendere le cellule in 2 mL di terreno completo di contarli con la camera di un emocitometro.
- Seme 200 µ l di ATDPCs cardiaca (2,5 x 105 cellule/mL) nel pool delle cellule dei costrutti PDMS 12 (Figura 1A, B) avere ~ 80% della superficie della semina coperta dalle cellule il giorno dopo e incubare a 37 ° C e 5% CO2.
Nota: Dopo 2 – 4 h, le cellule devono essere collegate. Inoculo di cellule è preparata secondo la dimensione delle cellule e la crescita. Per cellule più piccole, la densità di semina deve essere aumentata. - Delicatamente aggiungere 2 mL di terreno completo preriscaldata (α-MEM completati con 10% fetale bovino del siero, 1% L-Glutammina e 1% penicillina-streptomicina) per piastra.
- Incubare per una notte i costrutti alle condizioni di coltura (di solito 37 ° C e 5% CO2).
3. elettromeccanico stimolazione Setup (giorno 0)
- Prima di iniziare la procedura di prendere sei costrutti per stimolazione elettromeccanico e sei come controlli nonstimulated. Con meno di sei piastre per stimolazione, utilizzare costrutti di vuoti con lo stesso volume medio per garantire il corretto campo elettrico stimolazione.
- Pulire l'unità di stimolazione con etanolo al 70% e collocare nel flusso di armadio.
- Portare gli elettrodi sterili e pinzette all'interno dell'armadio di flusso.
- Eliminare il 90% dei media dalla piastra di coltura per manipolare facilmente degli elettrodi e dei costrutti. In primo luogo, è possibile posizionare i costrutti PDMS nella giusta posizione per garantire attrazione magnetica (spostamento di PDMS all'interno del piatto di cultura verso il magnete) tra magneti fissi e mobili. Quindi, collegare il filo di platino per i connettori di elettrodo e la parte PTFE nel suo spazio designato nel costrutto PDMS.
- Aggiungere 2,5 mL di terreno completo preriscaldato nuovo ogni costrutto.
Nota: Mantenere la sterilità durante tutta la procedura e operare su un costrutto in un momento. Mantenere il resto dei costrutti in incubatore a 37 ° C e 5% CO2 fino all'utilizzo. - Una volta che tutti i costrutti di PDMS sono collocati ed elettricamente collegati alla piattaforma, riportare la piattaforma in incubatore a 37 ° C e 5% CO2.
- Collegare la sorgente elettrica e meccanica.
-
Configurare il programma di stimolazione. Specificare i regimi di stimolazione elettrica e meccanica attraverso le interfacce utente di stimolatori elettrici e l'applicazione, che controlla la stimolazione meccanica. Impostare il sincronismo come segue.
- Accendere l'elettrostimolatore. Attesa per il menu principale ad apparire sul display.
- Quindi, selezionare opzione 2: modificare la sequenza + invio.
- Modificare la sequenza di Menu come segue.
- Utilizzare la scheda di modalità per selezionare tensione o corrente. Selezionare corrente facendo + e premere invio.
- Per la scheda di ampiezza , selezionare 1 (mA) con + /- e premere invio.
- Per il Periodo (T), seleziona 1000 (ms) con + /- e premere invio.
- Impostare la durata dell'impulso (Tw) su 2 (ms) con + /- e premere invio.
- Per la scheda di Trigger modalità , selezionare esterno dal software e premere invio.
- Ritorna al menu principale, selezionare opzione 4: generare la sequenza e premere invio.
Nota: Lo stimolatore elettrico riposa in standby fino a quando riceve un comando di trigger dall'applicazione di stimolatore meccanico attraverso la porta seriale.
- Eseguire la procedura seguente nella sezione stimolazione meccanica l'applicazione del pannello di controllo (Figura 2C).
- Scrivere 1.000 (ms) nel controllo di testo Periodo di impulso .
- Scrivere 500 (ms) nel controllo di testo tempo ON (Tw) per impostare la durata dell'impulso meccanico.
- Scrittura 2.000 (AU) nel controllo di testo escursione a consegnare un allungamento del costrutto di 10%. Questo è il numero di passi del motore di controllo lineare.
Nota: Il protocollo di stimolazione applicato qui consiste di impulsi a onda quadra monofasica corrente alternata 2 ms 50 mV/cm a 1 Hz e 10% che si estende per 7 giorni. I tempi di ascesa e la caduta dell'impulso meccanico sono impostati su 100 ms, per imitare approssimativamente la forma dell'impulso di pressione di focolare. Inoltre, la modalità di ripetizione è impostata su continua e c'è un contatore che Visualizza il numero di impulsi.
- Accendere l'elettrostimolatore. Attesa per il menu principale ad apparire sul display.
- Cambiare il supporto 2 volte alla settimana (lunedì e giovedì pomeriggio). Innanzitutto, rimuovere i vecchi media; Successivamente, aggiungere i media caldi sui lati del supporto PDMS, mai direttamente sulla piscina cella.
Nota: Se le cellule hanno un tasso di crescita elevato, i media dovrebbe essere cambiata 3 volte a settimana (ad esempio, lunedì, mercoledì e venerdì). È necessario scollegare e ricollegare tutti i cavi, ma non c'è nessuna necessità di rimuovere le piastre di coltura ed elettrodi dal loro posto. - Raccogliere i campioni dopo la sperimentazione viene eseguita.
4. campione insieme alla fine della sperimentazione (giorno 7)
-
Per le analisi di RNA
- Lavare il costrutto 2x con 3 mL di PBS 1X per 5 min a temperatura ambiente.
- Aggiungere 3 mL di tripsina-EDTA 0,05% per ogni piatto (sufficiente a coprire l'intero costrutto) e aspettare per 5 min a 37 ° C.
- Dopo le cellule sono staccate, aggiungere 2 mL di terreno completo per inattivare la tripsina-EDTA.
- Raccogliere tutte le celle in una 15 mL tubo e lavare il costrutto 2x con 3 mL di PBS per raccogliere tutte le cellule rimanenti.
- Centrifugare a 230 x g per 5 min 22 ° C.
- Rimuovere il supernatante e risospendere il pellet in 1 mL di PBS.
- Trasferire la soluzione di cella in una provetta da 1,5 mL e centrifugare a 230 x g per 5 min.
- Rimuovere il supernatante e conservare il pellet a-80 ° C a 700 µ l di reagente di lisi per ulteriore isolamento del RNA.
- Isolare il RNA usando un kit commerciale, seguendo le istruzioni del produttore.
- Retromarcia-trascrivere il RNA isolato usando il kit di esameri casuali, secondo il protocollo del produttore.
- Piccole concentrazioni di RNA, preamplificare e, quindi, diluire 1:5 con acqua RNAsi-libera prima che venga eseguita la reazione a catena della polimerasi successiva trascrizione d'inversione in tempo reale (RT-PCR). Continuare con il protocollo standard per RT-PCR in tempo reale e controllare i principali marcatori cardiaci.
Nota: Gli indicatori cardiaci tipici comprendono marcatori precoci e tardi da diverse categorie, come fattori di trascrizione cardiaco (rinforzatore del miocita specifico fattore 2A [MEF2A], proteina GATA-4 [GATA-4]) e strutturali (troponina cardiaca ho [cTnI], cardiaca troponina T [cTnT], α-actinina) e regolamento del calcio (Connexin43 [Cx43], sarco-/ del reticolo endoplasmatico Ca2 +-ATPase [SERCA2])30. Isolamento della proteina può essere eseguita anche se necessaria. Isolamento di RNA e proteina simultanea può essere eseguita con lo stesso campione, utilizzando commercialmente disponibili reagenti e Kit (Tabella materiali) se la quantità di campione è minore.
-
Per immunostainings
Nota: Questa operazione è eseguita direttamente sulle cellule adiacente alla piscina di cella del costrutto PDMS. Pertanto, si consiglia di mettere, ogni volta, 1 x 1 cm della pellicola di paraffina nella parte superiore della piscina di cella, a parte la piastra del coperchio, per ridurre al minimo l'evaporazione delle soluzioni di incubazione.- Lavare il costrutto 2x con 3 mL di PBS per 5 min a temperatura ambiente.
- Fissare le cellule attaccate al costrutto con 2 mL di formalina al 10% per 15 min a temperatura ambiente.
- Lavare le cellule 3 x con 3 mL di PBS per 5 min a temperatura ambiente. Per l'archiviazione a lungo termine, lasciare i campioni in PBS con 0,1% di sodio azide a 4 ° C.
- Permeabilize le cellule con 3 mL di PBS + 0,5% detergente (3x, in ogni tempo di 5 – 10 min, a temperatura ambiente).
- Incubare le cellule con 100 µ l di PBS + 0,2% detergente + 10% di siero equino, albumina di siero bovino 1% a temperatura ambiente per 1 h, per bloccare il legame non specifico anticorpo.
- Incubare le cellule con 100 µ l di PBS + 10% di siero di cavallo + detergente 0,2% + 1% di albumina di siero bovino e anticorpo primario a temperatura ambiente per 1 h. Ad esempio, gli anticorpi primari contro Cx43 (1: 100), sarcomeriche α-actinina (1: 100), GATA-4 (01:50), MEF2 (01:25) e SERCA2 (01:50).
- Lavare 3 volte con 3 mL di PBS a temperatura ambiente per 5 min.
- Incubare le cellule con 100 µ l di PBS + anticorpo secondario a temperatura ambiente al buio per 1 h.
Nota: Anticorpi secondari coniugati con diversi fluorofori e un agente di counterstaining sono stati usati. - Lavare 3 volte con 3 mL di PBS a temperatura ambiente al buio per 5 min.
- Incubare le cellule con 100 µ l di (0,1 µ g/mL) di macchiatura nucleare PBS a temperatura ambiente al buio per 15 min.
- Lavare 3 volte con 3 mL di PBS a temperatura ambiente al buio per 5 min.
- Conservare i campioni in 3 mL di PBS con 0,1% di sodio azide a 4 ° C fino all'acquisizione.
Nota: Acquisizione di microscopio è possibile su microscopi fluorescenti e confocale con obiettivi di distanza lunga-lavoro perché lo spessore di costrutto è di circa 0,5 mm.
Access restricted. Please log in or start a trial to view this content.
Risultati
Figura 2 rappresenta lo schema generale seguito per la stimolazione delle cellule. Brevemente, cellule sono state seminate sul costrutto PDMS e sottoposti a stimolazione elettromeccanica, con una media modifica eseguita due volte a settimana. Cellule nonstimulated sono state usate come controllo per il condizionamento elettromeccanico. Inoltre, abbiamo aggiunto un controllo supplementare per l'esperimento e sottocutaneo ATDPCs sono stati utilizzati come contr...
Access restricted. Please log in or start a trial to view this content.
Discussione
Elettromeccanica stimolazione sembra essere un'alternativa sicura per preparare le celle per un ambiente ostile cardiaco e rafforzare il loro impegno cardiaco. Qui, un protocollo descritto per cellule progenitrici cardiache aumenta l'espressione di marcatori cardiaci principali ed era segnalato per essere utile per loro prossimo impianto il miocardio infartuato murino30. In generale, ATDPCs cardiaco elettromeccanico stimolato ha aumentato l'espressione di geni correlati a presto, strutturali e reg...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare, ad eccezione del fatto che il dispositivo di stimolazione e il protocollo precedentemente sono stati brevettati (WO-2013185818-A1, WO-2017125159-A1).
Riconoscimenti
Gli autori desiderano ringraziare i membri del gruppo Strumentazione Biomedica (UPC, Barcellona), soprattutto prof J. Rosell-Ferrer ed elettronica e il programma di ricerca di ICREC (IGTP, Badalona). Inoltre, gli autori riconoscono le cellule staminali Translational Medicine journal e AlphaMed Press per consentire l'adattamento delle figure precedentemente pubblicati (Llucià-Valldeperas, et al. 30). lo sviluppo di questo prototipo e la progettazione del protocollo sono stati sostenuti dal Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y Competitividad (SAF 2014-59892), la Commissione europea 7 ° programma quadro ( RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330, 201516, 201502) e Fundación para la Innovación y la Prospectiva dell'en Salud España (FIPSE; 06-00001396-15).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Riferimenti
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93(2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055(2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499(2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895(2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , Barcelano, Spain. WO/2013/185818 (2013).
- Method for Conditioning Stem Cells. Spanish patent. , Barceleno, Spain. WO/2017/125159 (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon