Method Article
Características de imagem da doença pulmonar intersticiacional associada à esclerose sistêmica
Neste Artigo
Resumo
Aqui, apresentamos recomendações práticas para a realização de tomografia computadorizada de alta resolução torácica para diagnóstico e avaliação da doença pulmonar intersticiada relacionada à esclerose sistêmica.
Resumo
O diagnóstico precoce da doença pulmonar intersticiais relacionada à esclerose sistêmica (SSc-ILD) é importante para permitir que o tratamento seja administrado com atraso mínimo. No entanto, diagnosticar SSc-ILD é desafiador porque os sintomas-chave não são específicos. A tomografia computadorizada de alta resolução (HRCT) do tórax é reconhecida como um método de imagem sensível para diagnosticar e avaliar o SSc-ILD. A exposição dos pacientes à radiação ionizante pode ser considerada como uma limitação, embora medidas metodológicas possam ser tomadas para moderar isso. Apresentamos recomendações práticas para a realização de exames de HRCT e interpretação dos resultados. As principais características do SSc-ILD no HRCT incluem um padrão de pneumonia intersticiacional não específica (NSIP) com opísas periféricas de vidro moído e bronquiectasis de tração extensiva. Apesar das semelhanças entre SSc-ILD e fibrose pulmonar idiopática (IPF), o HRCT pode ser usado para diferenciar entre essas condições: no SSc-ILD em comparação com o IPF, há uma maior proporção de opacidade de vidro moído e a fibrose é menos grosseira. Um esôfago dilatado e cheio de ar com diâmetro >10 mm, sugestivo de dismotilidade esofágica é comumente visto em SSc-ILD. O tamanho da artéria pulmonar maior que a aorta ascendente adjacente sugere hipertensão pulmonar coexistente. Os nódulos devem ser monitorados devido ao aumento do risco de câncer de pulmão. Grande parte da doença no HRCT (≥20%) ou um alto escore de fibrose sugere um risco aumentado de mortalidade. O HRCT é central para diagnosticar SSc-ILD, e avaliações seriais podem ser úteis no monitoramento da progressão da doença ou na resposta ao tratamento.
Introdução
A esclerose sistêmica (SSc) é uma doença complexa, heterogênea e autoimune. Pode ser manifestado como vasculopatia, fenômeno de Raynaud e fibrose da pele e órgãos internos1. O SSc é classificado em subtipos da seguinte forma: cutâneo limitado, cutâneo difuso, esclerodermia seno (sem envolvimento da pele) e síndrome de sobreposição SSc1.
O SSc não é herdado de forma mendeliana, mas fatores genéticos parecem influenciar a suscetibilidade à doença. As taxas de incidência diferem entre os grupos étnicos e são aumentadas entre indivíduos com histórico familiar da doença2,3. Fatores de risco ambientais também parecem existir, com alta exposição a sílica ou solventes orgânicos aparecendo para aumentar a ocorrência de SSc4. A prevalência global de SSc é de cerca de 1 em 10.0001. Mais fêmeas do que homens são afetadas pelo SSC, com proporções femininas/masculinas relatadas variando entre 3:1 e 8:1, e a faixa etária com maior incidência da doença é de 45 a 54 anos5.
O pulmão é o segundo órgão visceral mais comumente afetado em pacientes com SSc6. Existem duas principais manifestações pulmonares de SSc: doença pulmonar intersticiacional (ILD) e hipertensão pulmonar7. ILD é geralmente fibroso; ocorre em aproximadamente 80% dos pacientes com SSc e é mais comum em esclerodermia cutânea difusa do que na forma limitada da doença1,,8. A hipertensão pulmonar pode manifestar-se como hipertensão arterial pulmonar isolada (PAH, que tem prevalência de 13-35% em SSc) ou hipertensão pulmonar resultante de envolvimento ventricular esquerdo/disfunção diastólica ou ILD/hipoxemia7. Os perfis de anticorpos diferem entre pacientes com SSc-ILD e aqueles com SSc-PAH. Por exemplo, a presença de anticorpos anti-Scl-70 está associada ao SSc-ILD8,enquanto anticorpos anticentromere são mais comuns em pacientes com SSc do que naqueles sem PAH9.
Os sintomas do SSc-ILD incluem dispneia, tosse, dor no peito e limitação do exercício. O ILD é um dos principais contribuintes para a morbidade no SSc10,11,12. Como consequência, os custos anuais de saúde de todas as causas têm sido relatados como mais elevados em pacientes com SSc-ILD do que naqueles com SSc e sem ILD: US$ 31.285-55.446 contra US$ 18.513-23.268,respectivamente 13.
O SSc-ILD é a principal causa de mortalidade em pacientes com SSC, representando 30-35% dos óbitos neste grupo10,14. A sobrevida mediana entre pacientes com SSc-ILD foi relatada como sendo de 5 a 8 anos10,15; em comparação, aproximadamente 76% da população global com SSc sobrevive há mais de 10 anos desde o início da doença16. Preditores significativos de mortalidade em SSc-ILD incluem idade, capacidade vital forçada (FVC), capacidade de difusão da linha de base do pulmão para monóxido de carbono (DLCO), extensão da doença na tomografia computadorizada de alta resolução (HRCT), presença de hipertensão pulmonar e níveis de antígeno Kerbs von den Lungren 6 (KL-6)17,18.
O diagnóstico precoce é importante para permitir que o tratamento seja administrado com atraso mínimo e, em pacientes com fenótipo progressivo, a progressão da doença pode potencialmente ser retardada. No entanto, diagnosticar SSc-ILD é desafiador porque sintomas não específicos de tosse, dispneia e fadiga podem ser confundidos com outros aspectos do SSc, como doença cardíaca e envolvimento musculoesquelético. As avaliações para o diagnóstico de ILDs incluem: apresentação clínica, histórico, estado de tabagismo, função pulmonar, imagem e, em alguns casos, biópsia pulmonar. A afirmação do diagnóstico SSc-ILD requer várias investigações, muitas vezes utilizadas na combinação19. As avaliações mais utilizadas incluem testes de função pulmonar e HRCT20,,21,,22,23. Outros métodos de imagem, como radiografia torácica e radiografia (por exemplo, ressonância magnética [RM], ultrassom pulmonar) também podem ser empregados22. Testes de função pulmonar são usados para avaliar a gravidade do ILD e monitorar seu curso. No entanto, o uso apenas de testes de função pulmonar é de uso limitado para o diagnóstico de SSc-ILD24,25. O HRCT do peito é visto como o meio não invasivo mais sensível de facilitar o diagnóstico diferencial do SSc-ILD19. Os resultados do HRCT de linha de base, bem como as alterações ao longo do tempo, podem ser usados para prever o curso futuro de doenças pulmonares e a resposta potencial à terapia26.
A exposição à radiação com HRCT é às vezes considerada como fator limitante para a triagem regular27,28; limitar o número de fatias é um método potencial para reduzir o risco de radiação, e a dose também pode ser reduzida diminuindo a tensão ou a corrente29,,30,,31. Alternativamente, diferentes métodos de avaliação podem ser considerados. Por exemplo, a ressonância magnética parece ter algum potencial para avaliação e acompanhamento de pacientes com ILD22. Em um estudo utilizando imagens de ressonância magnética ponderadas por T2 com sincronização respiratória, o HRCT foi realizado em paralelo como a avaliação "padrão-ouro"; 100% de sensibilidade e 60% de especificidade foram relatados com ressonância magnética para determinação da presença de ILD32. Concordância semelhante entre A Ressonância Magnética e HRCT na detecção e categorização do ILD foi relatada em outro estudo33. Apesar dos resultados promissores, a ressonância magnética é atualmente uma metodologia de pesquisa e ainda não está pronta para uso clínico generalizado.
Aqui, fornecemos uma visão prática da interpretação dos resultados de imagem, com foco no HRCT, para diagnosticar o envolvimento pulmonar no SSc, determinar o prognóstico e também explorar desenvolvimentos futuros que possam melhorar os métodos de imagem e a interpretação dos resultados. Imagens HRCT de casos representativos estão incluídas no artigo.
Protocolo
1. Digitalização hrct
- Realizar a varredura volumosa de aquisição de HRCT do baú36. Os agentes de contraste não são necessários36,37.
- Obtenha as seguintes aquisições com parâmetros apresentados na Tabela 136,37.
- Adquira uma varredura inspiratória supina (volumosa) dos apices pulmonares até a base pulmonar.
- Adquira uma varredura expiratória supina (sequencial com lacunas de 10 a 20 mm) de 2 cm abaixo dos apices pulmonares até a base pulmonar.
- Adquira um opcional inspirador propenso (sequencial com lacunas de 10 a 20 mm) da carina até a base pulmonar.
- Dê instruções respiratórias ao paciente antes de cada aquisição36,37. Para uma varredura inspiratória, diga "Respire fundo...e deixe sair. Respire fundo...e deixe sair. Tome outra respiração profunda, e segure sua respiração dentro Continue segurando a respiração"37.
- Obtenha varreduras inspiradoras na inspiração completa35,36.
- Use a colisão mais fina, o menor tempo de rotação e o tom mais alto para garantir que as imagens livres de movimento sejam obtidas36. Os parâmetros de digitalização sugeridos estão detalhados na Tabela 137.
- Para a ótima qualidade das varreduras volumosas, obtenha imagens de seção fina (<2 mm) com reconstrução de alta resolução espacial35,36.
- Revise as varreduras imediatamente após a aquisição e repita se algum artefato de movimento estiver presente ou se a inspiração inadequada ocorreu37.
2. Reportagem
- Prepare um relatório interpretativo.
- Compartilhe o relatório e as imagens do HRCT com a equipe de atendimento do paciente e adicione-as aos prontuários do paciente.
Resultados
Diagnóstico
As principais características do SSc-ILD no HRCT geralmente incluem um padrão de pneumonia intersticiacional não específica (NSIP) com opísas periféricas de vidro moído e bronquiectasis de tração extensiva(Figura 1 e Figura 2). As opacities de vidro moído têm uma etiologia ampla e muitas vezes não são específicas40,,41,42. Predominância central ou distribuição periférica com poupança subpleural é altamente sugestiva de NSIP (Figura 3).
Normalmente, os padrões de ILD em imagens HRCT incluem reticulações com distorção arquitetônica resultando em bronquiectase de tração/bronquiolectase (consistente com uma forma fibrosa de NSIP). De fato, a bronquiectase de tração e a bronquiolectase de tração são frequentemente as características predominantes do SSc-ILD (Figura 4)43. Achados adicionais podem incluir favo de mel (Figura 5; mais comum em formas limitadas de SSc), espessamento septal interlobular e linhas intralobulares, e micronódulos40,44. Favo de mel refere-se a espaços aéreos císticos agrupados de diâmetro tipicamente consistente (~3-10 mm) com paredes grossas e bem definidas31. Faxis de favo de mel e tração são características-chave da pneumonia interstícia usual (UIP) no HRCT. Embora este padrão esteja mais comumente associado à fibrose pulmonar idiopática (IPF), o protótipo fibrosing ILD com um fenótipo progressivo, às vezes pode ser visto em pacientes com SSc-ILD10. Recentemente, vários sinais foram identificados em pacientes com ILD relacionado à doença de tecido conjuntivo (incluindo SSc-ILD) e o padrão UIP no HRCT, mas não naqueles com IPF. Estes são o sinal de borda reta (ou seja, isolamento da fibrose às bases pulmonares com demarcação acentuada no plano craniocaudal sem extensão substancial ao longo das margens laterais dos pulmões em imagens coronais), o sinal predominante (ou exuberante) (>70% de porções fibrosas do pulmão), e o sinal anterior do lobo superior (ou seja, concentração de fibrose no aspecto anterior dos lóbulos superiores, com relativa poupança dos outros aspectos dos lobos superiores, e envolvimento concomitante do lobo inferior)45. O sinal de borda reta também foi associado à patologia NSIP46,que é o principal padrão de tomografia computadorizada no SSc-ILD10.
O esôfago dique recheado de ar é frequentemente observado em pacientes com SSc (Figura 6)47,,48,49 e em pacientes com SSc-ILD47,48. Embora não exista um limite de idade superior aceito onde um esôfago dilatado pode não ajudar mais a diferenciar SSc-ILD e IPF, um esôfago dilatado pode ser mais difícil de interpretar em pacientes com mais de 65 anos devido à crescente incidência de distúrbios de motilidade esofágica. Linfadopatia mediastinal (geralmente reativa), na qual o eixo curto do linfonodo excede 10 mm, também é frequentemente observado em pacientes com SSc-ILD47,50. O tamanho da artéria pulmonar maior que a aorta ascendente adjacente sugere hipertensão pulmonar coexistente(Figura 6),mesmo em pacientes sem doença pulmonar fibrosa51,,52,53. As áreas de consolidação sugerem infecção sobreposta, aspiração, organização de pneumonia, hemorragia ou malignidade. Os nódulos devem ser monitorados devido ao aumento do risco de câncer de pulmão no SSc-ILD7; o câncer primário mais comum a surgir em pacientes com SSc-ILD é o adenocarcinoma7,54.
O SSc-ILD compartilha uma série de semelhanças clínicas, mecanicistas e patológicas com o IPF15,55. No entanto, algumas características radiológicas permitem a diferenciação desses dois ILDs15,45. No SSc-ILD, em comparação com o IPF, há uma maior proporção de opacidade de vidro moído e a fibrose é menos grosseira. Nos casos de UIP no SSc, a favo de mel pode ser observada em mais de 70% do tecido fibroso-pulmonar ➤ o exuberante sinal de favo de mel56,57. Além disso, o sinal de quatro cantos (também conhecido como sinal anterior do lobo superior) é significativamente mais comum em SSc-ILD do que no IPF; trata-se de um padrão de inflamação e/ou fibrose focal ou desproporcional envolvendo os lobos superiores anterolaterais bilaterais e os lóbulos inferiores58.
As radiografias torácicas podem detectar inicialmente ILD; no entanto, eles não oferecem resolução de contraste suficiente para um diagnóstico confiável. Nas radiografias torácicas de pacientes com SSc-ILD, o padrão mais frequente é a reticulação predominante basal59. Outras características podem incluir bronquiectasis visível, perda de volume e favo de mel. Tal como acontece com o HRCT, a presença de um esôfago dilatado cheio de ar pode ser útil para apoiar o diagnóstico de SSc-ILD47.
Prognóstico
Vários achados de imagem diferentes têm se mostrado associados ao prognóstico em SSc-ILD. O risco de mortalidade tem sido relatado como maior em pacientes com uma extensão da doença de pelo menos 20% no HRCT (a sobrevida de 10 anos foi de 43% versus 67%, respectivamente, em pacientes com extensão da doença acima do limite de 20%)60. Da mesma forma, um alto escore de fibrose no HRCT (com base na extensão da reticulação e favo de mel) tem sido associado ao aumento da mortalidade61. Grandes diâmetros esofágicos estão associados ao aumento da gravidade do ILD e diminuição da DLCO48. A densidade pulmonar e o diâmetro da artéria pulmonar podem potencialmente ser usados para prever o risco de hipertensão pulmonar62. Os parâmetros de tomografia computadorizada e quantitativa também podem ser aproveitados para identificar o risco de declínio da função pulmonar ou mortalidade dos pacientes. Um estudo sugeriu que a extensão do ILD, quantificada a partir do HRCT, poderia ser usada para prever o declínio da FVC ao longo de 12meses 63. Em outro estudo, os parâmetros quantitativos da tomografia computadorizada proporcionaram resultados de risco de mortalidade consistentes com os modelos de predição clínica64. Apesar de seu potencial aparente, biomarcadores baseados em imagens são atualmente mais bem considerados a nível populacional, pois sua utilidade clínica em pacientes individuais não foi estabelecida.
Resposta ao tratamento
Ciclofosfamida e mofetil de micofenolato proporcionam benefício modesto em pacientes com SSc-ILD. No marco do Estudo pulmonar Scleroderma I, o tratamento de ciclofosfamatoma levou a uma progressão mais lenta da fibrose em comparação com o placebo65. Mais recentemente, o Estudo pulmonar Scleroderma II relatou eficácia semelhante e melhorabilidade com mofetil de micofenolato em comparação com o ciclofosfamatado66. No entanto, ainda há necessidade de melhores opções de tratamento para pacientes com SSc-ILD. As terapias atualmente investigadas incluem anticorpos monoclonais (por exemplo, rituximabe, abituzumabe), agentes antifibrotic (por exemplo, nintedanib, pirfenidone), o inibidor de trombina direta dabigatran, o inibidor proteasome bortezomib, e transplante hematopoiético de células-tronco19,67.
Exames de HRCT em série mostrando progressão da doença em paciente com SSc-ILD
Avaliações de HRCT realizadas em diferentes momentos podem ser utilizadas para investigar a progressão da doença. A Figura 7 mostra dois conjuntos de imagens hrct axial e coronal tiradas com 10 anos de diferença em um paciente com SSc-ILD. As imagens axiais e coronais iniciais (Figura 7A,B) do HRCT torácico mostram opacidade predominante de vidro moído basilar e reticulação com bronquiectase de tração leve e poupança subpleural consistente com NSIP neste paciente com SSc. Este último conjunto de imagens (Figura 7C, D) tiradas 10 anos depois, mostram aumento da reticulação e bronquiolectase de tração nas bases pulmonares com diminuição da opacidade de vidro moído nas imagens axiais e coronais(Figura 7C,D)de tomografia torácica consistente com leve piora da fibrose pulmonar. As varreduras de HRCT seriais também podem ser usadas para monitorar a resposta ao tratamento68,,69,70; isso foi demonstrado no Estudo pulmonar Scleroderma II, no qual foram utilizados escores de diagnóstico auxiliados por computador com base em tomografias computadorizadas para comparar a eficácia do ciclofosfamatto com o mofetil de micofenolato em pacientes com SSc-ILD68.
| Fase | Detector Colimação | Tensão (kV) | Corrente (mAs) | Varredura Intervalo | Campo | Rotação | Corrente do tubo Modulação |
| Supine inspiratório | Helicoidal 1,2 mm | 120 (pode ser rebaixado) | 230 (pode ser rebaixado) | N/A | ~1.0 | 0,5 segundos ou mais rápido | Em |
| Expiratório supino | Axial 2 x 1,0 mm | 120 | 150 | 20 mm | N/A | 1,0 segundos | Em |
| Inspiratório propenso | Axial 2 x 1,0 mm | 120 | 150 | 20 mm | N/A | 1,0 segundos | Em |
Tabela 1: Parâmetros de aquisição de tomografia computadorizada37. N/A = não aplicável.
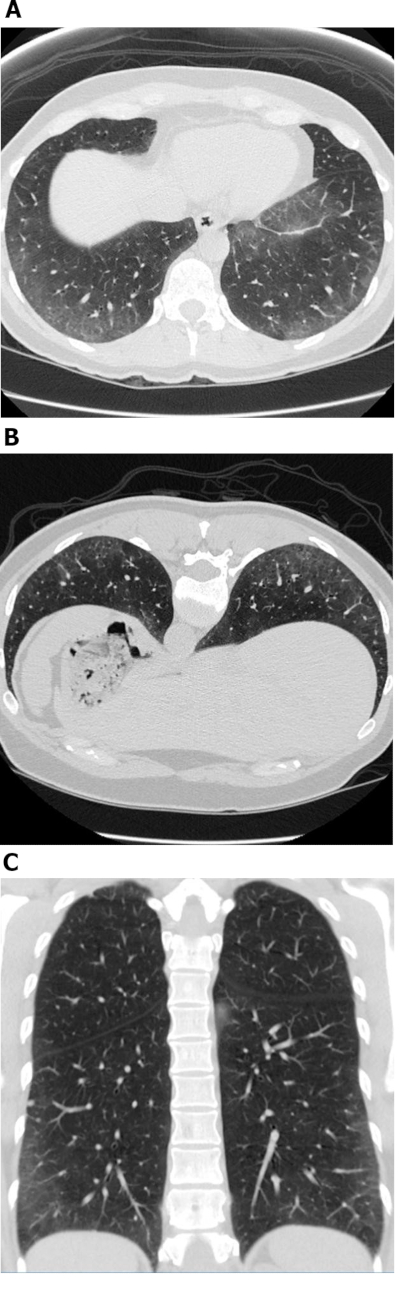
Figura 1: Esclerose sistêmica com padrão de doença NSIP celular. Imagens de tomografia computadorizada de alta resolução axial (A),propensas(B) e coronal(C)apresentam extensas opículturas periféricas e basais predominantes de vidro moído; estas são observações típicas com NSIP. A falta de bronquiectase de tração é sugestiva de um padrão de doença NSIP celular. NSIP = pneumonia intersticiacional não específica. Clique aqui para ver uma versão maior desta figura.
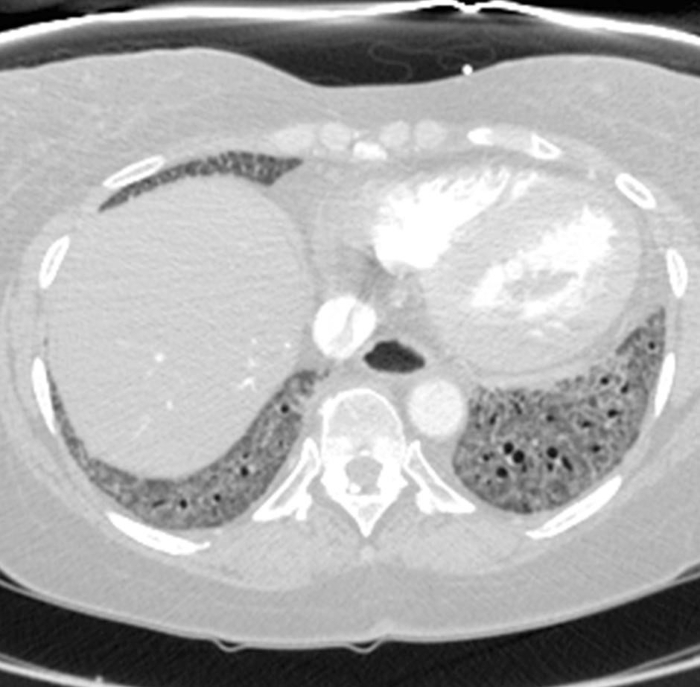
Figura 2: Esclerose sistêmica com padrão de pneumonia intersticial não específica fibrosa da doença. A imagem da tomografia computadorizada axial mostra extensas opacagens de vidro moído basal predominantes com bronquiectasis de tração associada. Notavelmente, o esôfago mostra dilatação marcada; isso é típico da esclerodermia. Clique aqui para ver uma versão maior desta figura.
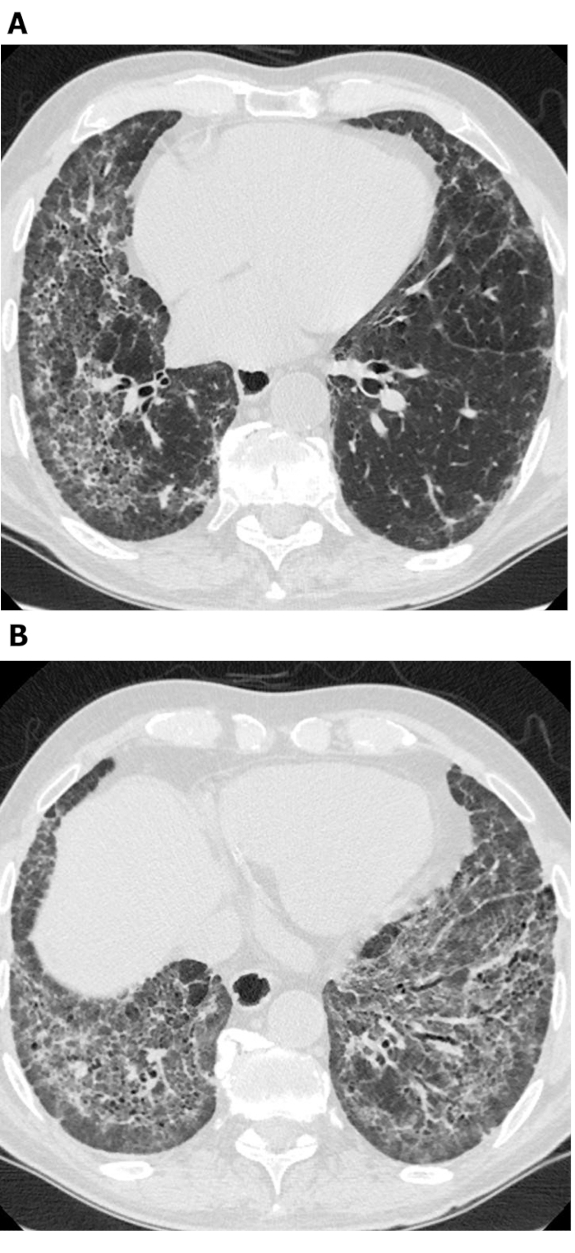
Figura 3: Esclerose sistêmica com padrão NSIP fibroso. Imagens de tomografia computadorizada de alta resolução axial(A e B) mostram extensas opacidades de vidro moído, reticulação, distorção arquitetônica e bronquiectasis de tração. Notavelmente, a poupança subpleural é aparente; isso é típico do NSIP e é visto em cerca de 50% de todos os casos. NSIP = pneumonia intersticiacional não específica. Clique aqui para ver uma versão maior desta figura.
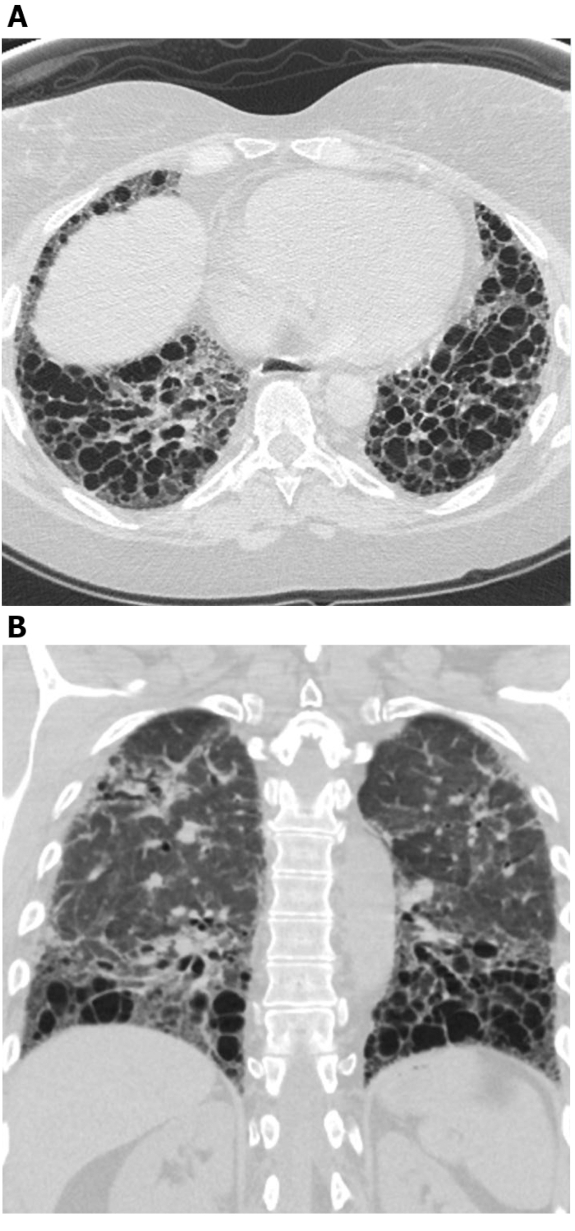
Figura 4: Esclerose sistêmica com bronquiectase de tração exuberante. Imagens de tomografia computadorizada de alta resolução axial (Axial( A ) e coronal(B)mostram extensas bronquiectasis de tração média e inferior da zona pulmonar média e inferior. Embora isso possa ser confundido com favo de mel, as áreas císticas se conectam entre si e poupam o pulmão subpleural imediato; isso é típico da bronquiectase. Clique aqui para ver uma versão maior desta figura.
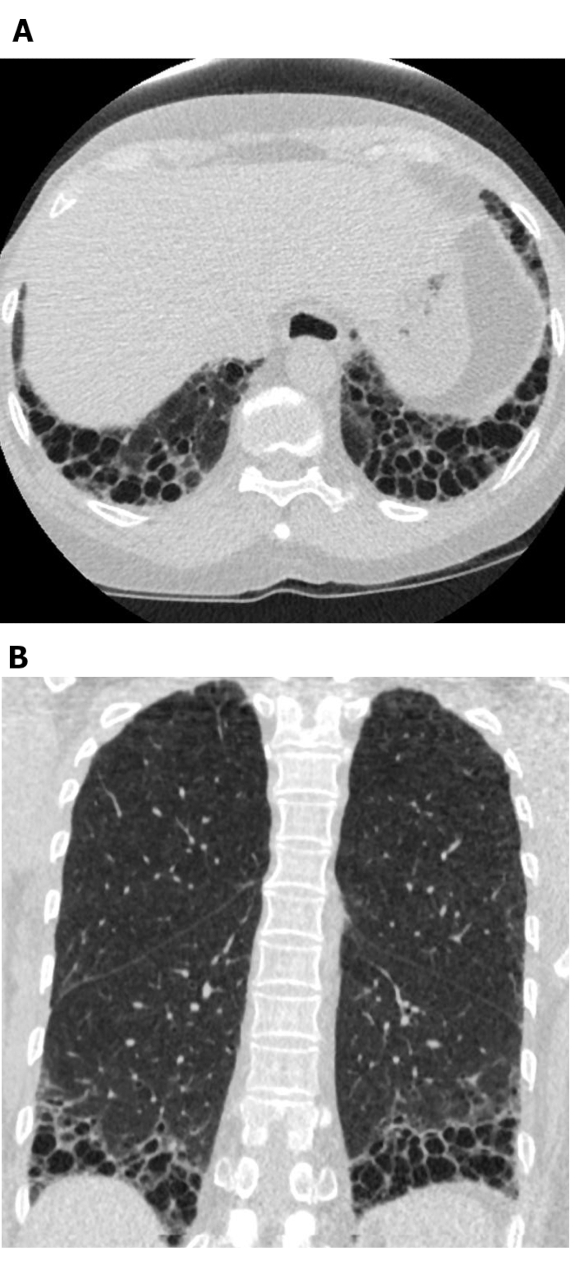
Figura 5: Esclerose sistêmica com padrão UIP de fibrose pulmonar. Imagens de tomografia computadorizada axial (A) e coronal(B)mostram a faxina e a bronquiectase predominantes periféricas e basais, de acordo com o padrão típico de UIP de fibrose pulmonar. Note o esôfago dilatado (atribuível à esclerodermia) e o favo de mel 'exuberante' (sugestivo de ILD relacionado à doença do tecido conjuntivo em vez de fibrose pulmonar idiopática). UIP = pneumonia intersticiacional usual. Clique aqui para ver uma versão maior desta figura.
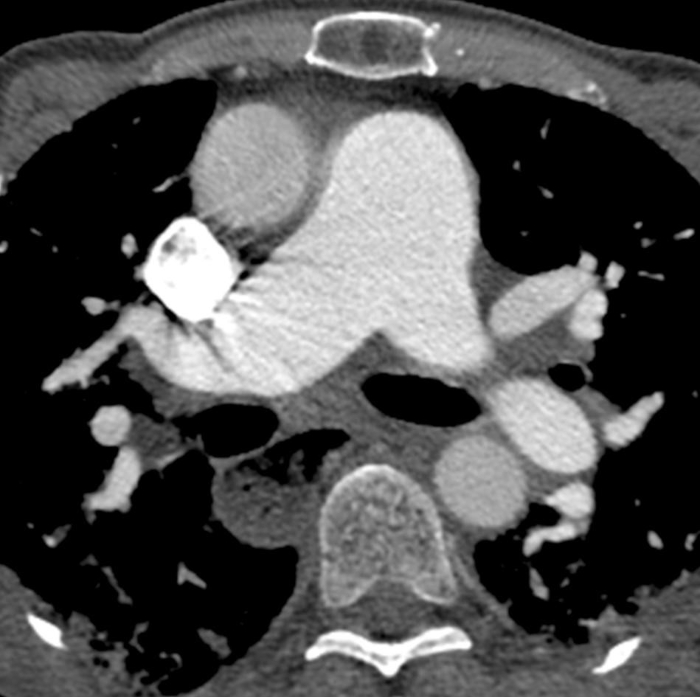
Figura 6: Esclerose sistêmica com hipertensão pulmonar e esôfago dilatado. A tomografia computadorizada com contraste mostra um aumento acentuado do tronco pulmonar, com uma medida maior do que a aorta ascendente adjacente que sugere hipertensão pulmonar subjacente. O esôfago está marcadamente dilatado; isso é atribuível à esclerodermia. Clique aqui para ver uma versão maior desta figura.
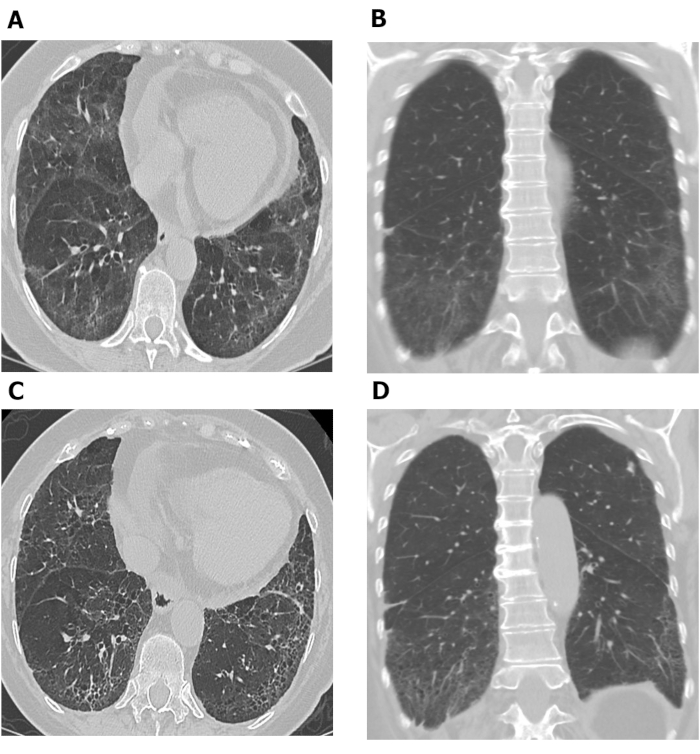
Figura 7: Imagens de HRCT torácicas em série mostrando progressão da fibrose pulmonar em paciente com SSc-ILD. Imagens axiais (A) e coronal(B)do TAC do peito mostram a opacidade e a reticulação predominantes de vidro moído basilar com bronquiectase de tração leve e poupança subpleural consistente com pneumonia intersticial não específica neste paciente com SSc. Após 10 anos, observa-se o aumento da reticulação e da bronquiolectase de tração nas bases pulmonares com diminuição da opacidade de vidro moído nas imagens de HRCT axial (C) e coronal(D),consistentes com leve piora da fibrose pulmonar. HRCT = tomografia computadorizada de alta resolução; SSc-ILD = doença pulmonar intersticiada associada à esclerodermia sistêmica. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora o HRCT seja atualmente o método definitivo de imagem para diagnosticar e avaliar o SSc-ILD, ele usa radiação ionizante e é relativamente caro. As radiografias torácicas podem ser realizadas em vez disso, embora estas não facilitem o diagnóstico diferencial na mesma medida que o HRCT, e uma radiografia torácica normal não elimina a possibilidade de ILD. Talvez o melhor uso de radiografias torácicas seja o monitoramento de doenças progressivas entre os exames de HRCT e para a exclusão de doenças complicadas, como pneumonia infecciosa, no cenário de piora aguda dos sintomas.
Uma limitação percebida do HRCT é a exposição à radiação. Como descrito anteriormente, novos métodos de realização de tomografias computadorizadas podem permitir que a exposição à radiação seja reduzida31, e, além disso, os scanners de tomografia atuais fornecem uma série de técnicas avançadas que oferecem a possibilidade no futuro de reduzir a exposição à radiação a níveis quase de radiografias torácicas. Alternativamente, métodos de imagem como ressonância magnética ou ultrassom pulmonar poderiam potencialmente ser usados para evitar expor o paciente à radiação no futuro32,71,72,73. Acreditamos que, embora existam considerações de risco-benefício associadas à utilização de imagens, as vantagens da TC no diagnóstico e na gestão do paciente superam em muito os riscos potenciais.
Os dados de imagem, particularmente o HRCT, fornecem, sem dúvida, as informações mais importantes para permitir o diagnóstico de SSc-ILD. A consideração detalhada dos padrões e características dos exames de HRCT é geralmente suficiente para distinguir o SSc-ILD de outras doenças pulmonares, com o benefício de evitar a necessidade de um procedimento de biópsia invasiva.
A avaliação visual das varreduras de HRCT introduz um grau de subjetividade e a possibilidade de variabilidade entre observadores. Métodos baseados em computador de interpretação da varredura HRCT têm sido investigados como uma possível abordagem para melhorar a precisão63,74. Por exemplo, abordagens quantitativas para a avaliação da fibrose pulmonar ou a extensão da doença podem ser utilizadas para avaliar a resposta ao tratamento68,70,75. No entanto, esses métodos não são amplamente utilizados na prática clínica diária neste momento.
Esperamos que as informações apresentadas neste manuscrito sirvam como um guia prático para auxiliar os médicos no uso de tomografias computadorizadas para diagnóstico de SSc-ILD e prognóstico determinante. Métodos aprimorados para a obtenção de imagens e para a interpretação de varreduras têm o potencial de reduzir a exposição dos pacientes à radiação e melhorar a precisão diagnóstica/prognóstico.
Divulgações
Jonathan Chung declara não haver potenciais conflitos de interesse em relação à pesquisa, autoria e/ou publicação deste artigo descritos; Christopher Walker declara o recebimento de royalties de Amirsys (Elsevier); e Stephen Hobbs declara o recebimento de royalties da Elsevier e Wolters Kluwer Health. A publicação do Open Access deste artigo é patrocinada pela Boehringer Ingelheim Pharmaceuticals, Inc.
O autor(s) atende aos critérios de autoria recomendados pelo Comitê Internacional de Editores de Revistas Médicas (ICMJE). Os autores não receberam nenhuma compensação direta relacionada ao desenvolvimento do vídeo. O suporte de escrita médica para o roteiro de vídeo foi fornecido por Leon Newman, PhD, da GeoMed, uma empresa de Ashfield, que foi contratada e financiada pela Boehringer Ingelheim Pharmaceuticals, Inc. (BIPI). O BIPI teve a oportunidade de revisar o vídeo final para precisão médica e científica, bem como considerações de propriedade intelectual.
Agradecimentos
Os autores atendem aos critérios de autoria recomendados pelo Comitê Internacional de Editores de Revistas Médicas (ICMJE). Os autores não receberam nenhuma compensação direta relacionada ao desenvolvimento do manuscrito. A assistência de redação foi fornecida por Ken Sutor, BSc, da GeoMed, uma empresa de Ashfield, parte da UDG Healthcare plc, que foi contratada e financiada pela Boehringer Ingelheim Pharmaceuticals, Inc. (BIPI). O BIPI teve a oportunidade de revisar o manuscrito para precisão médica e científica, bem como considerações de propriedade intelectual.
Materiais
| Name | Company | Catalog Number | Comments |
| CT scanners | Philips | NA | Multiple |
Referências
- Denton, C. P., Khanna, D. Systemic sclerosis. Lancet. 390 (10103), 1685-1699 (2017).
- Arnett, F. C., et al. Familial occurrence frequencies and relative risks for systemic sclerosis (scleroderma) in three United States cohorts. Arthritis & Rheumatism. 44 (6), 1359-1362 (2001).
- Barnes, J., Mayes, M. D. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Current Opinion in Rheumatology. 24 (2), 165-170 (2012).
- Marie, I., Gehanno, J. F. Environmental risk factors of systemic sclerosis. Seminars in Immunopathology. 37 (5), 463-473 (2015).
- Silman, A. J. Epidemiology of scleroderma. Annals of the Rheumatic Diseases. 50, 846-853 (1991).
- Scholand, M. B., et al. Interstitial lung disease in systemic sclerosis: diagnosis and management. Rheumatology. 1, 008 (2012).
- Solomon, J. J., et al. Scleroderma lung disease. European Respiratory Review. 22 (127), 6-19 (2013).
- Walker, U. A., et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials And Research group database. Annals of the Rheumatic Diseases. 66 (6), 754-763 (2007).
- Hinchcliff, M., Fischer, A., Schiopu, E., Steen, V. D., Investigators, P. Pulmonary hypertension assessment and recognition of outcomes in scleroderma (PHAROS): baseline characteristics and description of study population. The Journal of Rheumatology. 38 (10), 2172-2179 (2011).
- Giacomelli, R., et al. Interstitial lung disease in systemic sclerosis: current and future treatment. Rheumatology International. 37 (6), 853-863 (2017).
- Sanchez-Cano, D., et al. Interstitial lung disease in systemic sclerosis: data from the spanish scleroderma study group. Rheumatology International. 38 (3), 363-374 (2018).
- Silver, K. C., Silver, R. M. Management of systemic-sclerosis-associated interstitial lung disease. Rheumatic Diseases Clinics of North America. 41 (3), 439-457 (2015).
- Fischer, A., Kong, A. M., Swigris, J. J., Cole, A. L., Raimundo, K. All-cause healthcare costs and mortality in patients with systemic sclerosis with lung involvement. The Journal of Rheumatology. 45 (2), 235-241 (2018).
- Tyndall, A. J., et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Annals of the Rheumatic Diseases. 69 (10), 1809-1815 (2010).
- Herzog, E. L., et al. Review: interstitial lung disease associated with systemic sclerosis and idiopathic pulmonary fibrosis: how similar and distinct. Arthritis & Rheumatology. 66 (8), 1967-1978 (2014).
- Rubio-Rivas, M., Royo, C., Simeon, C. P., Corbella, X., Fonollosa, V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Seminars in Arthritis and Rheumatism. 44 (2), 208-219 (2014).
- Stock, C., et al. Serum KL-6 as a marker of disease progression in SSc-ILD. European Respiratory Journal. 52, (2018).
- Winstone, T. A., et al. Predictors of mortality and progression in scleroderma-associated interstitial lung disease: a systematic review. Chest. 146 (2), 422-436 (2014).
- Khanna, D., et al. Ongoing clinical trials and treatment options for patients with systemic sclerosis-associated interstitial lung disease. Rheumatology (Oxford). 58 (4), 567-579 (2019).
- Behr, J., Furst, D. E. Pulmonary function tests. Rheumatology (Oxford). 47, 65-67 (2008).
- Hax, V., et al. Clinical algorithms for the diagnosis and prognosis of interstitial lung disease in systemic sclerosis. Seminars in Arthritis and Rheumatism. 47 (2), 228-234 (2017).
- Molberg, O., Hoffmann-Vold, A. M. Interstitial lung disease in systemic sclerosis: progress in screening and early diagnosis. Current Opinion in Rheumatology. 28 (6), 613-618 (2016).
- Raghu, G., Goldman, L., Schafer, A. I. Interstital lung disease. Goldman-Cecil Medicine. , 575-588 (2016).
- Showalter, K., et al. Performance of forced vital capacity and lung diffusion cutpoints for associated radiographic interstitial lung disease in systemic sclerosis. The Journal of Rheumatology. 45 (11), 1572-1576 (2018).
- Suliman, Y. A., et al. Brief report: pulmonary function tests: high rate of false-negative results in the early detection and screening of scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 67 (12), 3256-3261 (2015).
- Roth, M. D., et al. Predicting treatment outcomes and responder subsets in scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 63 (9), 2797-2808 (2011).
- Kalra, M. K., Maher, M. M., Rizzo, S., Kanarek, D., Shepard, J. A. Radiation exposure from chest CT: issues and strategies. Journal of Korean Medical Science. 19 (2), 159-166 (2004).
- Siegel, J. A., Pennington, C. W., Sacks, B., Welsh, J. S. The birth of the illegitimate linear no-threshold model: an invalid paradigm for estimating risk following low-dose radiation exposure. American Journal of Clinical Oncology. 41 (2), 173-177 (2018).
- Frauenfelder, T., et al. Screening for interstitial lung disease in systemic sclerosis: performance of high-resolution CT with limited number of slices: a prospective study. Annals of the Rheumatic Diseases. 73 (12), 2069-2073 (2014).
- Kubo, T., et al. Radiation dose reduction in chest CT: a review. American Journal of Roentgenology. 190 (2), 335-343 (2008).
- Nguyen-Kim, T. D. L., et al. The impact of slice-reduced computed tomography on histogram-based densitometry assessment of lung fibrosis in patients with systemic sclerosis. Journal of Thoracic Disease. 10 (4), 2142-2152 (2018).
- Muller, C. S., Warszawiak, D., Paiva, E. D. S., Escuissato, D. L. Pulmonary magnetic resonance imaging is similar to chest tomography in detecting inflammation in patients with systemic sclerosis. Revista Brasileira de Reumatologia English Edition. 57 (5), 419-424 (2017).
- Pinal-Fernandez, I., et al. Fast 1.5 T chest MRI for the assessment of interstitial lung disease extent secondary to systemic sclerosis. Clinical Rheumatology. 35 (9), 2339-2345 (2016).
- Sverzellati, N. Highlights of HRCT imaging in IPF. Respiratory Research. 14, 3 (2013).
- Lynch, D. A., et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. The Lancet Respiratory Medicine. 6 (2), 138-153 (2018).
- Raghu, G., et al. Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 198 (5), 44-68 (2018).
- . Exam: CT thorax for interstitial lung disease Available from: https://www.pulmonaryfibrosis.org/docs/default-source/medical-community-documents/ct-chest-for-ild-protocol.pdf?sfvrsn=0 (2019)
- Doyle, T. J., Hunninghake, G. M., Rosas, I. O. Subclinical interstitial lung disease: why you should care. American Journal of Respiratory and Critical Care Medicine. 185 (11), 1147-1153 (2012).
- Peroni, D. G., Boner, A. L. Atelectasis: mechanisms, diagnosis and management. Paediatric Respiratory Reviews. 1 (3), 274-278 (2000).
- Branley, H. M. Pulmonary fibrosis in systemic sclerosis: diagnosis and management. Respiratory Medicine CME. 3, 10-14 (2010).
- Engeler, C. E., Tashjian, J. H., Trenkner, S. W., Walsh, J. W. Ground-glass opacity of the lung parenchyma: a guide to analysis with high-resolution CT. American Journal of Roentgenology. 160 (2), 249-251 (1993).
- Goldin, J. G., et al. High-resolution CT scan findings in patients with symptomatic scleroderma-related interstitial lung disease. Chest. 134 (2), 358-367 (2008).
- Strollo, D., Goldin, J. Imaging lung disease in systemic sclerosis. Current Rheumatology Reports. 12 (2), 156-161 (2010).
- Pandey, A. K., et al. Significance of various pulmonary and extrapulmonary abnormalities on HRCT of the chest in scleroderma lung. Indian Journal of Radiology and Imaging. 23 (4), 304-307 (2013).
- Chung, J. H., et al. CT Features of the usual interstitial pneumonia pattern: differentiating connective tissue disease-associated interstitial lung disease from idiopathic pulmonary fibrosis. American Journal of Roentgenology. 210 (2), 307-313 (2018).
- Zhan, X., et al. Differentiating usual interstitial pneumonia from nonspecific interstitial pneumonia using high-resolution computed tomography: the "Straight-edge Sign". Journal of Thoracic Imaging. 33 (4), 266-270 (2018).
- Farrokh, D., Abbasi, B., Fallah-Rastegar, Y., Mirfeizi, Z. The extrapulmonary manifestations of systemic sclerosis on chest high resolution computed tomography. Tanaffos. 14 (3), 193-200 (2015).
- Salaffi, F., et al. Relationship between interstitial lung disease and oesophageal dilatation on chest high-resolution computed tomography in patients with systemic sclerosis: a cross-sectional study. La Radiologia Medica. 123 (9), 655-663 (2018).
- Vonk, M. C., et al. Oesophageal dilatation on high-resolution computed tomography scan of the lungs as a sign of scleroderma. Annals of the Rheumatic Diseases. 67 (9), 1317-1321 (2008).
- Chowaniec, M., Skoczynska, M., Sokolik, R., Wiland, P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 56 (4), 249-254 (2018).
- McCall, R. K., Ravenel, J. G., Nietert, P. J., Granath, A., Silver, R. M. Relationship of main pulmonary artery diameter to pulmonary arterial pressure in scleroderma patients with and without interstitial fibrosis. Journal of Computer Assisted Tomography. 38 (2), 163-168 (2014).
- Pandey, A. K., et al. Predictors of pulmonary hypertension on high-resolution computed tomography of the chest in systemic sclerosis: a retrospective analysis. Canadian Association of Radiologists Journal. 61 (5), 291-296 (2010).
- Raymond, T. E., Khabbaza, J. E., Yadav, R., Tonelli, A. R. Significance of main pulmonary artery dilation on imaging studies. Annals of the American Thoracic Society. 11 (10), 1623-1632 (2014).
- Colaci, M., et al. Lung cancer in scleroderma: results from an Italian rheumatologic center and review of the literature. Autoimmunity Reviews. 12 (3), 374-379 (2013).
- Distler, O., et al. Design of a randomised, placebo-controlled clinical trial of nintedanib in patients with systemic sclerosis-associated interstitial lung disease (SENSCIS). Clinical and Experimental Rheumatology. 35 (4), 75-81 (2017).
- Desai, S. R., et al. CT features of lung disease in patients with systemic sclerosis: comparison with idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia. Radiology. 232 (2), 560-567 (2004).
- Mira-Avendano, I., et al. Interstitial lung disease and other pulmonary manifestations in connective tissue diseases. Mayo Clinic Proceedings. 94 (2), 309-325 (2019).
- Walkoff, L., White, D. B., Chung, J. H., Asante, D., Cox, C. W. The four corners sign: a specific imaging feature in differentiating systemic sclerosis-related interstitial lung disease from idiopathic pulmonary fibrosis. Journal of Thoracic Imaging. 33 (3), 197-203 (2018).
- Kotnur, M. R., Suresh, P., Reddy, V. S., Sharma, T., Salim, N. A. Systemic sclerosis with multiple pulmonary manifestations. Journal of Clinical & Diagnostic Research. 10 (6), 16-17 (2016).
- Goh, N. S., et al. Interstitial lung disease in systemic sclerosis: a simple staging system. American Journal of Respiratory and Critical Care Medicine. 177 (11), 1248-1254 (2008).
- Takei, R., et al. Radiographic fibrosis score predicts survival in systemic sclerosis-associated interstitial lung disease. Respirology. 23 (4), 385-391 (2018).
- Bakker, M. E., et al. Lung density and pulmonary artery diameter are predictors of pulmonary hypertension in systemic sclerosis. Journal of Thoracic Imaging. 32 (6), 391-397 (2017).
- Khanna, D., et al. Predictors of lung function decline in scleroderma-related interstitial lung disease based on high-resolution computed tomography: implications for cohort enrichment in systemic sclerosis-associated interstitial lung disease trials. Arthritis Research & Therapy. 17, 372 (2015).
- Ariani, A., et al. Quantitative chest computed tomography is associated with two prediction models of mortality in interstitial lung disease related to systemic sclerosis. Rheumatology (Oxford). 56 (6), 922-927 (2017).
- Goldin, J., et al. Treatment of scleroderma-interstitial lung disease with cyclophosphamide is associated with less progressive fibrosis on serial thoracic high-resolution CT scan than placebo: findings from the scleroderma lung study. Chest. 136 (5), 1333-1340 (2009).
- Tashkin, D. P., et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. The Lancet Respiratory Medicine. 4 (9), 708-719 (2016).
- Distler, O., et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. New England Journal of Medicine. 380, 2518-2528 (2019).
- Cappelli, S., et al. Interstitial lung disease in systemic sclerosis: where do we stand. European Respiratory Review. 24 (137), 411-419 (2015).
- Goldin, J. G., et al. Longitudinal changes in quantitative interstitial lung disease on CT after immunosuppression in the Scleroderma Lung Study II. Annals of the American Thoracic Society. 5 (11), 1286-1295 (2018).
- Wangkaew, S., Euathrongchit, J., Wattanawittawas, P., Kasitanon, N. Correlation of delta high-resolution computed tomography (HRCT) score with delta clinical variables in early systemic sclerosis (SSc) patients. Quantitative Imaging in Medicine and Surgery. 6 (4), 381-390 (2016).
- Kim, H. J., et al. Transitions to different patterns of interstitial lung disease in scleroderma with and without treatment. Annals of the Rheumatic Diseases. 75 (7), 1367-1371 (2016).
- Tardella, M., et al. Ultrasound B-lines in the evaluation of interstitial lung disease in patients with systemic sclerosis: cut-off point definition for the presence of significant pulmonary fibrosis. Medicine (Baltimore). 97 (18), 0566 (2018).
- Hassan, R. I., et al. Lung ultrasound as a screening method for interstitial lung disease in patients with systemic sclerosis. Journal of Clinical Rheumatology. , (2018).
- Wang, Y., Gargani, L., Barskova, T., Furst, D. E., Cerinic, M. M. Usefulness of lung ultrasound B-lines in connective tissue disease-associated interstitial lung disease: a literature review. Arthritis Research & Therapy. 19 (1), 206 (2017).
- Ariani, A., et al. Quantitative CT indexes are significantly associated with exercise oxygen desaturation in interstitial lung disease related to systemic sclerosis. The Clinical Respiratory Journal. 11 (6), 983-989 (2017).
- Kim, H. J., et al. Quantitative texture-based assessment of one-year changes in fibrotic reticular patterns on HRCT in scleroderma lung disease treated with oral cyclophosphamide. European Radiology. 21 (12), 2455-2465 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados