Method Article
Ligação covalente de moléculas únicas para espectroscopia de força baseada em AFM
Neste Artigo
Resumo
A fixação covalente de moléculas de sondas às pontas de cantilever da microscopia de força atômica (AFM) é uma técnica essencial para a investigação de suas propriedades físicas. Isso nos permite determinar a força de alongamento, a força de dessorção e o comprimento dos polímeros através da espectroscopia de força de molécula única baseada em AFM com alta reprodutibilidade.
Resumo
A espectroscopia de força única baseada em microscopia de força atômica (AFM) é uma ferramenta ideal para investigar as interações entre um único polímero e superfícies. Para um verdadeiro experimento de molécula única, o apego covalente da molécula da sonda é essencial porque só assim centenas de traços de extensão de força com uma única molécula podem ser obtidas. Muitos traços são necessários para provar que uma única molécula sozinha é sondada. Além disso, a passivação é crucial para evitar interações indesejadas entre a molécula de sonda única e a ponta cantilever AFM, bem como entre a ponta cantilever AFM e a superfície subjacente. O protocolo de funcionalidade aqui apresentado é confiável e pode ser facilmente aplicado a uma variedade de polímeros. Eventos característicos de moléculas simples (isto é, alongamentos e platôs) são detectados nos traços de extensão de força. A partir desses eventos, parâmetros físicos como força de alongamento, força de dessorção e comprimento de dessorção podem ser obtidos. Isso é particularmente importante para a investigação precisa de sistemas de resposta a estímulos no nível de molécula única. Como sistemas exemplares, os sistemas poli(etileno glicol) (PEG),poli(N-isopropylacrylamide) (PNiPAM) e poliestireno (PS) são esticados e desorados do SiOx (para PEG e PNiPAM) e de superfícies monocamadaauto-montadas hidrofóbicas (para PS) em ambiente aquoso.
Introdução
Desde sua invenção na década de 19801,o microscópio de força atômica (AFM) tornou-se uma das mais importantes técnicas de imagem em ciência natural com resolução espacial sub-nanômetro, resolução da força sub-piconewton e a possibilidade de medição em várias condições de solvente e temperatura2,3,4,5,6,7.
Além da imagem8,9, AFM é usado para realizar espectroscopia de força de molécula única (SMFS) dando uma visão das interações adesivos entre um único polímero e superfícies, propriedades físicas de polímeros únicos e mecanismos de desdobramento de proteínas7,10,11,12,,13,14,15,16. Em um experimento regular de SMFS, a ponta cantilever funcional é trazida em contato com uma superfície para que o polímero na ponta cantilever afsísia aesta superfície. Ao retirar a ponta cantilever da superfície, uma mudança na deflexão do cantilever AFM é convertida em uma força que leva a uma curva de extensão de força4. Parâmetros físicos como força de alongamento, força de dessorção e comprimento de dessorção podem ser determinados como dependentes de diferentes parâmetros, como puxar velocidade, tempo de habitação na superfície, profundidade de recuo na superfície, temperatura, solvente17,,18 e diferentes superfícies como substratos sólidos, filmes de polímeros ou bicamadas lipídicas suportadas19,20,21,22. Além disso, um polímero pode ser sondado em diferentes direções espaciais, investigando assim as propriedades de atrito do polímero23,24,25,26.
A fixação covalente do polímero investigado a uma ponta cantilever da AFM é essencial para tais estudos. Assim, um alto rendimento de eventos de molécula única com um e o mesmo polímero ligado a uma ponta cantilever AFM evita qualquer viés dos resultados devido à calibração da constante de mola do Cantilever AFM27,28, diferentes pontos de fixação29 ou polímeros variados (com diferentes comprimentos de contorno) como no caso de experimentos de nanopesca30,31,32. Além disso, as interações com outros polímeros, bem como efeitos de média, podem ser amplamente evitadas18,28. Para a fixação covalente de um polímero à ponta cantilever AFM, diferentes tipos de modificações químicas podem ser aplicadas, muitas das quais são resumidas no livro por Hermanson33. As reações de ligação baseadas em amina e tiol, bem como a química de cliques representam os métodos mais utilizados na funcionalidade da ponta cantilever AFM34,,35,,36,,37,,38,,39,,40,,41,,42. Becke et al.40 mostram como usar 1-etil-3-(3-dimetilaminopropyl)carbodiimid (EDC)/NHS química para anexar uma proteína a uma ponta cantilever AFM. No entanto, os referidos grupos funcionais tendem a se cruzar, levando a uma perda de funcionalidade43,44. Além disso, os carbodiimides mostram uma tendência à hidrólise rápida na solução43. Os grupos maleimida e tiol são geralmente mais estáveis e não apresentam reações de crosslinking. O protocolo apresentado é uma otimização dos protocolos previamente publicados nos termos das referências35,39.
Aqui, é apresentado um protocolo de funcionalidade confiável que pode ser facilmente ajustado a um grande número de polímeros diferentes, independentemente de propriedades como comprimento de contorno ou hidrofobicidade. Três polímeros diferentes foram escolhidos por exemplo: polietileno glicol hidrofílico (PEG) epoli(N-isopropylacrylamide) (PNiPAM), bem como poliestireno hidrofóbico de massa de alta mola (PS). A fim de fornecer uma capacidade de ligação covalente com uma molécula de ligação apropriada, os três polímeros foram selecionados por apresentarum telechelic thiol moiety como grupo final funcional. A molécula de linker em si é tipicamente um polímero PEG curto com dois locais ativos, um grupo de silano em uma extremidade e um grupo de maleimida na outra extremidade. O primeiro permite um apego covalente à ponta cantilever AFM e o segundo uma reação vinculante com o grupo tiol do polímero de massa de alta molar funcional. Além disso, as moléculas de linker PEG inativas servem como uma camada de passivação para evitar interações indesejadas entre o polímero da sonda e a ponta cantilever AFM, bem como entre a ponta cantilever AFM e a superfície subjacente.
Protocolo
NOTA: Consulte a Figura 1 para obter uma visão geral esquemmática.
1. Configuração do reagente
NOTA: Os polímeros utilizados para este protocolo são: maleimide-polietileno glicol-trietoxisiano (sillane-PEG-mal, 5 kDa), tiol-polietileno glicol-thiol (HS-PEG-SH, 35 kDa), tiol terminou poli(N-isopropylacrylamide) (PNiPAM-SH, 637 kDa) e tiol terminado poliestireno (PS-SH, 1,3 mDa).
- Preparar a massa molares bem definida e alta PNiPAM-SH via polimerização radical de transferência de átomos, seguida de conversão e redução do grupo final funcional para a introdução de um moiety de tiol, conforme descrito na literatura18. Consulte a Figura 1 para as estruturas detalhadas.
- Para armazenar os produtos químicos, prepare alíquotas menores dentro de um sistema de luvas seca com atmosfera de nitrogênio para evitar exposição ao oxigênio atmosférico e à umidade. Peg e PNiPAM são higroscópicos45,,46 e os grupos finais funcionais de PEG, PNiPAM e PS são conhecidos por se tornarem facilmente oxidados quando armazenados em condições ambientais33,,47,,48. Todos os produtos químicos devem ser armazenados a -20 °C.
- Use solventes de grau analítico ou superiores. Além disso, use água ultrapura para enxaguar chips e vidros cantilevers da AFM porque os experimentos de moléculaúnica são muito sensíveis a toda contaminação.
2. Configuração do equipamento
NOTA: Use pinças e béquers feitos de aço inoxidável ou vidro. Use pinças invertidas para uma aderência segura (por exemplo, o modelo R3 SA tem uma constante de mola baixa).
- Prepare a solução RCA (água ultrapura, peróxido de hidrogênio e amônia (5:1:1)) para limpar vidros e pinças.
- Coloque os vasos em um béquer e encha-o com RCA até que os vidros ou pinças estejam totalmente cobertos.
- Aqueça o béquer do passo 2.2 por 1h a 80 °C.
- Enxágüe os vasos posteriormente com água ultrapura até que nenhum cheiro pungente seja mais apurado (pelo menos três vezes).
- Seque vidros e pinças em um forno (120 °C).
3. Funcionalidade da ponta
NOTA: Todas as etapas devem ser realizadas em uma coifa de fumaça para evitar a inalação de vapores orgânicos. Além disso, luvas, jaleco e proteção ocular são necessários. Use luvas de nitríheiro ou látex para evitar contaminação. Use luvas resistentes a solventes quando usar tolueno. Todas as etapas, a menos que especificadas em contrário, são feitas na RT. Use equipamentos e luvas frescos para cada passo para evitar uma possível contaminação cruzada.
- Realize a ativação da superfície aplicando plasma de oxigênio ao chip AFM cantilever MLCT-Bio-DC.
NOTA: A eficiência do tratamento plasmático para outras etapas de funcionalização escala com o teor de oxigênio na câmara plasmática.- Use pinças recém-limpas para colocar chips AFM cantilever em uma câmara de plasma (40 kHz, 600 W).
- Use o programa de ativação modificado medida: evacuação (0,1 mbar) – inundação com oxigênio a uma pressão de: 0,2 mbar (4 min) – processo plasmático (potência: 40%, duração: 2 min, pressão do processo: 0,2 mbar).
- Ventilar a câmara e continue com o passo 3.2.2 imediatamente, a fim de evitar qualquer adsorção de contaminantes aos chips Cantilever AFM do ar.
- Silanização e PEGylation
NOTA: O tempo é um parâmetro crítico entre as etapas. Prepare soluções o mais frescas possível durante os tempos de espera. Os grupos de maleimida estão sujeitos à hidrólise em meios aquosos e os tiols facilmente se tornam oxidados a dissulfetos na solução33,47 impedindo reações de funcionalização da ponta AFM.- Prepare uma solução silano-PEG-mal em tolueno (1,25 mg/mL) em tubos de plástico ou vidro resistentes a solventes e despeje 6 mL da solução em placas de Petri planas, 3 mL cada.
NOTA: Se a ligação de vários polímeros de sonda for observada no experimento SMFS, a mistura de silano-PEG-mal com silano-PEG não funcional pode reduzir o número de pontos de ancoragem. Para o ajuste da camada de passivação PEG com diferentes massas (ou seja, comprimentos de contorno) pode ser utilizado27. - Incubar os chips AFM cantilever imediatamente após o passo 3.1.3 na solução silano-PEG-mal (até 10 chips por placa de Petri) por 3 h a 60 °C35.
- Tire os pratos de Petri do forno e deixe a solução esfriar por pelo menos 10 min.
- Enxágüe cada chip cantilever AFM cuidadosamente. Reduza o impacto das forças capilares no cantilever AFM ao passar pela interface ar-solvente, por exemplo, inclinando esses chips ligeiramente ao mergulhar na solução.
- Para polímeros PEG e PS, enxágue três vezes com tolueno.
- Para polímero PNiPAM, enxágue uma vez com tolueno e duas vezes com etanol.
- Escolha pelo menos dois chips AFM cantilever como controle de chips Cantilever da AFM, pulando o passo 3.3 e enxágue-os da seguinte forma para aumentar a polaridade do solvente:
- Para polímeros PEG e PS, enxágue duas vezes com etanol e uma vez com água ultrapura.
- Para polímero PNiPAM, enxágue duas vezes com água ultrapura.
NOTA: Controle Os chips Cantilever da AFM passaram por todas as etapas de funcionalidade, exceto o acessório de polímero (etapa 3.3). Eles servem para provar a limpeza do processo de funcionalidade, o sistema de suporte de chip AFM cantilever, as superfícies e os solventes usados para o experimento SMFS.
- Prepare uma solução silano-PEG-mal em tolueno (1,25 mg/mL) em tubos de plástico ou vidro resistentes a solventes e despeje 6 mL da solução em placas de Petri planas, 3 mL cada.
- Acessório de polímero covalente
NOTA: Embora se espere que a ponta cantilever aFM esteja completamente coberta com grupos de maleimida, existem apenas alguns locais de ligação para o polímero de sonda única, porque a maleimida sofre hidrólise na água levando a PEGs inativas47. Esses PEGs inativos atuam como uma camada de passivação, conforme descrito acima.- Incubar chips Cantilever AFM diretamente após a etapa 3.2.5 em uma das seguintes soluções de polímero em placas de Petri de 3 mL. Se o respectivo polímero não for dissolvido corretamente, use um banho de água de 40 °C e mexa bem a solução.
NOTA: Como o uso de polímeros terminais de tiol pode levar à formação de ligações de dissulfeto dificultando a reação com os grupos de maleimida de silano-PEG-mal, recomenda-se um agente redutor, em particular se a etapa 3.3 for aplicada em tampões aquosos para polímeros solúveis em água33.- Para polímeros PEG e PS, utilize uma concentração de 1,25 mg/mL em tolueno por 1 h a 60 °C.
- Para polímeros PNiPAM, utilize uma concentração de 1,25 mg/mL no etanol por 3 h em RT.
NOTA: Se a ligação de vários polímeros de sonda for observada no experimento SMFS, a concentração do polímero deve ser reduzida.
- Enxágüe cuidadosamente cada chip cantilever AFM.
- Para polímeros PEG e PS, enxágue duas vezes com tolueno, duas vezes com etanol e uma vez com água ultrapura após um resfriamento de 10 min.
- Para polímeros PNiPAM, enxágue duas vezes com etanol e duas vezes com água ultrapura.
- Armazene cada chip AFM cantilever separadamente em uma pequena placa de Petri (1 mL) cheia de água ultrapura a 4 °C até usar em um experimento.
- Incubar chips Cantilever AFM diretamente após a etapa 3.2.5 em uma das seguintes soluções de polímero em placas de Petri de 3 mL. Se o respectivo polímero não for dissolvido corretamente, use um banho de água de 40 °C e mexa bem a solução.
4. Preparação da superfície
- Wafer de óxido de silício
NOTA: Esta superfície foi utilizada para SMFS com PEG e PNiPAM.- Corte um wafer de óxido de silício em pequenos pedaços usando uma faca de diamante.
- Coloque as peças de óxido de silício separadamente em tubos de microcentrífuga e encha esses tubos com etanol.
- Sonice as peças de óxido de silício por 10 min.
- Enxágüe as peças de óxido de silício com etanol duas vezes e seque-as um fluxo de nitrogênio cuidadosamente. Use as peças de óxido de silício imediatamente.
- Monocamada auto-montada de alcancano hidrofóbico em ouro (SAM)
NOTA: Esta superfície foi utilizada para SMFS com PS. Consulte a literatura39,49 para obter mais informações sobre SAMs.- Use um wafer de silício revestido de ouro (A [100], 5 nm de titânio, 100 nm de ouro) para executar as etapas 4.1.1 – 4.1.4.
- Incubar as peças de superfície em uma solução de 1 dodecantiol (2 mM) por 18 horas.
- Enxágüe os SAMs recém-preparados em etanol duas vezes.
- SAMs secos com fluxo de nitrogênio para uso direto ou armazená-los em etanol por até 4 dias para uso posterior.
5. Aquisição de dados
NOTA: Todas as medições aqui apresentadas foram realizadas em água ultrapura com um Cypher ES AFM utilizando um estágio de amostra de aquecimento e resfriamento para variação de temperatura. Geralmente, todos os AFMs que fornecem a capacidade de medir em líquidos podem ser usados.
- Insira o chip afm cantilever funcionalno aftosa.
- Cole a superfície preparada em um suporte de amostra adequado para medir em líquidos (por exemplo, composto replicante de alta resolução 101RF ou um adesivo curável UV).
NOTA: Estes agentes de ligação são altamente inertes e resistentes a um grande número de solventes polares. A resistência do adesivo a solventes não polares (por exemplo, tolueno ou hexano) ou altas temperaturas deve ser verificada antes do uso. - Mergulhe o chip AFM cantilever e a amostra da sonda no líquido, aqui: água ultrapura.
NOTA: Uma gota de solvente (cerca de 100 μL) pode ser depositada no suporte do chip AFM cantilever. Cobrir o chip Cantilever AFM com solvente reduz as forças capilares, que de outra forma agiriam no cantilever AFM quando se aproximassem da superfície da amostra passando pela interface ar-solvente. - Se necessário, ajuste a temperatura e deixe o sistema equilibrar.
NOTA: As mudanças de temperatura podem resultar em uma deflexão do cantilever AFM devido a um efeito bimetálico para cantilevers AFM com um revestimento reflexivo como alumínio ou ouro. O equilíbrio deve ser realizado longe da superfície (vários μm) até que não seja observada qualquer alteração adicional do sinal de deflexão (até 15 min para MLCT-Bio-DC). - Varie a temperatura aleatoriamente para excluir quaisquer efeitos do envelhecimento da funcionalização. Certifique-se de que as temperaturas aplicadas não levem a uma dobra irreversível do cantilever AFM.
NOTA: Quaisquer efeitos de temperatura sobre propriedades solventes (como evaporação ou alterações na viscosidade) podem dificultar seus experimentos. Nos exemplos apresentados, a temperatura foi variada em uma faixa de até 40 K em etapas de 10 K tomando água como solvente (por exemplo, de 278 K a 318 K). - Aproxime-se da superfície para determinar o InvOLS (sensibilidade da alavanca óptica inversa) tomando curvas de extensão de força em uma superfície dura (como óxido de silício). Para isso, pegue o sinal de deflexão do fotodetector (em V) vs piezo distância e determine a inclinação da parte representando o recuo da ponta cantilever AFM na superfície subjacente (regime repulsivo) usando uma função linear. Para reduzir os erros, pegue a média de pelo menos cinco valores para obter o valor final do InvOLS. Para mais detalhes, consulte a literatura4,39.
NOTA: O InvOLS só pode ser determinado de forma confiável em superfícies duras. No caso de experimentos em superfícies macias ou interfaces certifique-se de colocar uma superfície dura perto de suas superfícies macias. Em seguida, a calibração InvOLS pode ser feita antes ou depois de seus experimentos de superfície macia sem a necessidade de desmontar a configuração AFM. - Para determinação constante da mola, mova o cantilever AFM para uma altura sem interações atraentes nem repulsivas entre a ponta cantilever e a superfície da AFM (vários μm). Em seguida, grave um espectro de ruído térmico onde a densidade espectral de energia (PSD) vs freqüência é plotada. As seguintes etapas geralmente são realizadas por funções incorporadas automatizadas em software AFM comercial: primeiro, o espectro de ruído térmico adquirido é analisado por ajuste de uma função ao PSD, por exemplo, um simples oscilador harmônico (SHO). O ajuste é feito até o mínimo entre a primeira e a segunda ressonância. Em segundo lugar, a área a parte montada do gráfico PSD vs frequência é determinada representando o deslocamento quadrado médio do cantilever AFM na direção vertical. Finalmente, o teorema da equipartição é usado para obter a constante de força cantilever AFM28,50.
NOTA: Deve ser utilizada uma faixa de freqüência apropriada que compreende o primeiro pico de ressonância do cantilever AFM. Para obter uma relação sinal-ruído satisfatória, pelo menos 10 PSDs devem ser acumulados com a maior resolução de freqüência possível. - Comece o experimento. Mapas de força de registro tomando curvas de extensão de força de forma semelhante à grade (por exemplo, 10 x 10 pontos para uma área de 20 x 20 μm2) para evitar quaisquer efeitos de superfície locais (por exemplo, impurezas, luxações) e para diferentes áreas de superfície médias.
NOTA: Os parâmetros típicos são uma velocidade de puxar de 1 μm/s e uma taxa de amostragem de 5 kHz para garantir uma resolução suficiente. A taxa de amostragem deve ser adaptada quando a velocidade de puxar for variada. A distância de retração deve ser adaptada ao contorno ou comprimento de dessorção do polímero medido (aproximadamente o dobro do comprimento esperado). - Use e varie o tempo de habitar em direção à superfície para permitir que o polímero único adere à superfície (tipicamente 0 a 5 s).
- Repita a determinação do InvOLS e a constante de mola no final do experimento para verificar a consistência e a estabilidade do sistema.
NOTA: Para uma forte adesão entre polímero e superfície, a calibração pode ser feita após o experimento real para preservar a funcionalização.
6. Avaliação de dados
NOTA: Para avaliação de dados, foi utilizado um software personalizado baseado em Igor Pro para a execução das seguintes etapas.
- Converta o sinal de deflexão bruto (em Volts) em valores de força (em Newtons) por multiplicação com o InvOLS gravado e a constante de mola determinada.
- Subtraia a deflexão do cantilever AFM (após a multiplicação do sinal de deflexão bruto com o InvOLS) da distância conduzida pelos elementos piezo na direção vertical, a fim de obter a verdadeira extensão (distância da superfície da ponta)4.
- Corrija as curvas de extensão de força obtidas para deriva, encaixando uma função linear à linha de base após o último evento e subtraindo a mesma da curva de extensão de força. A peça montada deve representar uma extensão suficiente da superfície onde não são observadas interações atraentes ou repulsivas entre a ponta cantilever aFM e a superfície subjacente. Em seguida, a linha de base é definida para o eixo zero.
NOTA: No caso de medidas em superfícies altamente reflexivas como o ouro, podem aparecer interferências. Estes resultam do reflexo parcial do raio laser da superfície e da parte traseira do cantilever AFM. Assim, as curvas de extensão de força obtidas podem mostrar um artefato de sinal de força sinusoidal ao longo da extensão vertical. Este é um artefato que dificulta os valores finais da força. Para ainda levar em conta essas curvas de extensão de força, é possível uma correção (Figura 2). - Se as interferências aparecerem nas curvas de extensão de força, selecione uma curva representativa de extensão de força (curva de retração) que não seja possivelmente um pico de adesão inespecífica e o mesmo artefato sinusoidal (ou seja, amplitude e fase)(Figura 2A).
NOTA: Suavizar a curva de extensão de força representativa para obter o padrão de baixa freqüência da interferência. - Selecione uma curva de extensão de força a ser corrigida(Figura 2B).
- Sobrepor ambas as curvas de extensão de força das etapas 6.4. e 6,5. para garantir que ambos mostrem o mesmo artefato sinusoidal (ou seja, amplitude e fase) (Figura 2C).
- Subtraia a curva de extensão de força representativa (suavizada) da curva de extensão de força a ser corrigida levando a uma linha de base reta em vez de uma linha de base sinusoidal(Figura 2D).
NOTA: Tome cuidado para que o pico de adesão inespecífico da curva representativa seja distinto de qualquer evento de molécula única que apareça nas curvas a serem corrigidas. Na verdade, a seleção da curva representativa é crucial para uma correção adequada.
Resultados
Os exemplos a seguir mostram resultados de alongamento de molécula única e dessorção dos polímeros PEG, PNiPAM e PS. Todas as pontas cantilever da AFM foram funcionalizadas com o protocolo acima informado. PEG e PNiPAM foram medidos em SiOx com variação de temperatura. Para uma discussão detalhada das curvas de alongamento dependentes da temperatura resultantes para PEG e PNiPAM, consulte Kolberg et al.18 Um motivo diferente de extensão de força é um platô de força constante (por exemplo, quando desordenar ps de monocamadas auto-montadas de metil a metil a bala de alcanque em ouro (SAM) na água4,27,39,51).
Exemplo 1: Alongamento do PEG e PNiPAM na água
O comportamento de alongamento dependente da temperatura na água foi medido usando polímeros PNiPAM e PEG univalentemente ligados a uma ponta cantilever AFM em uma extremidade e fisisorados em uma superfície SiOx na outra extremidade. Após os experimentos de calibração e controle limpo (menos de 2% das curvas de extensão de força mostram eventos de molécula única), pelo menos dois mapas de força foram registrados para cada cantilever AFM. O experimento dependente da temperatura foi realizado registrando pelo menos um mapa de força a cada temperatura. Quando apenas alguns eventos de alongamento apareceram, o respectivo cantilever AFM foi descartado e o próximo cantilever AFM do chip foi tomado (geralmente na ordem C, B, D e E de MLCT-Bio-DC). Para os dados exemplares do PEG, observou-se um único evento de alongamento em 95 das 500 curvas de extensão de força medidas (19%). Para o PNiPAM, 252 das 600 curvas de extensão de força apresentaram um padrão de alongamento (42%). Para uma melhor comparação das curvas de extensão de força, foi gerada uma única curva mestre para cada temperatura. Para isso, foram escolhidas apenas aquelas curvas com evento de alongamento a pelo menos 500 pN, onde as flutuações conformacionais e os efeitos solventes são insignificantes,52. O número final de trechos levados em conta foi 3 a 278 K, 7 em 298 K e 4 em 318 K para PEG e 4 em 278 K, 3 a 298 K e 3 a 318 K para PNiPAM18.
O procedimento para a geração de curvas-mestre é dado na Figura 3. As curvas de extensão de força escolhidas (Figura 3A) são redimensionadas para um comprimento L0 (extensão a uma força de 500 pN), ver Figura 3B. O pico de adesão mostra uma grande variação de adesão inespecífica entre a superfície e a ponta cantilever AFM, mas não influencia o comportamento de alongamento do polímero. Após a fusão das curvas de extensão de força redimensionadas, elas são mediadas por uma suavização binominal conforme apresentado na Figura 3C. Para isso, um filtro gaussiano convolve os dados com coeficientes normalizados derivados do triângulo de Pascal em um nível igual ao parâmetro de suavização 2053. Finalmente, uma curva mestre é obtida para cada temperatura, conforme dada na Figura 3D. O zoom-in mostra a faixa onde o efeito de temperatura no comportamento de extensão de força é mais pronunciado.
Uma comparação do comportamento de temperatura de PEG (A) e PNiPAM (B) pode ser encontrada na Figura 4. Para peg foi observada uma diminuição da força de alongamento com aumento da temperatura. Observou-se um aumento de aproximadamente 5% da extensão redimensionada a 100 pN ao aumentar a temperatura de 278 para 318 K. Para o PNiPAM, uma mudança dependente da temperatura oposta poderia ser revelada. Observou-se uma diminuição de aproximadamente 1% da extensão redimensionada a 100 pN quando a temperatura foi aumentada de 278 para 328 K. Além disso, a energia livre de alongamento poderia ser obtida a partir das curvas mestres de extensão de força, determinando a área a curva para qualquer valor de força. Isso poderia ser usado para extrair contribuições energéticas e entrópicas da energia livre de alongamento com a ajuda de simulações de dinâmica molecular (DM)18.
Exemplo 2: Desorção de PS de uma superfície SAM na água
A dessorção de PS de uma superfície SAM na água poderia ser usada para determinar a força de dessorção e comprimento e, assim, quantificar a interação hidrofóbica. Após a calibração, pelo menos dois mapas de força foram registrados em dois pontos diferentes da superfície. Quando o acessório de polímero foi bem sucedido, as curvas de extensão de força mostraram platôs de força constante, como característica característica, ver Figura 5A e Figura 5C. A dessorção semelhante ao planalto é observada quando a dinâmica das ligações sondadas é muito mais rápida do que a taxa de puxar da ponta cantilever AFM (quase-equilíbrio). As forças de dessorção de curvas de extensão de força semelhantes ao planalto fornecem energias livres de adesão integrando o traço de extensão de força54. Foram utilizados para determinar interações eletrostáticas, dispersivas e hidrofóbicas, bem como propriedades de atrito de polímeros únicos em superfícies em ambiente líquido2,,4,23,,51,,54,55.
Cada platô de força constante foi equipado com uma curva sigmoidal para determinar a força de dessorção e o comprimento de dessorção, que foram então plotados em histogramas. Os histogramas foram equipados com um gaussiano para extrair o valor máximo e o desvio padrão. Para uma melhor visão geral, os valores de força de dessorção e comprimento foram exibidos juntos em um gráfico de dispersão, conforme dado na Figura 5B e Figura 5D.
Para o poliestireno no SAM na água, as forças de dessorção determinadas correspondem aos valores previamente obtidos19,23. Como o comprimento de dessorção se correlaciona com o comprimento do contorno do polímero51,a distribuição do comprimento de dessorção pode ser usada como prova da ligação covalente do respectivo polímero à ponta cantilever AFM através de seu grupo final funcional. Assim, o comprimento de dessorção serve como impressão digital.
Para mais de um polímero ligado à ponta cantilever AFM, cascatas de platôs (passos discretos) podem ser observadas nas curvas de extensão de força56. Cada platô representa a dessorção de um polímero em uma extensão diferente. O experimento dado nas Figuras 5C e Figura 5D mostrou um caso típico de dois polímeros ligados à ponta cantilever AFM ao mesmo tempo. Ao encaixar a ruptura final, uma distribuição bimodal pôde ser encontrada para o comprimento da dessorção, enquanto a força de dessorção mostrou uma distribuição estreita. Neste caso, o menor comprimento de dessorção poderia ser encontrado em 90% das curvas de extensão de força, seja como um único platô ou como um platô adicional no planalto mais longo, conforme dado na Figura 5C. O maior comprimento de dessorção foi encontrado em 37% das curvas de extensão de força obtidas. Assim, a distribuição do comprimento de dessorção poderia ser usada para determinar o número de polímeros diferentes ligados à ponta cantilever AFM. Em geral, uma distribuição estreita dos valores de comprimento de dessorção é uma boa indicação de que um e o mesmo polímero único foram sondados nas curvas de extensão de força obtidas. Ao mesmo tempo, uma superposição das respectivas forças-extensão pode ser usada para decidir se um e o mesmo polímero único foi medido.
Depois de provar a ligação covalente de um único polímero PS, outros experimentos com este polímero PS podem ser realizados substrato variável (superfície sólida, bem como pelímos de polímero), condições de solvente, temperatura, velocidade de puxar ou tempo de mora.
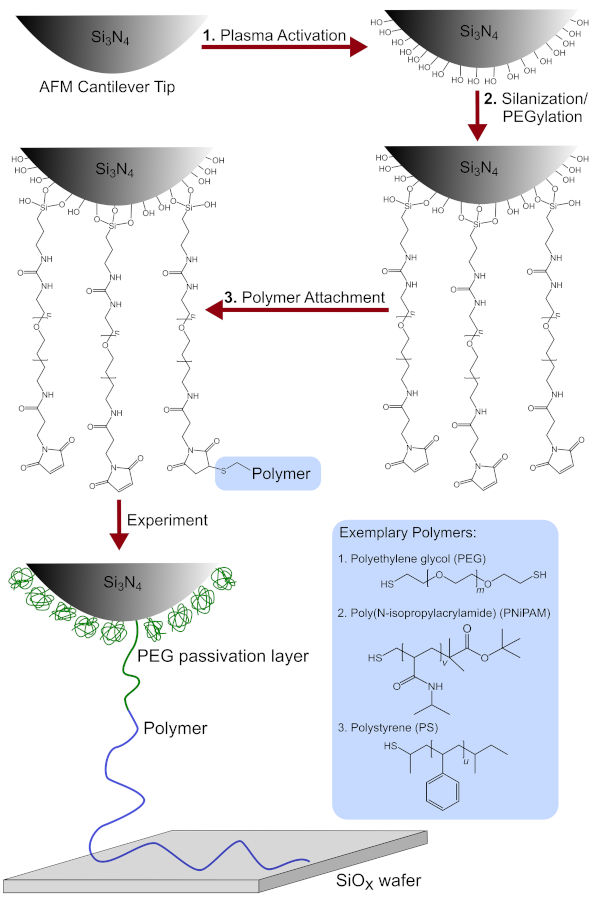
Figura 1: Visão geral esquemmática do processo de funcionalização da ponta. Inclui a modificação química da ponta cantilever AFM após (1) ativação plasmática (2) silanização/PEGylation e (3) fixação de polímero. Além disso, são mostradas as estruturas químicas detalhadas dos polímeros utilizados, peg, PNiPAM e PS. Clique aqui para ver uma versão maior desta figura.
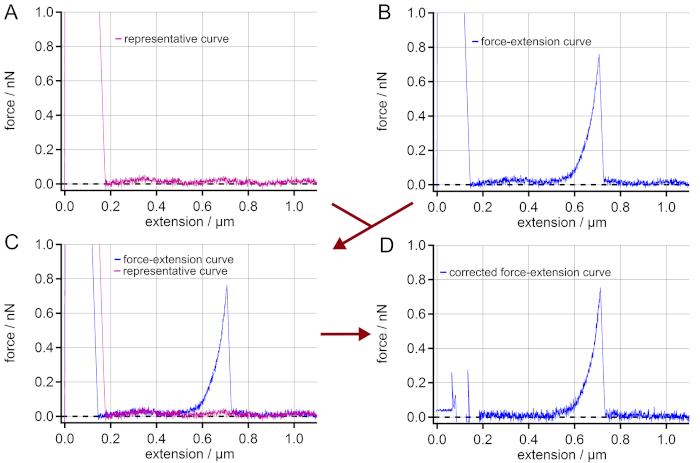
Figura 2: Eliminação de interferências nas curvas de extensão de força. (A) Encontre uma curva de extensão de força mostrando um artefato de sinal de força sinusoidal ao longo da extensão, mas não tendo nenhum evento de alongamento de molécula única. (B) Escolha uma curva de extensão de força com um único evento de molécula, que deve ser corrigido a partir do artefato sinusoidal. (C) Sobrepor as curvas para controlar se os artefatos sinusoidais das curvas realmente coincidirem. (D) Subtraindo a curva de extensão de força(A)de (B) obtém-se uma curva de extensão de força com uma linha de base reta. Embora o pico de adesão não possa ser usado para análise suplementar, a curva de extensão de força é agora corrigida para o artefato que leva a valores de força muito mais precisos na região do evento de molécula única (aqui: > 0,2 μm de extensão). Clique aqui para ver uma versão maior desta figura.
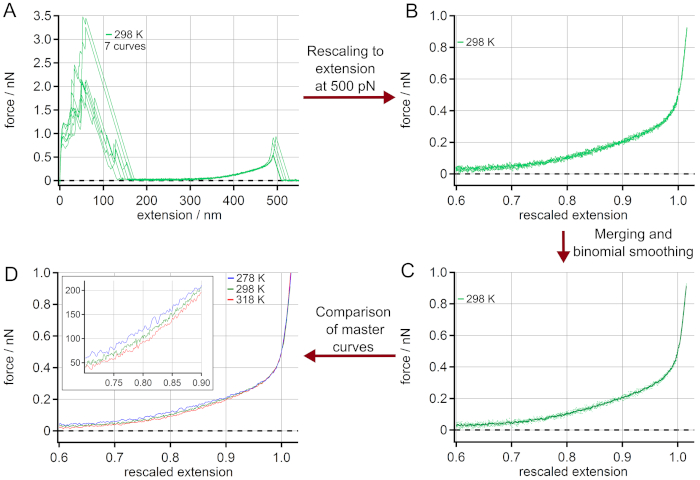
Figura 3: Determinação das curvas-mestre das curvas de extensão de força do PEG a 298 K. (A) Dados experimentais a 298 K, utilizando 7 curvas de extensão de força. Após a redimensionamento para um comprimento L0 a uma força de 500 pN(B),as curvas de extensão de força podem ser mescladas e médias por suavização binominal obtendo uma curva mestre(C). As curvas redimensionadas são dadas como pontilhadas, enquanto a curva principal é mostrada como uma linha sólida. Finalmente, as curvas-mestre obtidas para diferentes temperaturas podem ser comparadas (D). O zoom-in indica a faixa onde o efeito de temperatura no comportamento de extensão de força é mais pronunciado. Clique aqui para ver uma versão maior desta figura.
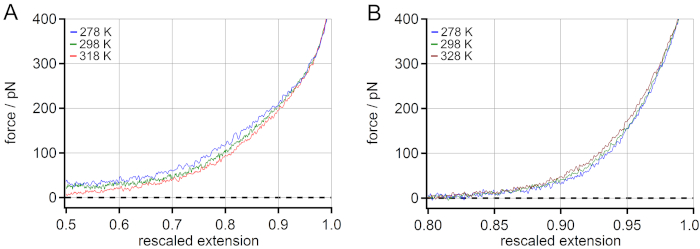
Figura 4: Comparação das curvas-mestre dependentes da temperatura de PNiPAM e PEG. Para peg, observa-se um aumento da extensão redimensionada a 100 pN (faixa de força média) ao aumentar a temperatura (A),enquanto para o PNiPAM é revelada uma mudança de temperatura dependente da temperatura(B). Clique aqui para ver uma versão maior desta figura.
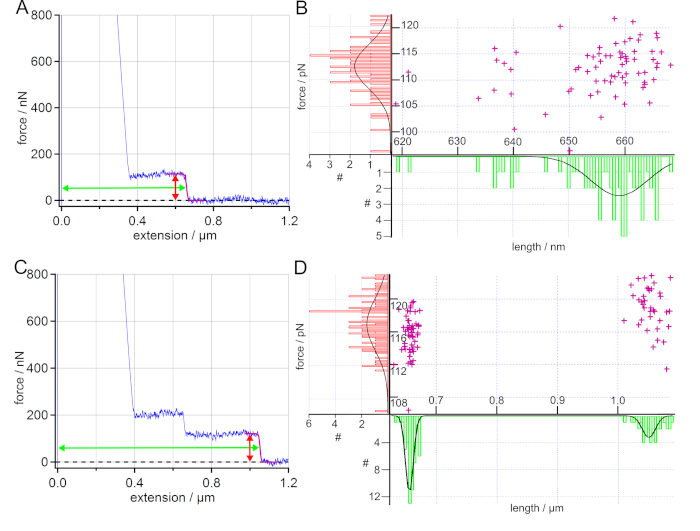
Figura 5: Análise das curvas de extensão de força de PS em SAM na água. (A)Curva de extensão de força exemplar (azul) com um ajuste sigmoidal do platô (roxo). Além disso, as setas marcam a força determinada (vermelha) e o comprimento (verde) do planalto. Os valores de força de dessorção e comprimento de dessorção obtidos por ataques sigmoidais são exibidos em um gráfico de dispersão e os histogramas resultantes são equipados com um gaussiano. (B) Os valores de força de dessorção e dessorção determinados são (112 ± 6) pN e (659 ± 7) nm, onde 93% das curvas de extensão de força apresentam tais eventos de planalto único. (C) Curva de extensão de força exemplar (azul) para dois polímeros ligados à ponta cantilever AFM ao mesmo tempo. Aqui, a força de dessorção mostra uma distribuição unimodal com um valor de força médio de (117 ± 5) pN, enquanto uma distribuição bimodal pode ser encontrada para o comprimento de dessorção levando a valores médios de comprimento de (656 ± 9) nm e (1050 ± 16) nm. (D) 90% das curvas de extensão de força amostradas apresentam apenas eventos de planalto único. Clique aqui para ver uma versão maior desta figura.
Discussão
O SMFS baseado em AFM é uma das principais ferramentas para investigar interações de moléculas únicas na física do polímero. Para um verdadeiro experimento de molécula única, a fixação covalente do polímero da sonda a uma ponta cantilever AFM é essencial.
Muitos trabalhos anteriores são baseados em experimentos de nanopesca, em particular para PNiPAM, onde os polímeros são adsorriados em uma superfície e, em seguida, esticados escolhendo-os aleatoriamente do substrato usando uma ponta cantilever AFM30,31. Isso pode alterar os resultados e levar a uma má interpretação do comportamento da molécula única. Lá, os efeitos cooperativos podem dominar os resultados porque as interações com polímeros vizinhos não podem ser excluídas. Isso tem um grande impacto nos resultados, especialmente para polímeros que mostram um comportamento significativamente diferente em massa em comparação com moléculas isoladas únicas57,58.
O protocolo de funcionalidade aqui apresentado é confiável e pode ser facilmente aplicado a diferentes polímeros, independentemente de seu comprimento de contorno, hidrofobicidade ou o impedimento estérico dos monômeros. Além disso, uma passivação é fornecida para evitar interações indesejadas entre o polímero de sonda única e a ponta cantilever AFM, bem como entre a ponta cantilever AFM e a superfície subjacente. Além disso, mostra-se a avaliação das curvas de extensão de força que mostram eventos de alongamento. Lá, propõe-se um procedimento para a determinação das curvas de extensão da força-mestre. Isso oferece um melhor meio de revelar, por exemplo, efeitos relacionados à temperatura sobre o comportamento de extensão da força. Além disso, é fornecida a análise de eventos de dessorção de moléculas únicas com platôs de força constante. Além disso, uma maneira simples de corrigir artefatos de sinal de força sinusoidal em curvas de extensão de força é dada que pode prejudicar os resultados do experimento.
Comparado com Stetter et al.39,o procedimento de funcionalização aqui apresentado é reduzido a três etapas em vez de quatro e a robustez do procedimento é melhorada. O maior benefício da realização de PEGylation e silanization em um passo é ter uma reação melhor controlada e aumentar o rendimento. Além disso, menos soluções precisam ser preparadas e menos etapas de lavagem são necessárias. Isso reduz o esforço e o tempo de preparação e aumenta a reprodutibilidade. Além disso, mover cantilevers AFM é sempre uma parte crítica do processo de funcionalização. Uma transferência de uma solução para a outra sempre corre o risco de influenciar fortemente a qualidade da funcionalização devido às transferências através da interface ar-água ou de perder cantilevers AFM por uso indevido de pinças.
Para provar a fixação covalente adequada de um único polímero a uma ponta cantilever AFM, diferentes condições devem ser atendidas. Em primeiro lugar, controlar os cantilevers da AFM são de importância significativa e devem estar preparados para cada funcionalização. O processo de funcionalização e a célula fluida para a realização dos experimentos são considerados apenas limpos, se um pequeno número de curvas de extensão de força mostrar em trechos ou platôs no experimento de controle (nos exemplos apresentados menos de 2%).
Um padrão claro de alongamento sem mais gotas ou máximas é essencial para ter eventos adequados de alongamento de moléculaúnica. Além disso, deve ser analisada a dependência da força de ruptura da taxa de carregamento da força na ruptura ou a resposta elástica completa da curva de estiramento, a fim de excluir a dessorção simultânea de múltiplos polímeros59,60. Para PEG e PNiPAM, 19% e 42% das curvas de extensão de força tomadas em diferentes posições da superfície apresentaram tal padrão de alongamento, respectivamente. Para obter eventos de alongamento, a fisisorpção do polímero à respectiva superfície subjacente deve ser forte. Caso contrário, um evento de dessorção semelhante ao planalto é observado. Isso é ainda mais decisivo para a detecção de eventos de alongamento em altas forças (até 500 pN ou mais). Como essa forte fisioaspiração não é atendida para cada curva de extensão de força, o rendimento de tais eventos é menor do que para eventos de dessorção semelhantes ao planalto puro. Como alternativa, grupos fortemente aderindo, como catechols ou quimioterapia entre polímero e superfície subjacente, podem ser usados. No entanto, isso requer a introdução de outros grupos funcionais ou locais de acoplamento no polímero61,62.
Na verdade, a massa (ou seja, comprimento do contorno) do polímero fornece uma impressão digital valiosa. Embora a massa não possa ser traduzida diretamente no comprimento do contorno medido pelas seguintes razões, a distribuição de comprimento é muito valiosa para definir eventos de molécula única. No caso de um polímero PNiPAMƉ com baixa polidispersidade ( =1,28), encontramos diferenças significativas nos valores de extensão para os eventos de alongamento obtidos (e, portanto, no comprimento do polímero) nos experimentos. Uma das razões para isso pode ser a determinação do comprimento do polímero e sua distribuição. Na cromatografia de exclusão de tamanho (SEC), um peso relativo do polímero alvo é determinado em comparação com padrões como PS ou poli (metacrilato de metila) (PMMA)63. Espera-se que o peso relativo presumido desvie-se do peso molecular absoluto porque o raio hidrodinâmico do polímero alvo e o padrão podem diferir significativamente. Além disso, a camada de silano pode ser oligmerizada por água espúria em tolueno durante o processo de funcionalidade. A fixação desses oligômeros à ponta cantilever da AFM leva a uma camada mais flexível com menos pontos de ancoragem64. Além disso, o ponto de fixação do polímero à camada de silício pode não estar necessariamente no ápice levando a uma mudança dos valores de comprimento detectados29. Enquanto um modelo de polímero como a cadeia de wormlike (WLC) ou o modelo de cadeia livremente articulada (FJC) não pode reproduzir o respectivo comportamento de extensão de força para PEG ou PNiPAM adequadamente ao longo de toda a faixa de extensão18,29,41,65,66, tal modelo de polímero pode ser valioso para outros sistemas poliméricos e proteicos10,15,67,68.
A fixação covalente de um único polímero PS (com um comprimento de contorno superior a 1 μm) só é considerada bem sucedida, quando um número considerável de curvas de extensão de força mostram um platô longo o suficiente de força constante(Figura 5). Um platô resultante da desoragem de um único polímero é definido por uma única queda acentuada de uma força constante para a linha de base em uma determinada extensão, conforme dado na Figura 5A. Se mais polímeros forem anexados à ponta cantilever AFM, observa-se uma cascata de platôs56 (Figura 5C). O comprimento do platô (comprimento de dessorção), correlacionando-se com o comprimento do contorno do polímero51,tem que ser significativamente maior do que qualquer pico de adesão devido à adesão inespecífica da ponta cantilever AFM à superfície subjacente (aqui em torno de 200 nm). As características que aparecem apenas em uma única curva de extensão de força não devem ser interpretadas. Nos experimentos apresentados, pelo menos 80 de 100 curvas mostraram um platô superior a 200 nm em pelo menos dois mapas de força em dois pontos diferentes na superfície. Além disso, a distribuição dos comprimentos de dessorção, utilizando parcelas de dispersão como dada na Figura 5B e 5D,revela se e quantos polímeros estão vinculados à ponta cantilever AFM. No caso da PS, uma distribuição estreita da força de dessorção e do comprimento retirados dos platôs das curvas de extensão de força serviu como evidência de um apego covalente bem sucedido. Isso finalmente provou o sucesso do protocolo de funcionalização. Assim, recomendamos fortemente apresentar tais distribuições de força e comprimento em publicações.
Avaliar curvas de extensão de força usando algoritmos incorporados que compreendem muitos parâmetros pré-definidos deve ser feito com cuidado. As razões são, por exemplo, que uma taxa de amostragem fixa não é apropriada para cada velocidade de puxar aplicada ou que uma suavização automatizada das curvas de extensão de força pode fazer uma média de detalhes importantes. Geralmente, uma compreensão adequada do respectivo procedimento de avaliação pode evitar erros no procedimento de avaliação, o que pode, por sua vez, influenciar fortemente os achados finais de um experimento SMFS baseado em AFM.
Em resumo, apresentamos um protocolo de funcionalidade que é confiável e pode ser facilmente aplicado a uma variedade de polímeros. Além disso, é apresentada uma avaliação adequada das curvas de extensão de força de molécula única, permitindo a determinação de parâmetros físicos como força de alongamento, força de dessorção e comprimento de dessorção. Os protocolos e procedimentos apresentados são valiosos para a investigação de sistemas de resposta a estímulos no nível de molécula única.
Divulgações
Os autores declaram que não têm interesse financeiro concorrente.
Agradecimentos
B.N.B. e T.H. reconhecem o financiamento da Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) a Estratégia de Excelência da Alemanha – EXC-2193/1 – 390951807, gefördert durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen der Exzellenzstrategie des Bundes und der Länder – EXC-2193/1 – 390951807, e conceder HU 997/1-13 (projeto nº 420798410). M.G. reconhece apoio parcial no quadro do Projeto LOEWE iNAPO pelo Ministério estadual de Educação Superior, Pesquisa e Artes de Hessen. Agradecemos ao Dr. Wolfgang Bronner e à Dra.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Dodecanethiol (≥98%) | Sigma-Aldrich, USA | 417364-500ML | Used for SAM |
| Ammonia solution (30%) | Roth, Germany | CP17.2 | Used for cleaning |
| Cypher ES | Asylum Research, an Oxford Instruments company, USA | - | AFM |
| Ethanol (≥99.9%) | Roth, Germany | PO76.1 | Solvent |
| Gold coated silicon wafer | Fraunhofer Institute for Applied Solid State Physics IAF, Germany | - | Used for SAM |
| High Resolution Replicating Compound | Microset Products Ltd, UK | 101RF | Bonding agent |
| Hydrogen peroxide solution | Sigma-Aldrich, USA | H1009 | Used for cleaning |
| Igor Pro | Wavemetrics, USA | - | Software environment |
| Tetra-30-LF-PC | Diener Electronic, Germany | - | Plasma chamber |
| Maleimide-polyethylene glycol-triethoxysilane | Creative PEG works, USA | PHB-1923 | Linker polymer |
| MLCT-Bio-DC | Bruker, USA | MLCT-Bio-DC | AFM cantilever |
| Prime CZ-Si wafer, n-type (Phosphor) TTV < 10 µm | MicroChemicals, Germany | WSA40600250 P1314SNN1 | Silicon wafer |
| Purelab Chorus 1, 18.2 MΩ cm | Elga LabWater, Germany | 10034-540 | Ultrapure water source |
| R3 SA | Vomm GmbH, Germany | 5803 Blank | Tweezers |
| Thiol terminated poly(N-isopropylacrylamide) | Gallei Group, Saarland University, Germany | - | PNiPAM probe polymer |
| Thiol terminated polystyrene | Polymer Source, Canada | P40722-SSH | PS probe polymer |
| Thiol-polyethylene glycol-thiol | Creative PEGWorks, USA | PSB-615 | PEG probe polymer |
| Toluene (99.99%) | Fisher Chemicals | T324-500 | Solvent |
Referências
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56 (9), 930-933 (1986).
- Hugel, T., Seitz, M. The Study of Molecular Interactions by AFM Force Spectroscopy. Macromolecular Rapid Communications. 22 (13), 989-1016 (2001).
- Butt, H. -J., Cappella, B., Kappl, M. Force measurements with the atomic force microscope: Technique, interpretation and applications. Surface Science Reports. 59 (1-6), 1(2005).
- Balzer, B. N., Hugel, T. Single-Molecule Detection and Manipulation. Reference Module in Materials Science and Materials Engineering. Hashmi, S. , Elsevier. Amsterdam. (2016).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1 (1), 41-57 (2019).
- Edwards, D. T., Faulk, J. K., LeBlanc, M. -A., Perkins, T. T. Force Spectroscopy with 9-μs Resolution and Sub-pN Stability by Tailoring AFM Cantilever Geometry. Biophysical journal. 113 (12), 2595-2600 (2017).
- Alsteens, D., et al. Nanomechanical mapping of first binding steps of a virus to animal cells. Nature Nanotechnology. 12 (2), 177-183 (2017).
- Kodera, N., Yamamoto, D., Ishikawa, R., Ando, T. Video imaging of walking myosin V by high-speed atomic force microscopy. Nature. 468, 72-76 (2010).
- Shibata, M., et al. Real-space and real-time dynamics of CRISPR-Cas9 visualized by high-speed atomic force microscopy. Nature Communications. 8 (1), 1-9 (2017).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible unfolding of individual titin immunoglobulin domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Oesterhelt, F., Oesterhelt, D., Pfeiffer, M., Engel, A., Gaub, H. E., Müller, D. J. Unfolding pathways of individual bacteriorhodopsins. Science. 288 (5463), New York, N.Y. 143-146 (2000).
- Hugel, T., Holland, N. B., Cattani, A., Moroder, L., Seitz, M., Gaub, H. E. Single-molecule optomechanical cycle. Science. 296 (5570), New York, N.Y. 1103-1106 (2002).
- Yu, H., Siewny, M. G. W., Edwards, D. T., Sanders, A. W., Perkins, T. T. Hidden dynamics in the unfolding of individual bacteriorhodopsin proteins. Science. 355 (6328), New York, N.Y. 945-950 (2017).
- Erlich, K. R., Sedlak, S. M., Jobst, M. A., Milles, L. F., Gaub, H. E. DNA-free directed assembly in single-molecule cut-and-paste. Nanoscale. 11 (2), 407-411 (2019).
- Rico, F., Russek, A., González, L., Grubmüller, H., Scheuring, S. Heterogeneous and rate-dependent streptavidin-biotin unbinding revealed by high-speed force spectroscopy and atomistic simulations. Proceedings of the National Academy of Sciences of the United States of America. 116 (14), 6594-6601 (2019).
- Löf, A., et al. Multiplexed protein force spectroscopy reveals equilibrium protein folding dynamics and the low-force response of von Willebrand factor. Proceedings of the National Academy of Sciences of the United States of America. 116 (38), 18798-18807 (2019).
- Kienle, S., Liese, S., Schwierz, N., Netz, R. R., Hugel, T. The effect of temperature on single-polypeptide adsorption. Chemphyschem : a European journal of chemical physics and physical chemistry. 13 (4), 982-989 (2012).
- Kolberg, A., et al. Opposing Temperature Dependence of the Stretching Response of Single PEG and PNiPAM Polymers. Journal of the American Chemical Society. 141 (29), 11603-11613 (2019).
- Balzer, B. N., et al. Cohesion Mechanisms of Polystyrene-Based Thin Polymer Films. Macromolecules. 46 (18), 7406-7414 (2013).
- Balzer, B. N., et al. Adhesion property profiles of supported thin polymer films. ACS Applied Materials & Interfaces. 5 (13), 6300-6306 (2013).
- Stetter, F. W. S., Cwiklik, L., Jungwirth, P., Hugel, T. Single Lipid Extraction: The Anchoring Strength of Cholesterol in Liquid-Ordered and Liquid-Disordered Phases. Biophysical journal. 107 (5), 1167-1175 (2014).
- Schwierz, N., Krysiak, S., Hugel, T., Zacharias, M. Mechanism of Reversible Peptide-Bilayer Attachment: Combined Simulation and Experimental Single-Molecule Study. Langmuir. 32 (3), 810-821 (2016).
- Balzer, B. N., et al. Nanoscale Friction Mechanisms at Solid-Liquid Interfaces. Angewandte Chemie International Edition. 52 (25), 6541-6544 (2013).
- Balzer, B. N., Kienle, S., Gallei, M., von Klitzing, R., Rehahn, M., Hugel, T. Stick-Slip Mechanisms at the Nanoscale. Soft Materials. 12, 106-114 (2014).
- Kühner, F., Erdmann, M., Sonnenberg, L., Serr, A., Morfill, J., Gaub, H. E. Friction of single polymers at surfaces. Langmuir. 22 (26), 11180-11186 (2006).
- Grebíková, L., Gojzewski, H., Kieviet, B. D., Klein Gunnewiek, M., Vancso, G. J. Pulling angle-dependent force microscopy. The Review of Scientific Instruments. 88 (3), 33705(2017).
- Geisler, M., et al. Hydrophobic and Hofmeister effects on the adhesion of spider silk proteins onto solid substrates: an AFM-based single-molecule study. Langmuir. 24 (4), 1350-1355 (2008).
- Pirzer, T., Hugel, T. Atomic force microscopy spring constant determination in viscous liquids. Review of Scientific Instruments. 80 (3), 35110(2009).
- Liese, S., et al. Hydration Effects Turn a Highly Stretched Polymer from an Entropic into an Energetic Spring. ACS Nano. 11 (1), 702-712 (2017).
- Cui, S., Pang, X., Zhang, S., Yu, Y., Ma, H., Zhang, X. Unexpected Temperature-Dependent Single Chain Mechanics of Poly(N-isopropyl-acrylamide) in Water. Langmuir. 28 (11), 5151-5157 (2012).
- Liang, X., Nakajima, K. Nanofishing of a Single Polymer Chain: Temperature-Induced Coil-Globule Transition of Poly(N -isopropylacrylamide) Chain in Water. Macromolecular Chemistry and Physics. 219 (3), 1700394(2018).
- Zhang, W., Zou, S., Wang, C., Zhang, X. Single Polymer Chain Elongation of Poly(N -isopropylacrylamide) and Poly(acrylamide) by Atomic Force Microscopy. The Journal of Physical Chemistry B. 104 (44), 10258-10264 (2000).
- Hermanson, G. T. Bioconjugate techniques - 3rd Edition. , Academic Press. San Diego. (2013).
- Leitner, M., et al. Single-molecule AFM characterization of individual chemically tagged DNA tetrahedra. ACS Nano. 5 (9), 7048-7054 (2011).
- Walder, R., et al. Rapid Characterization of a Mechanically Labile α-Helical Protein Enabled by Efficient Site-Specific Bioconjugation. Journal of the American Chemical Society. 139 (29), 9867-9875 (2017).
- Tang, J., et al. High-affinity tags fused to s-layer proteins probed by atomic force microscopy. Langmuir. 24 (4), 1324-1329 (2008).
- Wildling, L., et al. Linking of sensor molecules with amino groups to amino-functionalized AFM tips. Bioconjugate Chemistry. 22 (6), 1239-1248 (2011).
- Maity, S., Viazovkina, E., Gall, A., Lyubchenko, Y. A. A Metal-free Click Chemistry Approach for the Assembly and Probing of Biomolecules. Journal of Nature and Science. 2 (4), 187(2016).
- Stetter, F. W. S., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456(2015).
- Becke, T. D., et al. Covalent Immobilization of Proteins for the Single Molecule Force Spectroscopy. Journal of Visualized Experiments. (138), e58167(2018).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS Nano. 11 (6), 6346-6354 (2017).
- Newton, R., et al. Combining confocal and atomic force microscopy to quantify single-virus binding to mammalian cell surfaces. Nature Protocols. 12 (11), 2275-2292 (2017).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analytical Biochemistry. 156 (1), 220-222 (1986).
- Grabarek, Z., Gergely, J. Zero-length crosslinking procedure with the use of active esters. Analytical Biochemistry. 185 (1), 131-135 (1990).
- Baird, J. A., Olayo-Valles, R., Rinaldi, C., Taylor, L. S. Effect of Molecular Weight, Temperature, and Additives on the Moisture Sorption Properties of Polyethylene Glycol. Journal of Pharmaceutical Sciences. 99 (1), 154-168 (2010).
- Halperin, A., Kröger, M., Winnik, F. M. Poly(N-isopropylacrylamide) Phase Diagrams: Fifty Years of Research. Angewandte Chemie International Edition. 54 (51), 15342-15367 (2015).
- Barradas, R. G., Fletcher, S., Porter, J. D. The hydrolysis of maleimide in alkaline solution. Canadian Journal of Chemistry. 54 (9), 1400-1404 (1976).
- Kharasch, N., Tarbell, D. S. Chapter 10 - The Mechanism of Oxidation of Thiols to Disulfides. Organic Sulfur Compounds. , 97-102 (1961).
- Folkers, J. P., Laibinis, P. E., Whitesides, G. M. Self-assembled monolayers of alkanethiols on gold: comparisons of monolayers containing mixtures of short- and long-chain constituents with methyl and hydroxymethyl terminal groups. Langmuir. 8 (5), 1330-1341 (1992).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Review of Scientific Instruments. 64 (7), 1868-1873 (1998).
- Krysiak, S., Liese, S., Netz, R. R., Hugel, T. Peptide desorption kinetics from single molecule force spectroscopy studies. Journal of the American Chemical Society. 136 (2), 688-697 (2014).
- Hugel, T., Rief, M., Seitz, M., Gaub, H. E., Netz, R. R. Highly Stretched Single Polymers: Atomic-Force-Microscope Experiments Versus Ab-Initio Theory. Physical Review Letters. 94 (4), 48301(2005).
- Marchand, P., Marmet, L. Binomial smoothing filter: A way to avoid some pitfalls of least-squares polynomial smoothing. Review of Scientific Instruments. 54 (8), 1034-1041 (1983).
- Horinek, D., et al. Peptide adsorption on a hydrophobic surface results from an interplay of solvation, surface, and intrapeptide forces. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2842-2847 (2008).
- Friedsam, C., Gaub, H. E., Netz, R. R. Adsorption energies of single charged polymers. EPL (Europhysics Letters). 72 (5), 844-850 (2005).
- Scherer, A., Zhou, C., Michaelis, J., Brauchle, C., Zumbusch, A. Intermolecular Interactions of Polymer Molecules Determined by Single-Molecule Force Spectroscopy. Macromolecules. 38 (23), 9821-9825 (2005).
- Abbott, L. J., Tucker, A. K., Stevens, M. J. Single Chain Structure of a Poly(N-isopropylacrylamide) Surfactant in Water. The Journal of Physical Chemistry B. 119 (9), 3837-3845 (2015).
- Okano, T., Bae, Y. H., Jacobs, H., Kim, S. W. Thermally on-off switching polymers for drug permeation and release. Journal of Controlled Release. 11 (1), 255-265 (1990).
- Sulchek, T., Friddle, R. W., Noy, A. Strength of multiple parallel biological bonds. Biophysical journal. 90 (12), 4686-4691 (2006).
- Sulchek, T. A., et al. Dynamic force spectroscopy of parallel individual Mucin1-antibody bonds. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16638-16643 (2005).
- Krysiak, S., Wei, Q., Rischka, K., Hartwig, A., Haag, R., Hugel, T. Adsorption mechanism and valency of catechol-functionalized hyperbranched polyglycerols. Beilstein Journal of Organic Chemistry. 11, 828-836 (2015).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating receptor-ligand systems of the cellulosome with AFM-based single-molecule force spectroscopy. Journal of Visualized Experiments. (82), e50950(2013).
- Trathnigg, B. Determination of MWD and chemical composition of polymers by chromatographic techniques. Progress in Polymer Science. 20 (4), 615-650 (1995).
- Blass, J., Albrecht, M., Wenz, G., Zang, Y. N., Bennewitz, R. Single-molecule force spectroscopy of fast reversible bonds. Physical Chemistry Chemical Physics. 19 (7), 5239-5245 (2017).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single molecule force spectroscopy by AFM indicates helical structure of poly(ethylene-glycol) in water. New Journal of Physics. 1, 1-11 (1999).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying thiol-gold interactions towards the efficient strength control. Nature Communications. 5, 4348(2014).
- Lyu, X., Song, Y., Feng, W., Zhang, W. Direct Observation of Single-Molecule Stick-Slip Motion in Polyamide Single Crystals. ACS Macro Letters. 7 (6), 762-766 (2018).
- Hugel, T., et al. Elasticity of Single Polyelectrolyte Chains and Their Desorption from Solid Supports Studied by AFM Based Single Molecule Force Spectroscopy. Macromolecules. 34 (4), 1039-1047 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados