É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo a evolução temporal de materiais em nanoescala com espalhamento de nêutrons de fluxo interrompido e de pequeno ângulo
Neste Artigo
Resumo
Este protocolo apresenta o uso de um ambiente de amostra de fluxo interrompido para misturar rapidamente múltiplas soluções líquidas in situ durante uma medição de espalhamento de nêutrons de pequeno ângulo e para estudar processos cinéticos em escalas de comprimento nanométrico e segundas escalas de tempo.
Resumo
Este artigo apresenta o uso de um ambiente de amostra de espalhamento de nêutrons de pequeno ângulo (SANS) de fluxo interrompido para misturar rapidamente amostras líquidas e estudar processos cinéticos em nanoescala em escalas de tempo de segundos a minutos. O ambiente de amostra de fluxo interrompido usa bombas de seringa disponíveis comercialmente para misturar os volumes desejados de amostras líquidas que são então injetadas através de um misturador dinâmico em uma célula de vidro de quartzo em aproximadamente 1 s. A aquisição de dados SANS resolvida no tempo é sincronizada com a mistura de amostras para acompanhar a evolução da nanoestrutura em solução após a mistura.
Para fazer o uso mais eficiente do tempo de feixe de nêutrons, usamos uma série de válvulas seletoras de fluxo para carregar, enxaguar e secar automaticamente a célula entre as medições, permitindo a coleta repetida de dados ao longo de várias injeções de amostra. As injeções de amostra são repetidas até que estatísticas suficientes de espalhamento de nêutrons sejam coletadas. A configuração de mistura pode ser programada para variar sistematicamente as condições para medir a cinética em diferentes razões de mistura, concentrações de amostra, concentrações de aditivos e temperaturas. O volume mínimo de amostra necessário por injeção é de aproximadamente 150 μL, dependendo do comprimento do caminho da célula de quartzo.
Resultados representativos usando este ambiente de amostra de fluxo interrompido são apresentados para uma cinética de troca rápida de lipídios na presença de um aditivo, a ciclodextrina. As vesículas trocam os lipídios do folheto externo (exterior) na ordem de segundos e trocam totalmente os lipídios internos e externos em poucas horas. A medição da cinética de troca lipídica requer mistura in situ para capturar os processos mais rápidos (segundos) e mais lentos (minutos) e extrair as constantes de taxa cinética. O mesmo ambiente de amostra também pode ser usado para sondar a troca molecular em outros tipos de amostras líquidas, como nanopartículas lipídicas, proteínas, surfactantes, polímeros, emulsões ou nanopartículas inorgânicas. Medir as transformações estruturais em nanoescala e a cinética de sistemas de troca ou reação fornecerá novos insights sobre os processos que evoluem na nanoescala.
Introdução
O espalhamento de nêutrons a baixo ângulo (SANS) fornece uma maneira única de medir os tamanhos, formas, interações e organização de vários materiais em escalas de comprimento de ≈1 nm a ≈100 nm 1,2,3. Instrumentos recentes, incluindo instrumentos VSANS (very small-angle neutron scattering) com espelhos de focalização, ultrapassam os limites para medir escalas de comprimento ainda maiores de até ≈1000 nm 4,5. Em geral, o contraste de espalhamento único inerente aos métodos de espalhamento de nêutrons oferece várias vantagens na mensuração do tempo de evolução de estruturas nanométricas, tais como a agregação de componentes em formulações farmacêuticas6, reações de reticulação e gelificação em sistemas poliméricos7,8, na mesocristalização de proteínas de membrana9,10, degradação e desdobramento de proteínas11,12 e crescimento de materiais à base de sílica13,14,15. O contraste de dispersão exclusivo torna o SANS (TR-SANS) resolvido no tempo um complemento útil para outras medições baseadas em fluxo parado.
Métodos de mistura de fluxo interrompido são frequentemente implementados em espalhamento de raios X a baixos ângulos (SAXS)16,17,18,19,20,21, espectroscopia de fluorescência 22,23,24,25,26 e espalhamento de luz27,28,29,30, 31,32 experimentos para estudar processos cinéticos em escalas de tempo de milissegundos. Uma diferença importante entre SANS e SAXS é que o espalhamento de nêutrons é uma técnica de caracterização não destrutiva e, como tal, o SANS pode ser usado para medir a mesma amostra por horas ou até dias sem danos de radiação ionizante na amostra, o que pode acontecer durante experimentos de espalhamento de raios X de alto fluxo33. Como medidas repetidas de SANS não alteram a estrutura química da molécula ou amostra da sonda, a evolução temporal pode ser estudada sem efeitos do fotoclareamento, por exemplo, o que pode complicar medidas cinéticas que dependem de fluorescência23,24. Além disso, o SANS pode ser usado para medir amostras altamente concentradas e opticamente opacas que muitas vezes são difíceis de caracterizar com técnicas baseadas em luz, como espalhamento dinâmico de luz.
Além de fornecer informações estruturais sobre a nanoescala, o SANS pode ser usado para sondar a composição local dessas estruturas através da variação no contraste de densidade de comprimento de espalhamento de nêutrons. A densidade de comprimento de espalhamento (SLD) de diferentes elementos varia aleatoriamente ao longo da tabela periódica e varia com diferentes isótopos do mesmo elemento. Um exemplo comumente explorado é o hidrogênio (1H ou H) e o deutério (2H ou D), que têm comprimentos de espalhamento de nêutrons muito diferentes. Portanto, materiais ricos em hidrogênio, como surfactantes, lipídios, proteínas, RNA, DNA e outros polímeros, podem ser distinguidos dos solventes deuterados usando SANS sem alterar significativamente as propriedades físicas do sistema. No entanto, é importante notar que a troca H/D pode afetar a densidade, a ligação de hidrogênio e as temperaturas de transição de fase na amostra. No entanto, a sensibilidade única do SANS a materiais ricos em hidrogênio é especialmente útil em pesquisas de matéria mole, onde as amostras de interesse têm menor espalhamento, contraste e sinal em técnicas baseadas em raios-X, como o SAXS. A substituição isotópica também torna o SANS uma ferramenta poderosa para estudar a cinética de troca molecular em materiais ricos em hidrogênio simplesmente misturando moléculas marcadas com H e D. A substituição isotópica é particularmente útil em sistemas onde corantes fluorescentes volumosos são maiores que o surfactante ou moléculas lipídicas de interesse e podem influenciar a cinética de troca34,35.
As medições SANS resolvidas no tempo são vantajosas porque a intensidade medida é função do tempo, da escala de comprimento e do contraste SLD. Como tal, os experimentos TR-SANS podem ser projetados para investigar as mudanças dependentes do tempo nas distribuições espaciais e nas composições das amostras. Essas vantagens únicas do SANS levaram a importantes insights sobre processos cinéticos em muitos sistemas de materiais moles, como surfactantes 36,37,38, emulsões 39,40,41, lipídios 34,42,43,44,45,46,47,48,49 ,50, e polímeros 51,52,53,54,55,56,57,58,59,60,61,62. A maioria dos estudos TR-SANS tem se concentrado em escalas de tempo de minutos a horas. No entanto, muitos processos cinéticos de interesse ocorrem na segunda escala de tempo e são essenciais para a compreensão dos mecanismos subjacentes. A captura desses primeiros pontos de tempo requer que as soluções sejam rapidamente misturadas e medidas in situ, nas quais a mistura é sincronizada com a coleta de dados durante o espalhamento de luz de fluxo interrompido 27,28,29,30,31,32, fluorescência 22,23,24,25,26 e raios X 16,17,18,19,20,21 experimentos. Este trabalho descreve o uso de um ambiente de amostra projetado para misturar rapidamente várias amostras líquidas e injetar a mistura em uma célula de vidro de quartzo para medições de TR-SANS. O dispositivo de mistura é uma adaptação do dispositivo reoSANS capilar63 recentemente desenvolvido e usa várias bombas de seringa e válvulas para controlar a mistura de amostras e automatizar a limpeza das células. Ao conectar bombas de seringa a uma série de válvulas seletoras de fluxo, vários fluxos de entrada podem ser repetidamente misturados, medidos, enxaguados e secos para facilitar as medições TR-SANS na escala de tempo de segundos.
O procedimento atual pressupõe que as amostras de interesse tenham sido identificadas e preparadas. Nós nos concentramos na configuração de mistura in situ e nos métodos para coletar dados TR-SANS. Os dados de espalhamento de nêutrons foram coletados no instrumento VSANS no NIST Center for Neutron Research (NCNR); no entanto, o procedimento deve ser aplicável a outros instrumentos SANS. Os leitores interessados em implementar protocolos semelhantes em outros instrumentos SANS devem consultar os cientistas locais do instrumento para determinar a configuração ideal do instrumento para maximizar o fluxo de nêutrons na escala de comprimento e tempo desejadas mais relevantes para os processos cinéticos de interesse. Os dados aqui apresentados foram coletados usando a configuração de feixe branco de alto fluxo em VSANS para maximizar a contagem de nêutrons na perda de resolução espacial5. Os carruagens dos detectores foram posicionados de modo a cobrir uma faixa de vetores de espalhamento (q), 0,005 Å-1 < q < 0,5 Å-1, correspondendo a escalas de comprimento de ≈130 nm a ≈13 nm. O vetor de espalhamento é definido como q = 4π/λ pecado (θ/2) em que λ é o comprimento de onda de nêutrons, e θ é o ângulo de espalhamento.
O dispositivo de mistura de fluxo parado usado para as medições TR-SANS consiste em várias bombas, seringas de enxágue, seringas de amostra, seletores de fluxo, bem como misturador adinâmico, célula de amostra e recipiente de amostra mista, como mostrado na Figura 1. Todos os caminhos de fluido selados estão localizados dentro de um gabinete com ar condicionado, que inclui seringas, válvulas, tubos de conexão, misturador dinâmico e células de amostra. Um ar condicionado termoelétrico programável é usado para controlar a temperatura do gabinete na faixa de 10 °C a 50 °C dentro de ±1 °C. Observe que parte do isolamento do gabinete foi removido para mostrar as partes de trabalho do dispositivo. O gabinete do dispositivo de mistura principal é posicionado em um estágio de translação na linha de luz NG3 VSANS no NCNR. A posição do compartimento é ajustada usando o estágio de translação para posicionar a célula de amostra no caminho do feixe de nêutrons (linha tracejada amarela).

Figura 1: Um exemplo de configuração para combinar medições de mistura de fluxo interrompido e espalhamento de nêutrons de pequeno ângulo na linha de luz VSANS no NIST Center for Neutron Research. A configuração contém quatro bombas de seringa, duas seringas para enxágue com solvente e duas seringas para injeção de amostra, quatro válvulas seletoras de bomba, duas válvulas seletoras de misturador, um misturador dinâmico, uma célula de quartzo de fluxo e um recipiente de amostra mista. Os nêutrons incidentes se espalham pela amostra mista localizada dentro da célula da amostra. Um gabinete isolado com janelas de quartzo e uma unidade termoelétrica de ar condicionado é usado para controlar a amostra e todos os equipamentos a uma temperatura constante. A linha tracejada amarela mostra o caminho do feixe de nêutrons. Barra de escala = 10 cm. Clique aqui para ver uma versão maior desta figura.
O dispositivo representado na Figura 1 é configurado com duas seringas de amostra, duas seringas de enxágue e uma célula de amostra. Os fluxogramas correspondentes para as diferentes etapas do protocolo estão ilustrados na Figura 2. Os volumes desejados das duas amostras diferentes são injetados no misturador e na célula da amostra (Figura 2A). Uma vez que a célula de amostra é preenchida, a válvula de comutador de entrada (ISV) e a válvula de comutador de saída (OSV) são fechadas para isolar a célula de amostra do misturador dinâmico e evitar a retrodifusão da amostra na célula durante a coleta de dados do TR-SANS (Figura 2B). Antes do misturador dinâmico, a tubulação de conexão varia em comprimento de 10 cm a 1 m e não afeta o tempo de atraso de mistura. No entanto, as conexões de tubulação entre o misturador dinâmico e a célula de amostra afetarão o tempo de atraso de mistura e o volume de injeção de amostra necessário. Tubos pré-cortados de aço inoxidável com diâmetro interno de 0,04 polegadas (1 mm) e 100 mm de comprimento são usados para conectar o misturador dinâmico, as válvulas seletoras do misturador (MSV1 e MSV2) e o ISV e OSV. Tubos fluorados com 1 mm de diâmetro interno e 115 mm de comprimento são usados para conectar o ISV e o OSV (ou a saída dinâmica do misturador) à célula da amostra. O volume total de micção que influencia o tempo de atraso de mistura inclui o volume de micção do misturador (0,15 mL), a tubulação entre a saída do misturador e a entrada da célula de amostra (0,09 mL) e o volume da célula de amostra (0,16 mL). Neste exemplo, o volume total da micção é de 0,4 mL. Os volumes de vazios internos das válvulas são insignificantes em comparação com os volumes de vazio de tubulação, misturador e célula de amostra. Por exemplo, as válvulas seletoras de baixa pressão empregadas (diâmetro do furo de 0,75 mm) contêm volumes de vazio aproximados de 4 μL, enquanto as válvulas seletoras de alta pressão e válvulas de comutação (diâmetro do furo de 0,25 mm) contêm volumes de vazio aproximados de 0,5 μL.
Após a conclusão da medição do TR-SANS, a amostra é empurrada para fora da célula com solvente, e o solvente de enxágue é bombeado repetidamente através da célula para remover a amostra residual e limpar a célula da amostra (Figura 2C). Observe que as seringas de enxágue são conectadas a reservatórios de solvente maiores (por exemplo, água e etanol) por meio de valores de seletor de bomba para garantir que volumes adequados de solvente estejam disponíveis para limpar a célula de amostra entre as execuções de medição. Fontes de solventes, fontes de amostras e recipientes de amostras mistas que contêm líquidos inflamáveis são posicionados em um compartimento separado sem equipamento elétrico para eliminar todas as possíveis fontes de ignição. Além disso, tampas de garrafas com bloqueio de vapor são usadas para minimizar vapores inflamáveis e evaporação de solventes. Finalmente, a célula da amostra é seca com uma corrente de gás nitrogênio para remover o solvente de enxágue residual (Figura 2D). A pressão de entrada do gás nitrogênio para a válvula seletora do misturador é regulada para aproximadamente 2 bar (0,2 MPa, pressão manométrica) usando um regulador de pressão manual localizado no cilindro de gás nitrogênio. Uma vez que a célula de amostra esteja suficientemente limpa e seca, uma nova amostra misturada é injetada na célula de amostra para o próximo ciclo de medição (repetindo a mistura e a injeção ilustradas no diagrama de fluxo na Figura 2A).
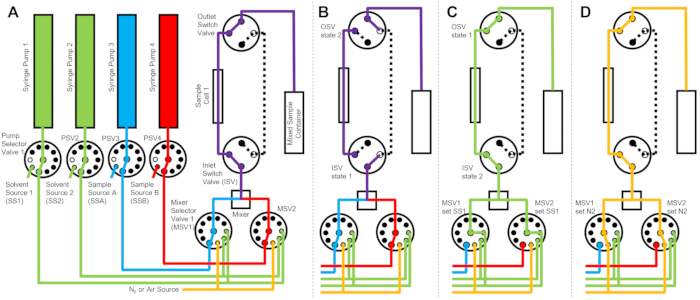
Figura 2: Exemplo de diagrama de fluxo usando uma célula de amostra, duas amostras misturando e dois solventes de enxágue para limpeza . (A) Mistura da amostra A (azul) e da amostra B (vermelho) e, em seguida, fluir a amostra mista (roxa) para a célula da amostra. (B) Durante a coleta de dados, o dispositivo de fluxo interrompido indica onde as válvulas de comutação ISV e OSV são fechadas para isolar a célula da amostra e impedir a retrodifusão da amostra durante a coleta de dados. (C) As etapas de limpeza em que a célula da amostra é lavada com solvente de enxágue de SS1 (verde) após a coleta de dados. (D) Etapa de secagem em que a célula da amostra é seca com gás nitrogênio (laranja). Abreviações: PSV = válvula seletora da bomba; MSV = válvula seletora misturadora; OSV = válvula de interruptor de saída; ISV = válvula de comutador de entrada; SS1 = fonte de solvente 1; SSA = fonte de amostra A; N2 = fonte de gás nitrogênio. Clique aqui para ver uma versão maior desta figura.
A Figura 3 mostra diagramas de fluxo para uma versão ligeiramente diferente, na qual a configuração de mistura é configurada com duas células de amostra separadas conectadas às mesmas válvulas de comutação (Figura 3A). Enquanto os dados do TR-SANS são coletados na célula de amostra 1, a célula de amostra 2 é lavada (Figura 3B) e seca (Figura 3C). Quando a coleta de dados é concluída para a Célula de Amostra 1, a Válvula do Interruptor de Entrada direciona uma amostra recém-misturada para a Célula de Amostra 2 para a coleta de dados (Figura 3D). Enquanto os dados do TR-SANS são coletados na célula de amostra 2, a célula de amostra 1 é lavada e seca (Figura 3E). Este processo alternado e paralelo entre duas células de amostra minimiza o tempo entre as injeções subsequentes da amostra e maximiza o uso do tempo do feixe de nêutrons.
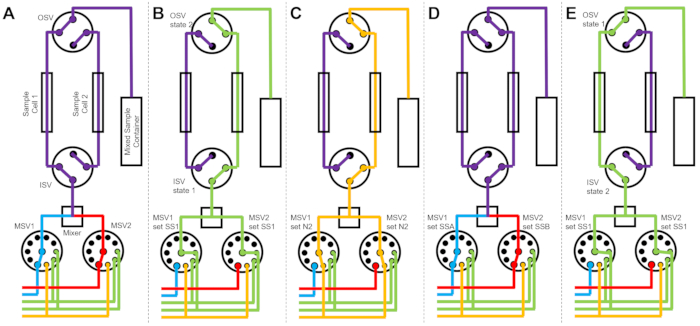
Figura 3: Exemplo de diagrama de fluxo usando duas células de amostra, duas amostras misturando e dois solventes de enxágue para limpeza. (A) Misturar a amostra A (azul) e a amostra B (vermelho) e, em seguida, fluir a amostra mista (roxa) para a célula 1 da amostra. (B) O estado do dispositivo de fluxo interrompido durante a coleta de dados na célula de amostra 1, enquanto a célula de amostra 2 é lavada com solvente de SS1 (verde). (C) O estado do dispositivo de fluxo interrompido durante a coleta de dados na célula de amostra 1, enquanto a célula de amostra 2 é seca com gás nitrogênio (laranja). (D) Uma vez concluída a coleta de dados da célula 1 da amostra, uma nova amostra (roxa) é imediatamente misturada e fluída para a célula 2 da amostra. (E) O estado do dispositivo de fluxo interrompido durante a coleta de dados na célula de amostra 2, enquanto a célula de amostra 1 é lavada com solvente de SS1 (verde). Enquanto uma célula de amostra está sendo medida, a outra célula de amostra está sendo limpa e seca. O processo de medição de fluxo interrompido alterna entre duas células de amostra para minimizar o tempo entre as injeções subsequentes de mistura de amostras. Abreviações: PSV = válvula seletora da bomba; MSV = válvula seletora misturadora; OSV = válvula de interruptor de saída; ISV = válvula de comutador de entrada; SS1 = fonte de solvente 1; SSA = fonte de amostra A; N2 = fonte de gás nitrogênio. Clique aqui para ver uma versão maior desta figura.
Um protocolo passo a passo é descrito abaixo para conectar as bombas e linhas de tubulação, preparar o sistema, enxaguar e secar a célula da amostra e injetar a amostra mista. Embora a configuração de célula única seja demonstrada pela simplicidade (Figura 2), a configuração modular flexível, o protocolo e os scripts podem ser facilmente modificados para implementar mais bombas de seringa, válvulas, misturadores ou configurações de célula de amostra, como a configuração de célula de duas amostras mostrada na Figura 3. Dados representativos da taxa bruta de contagem de nêutrons coletados ao longo dos ciclos de injeção de mistura e limpeza são mostrados na Figura 4, enquanto a cinética de troca lipídica medida em 3 temperaturas diferentes e a intensidade dispersa normalizada extraída correspondente à fração de lipídios trocados são mostrados na Figura 5 e na Figura 6, respectivamente.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Configure e inicie o sistema de fluxo interrompido.
- Ligue todas as fontes de alimentação da bomba e misturadores dinâmicos usando o interruptor de alimentação.
- Inicie todas as bombas e válvulas na interface gráfica do usuário (GUI) de controle do sistema de fluxo interrompido inserindo o caminho de configuração do dispositivo e usando os comandos bus=qmixbus. Bus(), bus.open(), bus.start(), pump=qmixpump. Pump(), pump.enable() e valve=ViciMultiposSelector() (veja exemplo de código de iniciação disponível em um repositório online de código aberto64).
- Calibre as bombas antes de colocar seringas usando o comando pump.calibrate().
- Confirme se as válvulas foram iniciadas e mova para a porta do seletor correta no comando usando o comando valve.setPort() e valve.getPort().
- Atribua o tipo de seringa a ser usado para cada bomba usando o comando pump.set_syringe_param(A, B), no qual A é o diâmetro interno do tambor da seringa (mm) e B é a distância máxima do curso do pistão da seringa (mm).
- Conecte as seringas de amostra às bombas de seringa.
- Depois de garantir que as bombas foram calibradas, rosqueie em barris de seringa limpos para a conexão na parte superior da bomba (cabeça de montagem da seringa).
- Ao usar seringas de vidro, certifique-se de que a cabeça de montagem da seringa esteja solta antes de dispensar o volume de enchimento, para que a seringa de vidro não se quebre devido à força excessiva do pistão da seringa.
- Rosqueie o pistão da seringa à conexão na parte inferior da bomba (cauda da montagem da seringa).
- Depois que o barril da seringa e o pistão da seringa estiverem conectados à bomba, distribua o volume de enchimento do tipo de seringa usando o comando pump.empty(), que move o pistão da seringa para o topo do barril da seringa.
- Ao usar seringas de vidro, aperte a cabeça de montagem da seringa depois que o movimento do pistão parar.
- Conecte a tubulação às fontes de amostra e solvente, seringas, válvulas, misturadores, células de amostra e recipiente de amostra mista.
- Conecte a tubulação da bomba de seringa às válvulas seletoras da bomba.
- Conecte a tubulação da válvula seletora da bomba às fontes de amostra.
- Conecte a tubulação da válvula seletora da bomba às fontes de solvente de enxágue.
- Conecte a tubulação da válvula seletora da bomba à tubulação da válvula seletora do misturador.
- Conecte a tubulação da válvula seletora do misturador à fonte de gás nitrogênio.
- Conecte a tubulação da válvula seletora do misturador às entradas do misturador.
- Conecte a saída do misturador à válvula do interruptor de entrada.
- Conecte a válvula do interruptor de entrada à entrada da célula de amostra.
- Conecte a saída da célula de amostra à válvula do interruptor de saída.
- Conecte a válvula do interruptor de saída ao recipiente de amostra mista.
- Defina todas as conexões de tubulação e válvula feitas (Etapa 1.7) na GUI de controle do sistema de fluxo interrompido digitando as conexões de número de porta correspondentes feitas a cada válvula (veja o código de controle de exemplo no repositório de código aberto on-line64).
- Calcular o volume vazio da tubulação entre a entrada do misturador e a saída da célula de amostra, que define a quantidade mínima de amostra necessária para preencher a célula de amostra para cada medição.
2. Carregue a amostra.
- Defina o volume de enchimento de amostra desejado e o volume de enchimento de solvente na GUI de controle do sistema de fluxo interrompido digitando os números desejados (veja o código de controle de exemplo no repositório de código aberto on-line64).
- Use o comando pump.aspirate () para puxar (aspirar) os volumes desejados de amostra e solvente de suas fontes para as seringas de amostra através das válvulas seletoras da bomba.
NOTA: Ao carregar pela primeira vez uma seringa vazia, o ar estará presente na parte superior da seringa que deve ser purgada para primer o sistema com amostra e solvente na etapa 3.
3. Prima o sistema.
- Use o comando pump.dispense() para empurrar para fora (dispensar) todo o ar de seringas, linhas de tubulação e válvulas. Certifique-se de que seja dispensado volume suficiente de líquido de cada seringa para remover completamente todo o ar das seringas, tubos e válvulas. Se as bolhas de ar estiverem visíveis dentro de qualquer tubo, continue a distribuir solvente ou amostra até que as bolhas sejam removidas.
- Uma vez que o ar tenha sido removido do sistema, execute pelo menos um procedimento de injeção e enxágue da amostra (sem dados de espalhamento de nêutrons coletados).
- Clique para selecionar a célula rotulada Iniciar experimento de mistura na GUI de controle.
- Com esta célula ativamente selecionada, clique no botão Executar (triângulo retângulo) localizado na parte superior da GUI de controle ou pressione as teclas Shift e Enter juntas no teclado.
- Inspecione visualmente a célula de amostra para confirmar se não há bolhas de ar.
- Se houver bolhas de ar, repita as etapas de protocolo 3.1 e 3.2 para purgar ainda mais o ar das linhas de tubulação.
- Se bolhas de ar não estiverem presentes na célula de amostra, prossiga para a etapa 4 para definir as etapas restantes do protocolo do experimento.
4. Defina o protocolo de mistura de fluxo interrompido no script do programa (veja o exemplo de código no repositório de código aberto online64).
- Insira o ponto de ajuste de temperatura da unidade de ar condicionado programável (CA) que controla a temperatura do gabinete isolado ao redor do dispositivo de fluxo interrompido.
- Enquanto mantém pressionado o botão estrela na unidade de controle CA, pressione as setas para cima e para baixo para alterar a temperatura do setpoint. Como alternativa, digite o setpoint de temperatura desejado na GUI de controle e clique em Executar.
- Aguarde 15-30 min para permitir que o interior do compartimento se equilibre na temperatura desejada antes de iniciar os experimentos cinéticos.
NOTA: A faixa de temperatura acessível está atualmente entre 10 °C e 50 °C, e a estabilidade de temperatura é ± 1 °C.
- Insira todas as etapas da sequência de enxágue digitando os volumes, taxas de fluxo, tempos e número de repetições apropriados na GUI de controle.
- Definir o volume de cada amostra a ser injetada, o que define a vazão total (Q).
- Defina o volume de cada solvente a ser injetado durante o procedimento de enxágue.
- Defina o tempo de secagem entre cada subetapa de enxágue (tseco).
- Defina o número de subetapas de enxágue.
- Defina os diferentes solventes para as etapas subsequentes de enxágue.
- Definir o número de repetições de enxágue a serem realizadas após cada medição (nenxágue).
- Defina o tempo para secar completamente a célula de amostra e o misturador, fornecendo uma célula de amostra limpa para a injeção subsequente da amostra (tdry_final).
- Defina todas as etapas de sequência de injeção de amostra digitando os volumes, taxas de fluxo e tempos apropriados na GUI de controle do sistema de fluxo interrompido.
- Definir o volume de cada amostra a ser injetada e a vazão.
- Calcule o tempo de atraso (t delay) a partir do volume vazio (V void) e da taxa de fluxo total (tdelay = Vvoid/Q).
Observação : O tempo de atraso é o tempo necessário para preencher a célula de amostra com a amostra mista. - Defina o tempo de aquisição desejado para os dados do TR-SANS de modo que todo o processo cinético de interesse tenha ocorrido (tscatt).
- Defina o tempo de espera entre o final do experimento de espalhamento e o início dos ciclos de enxágue (twait).
NOTA: Este tempo de espera deve ser de pelo menos 100 s se a transmissão de neutrões da amostra tiver de ser medida antes de ser enxaguada da célula. A transmissão da amostra é necessária durante o processamento de dados para reduzir os dados à intensidade absoluta. - Defina o número de ciclos de injeção a realizar com as sequências de enxágüe executadas entre cada injeção definidas na etapa 4.2 (nciclo).
- Calcule o tempo total de um único ciclo de coleta de dados de fluxo interrompido (ciclo t) usando a equação (1).
ciclo t = n× de enxágue (t atraso + tseco) + tdry_final + tatraso + tdispersão (1)
em que nenxágue = número de repetições de enxágue (passo 4.2.6); tdelay = tempo de atraso do dispositivo de fluxo parado (passo 4.3.2); tseco = tempo de secagem entre cada subetapa de enxágue (etapa 4.2.3); tdry_final = tempo para secar completamente a célula da amostra e o misturador (passo 4.2.7); tscatt = tempo de aquisição de dados TR-SANS desejado (passo 4.3.3)
5. Defina os parâmetros de espalhamento de nêutrons de ângulo pequeno na GUI de controle de instrumentos SANS.
- Determine as escalas de comprimento e a faixa q de interesse para cada amostra.
- Defina a configuração do instrumento para cobrir a faixa q de interesse desejada, maximizando o fluxo de nêutrons na amostra.
- Defina o tempo total de aquisição de dados VSANS na GUI de controle de instrumentos SANS para o tempo de ciclo calculado na etapa 4.4 (tempo de aquisição de dados de espalhamento de nêutrons =ciclo t).
- Defina o tempo de medição de transmissão da amostra para 100 s na GUI de controle de instrumentos SANS.
- Usando a GUI de controle de instrumento SANS, ative a coleta de dados no modo de evento digitando GenerateEventModeData true na linha de comando.
6. Colete medições de espalhamento padrão para redução de dados antes de iniciar o experimento de fluxo interrompido para processar os dados TR-SANS.
- Meça a dispersão de fundo.
- Verifique se o obturador do instrumento local está fechado.
- Conecte a amostra de feixe bloqueado à parte traseira da abertura da amostra, proteja o ambiente do instrumento local e abra o obturador do instrumento local.
- Defina o tempo de aquisição de dados de espalhamento de feixe bloqueado no software e colete dados de espalhamento de feixe bloqueado, contando para a mesma duração que o maior tempo de aquisição de dados de espalhamento (tscatt).
- Quando a coleta de dados estiver concluída, feche o obturador do instrumento e remova a amostra de feixe bloqueado da abertura da amostra.
- Meça a dispersão de células vazias.
- Certifique-se de que a célula de amostra foi completamente enxaguada e seca.
- Abra o obturador do instrumento local.
- Coletar a medição de transmissão de célula vazia por 100 s.
- Coletar a medida de espalhamento de células vazias, contando pelo menos o maior tempo de aquisição (tscatt).
7. Comece o experimento de fluxo interrompido.
- Inicie a coleta de dados de dispersão do VSANS no modo de evento .
- Certifique-se de que a área do instrumento local esteja segura e, em seguida, abra o obturador do feixe de instrumentos local.
- Inicie a coleta de dados SANS usando o software de controle de instrumentos SANS no computador de instrumentos, arrastando e soltando as execuções desejadas na fila de instrumentos.
NOTA: Para garantir que os primeiros pontos de tempo sejam medidos, inicie a coleta de dados antes de iniciar o experimento de mistura de fluxo interrompido. Os dados serão pós-processados em uma etapa posterior para contabilizar o tempo de atraso (tdelay).
- Inicie o experimento de mistura de fluxo interrompido na GUI de controle.
- Selecione a célula do notebook rotulada Iniciar experimento de mistura na GUI de controle do sistema de fluxo interrompido.
- Com esta célula ativamente selecionada, clique no botão Executar (triângulo retângulo) localizado na parte superior do programa de controle de dispositivo de fluxo interrompido ou pressione as teclas Shift e Enter juntas no teclado.
- Confirme se o protocolo de mistura de fluxo interrompido definido na secção 4 começou a funcionar.
- Adicione a medição de transmissão de 100 s à fila de instrumentos VSANS após a execução de dispersão usando a GUI de controle de instrumentos SANS.
- Adicione uma execução de medição de dispersão e uma execução de medição de transmissão à fila de instrumentos para cada ciclo de mistura de fluxo interrompido restante (ciclo n- 1, etapa 4.3.5) na GUI de controle de instrumentos SANS.
8. Processar e reduzir dados para remover todos os fundos, corrigir a sensibilidade do detector e corrigir a transmissão da amostra.
- Baixe os arquivos de dados de dispersão e os arquivos de eventos associados do servidor.
NOTA: Arquivos de eventos de detectores separados serão gerados após cada medição do VSANS, um arquivo de eventos para cada carro de detector ativo (por exemplo, detector frontal, médio e/ou traseiro). - Coloque os dados de dispersão para os compartimentos de tempo desejados usando o comando events=Rebin(filename) seguido pelo comando e vents.do_rebinning(timebins), no qual o nome do arquivo de entrada corresponde ao nome do arquivo de dados SANS desejado etimebins é uma lista dos limites de compartimento de tempo desejados em segundos.
NOTA: Se os timebins de entrada forem inseridos como um único número em vez de uma lista, os dados serão agrupados em N número de compartimentos com larguras de tempo iguais, onde N é o timebins de entrada (veja scripts de software fornecidos pela linha de luz e repositório de código aberto on-line disponível64). - Reduza o espalhamento binned de dados usando o software fornecido pela linha de luz65.
9. Analise os dados do TR-SANS.
- Calcular o tempo de interesse do processo (processo t) a partir dos tempos de medição usando a equação (2).
t processo = ti - tstop + tdelay (2)
Onde ti é o tempo de medição que começa depois que o fluxo é interrompido, tstop é o tempo de medição imediatamente quando o fluxo é interrompido, e tdelay é o tempo de atraso. - Plotar a intensidade dependente de q I(q) em função do tempo de processo usando os compartimentos de tempo definidos na etapa 8.2 e oprocesso t calculado na etapa 9.1.
NOTA: O tempo de processo acessível mais cedo é restrito por tdelay. Para medir os pontos de tempo de processo anteriores, aumente a taxa de fluxo total (Q) ou diminua o volume total de vazios (Vvoid). - Extrair os parâmetros cinéticos de interesse da mudança em I(q) em função do tempo de processo.
10. Termine o experimento.
- Desligue o feixe de nêutrons fechando o obturador do instrumento local.
- Execute uma verificação de radiação usando um monitor de radiação fornecido pela linha de luz antes de desconectar quaisquer peças, tubulações ou descarregar quaisquer amostras ou recipientes de amostras mistas.
- Transfira as seringas, tubos e recipientes de amostras mistas para o departamento de física da saúde.
- Preencha formulários de física da saúde e aguarde a avaliação pelo pessoal de física da saúde.
Access restricted. Please log in or start a trial to view this content.
Resultados
Os dados representativos de nêutrons aqui apresentados medem a cinética de troca lipídica na presença de metil-β-ciclodextrina (mβCD), um aditivo que catalisa a troca lipídica entre vesículas com a taxa de câmbio (ke)66,67. Estudos prévios de fluorescência mostraram que k e depende da concentração de mβCD,e a meia-vida do processo de troca é da ordem deminutos 68. Os presentes experimentos utilizam TR-S...
Access restricted. Please log in or start a trial to view this content.
Discussão
O procedimento atual descreve o dispositivo de mistura e as etapas para executar medições TR-SANS de fluxo interrompido. O dispositivo e o protocolo são otimizados para amostras líquidas de baixa viscosidade onde as escalas de tempo de interesse são de ≈1 s a 5 min. Para escalas de tempo superiores a 5 min, misturar manualmente as amostras e carregá-las em células de espalhamento padrão pode ser mais fácil e desejável, especialmente para amostras, géis ou pastas de alta viscosidade. O acesso a escalas de tem...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
O acesso ao NG3 VSANS foi fornecido pelo Center for High-Resolution Neutron Scattering, uma parceria entre o National Institute of Standards and Technology e a National Science Foundation sob o Acordo Nº DMR-2010792. M.H.L.N reconhece o financiamento fornecido pela Mitacs Globalink (Canadá). A identificação de quaisquer produtos comerciais ou nomes comerciais é para promover a compreensão e não implica endosso ou recomendação pelo Instituto Nacional de Padrões e Tecnologia.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Referências
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101(2007).
- Grillo, I. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. Borsali, R., Pecora, R. , Springer. Dordrecht. (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31(2015).
- Kline, S. 2019 NCNR Annual Report, Special Publication (NIST SP). , National Institute of Standards and Technology. Gaithersburg, MD. (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470(2021).
- van't Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948(2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349(2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227(2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142(2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874(2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) - Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101(2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591(2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667(2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302(2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. , Springer. Cham. 51(2013).
- Choi, S. -H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802(2010).
- Choi, S. -H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599(2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov. , Available from: https://github.com/usnistgov/stopped-flow-sans (2021).
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados