Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение временной эволюции наноразмерных материалов с остановленным потоком и малоугловым рассеянием нейтронов
В этой статье
Резюме
В этом протоколе представлено использование среды проб с остановленным потоком для быстрого смешивания нескольких жидких растворов in situ во время измерения малоуглового рассеяния нейтронов и для изучения кинетических процессов в нанометровых масштабах длины и во вторых временных масштабах.
Аннотация
В этой статье представлено использование среды образца малоуглового рассеяния нейтронов (SANS) с остановленным потоком для быстрого смешивания жидких образцов и изучения наноразмерных кинетических процессов в масштабах времени от секунд до минут. В среде проб с остановленным потоком используются коммерчески доступные шприцевые насосы для смешивания желаемых объемов жидких образцов, которые затем впрыскиваются через динамический смеситель в ячейку из кварцевого стекла примерно за 1 с. Сбор данных SANS с временным разрешением синхронизируется со смешиванием образца, чтобы проследить эволюцию наноструктуры в растворе после смешивания.
Чтобы максимально эффективно использовать время нейтронного пучка, мы используем серию селекторных клапанов потока для автоматической загрузки, промывки и сушки ячейки между измерениями, что позволяет многократно собирать данные во время нескольких впрысков образца. Инъекции образцов повторяют до тех пор, пока не будет собрана достаточная статистика рассеяния нейтронов. Установка смешивания может быть запрограммирована на систематическое изменение условий для измерения кинетики при различных соотношениях смешивания, концентрациях проб, концентрациях добавок и температурах. Минимальный объем образца, необходимый для одной инъекции, составляет приблизительно 150 мкл в зависимости от длины пути кварцевой ячейки.
Представлены репрезентативные результаты с использованием этой среды образца с остановленным потоком для кинетики быстрого липидного обмена в присутствии добавки, циклодекстрина. Везикулы обмениваются наружными (внешними) липидами порядка секунд и полностью обмениваются как внутренними, так и внешними липидами в течение нескольких часов. Измерение кинетики липидного обмена требует смешивания in situ для захвата более быстрых (секунды) и более медленных (минуты) процессов и извлечения констант кинетической скорости. Одна и та же среда образца также может быть использована для зондирования молекулярного обмена в других типах жидких образцов, таких как липидные наночастицы, белки, поверхностно-активные вещества, полимеры, эмульсии или неорганические наночастицы. Измерение наноразмерных структурных преобразований и кинетики взаимозаменяющихся или реагирующих систем позволит по-новому взглянуть на процессы, которые развиваются на наноуровне.
Введение
Малоугловое рассеяние нейтронов (SANS) обеспечивает уникальный способ измерения размеров, форм, взаимодействий и организации различных материалов на масштабах длин от ≈1 нм до ≈100 нм 1,2,3. Современные приборы, в том числе приборы VSANS (очень малоугловое рассеяние нейтронов) с фокусирующими зеркалами, раздвигают границы измерения еще больших масштабов длины до ≈1000 нм 4,5. В целом, уникальный контраст рассеяния, присущий методам рассеяния нейтронов, дает ряд преимуществ при измерении временной эволюции наноразмерных структур, таких как агрегация компонентов в фармацевтических препаратах6, реакции сшивания и гелеобразования в полимерных системах 7,8, мезокристаллизация мембранных белков9,10, деградация и развертывание белков11,12 и рост материалов на основе кремнезема13,14,15. Уникальный контраст рассеяния делает SANS С ВРЕМЕННЫМ РАЗРЕШЕНИЕМ (TR-SANS) полезным дополнением к другим измерениям на основе остановленного потока.
Методы смешивания с остановленным потоком часто реализуются при малоугловом рассеянии рентгеновских лучей (SAXS)16,17,18,19,20,21, флуоресцентной спектроскопии 22,23,24,25,26 и рассеянии света27,28,29,30, 31,32 эксперимента по изучению кинетических процессов на миллисекундных временных масштабах. Важное различие между SANS и SAXS заключается в том, что рассеяние нейтронов является методом неразрушающего определения характеристик, и поэтому SANS можно использовать для измерения одного и того же образца в течение нескольких часов или даже дней без повреждения образца ионизирующим излучением, что может произойти во время экспериментов по рассеянию рентгеновских лучей с более высоким потоком33. Поскольку повторные измерения SANS не изменят химическую структуру молекулы зонда или образца, эволюция времени может быть изучена, например, без эффектов фотообесцвечивания, что может усложнить измерения кинетики, основанные на флуоресценции23,24. Кроме того, SANS можно использовать для измерения высококонцентрированных и оптически непрозрачных образцов, которые часто трудно охарактеризовать с помощью методов, основанных на свете, таких как динамическое рассеяние света.
В дополнение к предоставлению структурной информации на наноуровне, SANS может быть использован для исследования локального состава этих структур через изменение контраста плотности длины рассеяния нейтронов. Плотность длины рассеяния (SLD) различных элементов случайным образом изменяется в периодической таблице и изменяется в зависимости от разных изотопов одного и того же элемента. Обычно используемым примером является водород (1H или H) и дейтерий (2H или D), которые имеют совершенно разные длины рассеяния нейтронов. Таким образом, богатые водородом материалы, такие как поверхностно-активные вещества, липиды, белки, РНК, ДНК и другие полимеры, можно отличить от дейтерированных растворителей с использованием SANS без существенного изменения физических свойств системы. Однако важно отметить, что H/D обмен может влиять на плотность, водородную связь и температуру фазового перехода в образце. Тем не менее, уникальная чувствительность SANS к материалам, богатым водородом, особенно полезна в исследованиях мягкой материи, где интересующие образцы имеют более низкий контраст рассеяния и сигнал в рентгеновских методах, таких как SAXS. Изотопное замещение также делает SANS мощным инструментом для изучения кинетики молекулярного обмена в богатых водородом материалах путем простого смешивания молекул, меченных H и D. Изотопное замещение особенно полезно в системах, где громоздкие флуоресцентные красители больше, чем интересующие молекулы поверхностно-активного вещества или липидов, и могут влиять на кинетику обмена34,35.
Измерения SANS с временным разрешением выгодны, поскольку измеренная интенсивность зависит от времени, шкалы длины и контраста SLD. Таким образом, эксперименты TR-SANS могут быть разработаны для исследования зависящих от времени изменений в пространственных распределениях и составах образцов. Эти уникальные преимущества SANS привели к важному пониманию кинетических процессов во многих системах мягких материалов, таких как поверхностно-активные вещества 36,37,38, эмульсии 39,40,41, липиды 34,42,43,44,45,46,47,48,49 ,50, и полимеры 51,52,53,54,55,56,57,58,59,60,61,62. Большинство исследований TR-SANS были сосредоточены на временных масштабах от минут до часов. Тем не менее, многие кинетические процессы, представляющие интерес, происходят на втором временном масштабе и необходимы для понимания основных механизмов. Захват этих ранних временных точек требует, чтобы растворы были быстро смешаны и измерены in situ, в котором смешивание синхронизируется со сбором данных во время рассеяния света с остановившимся потоком 27,28,29,30,31,32, флуоресценции 22,23,24,25,26 и рентгеновского излучения 16,17,18,19,20,21 экспериментов. В этой работе описывается использование среды для образцов, предназначенной для быстрого смешивания нескольких жидких образцов и впрыска смеси в ячейку из кварцевого стекла для измерений TR-SANS. Смесительное устройство является адаптацией недавно разработанного капиллярного устройства63 rheoSANS и использует несколько шприцевых насосов и клапанов для управления перемешиванием проб и автоматизации очистки клеток. Подключая шприцевые насосы к ряду клапанов селектора потока, можно многократно смешивать, измерять, промывать и сушить несколько входных потоков для облегчения измерений TR-SANS в секундной шкале времени.
Нынешняя процедура предполагает, что интересующие образцы были идентифицированы и подготовлены. Мы фокусируемся на установке смешивания in situ и методах сбора данных TR-SANS. Данные о рассеянии нейтронов были собраны на приборе VSANS в Центре нейтронных исследований NIST (NCNR); однако эта процедура должна быть применима к другим документам SANS. Читатели, заинтересованные в реализации аналогичных протоколов на других приборах SANS, должны проконсультироваться с местными учеными-приборостроителями, чтобы определить оптимальную конфигурацию прибора для максимизации потока нейтронов в желаемом масштабе длины и масштабе времени, наиболее подходящем для интересующих кинетических процессов. Представленные здесь данные были собраны с использованием конфигурации «белого луча» с высоким потоком на VSANS для максимизации количества нейтронов при потере пространственного разрешения5. Каретки детектора были расположены так, чтобы охватывать диапазон векторов рассеяния (q), 0,005 Å-1 < q < 0,5 Å-1, что соответствует масштабам длин от ≈130 нм до ≈13 нм. Вектор рассеяния определяется как q = 4π/λ sin (θ/2), где λ — длина волны нейтрона, а θ — угол рассеяния.
Устройство для смешивания с остановленным потоком, используемое для измерений TR-SANS, состоит из нескольких насосов, промывочных шприцев, шприцев для отбора проб, селекторов потока, а также адинамического смесителя, ячейки для проб и контейнера для смешанных образцов, как показано на рисунке 1. Все герметичные жидкостные тракты расположены внутри кондиционируемого корпуса, который включает в себя шприцы, клапаны, соединительные трубки, динамический смеситель и ячейки для проб. Программируемый термоэлектрический кондиционер используется для контроля температуры корпуса в диапазоне от 10 °C до 50 °C в пределах ±1 °C. Обратите внимание, что часть изоляции корпуса была удалена, чтобы показать рабочие части устройства. Корпус основного смесительного устройства расположен на ступени поступательного движения на лучевой линии NG3 VSANS в NCNR. Положение корпуса регулируется с помощью передаточного столика для позиционирования ячейки образца на пути нейтронного пучка (желтая пунктирная линия).

Рисунок 1: Пример установки для совмещения измерений смешивания остановленного потока и малоуглового рассеяния нейтронов на линии пучка VSANS в Центре нейтронных исследований NIST. Установка содержит четыре шприцевых насоса, два шприца для промывки растворителем и два шприца для впрыска пробы, четыре селекторных клапана насоса, два селекторных клапана смесителя, динамический смеситель, проточную кварцевую ячейку и контейнер для смешанных образцов. Падающие нейтроны рассеиваются от смешанного образца, находящегося внутри ячейки образца. Изолированный корпус с кварцевыми окнами и термоэлектрическим кондиционером используется для контроля образца и всего оборудования при постоянной температуре. Желтая пунктирная линия показывает траекторию пучка нейтронов. Масштабная линейка = 10 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Устройство, изображенное на фиг.1 , сконфигурировано с двумя шприцами для образцов, двумя шприцами для промывки и одной ячейкой для образца. Соответствующие блок-схемы для различных этапов протокола проиллюстрированы на рисунке 2. Желаемые объемы двух разных образцов впрыскиваются в смеситель и ячейку для образцов (рис. 2A). После заполнения ячейки для отбора проб впускной клапан (ISV) и выходной выключающий клапан (OSV) закрываются, чтобы изолировать ячейку для отбора проб от динамического смесителя и предотвратить обратную диффузию образца в ячейку во время сбора данных TR-SANS (рис. 2B). Перед динамическим смесителем соединительная трубка изменяется по длине от 10 см до 1 м и не влияет на время задержки смешивания. Однако соединения трубок между динамическим смесителем и ячейкой для отбора проб будут влиять на время задержки смешивания и требуемый объем впрыска образца. Предварительно нарезанные трубки из нержавеющей стали с внутренним диаметром 0,04 дюйма (1 мм) и длиной 100 мм используются для подключения динамического смесителя, селекторных клапанов смесителя (MSV1 и MSV2), а также независимых поставщиков программного обеспечения и OSV. Фторированная трубка с внутренним диаметром 1 мм и длиной 115 мм используется для подключения ISV и OSV (или выхода динамического смесителя) к ячейке для образцов. Общий объем пустоты, влияющий на время задержки смешивания, включает объем пустот смесителя (0,15 мл), трубку между выходным отверстием смесителя и входным отверстием ячейки для отбора проб (0,09 мл) и объем ячейки для отбора проб (0,16 мл). В этом примере общий объем пустоты составляет 0,4 мл. Внутренние объемы пустот клапанов незначительны по сравнению с объемами пустот трубок, смесителя и ячейки для образцов. Например, используемые селекторные клапаны низкого давления (диаметр отверстия 0,75 мм) содержат приблизительный объем пустот 4 мкл, в то время как селекторные клапаны высокого давления и переключающие клапаны (диаметр отверстия 0,25 мм) содержат приблизительные объемы пустот 0,5 мкл.
После завершения измерения TR-SANS образец выталкивается из ячейки с растворителем, и промывочный растворитель многократно прокачивается через ячейку для удаления остаточного образца и очистки ячейки для образца (рис. 2C). Обратите внимание, что шприцы для полоскания подключаются к большим резервуарам для растворителей (например, для воды и этанола) с помощью селектора значений насоса, чтобы обеспечить наличие достаточных объемов растворителя для очистки ячейки образца между прогонами. Источники растворителей, источники проб и емкости для смешанных образцов, содержащие легковоспламеняющиеся жидкости, размещаются в отдельном корпусе без электрооборудования для устранения всех возможных источников воспламенения. Кроме того, крышки бутылок с паровой блокировкой используются для минимизации легковоспламеняющихся паров и испарения растворителя. Наконец, ячейку для отбора проб сушат потоком газообразного азота для удаления остатков промывочного растворителя (рис. 2D). Давление газообразного азота на входе в селекторный клапан смесителя регулируется примерно до 2 бар (0,2 МПа, манометрическое давление) с помощью ручного регулятора давления, расположенного на баллоне с газообразным азотом. После того, как ячейка для отбора проб достаточно очищена и высушена, вновь смешанный образец вводится в ячейку для образца для следующего цикла измерения (повторяя смешивание и впрыск, показанные на блок-схеме на рисунке 2A).
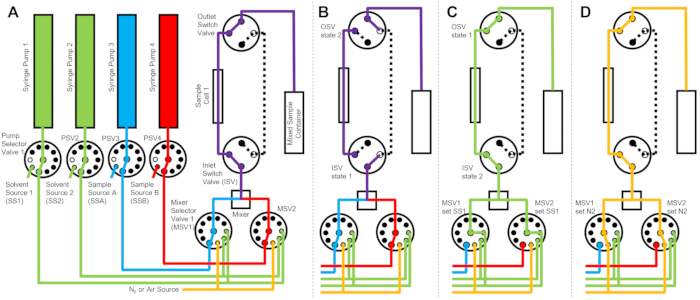
Рисунок 2: Пример блок-схемы с использованием одной ячейки для образцов, смешивания двух образцов и двух промывочных растворителей для очистки . (A) Смешивание образца A (синий) и образца B (красный), а затем подача смешанного образца (фиолетового) в ячейку для образца. (B) Во время сбора данных - состояние устройства остановки потока, при котором переключающие клапаны ISV и OSV закрыты для изоляции ячейки для отбора проб и предотвращения обратной диффузии пробы во время сбора данных. (C) Этапы очистки, на которых ячейка для отбора проб промывается промывочным растворителем SS1 (зеленый) после сбора данных. (D) Стадия сушки, на которой ячейка для отбора проб осушается газообразным азотом (оранжевый). Сокращения: ПСВ = селекторный клапан насоса; MSV = селекторный клапан смесителя; OSV = выпускной выключательный клапан; ISV = впускной выключательный клапан; SS1 = источник растворителя 1; SSA = источник пробы A; N2 = источник газообразного азота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 3 показаны блок-схемы для несколько иной версии, в которой смесительная установка сконфигурирована с двумя отдельными ячейками для отбора проб, подключенными к одним и тем же переключающим клапанам (рис. 3A). В то время как данные TR-SANS собираются в ячейке образца 1, ячейка образца 2 промывается (рис. 3B) и сушат (рис. 3C). Когда сбор данных для ячейки образца 1 завершен, клапан впускного переключателя направляет вновь смешанный образец в ячейку образца 2 для сбора данных (рис. 3D). В то время как данные TR-SANS собираются в ячейке образца 2, ячейка образца 1 промывается и сушится (рис. 3E). Этот чередующийся, параллельный процесс между двумя ячейками для образцов сводит к минимуму время между последующими инъекциями образца и максимизирует использование времени нейтронного пучка.
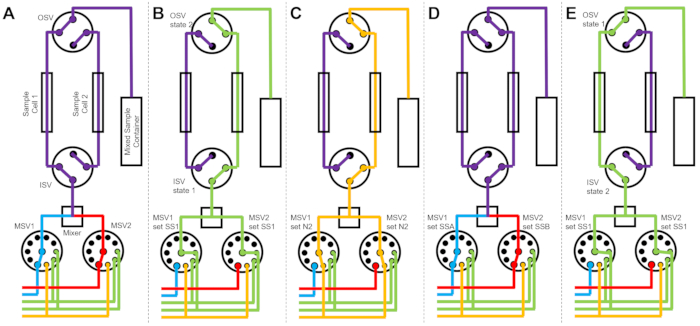
Рисунок 3: Пример блок-схемы с использованием ячеек с двумя образцами, смешивания двух образцов и двух промывочных растворителей для очистки. (A) Смешивание образца A (синий) и образца B (красный) и последующее переливание смешанного образца (фиолетового) в ячейку для образца 1. (B) Состояние устройства остановки потока во время сбора данных на ячейке 1 для отбора проб, в то время как ячейка для отбора проб 2 промывается растворителем из SS1 (зеленый). (C) Состояние устройства остановки потока во время сбора данных на ячейке 1 для отбора проб, когда ячейка 2 для отбора проб осушается газообразным азотом (оранжевый). (D) После того, как сбор данных ячейки образца 1 завершен, новый образец (фиолетовый) немедленно смешивается и подается в ячейку образца 2. (E) Состояние устройства остановки потока во время сбора данных на ячейке 2 для отбора проб во время промывки ячейки 1 для отбора проб растворителем из SS1 (зеленый цвет). В то время как одна ячейка образца измеряется, другая ячейка образца очищается и сушится. Процесс измерения остановленного потока чередуется между двумя ячейками для отбора проб, чтобы свести к минимуму время между последующими впрысками для смешивания проб. Сокращения: ПСВ = селекторный клапан насоса; MSV = селекторный клапан смесителя; OSV = выпускной выключательный клапан; ISV = впускной выключательный клапан; SS1 = источник растворителя 1; SSA = источник пробы A; N2 = источник газообразного азота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Ниже описан пошаговый протокол для подключения насосов и трубопроводов насосно-компрессорных труб, заливки системы, промывки и сушки ячейки для отбора проб и впрыска смешанного образца. Несмотря на то, что конфигурация с одной ячейкой продемонстрирована для простоты (рис. 2), гибкая модульная установка, протокол и сценарии могут быть легко изменены для реализации большего количества шприцевых насосов, клапанов, смесителей или конфигураций ячеек для образцов, таких как конфигурация ячеек с двумя образцами, показанная на рисунке 3. Репрезентативные данные о скорости подсчета необработанных нейтронов, собранные во время циклов впрыска смешивания и очистки, показаны на рисунке 4, в то время как кинетика липидного обмена, измеренная при 3 различных температурах, и извлеченная нормализованная интенсивность рассеяния, соответствующая доле обмененных липидов, показаны на рисунке 5 и рисунке 6 соответственно.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Настройте и запустите систему остановки потока.
- Включите все источники питания насоса и динамические смесители с помощью выключателя питания.
- Инициируйте все насосы и клапаны в графическом пользовательском интерфейсе (GUI) управления системой с остановленным потоком, введя путь конфигурации устройства и используя команды bus=qmixbus. Bus(), bus.open(), bus.start(), pump=qmixpump. Pump(), pump.enable() и valve=ViciMultiposSelector() (см. пример кода инициации, доступный в онлайн-репозитории с открытым исходным кодом64).
- Откалибруйте насосы перед подключением шприцев с помощью команды pump.calibrate().
- Убедитесь, что клапаны инициированы, и перейдите к правильному порту селектора по команде с помощью команд valve.setPort() и valve.getPort().
- Назначьте тип шприца, который будет использоваться для каждого насоса, используя команду pump.set_syringe_param(A , B)), где A — внутренний диаметр цилиндра шприца (мм), а B — максимальное расстояние хода шприца (мм).
- Подсоедините шприцы для образцов к шприцевым насосам.
- Убедившись, что насосы откалиброваны, прикрутите чистые цилиндры шприца к патрубку в верхней части насоса (головка крепления шприца).
- При использовании стеклянных шприцев перед дозированием объема наполнения убедитесь, что головка крепления шприца ослаблена, чтобы стеклянный шприц не разбился из-за чрезмерного усилия поршня шприца.
- Вкрутите поршень шприца в штуцер в нижней части насоса (хвост крепления шприца).
- После того, как цилиндр шприца и поршень шприца соединены с насосом, дозируйте объем наполнения шприца с помощью команды pump.empty(), которая перемещает поршень шприца в верхнюю часть ствола шприца.
- При использовании стеклянных шприцев затяните головку крепления шприца после прекращения движения поршня.
- Подсоедините трубку к источникам образцов и растворителей, шприцам, клапанам, смесителям, ячейкам для образцов и контейнеру для смешанных образцов.
- Подсоедините трубку шприцевого насоса к клапанам селектора насоса.
- Подсоедините трубку клапана селектора насоса к источникам проб.
- Подсоедините трубку селекторного клапана насоса к источникам промывочного растворителя.
- Подсоедините трубку селекторного клапана насоса к трубке селекторного клапана смесителя.
- Подсоедините трубку клапана селектора смесителя к источнику газообразного азота.
- Подсоедините трубку селекторного клапана смесителя к входным отверстиям смесителя.
- Подсоедините выходное отверстие смесителя к впускному клапану.
- Подсоедините клапан впускного переключателя к входному отверстию пробоотборника.
- Подсоедините выходное отверстие ячейки для отбора проб к выходному клапану.
- Подсоедините выпускной выключатель клапана к контейнеру для смешанных образцов.
- Определите все соединения трубок и клапанов (этап 1.7) в графическом интерфейсе управления системой остановленного потока, введя соответствующие номера портов, подключенные к каждому клапану (см. пример кода управления в онлайн-репозитории64 с открытым исходным кодом).
- Рассчитайте объем пустот трубки между входом смесителя и выходом ячейки для отбора проб, который определяет минимальное количество пробы, необходимое для заполнения ячейки для отбора проб для каждого измерения.
2. Загрузите образец.
- Установите желаемый объем заполнения образца и объем заполнения растворителем в графическом интерфейсе управления системой остановленного потока, введя желаемые числа (см. пример управляющего кода в онлайн-репозитории с открытым исходным кодом64).
- Используйте команду pump.aspirate () для втягивания (аспирации) желаемых объемов образца и растворителя из их источников в шприцы для образцов через селекторные клапаны насоса.
ПРИМЕЧАНИЕ: При первой загрузке пустого шприца в верхней части шприца будет присутствовать воздух, который необходимо продуть, чтобы заполнить систему образцом и растворителем на шаге 3.
3. Подготовьте систему.
- Используйте команду pump.dispense(), чтобы вытолкнуть (выдать) весь воздух из шприцев, трубопроводов и клапанов. Убедитесь, что из каждого шприца выливается достаточный объем жидкости, чтобы полностью удалить весь воздух из шприцев, трубок и клапанов. Если внутри какой-либо трубки видны пузырьки воздуха, продолжайте дозировать растворитель или образец до тех пор, пока пузырьки не будут удалены.
- После того, как воздух будет очищен от системы, выполните по крайней мере одну процедуру впрыска и промывки образца (без сбора данных о рассеянии нейтронов).
- Щелкните, чтобы выбрать ячейку с надписью Начать эксперимент по смешиванию в графическом интерфейсе элемента управления.
- Когда эта ячейка активно выбрана, нажмите кнопку «Выполнить » (правый треугольник), расположенную в верхней части графического интерфейса управления, или одновременно нажмите клавиши Shift и Enter на клавиатуре.
- Визуально осмотрите ячейку для образца, чтобы убедиться, что пузырьки воздуха отсутствуют.
- Если пузырьки воздуха присутствуют, повторите шаги протокола 3.1 и 3.2 для дальнейшей очистки трубопроводов от воздуха.
- Если пузырьки воздуха отсутствуют в ячейке образца, перейдите к шагу 4, чтобы определить оставшиеся шаги протокола эксперимента.
4. Определите протокол смешивания с остановленным потоком в программном сценарии (см. пример кода в онлайн-репозитории с открытым исходным кодом64).
- Введите заданное значение температуры программируемого блока кондиционирования воздуха (AC), который контролирует температуру изолированного корпуса, окружающего устройство остановки потока.
- Удерживая кнопку со звездочкой на блоке управления переменным током, нажимайте стрелки вверх и вниз , чтобы изменить заданную температуру. Кроме того, введите желаемое заданное значение температуры в графическом интерфейсе управления и нажмите «Выполнить».
- Подождите 15-30 минут, чтобы внутренняя часть корпуса уравновесилась при желаемой температуре, прежде чем начинать кинетические эксперименты.
ПРИМЕЧАНИЕ: Доступный диапазон температур в настоящее время составляет от 10 ° C до 50 ° C, а стабильность температуры составляет ± 1 ° C.
- Введите все этапы последовательности промывки, введя соответствующие объемы, скорости потока, время и количество повторений в графическом интерфейсе управления.
- Определите объем каждой впрыскиваемой пробы, который определяет общий расход (Q).
- Определите объем каждого растворителя, который будет вводиться во время процедуры промывки.
- Определите время сушки между каждым подэтапом промывки (tсушки).
- Определите количество подэтапов полоскания.
- Определите различные растворители для последующих этапов ополаскивания.
- Определите количество повторений полоскания, которые необходимо выполнять после каждого измерения (nполосканий).
- Определите время полного высыхания ячейки для отбора проб и смесителя, обеспечив чистую ячейку для последующего впрыска образца (tdry_final).
- Определите все этапы последовательности впрыска пробы, введя соответствующие объемы, скорости потока и время в графическом интерфейсе управления системой остановки потока.
- Определите объем каждой впрыскиваемой пробы и скорость потока.
- Рассчитайте время задержки (задержку t) по объему пустоты (V пустоты) и общему расходу (tзадержки = Vпустоты/Q).
ПРИМЕЧАНИЕ: Время задержки - это время, необходимое для заполнения ячейки образца смешанным образцом. - Определите желаемое время сбора данных TR-SANS таким образом, чтобы произошел весь интересующий кинетический процесс (tscatt).
- Установите время ожидания между окончанием эксперимента по рассеянию и началом циклов полоскания (tожидания).
ПРИМЕЧАНИЕ: Это время ожидания должно составлять не менее 100 с, если необходимо измерить нейтронное пропускание образца до того, как он будет вымыт из ячейки. Передача образца необходима во время обработки данных, чтобы уменьшить данные до абсолютной интенсивности. - Определите количество циклов впрыска, которые необходимо выполнить с последовательностями промывки, выполняемыми между каждым впрыском, которые определены на шаге 4.2 (nциклов).
- Рассчитайте общее время одного цикла сбора данных с остановленным потоком (t-цикл), используя уравнение (1).
Цикл t = n ×полоскания (t задержка + tсушка) + tdry_final + tзадержка + tscatt (1)
где n полосканий = количество повторенийполоскания (этап 4.2.6); tзадержка = время задержки устройства остановки потока (этап 4.3.2); tсушка = время высыхания между каждым подэтапом промывки (этап 4.2.3); tdry_final = время полного высыхания ячейки для отбора проб и смесителя (этап 4.2.7); tscatt = желаемое время сбора данных TR-SANS (этап 4.3.3)
5. Определите параметры малоуглового рассеяния нейтронов в графическом интерфейсе управления прибором SANS.
- Определите шкалы длины и интересующий q-диапазон для каждого образца.
- Определите конфигурацию прибора так, чтобы охватить желаемый диапазон добротности, максимизируя при этом поток нейтронов в образце.
- Установите общее время сбора данных VSANS в графическом интерфейсе управления прибором SANS на расчетное время цикла на шаге 4.4 (время сбора данных о рассеянии нейтронов= цикл t).
- Установите время измерения передачи образца равным 100 с в графическом интерфейсе управления прибором SANS.
- Используя графический интерфейс управления прибором SANS, включите сбор данных в режиме событий, введя GenerateEventModeData true в командной строке.
6. Соберите стандартные измерения рассеяния для уменьшения данных перед началом эксперимента с остановленным потоком для обработки данных TR-SANS.
- Измерьте фоновое рассеяние.
- Убедитесь, что шторка местного прибора закрыта.
- Прикрепите образец заблокированного луча к задней части отверстия образца, закрепите местную среду прибора и откройте затвор местного прибора.
- Определите время сбора данных о рассеянии заблокированного луча в программном обеспечении и соберите данные о рассеянии заблокированного луча, считая за ту же продолжительность, что и самое длинное время сбора данных о рассеянии (tscatt).
- После завершения сбора данных закройте затвор прибора и извлеките заблокированный образец луча из апертуры образца.
- Измерьте рассеяние пустых ячеек.
- Убедитесь, что ячейка образца была тщательно промыта и высушена.
- Откройте локальный затвор прибора.
- Соберите измерение пропускания пустой ячейки за 100 с.
- Соберите измерение рассеяния пустых ячеек, подсчитывая по крайней мере самое длинное время сбора (tscatt).
7. Начните эксперимент с остановленным потоком.
- Запустите сбор данных рассеяния VSANS в режиме событий .
- Убедитесь, что локальная область прибора надежно закреплена, а затем откройте шторку местного приборного луча.
- Начните сбор данных SANS с помощью программного обеспечения для управления прибором SANS на компьютере прибора, перетащив нужные прогоны в очередь приборов.
ПРИМЕЧАНИЕ: Чтобы убедиться, что измерены самые ранние моменты времени, начните сбор данных перед началом эксперимента по смешиванию с остановленным потоком. Данные будут подвергнуты последующей обработке на более позднем этапе, чтобы учесть время задержки (tзадержки).
- Запустите эксперимент по смешиванию с остановленным потоком в графическом интерфейсе управления.
- Выберите ячейку записной книжки с надписью " Начать эксперимент по смешиванию " в графическом интерфейсе управления системой останового потока.
- При активном выделении этой ячейки нажмите на кнопку «Выполнить » (правый треугольник), расположенную в верхней части программы управления устройством остановившегося потока, или одновременно нажмите клавиши Shift и Enter на клавиатуре.
- Убедитесь, что протокол смешивания с остановленным потоком, определенный в разделе 4, начал работать.
- Добавьте измерение передачи 100 с в очередь приборов VSANS после запуска рассеяния с помощью графического интерфейса управления прибором SANS.
- Добавьте один цикл измерения рассеяния и один цикл измерения передачи в очередь приборов для каждого оставшегося цикла смешивания с остановленным потоком (nциклов - 1, шаг 4.3.5) в графическом интерфейсе управления прибором SANS.
8. Обработайте и сократите данные, чтобы удалить все фоны, исправить чувствительность детектора и скорректировать передачу образца.
- Загрузите файлы данных рассеяния и связанные с ними файлы событий с сервера.
ПРИМЕЧАНИЕ: После каждого измерения VSANS будут генерироваться отдельные файлы событий детектора, по одному файлу событий для каждой активной каретки детектора (например, переднего, среднего и/или заднего детектора). - Поместите данные рассеяния в нужные временные ячейки с помощью команды events=Rebin(filename), за которой следует команда e vents.do_rebinning(timebins), в которой входное имя файла соответствует имени нужного файла данных SANS, аtimebins представляет собой список желаемых границ временного интервала в секундах.
ПРИМЕЧАНИЕ: Если входные временные ячейки введены в виде одного числа, а не списка, то данные будут объединены в N ячеек с равной шириной времени, где N - входные временные ячейки (см. программные сценарии, предоставляемые лучевой линией и доступным онлайн-репозиторием с открытым исходным кодом64). - Уменьшите количество бинированных данных рассеяния с помощью программного обеспечения, поставляемого с линиейлуча 65.
9. Проанализируйте данные TR-SANS.
- Рассчитайте интересующее время процесса(процесс t) из времени измерения, используя уравнение (2).
Процесс t = ti - tостановка + tзадержка (2)
Где ti — ячейки времени измерения, начинающиеся после остановки потока, tstop — время измерения сразу после остановки потока,а t задержка — время задержки. - Постройте график q-зависимой интенсивности I(q) в зависимости от времени процесса, используя временные ячейки, определенные на шаге 8.2, иt-процесс, рассчитанный на шаге 9.1.
ПРИМЕЧАНИЕ: Самое раннее доступное время процесса ограниченозадержкой t. Чтобы измерить более ранние моменты времени процесса, увеличьте общий расход (Q) или уменьшите общий объем пустот (Vпустоты). - Извлеките интересующие кинетические параметры из изменения I(q) в зависимости от времени процесса.
10. Завершите эксперимент.
- Выключите пучок нейтронов, закрыв локальный затвор прибора.
- Выполните радиационную проверку с помощью радиационного монитора, предусмотренного линией луча, прежде чем отсоединять какие-либо детали, трубки или выгружать какие-либо образцы или контейнеры для смешанных образцов.
- Передайте шприцы, трубки и контейнер для смешанных образцов в отдел физики здоровья.
- Заполните формы по физике здоровья и дождитесь оценки персоналом по физике здоровья.
Access restricted. Please log in or start a trial to view this content.
Результаты
Репрезентативные нейтронные данные, показанные здесь, измеряют кинетику липидного обмена в присутствии метил-β-циклодекстрина (mβCD), добавки, катализирующей липидный обмен между везикулами со скоростью обмена (ke)66,67. Предыдущие флуоресцентные иссл...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Текущая процедура описывает смесительное устройство и шаги для выполнения измерений TR-SANS с остановленным потоком. Устройство и протокол оптимизированы для образцов жидкостей с низкой вязкостью, где интересующие временные масштабы составляют от ≈1 с до 5 минут. Для временных масштабов...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликтов интересов, о которых можно было бы заявить.
Благодарности
Доступ к NG3 VSANS был предоставлен Центром рассеяния нейтронов высокого разрешения, партнерством между Национальным институтом стандартов и технологий и Национальным научным фондом в соответствии с соглашением No DMR-2010792. M.H.L.N выражает признательность за финансирование, предоставленное компанией Mitacs Globalink (Канада). Идентификация любых коммерческих продуктов или торговых наименований призвана способствовать пониманию и не подразумевает одобрения или рекомендации со стороны Национального института стандартов и технологий.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Ссылки
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101(2007).
- Grillo, I. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. Borsali, R., Pecora, R. , Springer. Dordrecht. (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31(2015).
- Kline, S. 2019 NCNR Annual Report, Special Publication (NIST SP). , National Institute of Standards and Technology. Gaithersburg, MD. (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470(2021).
- van't Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948(2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349(2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227(2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142(2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874(2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) - Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101(2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591(2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667(2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302(2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. , Springer. Cham. 51(2013).
- Choi, S. -H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802(2010).
- Choi, S. -H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599(2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov. , Available from: https://github.com/usnistgov/stopped-flow-sans (2021).
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111(2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены