Method Article
Transeção da Medula Espinhal em Xenopus laevis Tadpoles
Neste Artigo
Resumo
A transeção da medula espinhal xenopus laevis é um método de lesão relevante para estudar lesão medular e regeneração, fazendo um corte transversal que corta completamente a medula espinhal no nível torácico.
Resumo
A lesão medular (SCI) é uma aflição permanente, que afeta os nervos motores e sensoriais do sistema nervoso central (SNC), resultando em paralisia sob o local da lesão. Até o momento, não há terapia de recuperação funcional para SCI, e há falta de clareza em relação aos muitos complexos e eventos dinâmicos que ocorrem após o SCI. Muitos organismos não-mamíferos podem se regenerar após sci severo, como peixes teleost, anfíbios urodele, e estágios larvais de anurianos anfíbios, incluindo girinos xenopus laevis . Estes são organismos modelo de boa fé para estudar e entender a resposta ao SCI e os mecanismos subjacentes a processos regenerativos bem sucedidos. Esse tipo de pesquisa pode levar à identificação de potenciais alvos para intervenção terapêutica sci. Este artigo descreve como realizar a transeção medular do girino Xenopus laevis , incluindo criação, cirurgia, pós-cirurgia e avaliação de testes funcionais. Este método de lesão pode ser aplicado para elucidar os diferentes passos da regeneração da medula espinhal, estudando os mecanismos celulares, moleculares e genéticos, bem como a evolução histológica e funcional após a SCI e durante a regeneração da medula espinhal.
Introdução
A lesão medular (SCI) é uma aflição que afeta aproximadamente 250.000-500.000 pessoas em todo o mundo a cada ano1. Além dessa alta prevalência, a SCI afeta nervos sensoriais e motores, gerando paralisia sob o local da lesão e desconexão de alguns órgãos internos do controle do SNC. A medula espinhal, parte do CNS, não consegue se regenerar, e devido à complexidade da aflição e à falta de compreensão completa de todos os processos envolvidos, ainda não há terapias eficientes que permitam a recuperação funcional.
Organismos não mamíferos, como peixes teleost, anfíbios urodeles e estágios larvais de anfíbios anureanos, que podem regenerar a medula espinhal após sci2,3,4 severos, são excelentes organismos modelo para estudar os processos que regem um evento regenerativo bem sucedido e entender a falha da regeneração de mamíferos. Esse entendimento é de grande interesse, pois poderia fornecer insights originais para desenvolver novos alvos terapêuticos e possíveis terapias para o SCI.
O sapo anuran, Xenopus laevis, é um excelente organismo modelo para estudar SCI. Possui excelentes capacidades regenerativas durante os estágios do girino, que são progressivamente perdidos durante a metamorfose, permitindo a experimentação nas etapas regenerativa e não regerativa3,5. O método de lesão estabelecido para estudar SCI em girinos xenopus laevis consiste em amputação da cauda, onde toda a cauda é removida, incluindo tecidos como músculo, notocord e medula espinhal6. Essa abordagem tem sido fundamental na compreensão de mecanismos gerais de processos regenerativos4,7,8,9,10.
Como a amputação da cauda envolve múltiplos tecidos, além da medula espinhal, o que é diferente do que acontece após o SCI humano, é necessário um paradigma de lesão mais relevante para o estudo da SCI. Baseamos-nos em estudos utilizados no passado11 para gerar descrições abrangentes de paradigmas de lesões5,12,13,14 e diferentes métodos para o estudo de SCI12,13,14,15,16,17,18 . Após a transeção da medula espinhal, a porção caudal da medula espinhal pode ser isolada para RNA e expressão proteica e análises de alto rendimento14,19,20,21. Além disso, injeções intracelomicas de drogas e pequenas moléculas, bem como eletroporação de cDNA, RNA ou morfolnos, antes ou depois da transeção medular, permitem o estudo dos efeitos dessas moléculas na prevenção ou tratamento de SCI ou de eventos específicos ocorridos após a regeneração da medula espinhal13,14 . Além disso, a evolução das lesões e os processos regenerativos podem ser estudados em diferentes tempos após lesões utilizando abordagens bioquímicas, moleculares, histológicas e funcionais12,13,14,17,19,20,21,22,23.
Por fim, todas as técnicas acima mencionadas podem ser utilizadas em estágios não regenerativos, destacando uma das vantagens mais importantes do uso do Xenopus laevis como organismo modelo para estudar SCI, os estudos comparativos de mecanismos regenerativos e não regenerativos na mesma espécie13,19,20,21,22. Este artigo apresenta um protocolo para a transeção medular do girino Xenopus laevis, começando com a encenação e seleção de girinos regenerativos nieuwkoop e faber (NF). Isso é seguido pela descrição dos procedimentos para cirurgia medular para produzir animais falsos e transeccionados, cuidados pós-cirúrgicos e, finalmente, a análise da recuperação funcional pela medição da distância livre de natação do girino.
Protocolo
Este protocolo fornece informações suficientes para realizar com sucesso a transeção da medula espinhal. Note-se que existem excelentes protocolos detalhados dessas técnicas publicadas em outros lugares14, que podem complementar a apresentada aqui. Todos os procedimentos animais foram aprovados pela Comissão de Bioética e Biossegurança da Faculdade de Ciências Biológicas da Pontifícia Universidad Católica de Chile.
1. Acasalamento natural de sapos
- Três a cinco dias antes do acasalamento, subcutâneamente pré-injetou sapos machos e fêmeas com 50 unidades de gonadotropina coriônica humana (hCG). Use a técnica "garra de ferro" para conter os sapos; como os sapos são escorregadios, use uma rede para cercar o sapo, se necessário. Insira a ponta de uma agulha de 26 G x 1/2" posterior à linha lateral, empurrando-a dorsalmente para uma profundidade de 1 cm, entre a pele e o músculo.
- Antes do acasalamento, injete o macho com 300 unidades e a fêmea com 700 unidades de hCG.
- Para que o acasalamento ocorra, coloque o macho e a fêmea em 2 L de 0,1x solução Barth imediatamente após esfriar a solução a 4 °C por 15 min para se assemelhar às condições da mola e deixe durante a noite a 18 °C.
- Dezesseis horas depois, recolhe cuidadosamente os embriões com a ajuda de uma pipeta pasteur de plástico, com a ponta cortada, e coloque-os em placas de Petri de 10 cm de diâmetro. Remova a camada de geleia embrionária incubando os embriões com 25 mL de 2% de cisteína em água destilada (pH 7.8; garanta que a solução cubra os embriões) por 5 minutos com leve agitação. Lave 3 vezes com água destilada e 3 vezes com solução 0.1x Barth (8,9 mM NaCl; 102 μM KCl; 238,1 μM NaHCO3; 1 mM 4-(2- hidroxitil)-1-piperazina ácido etanoessulfônico (HEPES); 81,14 μM MgSO4; 33,88 μM Ca(NO3)2; 40,81 μM CaCl2, pH 7.6).
- Selecione embriões saudáveis que tenham uma cor acastanhada e blastomeres simetricamente divisórias. Coloque os embriões em placas de Petri de 10 cm de diâmetro com 50 mL de solução 0,1x Barth a uma densidade de no máximo 100 embriões por prato.
2. Pecuária
- Durante a primeira semana, mantenha os embriões a 18 °C até que saiam do saco de vitelino. Durante este tempo, mude a solução Barth todos os dias, e remova embriões mortos esbranquiçadas e girinos apresentando qualquer alteração anatômica visível ou girinos sem qualquer movimento de natação.
- Após a primeira semana, transfira girinos para água sem cloro em tanques plásticos a uma densidade de 10 animais por litro. Cresça girinos a 20-21 °C com um ciclo escuro de luz/12 h de 12 h, com pedras de oxigênio disponíveis em cada tanque para aerar a água e alimentado uma vez por dia com 0,5 mg por animal. Substitua a água uma vez por semana e verifique se há resíduos acumulados e animais mortos diariamente24.
3. Encenação
- Três a quatro semanas após a fertilização, coloque os animais em uma placa de Petri; então, um por um, verifique a morfologia e aparência de membros dianteiros e desamarbios traseiros. Se necessário, anestesia os animais colocando os animais em uma placa de Petri com 50 mL de 0,02% de mesilato de tricina em solução 0,1x Barth para melhor manipulação. Depois de não mais de 2 minutos, coloque os animais em solução 0.1x Barth para recuperação da anestesia.
- Procure as seguintes características anatômicas do estágio 50 animais25: membros dianteiros que estão apenas aparecendo e são esféricos (Figura 1); hindlimbs que são salientes e são esféricos (Figura 1).
NOTA: Podem ser utilizados animais das etapas 49 a 51 para este procedimento (Figura 1); para obter mais informações sobre os estágios, consulte Nieuwkoop e Faber's Normal Table of Xenopus laevis25.
4. Cirurgia: transeção da medula espinhal e animais operados por vergonha
- Anestesize estágio 50 girinos colocando-os em uma placa de Petri com 50 mL de 0,02% de mesílato de tricaine em 0,1x solução barth por 2 min.
- Com a ajuda de uma colher de sopa e fórceps, coloque o girino, dorsal side-up, em um pedaço molhado de gaze na metade superior de uma placa de petri de vidro.
- Realize uma incisão da pele e músculos dorsais no nível meio torácico (Figura 2A, B) usando tesoura de mola de microdisseção.
- Para controlar animais falsos, certifique-se de que o tamanho da incisão é de apenas ~0,2 mm (Figura 2C); não danifique a medula espinhal (Figura 2D,D').
- Para animais transectados, realize uma segunda incisão de ~0,2 mm (Figura 2C) para transectar totalmente a medula espinhal (Figura 2E,E').
5. Cuidados pós-cirurgia
- Após a cirurgia, transfira os girinos para um tanque contendo 0,5 L de solução 0,1x Barth com 1x Penicillin-estreptomicina, a uma densidade de 10-12 animais por tanque. Mantenha os animais transectos e controle em tanques separados.
NOTA: Girinos se recuperarão da anestesia em alguns minutos. - Mantenha os girinos com aeração a uma temperatura de 20-21 °C.
- Mude a solução Barth com antibióticos a cada dois dias até o final do experimento.
- Comece a alimentar os animais um dia após a cirurgia, uma vez por dia.
- Eliminar animais mortos.
6. Ensaio de natação
- Obtenha uma caixa com iluminação LED por dentro, coberta com uma folha transparente de poliestireno, que permite que a luz passe.
- Instale uma câmera sobre a caixa led.
- Coloque uma placa de Petri de 15 cm de diâmetro em cima da caixa, recheada com 100 mL de solução barth de 0,1x.
- Um dia após a transeção, coloque um girino na placa de Petri e deixe por um período de adaptação de 5 minutos.
- Após a adaptação, inicie o rastreamento de vídeo do comportamento de natação livre usando o software referenciado (veja a Tabela de Materiais) por 5 minutos.
- Depois que o vídeo for concluído, transfira o girino de volta para o tanque.
- Repita o vídeo de rastreamento 5, 10, 15 e 20 dias após a transção (Figura 3).
7. Considerações bioéticas
NOTA: A mortalidade de animais após cirurgia e transeção é de 13% e 30%, respectivamente. Além disso, é necessário um mínimo de 15-20 animais por grupo para análise estatística. Portanto, comece com 23 animais falsos e 26 transeccionados.
- Anestesiar os animais com 0,02% de mesilato de tricaine por 2 minutos para garantir a redução da atividade neuronal e motora e dor antes da cirurgia.
- Após a cirurgia, verifique se os animais se recuperam da anestesia. Além disso, alimente e verifique os animais diariamente.
- Após terminar o ensaio de natação, sacrifique os animais com uma overdose de mesilato tricaine (1% de mesílato tricaine preparado em solução de bicarbonato de sódio de 30 mM).
Resultados
O protocolo aqui descrito permite o estudo da regeneração da medula espinhal em Xenopus laevis. Os efeitos de tratamentos farmacológicos específicos e a contribuição de expressão genética específica na regeneração da medula espinhal podem ser avaliados medindo seus efeitos na recuperação da natação. A distância total de natação é traçada contra os dias após a lesão para comparar o controle e os animais tratados em um ponto de tempo específico ou durante um período especificado. A recuperação da função motora através do tempo é exemplificada na Figura 3, mostrando a distância de natação em 5, 10, 15 e 20 dias após a transeção. Em 5 dias após a transeção, os animais nadaram em média 0,7 m em 5 min, mostrando uma capacidade reduzida de natação. Essa capacidade aumentou com os dias de passagem, uma vez que foi observada uma média de 2,1 e 3,1 m/5 min após 10 e 15 dias após a transeção, respectivamente, e a recuperação completa das capacidades de natação foi observada em 20 dias após a transeção, com média de 5,7 m/5 min.
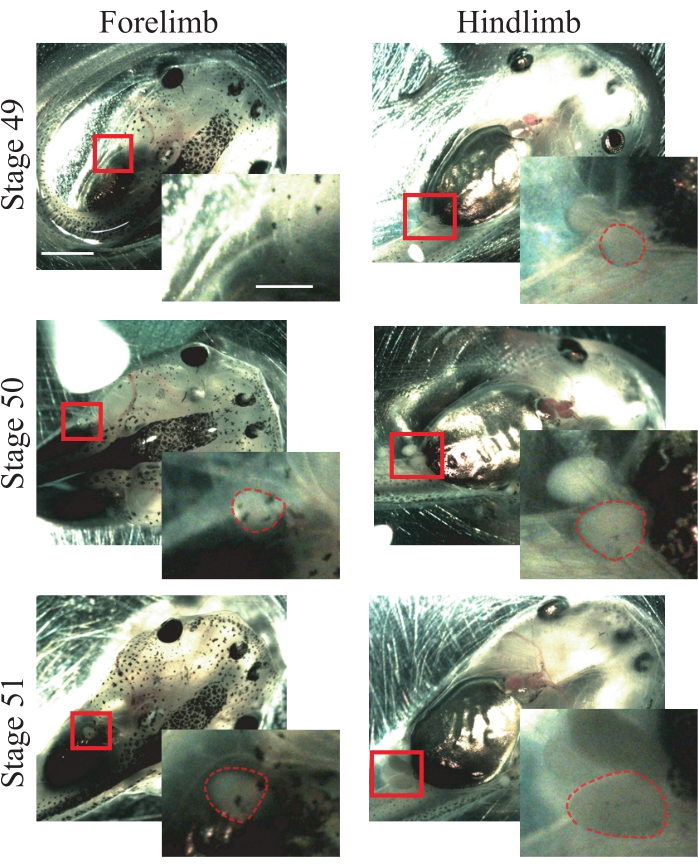
Figura 1: Fase do girino xenopus. Imagens representativas das etapas 49-51, mostrando preliminares e retrocessos para referência de encenação animal. Barras de escala = 2 mm. As ampliações da região encaixotada são mostradas no baixo-direito de cada imagem. Barras de escala = 1 mm. No estágio 49, os membros dianteiros não são observados, enquanto os obstáculos estão apenas aparecendo, mostrando uma forma esférica. O estágio 50 apresenta membros dianteiros que estão apenas aparecendo, mostrando uma forma esférica e hindlimbs salientes com uma forma esférica. No estágio 51, os membros dianteiros apresentam uma forma esférica saliente e as subidas traseiras em uma forma alongada salientes. Contornos tracejados mostram preliminares e barras traseiras. Clique aqui para ver uma versão maior desta figura.
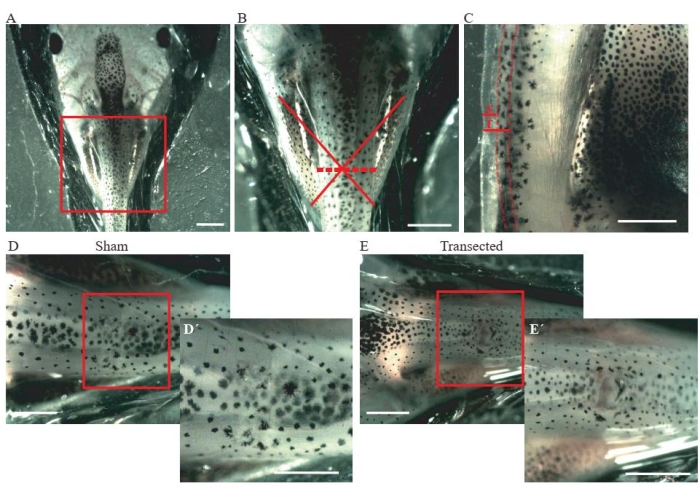
Figura 2: Transeção da medula espinhal. (A) Imagem representativa mostrando o posicionamento correto do animal, lado dorsal para cima, para a realização da cirurgia. Barra de escala = 2 mm. (B) A ampliação de A mostra a localização e extensão da lesão. A cruz vermelha mostra a localização exata do local da lesão no nível torácico da medula espinhal, e a linha tracejada mostra a extensão da lesão. Barra de escala = 1 mm. (C) Imagem representativa mostrando uma visão lateral do nível torácico da medula espinhal. A extensão da incisão falsa e da transeção são mostradas. Linhas tracejadas delineiam os limites da medula espinhal. Barra de escala = 1 mm. (D) Imagem representativa mostrando um animal falso com uma medula espinhal intacta. Barras de escala = 1 mm. (E) Imagem representativa mostrando um animal transcectado com uma medula espinhal interrompida. Barras de escala = 1 mm. As ampliações da região encaixotada são mostradas no baixo-direito de cada imagem (D' e E'). Barras de escala = 1 mm. Abreviaturas: S = incisão falsa; T = transeção. Clique aqui para ver uma versão maior desta figura.
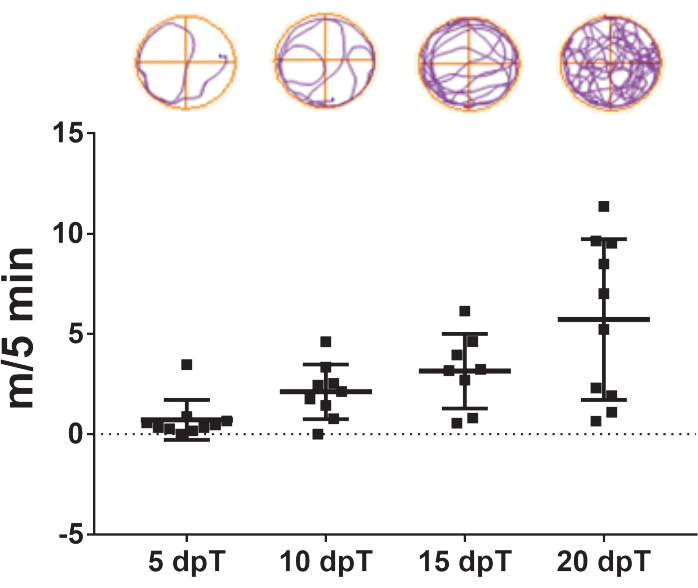
Figura 3: Recuperação da função de natação ao longo do tempo. Parcela representativa da distância de natação coberta por animais transectados em 5 minutos às 5, 10, 15 e 20 dias pós transeção. Amostras de trajetórias de natação são mostradas no topo. Dados apresentados como média ± SEM de 10 girinos. Abreviaturas: dpT = dias pós transeção; SEM = erro padrão da média. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo aqui descrito é um excelente método para realizar SCI e avaliar a recuperação funcional. Para a reprodutibilidade, é essencial cultivar girinos saudáveis e escolher animais de tamanho semelhantes. A falta de alimentação adequada gera estresse de nutrientes, o que resulta em baixas capacidades regenerativas26; portanto, deve-se prestar atenção especial à alimentação do girino. À medida que os girinos atingem o estágio 50 após 3-4 semanas, eles podem ser criados a temperaturas mais altas para acelerar o processo de crescimento, sendo 18-25 °C ótimo27. A qualidade da água é importante, pois os animais são sensíveis às condições da água e produtos químicos. As condições ideais de água incluem o uso de água filtrada por carbono, sem cloro, com os seguintes parâmetros: pH (6,5-7,5), cloreto (<0,02 mg/L), condutividade da água (1,0 mS/cm ± 0,1 unidades), cobre (<0,3 mg/L); dureza carbonato (KH: 5-10 dKH); dureza geral (GH: 6-16 dGH); nitrato (NO3: <20 mg/L); e nitrito (NO2: <0,1 mg/L)14,27,28. Além disso, para evitar contaminação, os tanques plásticos devem ser limpos uma vez por semana para a criação de animais ou a cada dois dias após a cirurgia, lavando-se bem com água sem cloreto e uma esponja; detergente deve ser evitado.
Para uma melhor taxa de sobrevivência após a cirurgia, os girinos não devem ser expostos à anestesia por longos períodos (não mais do que 2 minutos). Além disso, recomenda-se anestesiar um girino de cada vez. Como os animais precisam se manter hidratados, mantenha os animais imersos em solução o tempo todo antes e depois da cirurgia, e despeje a solução com uma colher em cima do girino antes de começar a cirurgia. Certifique-se de que o dano é extenso o suficiente para cobrir toda a medula espinhal, mas não muito extensa, pois pode induzir má recuperação funcional ou morte. Se o notochord for danificado, o animal será dobrado, e a recuperação funcional será afetada. Se o dano se estender além do notochord, a probabilidade de morte aumenta14. Durante o ensaio de natação, a gravação é considerada correta se o software identificar cada animal com uma sombra azul; caso contrário, a gravação deve ser repetida. É importante evitar mudanças de movimento e ar ou luz durante o processo de gravação para evitar erros de gravação.
Ainda há muitas questões abertas sobre os mecanismos celulares e moleculares subjacentes aos danos e regeneração da medula espinhal. O protocolo descrito neste trabalho pode ser utilizado para estudar a contribuição de diferentes eventos celulares, expressão genética e tratamentos na recuperação funcional, determinados pela medição das capacidades de natação. Além disso, muitas outras técnicas podem ser aplicadas aos animais operados. A medula espinhal pode ser isolada para realizar extração de proteína e/ou mRNA14 para estudar perfis de proteína e expressão genética após danos e tratamento19,20. Esta cirurgia também tem sido a base para o estudo da resposta celular da medula espinhal22 e o comportamento das células progenitoras tronco neural12,13,22 após lesão medular. As cascatas de sinalização envolvidas na regeneração da medula espinhal também foram estudadas usando o paradigma de dano da medula espinhal descrito aqui23. Em resumo, o protocolo aqui descrito é um excelente modelo para estudar lesão e regeneração da medula espinhal e tem sido utilizado para muitos estudos que contribuíram para o conhecimento existente sobre o assunto.
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Este trabalho foi financiado por bolsas de pesquisa de: PG Slater: FONDECYT N° 3190820; J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Materiais
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Referências
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados