Method Article
Трансекция спинного мозга у головастиков Xenopus laevis
В этой статье
Резюме
Xenopus laevis tadpole перетекания спинного мозга является соответствующим методом травмирования для изучения повреждения и регенерации спинного мозга путем поперечного разреза, который полностью разрывает спинной мозг на грудном уровне.
Аннотация
Травма спинного мозга (ТСМ) является постоянным заболеванием, которое влияет на двигательные и сенсорные нервы центральной нервной системы (ЦНС), что приводит к параличу под местом травмы. На сегодняшний день не существует функциональной восстановительной терапии при ТСМ, и отсутствует ясность в отношении многих комплексов и динамических событий, происходящих после ТСМ. Многие немлекопитающие организмы могут регенерировать после тяжелой ТСМ, такие как телеостные рыбы, амфибии уроделе и личиночные стадии амфибий анурана, включая головастиков Xenopus laevis . Это настоящие модельные организмы для изучения и понимания реакции на ТСМ и механизмов, лежащих в основе успешных регенеративных процессов. Этот тип исследований может привести к выявлению потенциальных целей для терапевтического вмешательства ТСМ. В этой статье описывается, как выполнять трансекцию спинного мозга головастиков Xenopus laevis , включая животноводство, хирургию, послеоперационный уход и оценку функционального теста. Этот метод травмирования может быть применен для выяснения различных этапов регенерации спинного мозга путем изучения клеточных, молекулярных и генетических механизмов, а также гистологической и функциональной эволюции после ТСМ и во время регенерации спинного мозга.
Введение
Травма спинного мозга (ТСМ) - это заболевание, которое ежегодно поражает примерно 250 000-500 000 человек во всем мире1. В дополнение к этой высокой распространенности, ТСМ влияет на сенсорные и двигательные нервы, вызывая паралич под местом повреждения и отключение некоторых внутренних органов от контроля ЦНС. Спинной мозг, входящий в состав ЦНС, не может регенерировать, и из-за сложности недуга и отсутствия полного понимания всех вовлеченных процессов до сих пор нет эффективных методов лечения, позволяющих функционально восстановиться.
Немлекопитающие организмы, такие как телеостные рыбы, амфибии уроделе и личиночные стадии амфибий анурана, которые могут регенерировать спинной мозг после тяжелой ТСМ2,3,4, являются отличными модельными организмами для изучения процессов, которые управляют успешным регенеративным событием и понимания неудачи регенерации млекопитающих. Это понимание представляет большой интерес, поскольку оно может дать оригинальную информацию для разработки новых терапевтических целей и возможных методов лечения ТСМ.
Анурановая лягушка, Xenopus laevis, является отличным модельным организмом для изучения ТСМ. Обладает отличными регенеративными способностями на стадиях головастиков, которые постепенно теряются во время метаморфоз, что позволяет экспериментировать на регенеративной и нерегенеративной стадиях3,5. Установленный метод травмирования для изучения ТСМ у головастиков Xenopus laevis состоит из ампутации хвоста, при которой удаляется весь хвост, включая такие ткани, как мышцы, нотохорда и спинной мозг6. Этот подход сыграл важную роль в понимании общих механизмов регенеративных процессов4,7,8,9,10.
Поскольку ампутация хвоста включает в себя несколько тканей в дополнение к спинному мозгу, что отличается от того, что происходит после ТСМ человека, для изучения ТСМ необходима более актуальная парадигма травмы. Мы опирались на исследования, использованные в прошлом11 для получения исчерпывающих описаний парадигм травм5,12,13,14 и различных методов изучения SCI12,13,14,15,16,17,18 . После трансекции спинного мозга каудальная часть спинного мозга может быть выделена для экспрессии РНК и белка и высокопроизводительных анализов14,19,20,21. Кроме того, интрацеломные инъекции лекарств и малых молекул, а также электропорация кДНК, РНК или морфолино до или после трансекции спинного мозга позволяют изучать влияние этих молекул на профилактику или лечение ТСМ или конкретных событий, происходящих после ТСМ и регенерации спинного мозга13,14 . Кроме того, эволюция травм и регенеративные процессы могут быть изучены в разное время после травмы с использованием биохимического, молекулярного, гистологического и функционального подходов12,13,14,17,19,20,21,22,23.
Наконец, все вышеупомянутые методики могут быть использованы на нерегенеративных стадиях, подчеркивая одно из важнейших преимуществ использования Xenopus laevis в качестве модельного организма для изучения ТСМ, сравнительных исследований регенеративных и нерегенеративных механизмов у одних и тех же видов13,19,20,21,22. В данной работе представлен протокол трансекции спинного мозга головастиков Xenopus laevis, начиная со стадии и отбора регенеративных головастиков Nieuwkoop и Faber (NF) стадии 50. Далее следует описание процедур хирургии спинного мозга для получения фиктивных и трансективных животных, послеоперационный уход и, наконец, анализ функционального восстановления путем измерения расстояния плавания свободного головастика.
протокол
Этот протокол предоставляет достаточно информации для успешного выполнения трансекции спинного мозга. Следует отметить, что существуют отличные подробные протоколы этих методов, опубликованные в другом месте14, которые могут дополнить представленный здесь. Все процедуры для животных были одобрены Комитетом по биоэтике и биобезопасности факультета биологических наук Папского католического университета Чили.
1. Естественное спаривание лягушек
- За три-пять дней до спаривания подкожно предустанавливают самцов и самок лягушек с 50 единицами хорионического гонадотропина человека (ХГЧ). Используйте технику «железного когтя» для сдерживания лягушек; поскольку лягушки скользкие, используйте сеть, чтобы окружить лягушку, если это необходимо. Вставьте кончик иглы размером 26 G x 1/2" сзади к боковой линии, протолкнув ее дорсально на глубину 1 см, между кожей и мышцей.
- Перед спариванием вводите самцу 300 единиц, а самке 700 единиц ХГЧ.
- Для спаривания поместите самца и самку в 2 л раствора 0,1x Барта сразу после охлаждения раствора при 4 °C в течение 15 мин, чтобы они напоминали весенние условия, и оставьте на ночь при 18 °C.
- Шестнадцать часов спустя тщательно соберите эмбрионы с помощью пластиковой пипетки Пастера, отрезав наконечник, и поместите их в чашки Петри диаметром 10 см. Удаляют оболочку эмбрионального желе путем инкубации эмбрионов с 25 мл 2% цистеина в дистиллированной воде (рН 7,8; убедитесь, что раствор покрывает эмбрионы) в течение 5 мин с легким перемешиванием. Промыть 3 раза дистиллированной водой и 3 раза раствором Барта (8,9 мМ NaCl; 102 мкМ KCl; 238,1 мкМ NaHCO3; 1 мМ 4-(2-гидроксиэтил)-1-пиперазин этанесульфоновая кислота (HEPES); 81,14 мкМ MgSO4; 33,88 мкМ Ca(NO3)2; 40,81 мкМ CaCl2, рН 7,6).
- Отбирают здоровые эмбрионы, имеющие коричневатый цвет и симметрично делящиеся бластомеры. Поместите эмбрионы в чашки Петри диаметром 10 см с 50 мл раствора 0,1x Барта при плотности не более 100 эмбрионов на чашку.
2. Животноводство
- В течение первой недели поддерживайте эмбрионы при температуре 18 °C, пока они не выйдут из вителлинового мешка. В течение этого времени меняйте раствор Барта каждый день и удаляйте беловатые мертвые эмбрионы и головастиков, представляющих любые видимые анатомические изменения или головастики без каких-либо плавательных движений.
- После первой недели переносите головастиков в бесхлорную воду в пластиковых емкостях плотностью 10 животных на литр. Выращивайте головастиков при 20-21 °C с 12-часовым световым / 12-часовым темным циклом, с кислородными камнями, доступными в каждом резервуаре для аэрации воды и скармливаемым один раз в день по 0,5 мг на животное. Заменяйте воду раз в неделю и ежедневно проверяйте наличие накопленных отходов и мертвых животных24.
3. Постановка
- Через три-четыре недели после оплодотворения поместите животных в чашку Петри; затем, один за другим, проверяйте морфологию и внешний вид передних и задних конечностей. При необходимости обезболивают животных, помещая животных в чашку Петри с 50 мл 0,02% трицина мезилата в растворе 0,1x Барта для лучшей манипуляции. Через не более 2 мин поместите животных в 0,1x раствор Барта для восстановления после анестезии.
- Обратите внимание на следующие анатомические характеристики животных 50 стадии25: передние конечности, которые только появляются и являются сферическими (рисунок 1); задние конечности, выступающие и сферические (рисунок 1).
ПРИМЕЧАНИЕ: Для этой процедуры могут быть использованы животные с 49 по 51 стадию (рисунок 1); Для получения дополнительной информации о стадиях обратитесь к Nieuwkoop и Faber's Normal Table of Xenopus laevis25.
4. Хирургия: трансекция спинного мозга и фиктивные прооперированные животные
- Обезболивают головастиков стадии 50, помещая их в чашку Петри с 50 мл 0,02% трицина мезилата в 0,1x растворе Барта в течение 2 мин.
- С помощью столовой ложки и щипцов поместите головастика спинной стороной вверх на влажный кусок марли в верхней половине стеклянной чашки Петри.
- Выполните разрез кожи и спинных мышц на средне-грудном уровне (рисунок 2А, В) с помощью пружинных ножниц микродиссекции.
- Для контрольных фиктивных животных убедитесь, что размер разреза составляет всего ~0,2 мм (рисунок 2C); не повреждают спинной мозг (рисунок 2D,D').
- Для трансецированных животных выполняют второй разрез ~0,2 мм (рисунок 2C), чтобы полностью трансектировать спинной мозг (рисунок 2E, E').
5. Послеоперационный уход
- После операции переложите головастиков в резервуар, содержащий 0,5 л 0,1x раствора Барта с 1x Пенициллин-стрептомицином, при плотности 10-12 животных на резервуар. Поддерживайте трансективных и контролируйте фиктивных животных в отдельных резервуарах.
ПРИМЕЧАНИЕ: Головастики восстановятся после анестезии через пару минут. - Поддерживать головастиков с аэрацией при температуре 20-21 °C.
- Меняйте раствор Барта антибиотиками через день до конца эксперимента.
- Начните кормить животных через день после операции, один раз в день.
- Уничтожайте мертвых животных.
6. Плавательный анализ
- Получите коробку со светодиодной подсветкой изнутри, покрытую прозрачным полистирольным листом, который пропускает свет.
- Установите камеру над светодиодным блоком.
- Поместите чашку Петри диаметром 15 см поверх коробки, заполненную 100 мл раствора 0,1x Барта.
- Однажды после трансекции поместите головастика в чашку Петри и оставьте на 5-минутный адаптационный период.
- После адаптации начните видеоотслеживание поведения свободного плавания с помощью указанного программного обеспечения (см. Таблицу материалов) в течение 5 минут.
- После того, как видео будет завершено, перенесите головастика обратно в его резервуар.
- Повторите отслеживание видео через 5, 10, 15 и 20 дней после трансекции (рисунок 3).
7. Биоэтические соображения
ПРИМЕЧАНИЕ: Смертность животных после фиктивной операции и трансекции составляет 13% и 30% соответственно. Кроме того, для статистического анализа необходимо минимум 15-20 животных на группу. Поэтому начните с 23 бутафорских и 26 трансективных животных.
- Обезболивайте животных 0,02% трикаина мезилата в течение 2 мин, чтобы обеспечить снижение нейронной и двигательной активности и боли перед операцией.
- После операции проверьте животных на восстановление после анестезии. Кроме того, ежедневно кормите и проверяйте животных.
- После окончания плавательного анализа принесите в жертву животных с передозировкой трикаина мезилата (1% трикаина мезилата, приготовленного в 30 мМ растворе бикарбоната натрия).
Результаты
Протокол, описанный в настоящем описании, позволяет изучать регенерацию спинного мозга у Xenopus laevis. Эффекты конкретных фармакологических методов лечения и вклад специфической экспрессии генов в регенерацию спинного мозга можно оценить, измерив их влияние на восстановление плавания. Общее расстояние плавания строится по дням после травмы для сравнения контрольных и обработанных животных в определенный момент времени или в течение определенного периода времени. Восстановление двигательной функции с течением времени проиллюстрировано на рисунке 3, показывающем расстояние плавания через 5, 10, 15 и 20 дней после трансекции. Через 5 дней после трансекции животные проплыли в среднем 0,7 м за 5 мин, демонстрируя сниженную плавательную способность. Эта емкость увеличивалась с переходными днями, так как в среднем через 10 и 15 дней после трансекции наблюдалось в среднем 2,1 и 3,1 м/5 мин, а полное восстановление плавательной способности наблюдалось через 20 дней после трансекции, в среднем 5,7 м/5 мин.
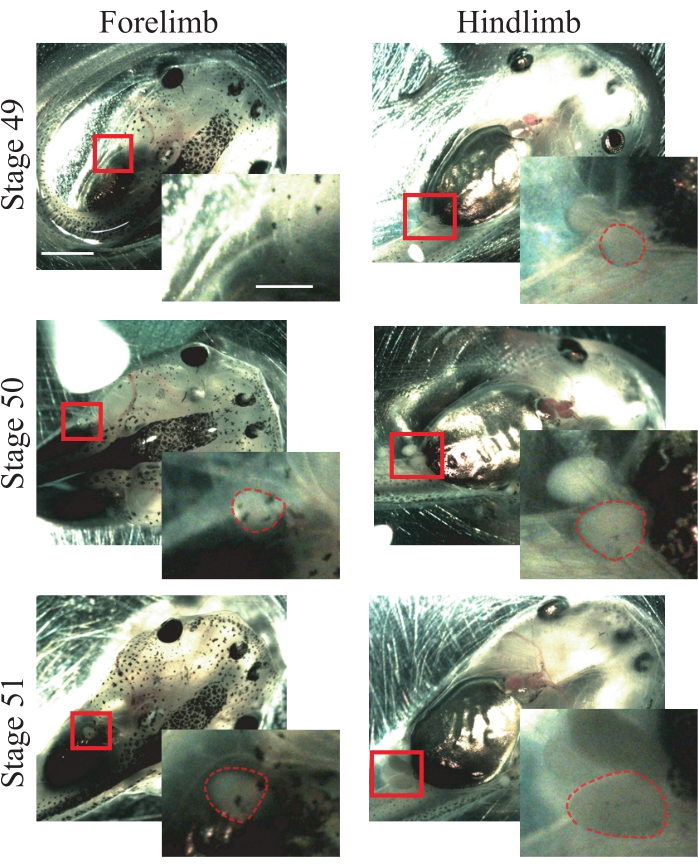
Рисунок 1: Постановка головастика Ксенопуса. Репрезентативные изображения стадий 49-51, показывающие передние и задние конечности для постановки животных. Шкала стержней = 2 мм. Увеличение области в коробке отображается в правом нижнем углу каждого изображения. Шкала стержней = 1 мм. На стадии 49 передние конечности не наблюдаются, в то время как задние конечности просто появляются, показывая сферическую форму. Стадия 50 представляет передние конечности, которые только появляются, показывая сферическую форму и задние конечности, выступающие сферической формой. На стадии 51 передние конечности имеют выступающую сферическую форму, а задние конечности - выступающую вытянутую форму. Пунктирные очертания показывают передние и задние конечности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
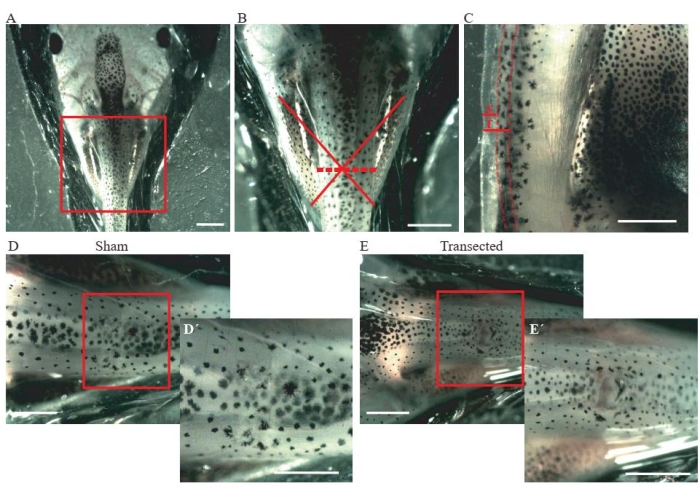
Рисунок 2: Трансекция спинного мозга. (А) Репрезентативное изображение, показывающее правильное позиционирование животного, спинной стороной вверх, для выполнения операции. Шкала = 2 мм. (B) Увеличение A показывает местоположение и степень травмы. Красный крест показывает точное местоположение места травмы на грудном уровне спинного мозга, а пунктирная линия показывает степень травмы. Шкала стержня = 1 мм. (C) Репрезентативное изображение, показывающее боковой вид грудного уровня спинного мозга. Показано расширение фиктивного разреза и трансекции. Пунктирные линии очерчивают границы спинного мозга. Шкала = 1 мм. (D) Репрезентативное изображение, показывающее фиктивное животное с неповрежденным спинным мозгом. Шкала стержней = 1 мм. (E) Репрезентативное изображение, показывающее трансецированное животное с прерванным спинным мозгом. Шкала стержней = 1 мм. Увеличения коробочной области показаны в правом нижнем углу каждого изображения (D' и E'). Шкала стержней = 1 мм. Сокращения: S = фиктивный разрез; T = трансекция. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
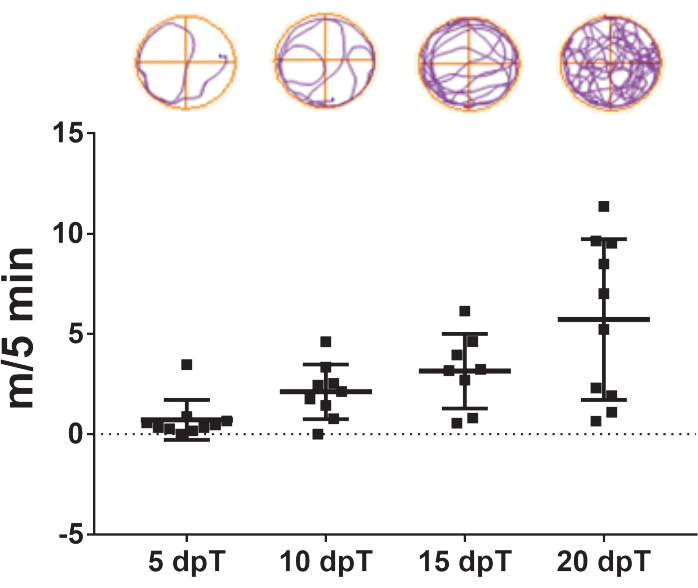
Рисунок 3: Восстановление функции плавания с течением времени. Репрезентативный точечный график расстояния плавания, пройденного трансективными животными за 5 мин через 5, 10, 15 и 20 дней после трансекции. Образцы траекторий плавания показаны сверху. Данные, представленные как средние ± SEM от 10 головастиков. Сокращения: dpT = дни после трансекции; SEM = стандартная погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Протокол, описанный здесь, является отличным методом для выполнения ТСМ и оценки функционального восстановления. Для воспроизводимости важно выращивать здоровых головастиков и выбирать животных, похожих по размеру. Отсутствие надлежащего кормления порождает питательный стресс, что приводит к снижению регенеративных способностей26; поэтому особое внимание следует уделить кормлению головастиков. Когда головастики достигают стадии 50 через 3-4 недели, их можно выращивать при более высоких температурах для ускорения процесса роста, причем оптимально 18-25 ° C27. Качество воды важно, так как животные чувствительны к водным условиям и химическим продуктам. Оптимальные условия воды включают использование отфильтрованной углерода, безхлорной воды со следующими параметрами: рН (6,5-7,5), хлорид (<0,02 мг/л), проводимость воды (1,0 мСм/см ± 0,1 единицы), медь (<0,3 мг/л); карбонатная твердость (KH: 5-10 dKH); общая твердость (GH: 6-16 dGH); нитрат (NO3: <20 мг/л); и нитрит (NO2: <0,1 мг/л)14,27,28. Кроме того, во избежание загрязнения пластиковые емкости следует чистить один раз в неделю для выращивания животных или через день после операции, тщательно промывая безхлоридной водой и губкой; моющих средств следует избегать.
Для лучшей выживаемости после операции головастики не должны подвергаться анестезии в течение длительных периодов времени (не более 2 мин). Более того, рекомендуется обезболивать по одному головастику за раз. Поскольку животные должны оставаться гидратированными, держите животных погруженными в раствор все время до и после операции и вылейте раствор ложкой поверх головастика перед началом операции. Убедитесь, что повреждение достаточно обширно, чтобы охватить весь спинной мозг, но не слишком обширно, так как оно может вызвать плохое функциональное восстановление или смерть. Если нотохорд поврежден, животное будет согнуто, и будет нарушено функциональное восстановление. Если повреждение выходит за пределы нотохорды, вероятность летального исхода возрастает14. Во время плавательного анализа запись считается правильной, если программное обеспечение идентифицирует каждое животное с синей тенью; в противном случае запись должна быть повторена. Важно избегать движения и изменения воздуха или света во время процесса записи, чтобы предотвратить ошибки записи.
Есть еще много открытых вопросов о клеточных и молекулярных механизмах, лежащих в основе повреждения и регенерации спинного мозга. Протокол, описанный в этой работе, может быть использован для изучения вклада различных клеточных событий, экспрессии генов и лечения в функциональное восстановление, определяемое путем измерения способности к плаванию. Кроме того, многие другие методы могут быть применены к оперируемым животным. Спинной мозг может быть выделен для выполнения экстракции белка и/или мРНК14 для изучения профилей экспрессии белка и генов после повреждения и лечения19,20. Эта операция также послужила основой для изучения клеточного ответа спинного мозга22 и поведения нервных стволовых клеток-предшественников12,13,22 после травмы спинного мозга. Сигнальные каскады, участвующие в регенерации спинного мозга, также были изучены с использованием парадигмы повреждения спинного мозга, описанной в настоящем документе23. Таким образом, протокол, описанный здесь, является отличной моделью для изучения травмы и регенерации спинного мозга и использовался для многих исследований, которые способствовали существующим знаниям о предмете.
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Эта работа финансировалась за счет исследовательских грантов от: PG Slater: FONDECYT N° 3190820; Х. Ларраин: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Материалы
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Ссылки
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены