Method Article
Transplante de Microglia Pluripotente Pluripotente Induzido Humano em Microglia De camundongos imunocompetentes através da Rota Transnasal Não Invasiva
Neste Artigo
Resumo
O protocolo aqui apresentado permite o transplante de microglia humana derivada de células-tronco pluripotentes induzidas (iPSMG) no cérebro através de uma rota transnasal em camundongos imunocompetentes. O método de preparação e transplante transnasal das células e a administração da mistura de citocinas para a manutenção do iPSMG é mostrado.
Resumo
Microglia é a população especializada de células macrófagos do cérebro. Eles desempenham papéis essenciais nas funções cerebrais fisiológicas e patológicas. A maior parte do nosso entendimento atual da microglia é baseada em experimentos realizados no camundongo. A microglia humana difere da microglia do camundongo e, portanto, a resposta e características da microglia do rato podem nem sempre representar a da microglia humana. Além disso, devido a dificuldades éticas e técnicas, a pesquisa sobre microglia humana se restringe ao sistema de cultura in vitro , que não capitula características in vivo da microglia. Para superar essas questões, um método simplificado para transplante não invasivamente induzido microglia humana derivada de células-tronco pluripotentes (iPSMG) no cérebro de camundongos imunocompetentes através de uma rota transnasal em combinação com o esgotamento farmacológico de microglia endógena usando um antagonista do receptor fator 1 estimulador de colônias (CSF1R). Este protocolo fornece uma maneira de transplantar invasivamente células no cérebro do camundongo e, portanto, pode ser valioso para avaliar o papel in vivo da microglia humana em funções cerebrais fisiológicas e patológicas.
Introdução
A microglia é uma população especializada de células semelhantes ao macrófago no sistema nervoso central (SNC) e desempenha papéis essenciais no controle de várias funções cerebrais, como o desenvolvimento de circuitos neurais, a modulação da neurotransmissão e a manutenção da homeostase cerebral 1,2,3. Embora a microglia murina compartilhe muitas funções com as dos humanos, elas mostram diferenças específicas das espécies. Assim, a resposta da microglia do rato a vários estímulos pode nem sempre representar a da microglia humana 4,5,6. Embora muitos estudos tenham analisado a microglia humana, esses experimentos estão limitados a estudos in vitro. Microglia humana cultivada in vitro mostram características morfológicas e expressão genética que são muito diferentes daquelas in vivo. Assim, experimentos in vitro nem sempre podem capitular as características in vivo da microglia humana. Por isso, é necessário um sistema experimental para estudar microglia humana in vivo.
Recentemente, para estudar as características in vivo da microglia humana, células-tronco pluripotentes in vitro geradas in vitro (iPSCs)- ou microglia humana derivada de células-tronco embrionárias são cirurgicamente transplantadas em cérebro de camundongos 7,8,9,10,11,12,13,14. Usando essa abordagem, várias características in vivo da microglia humana foram caracterizadas. No entanto, o uso generalizado deste método é limitado por duas razões. Primeiro é a exigência de camundongos imuno-deficientes. Assim, para estudar o papel da microglia humana em várias doenças neurodegenerativas, os camundongos portadores de mutação da doença devem ser cruzados em camundongos imunes deficientes, o que requer tempo e esforço significativos. Além disso, em várias doenças neurológicas, as células imunes periféricas, como as células T, podem modular funções microgliais 15,16,17. Portanto, experimentos realizados em camundongos deficientes imunológicos podem não representar características de boa fé da microglia humana in vivo. Em segundo lugar, cirurgias invasivas para transplante de microglia requerem equipamentos adicionais e treinamento. Além disso, lesões cerebrais durante transplante invasivo podem alterar fenótipos microgliais.
Neste protocolo, é descrito18 o transplante transnasal não invasivo (Tsn) do iPSMG em camundongos do tipo selvagem imunocompetente. Combinando on/off farmacológico de um antagonista CSF1R PLX5622 que esgota microglia de camundongosendógenos 19 e Tsn, o iPSMG pode ser transplantado não invasivamente no cérebro do camundongo. Além disso, com a aplicação de citocina humana exógena, o iPSMG transplantado permanece viável por 60 dias de forma específica da região sem nenhum imunossupressor.
Protocolo
Todos os animais utilizados neste estudo foram obtidos, abrigados, cuidados e utilizados de acordo com os "Princípios Orientadores no Cuidado e Uso de Animais no Campo das Ciências Fisiológicas" publicados pela Sociedade Fisiológica do Japão20, e com a aprovação prévia do Comitê de Cuidados Com Animais da Universidade de Yamanashi (Yamanashi, Japão).
1. Preparação de meio celular, meio de transplante e mistura de anestesia
- Prepare o meio celular adicionando 10% de soro bovino fetal e penicilina/estreptomicina de 0,1% em DMEM.
- Prepare o meio de transplante adicionando hCSF1 (250 ng/mL) e hTGF-β1 (100 ng/mL) ao meio celular.
- Prepare a mistura de anestesia para injeção intraperitoneal misturando 0,45 mL de cloridrato de medetomidina, 1,2 mL de midazolam e 1,5 mL de tartarato butorphanol em 11,8 mL de soro fisiológico normal.
2. Preparação do iPSMG
NOTA: O iPSMG congelado (Tabela de Materiais) foi mantido a -80 °C até o uso.
- Descongele as células congeladas rapidamente em um banho de água de 37 °C. Gire as amostras até que todo o gelo visível tenha derretido.
- Adicione o iPSMG descongelado à mídia cultural aquecida a 37 °C. Adicione 1 mL de células descongeladas contendo meio (1 × 106 células) a 10 mL da mídia cultural.
- Centrifugar as células a 300 x g por 5 min para obter uma pelota celular.
- Após a centrifugação, remova todos os supernantes sem perturbar a pelota celular. A remoção completa do supernascimento é desejável para reduzir a diluição da concentração de citocinas no meio de transplante.
- Adicione o meio de transplante para obter uma concentração celular de 1 x 105 células/μL.
- Coloque o iPSMG no gelo e proceda imediatamente para o transplante.
NOTA: A preparação do iPSMG para transplante é realizada em um banco limpo para evitar contaminação.
3. Preparação do rato para transplante transnasal (Tsn)
- Alimente os camundongos machos do tipo selvagem (C57BL/6J, 8 semanas de idade) com PLX5622 contendo dieta por 7 dias.
- Ao final do7º dia, cesse a dieta PLX e alimente os camundongos com uma dieta normal até o final do estudo.
NOTA: A dieta contendo PLX5622 é preparada adicionando 1,2 g de PLX5622 em 1 kg de AIN-93G (Tabela de Materiais).
4. Transplante transnasal de células
- 24 h após a cessação da alimentação PLX, pese os camundongos e anestesia-os usando uma injeção intraperitoneal da mistura de anestesia (0,2 mL/20 g).
- Depois que os camundongos forem completamente anestesiados como avaliados pela falta de resposta ao reflexo de retirada do pedal (beliscão firme do dedo do pé), administre 2,5 μL de hialuronidase em PBS (100 U/mL) a 1 h antes de Tsn de iPSMG para cada narina duas vezes usando uma ponta de pipeta de 10 μL para aumentar a permeabilidade da mucosa nasal.
- Após a aplicação de hialuronidase, coloque os ratos na posição supina.
- Repita o passo 4,2 10 min antes do transplante transnasal do iPSMG.
- Aplique 2,5 μL de suspensão celular em uma narina do mouse usando uma ponta de pipeta de 10 μL.
- Coloque o mouse na posição supina por 5 minutos antes da administração da suspensão celular para a outra narina.
- Repita as etapas 4,5 e 4,6 quatro vezes, aplicando um volume total de 20 μL por animal.
- Coloque o mouse na posição supina em uma almofada de calor de 37 °C até a recuperação da anestesia.
- Às 48 h após a cessação da alimentação PLX, repita os passos 4.1-4.7 nos mesmos camundongos mais uma vez.
NOTA: Deve-se notar que o iPSMG é colocado no gelo durante o transplante.
5. Aplicação de citocinas
- Anestesiar os camundongos por uma injeção intraperitoneal de mistura de anestesia (0,2 mL/20 g).
- Aplique 2,5 μL do meio de transplante em uma narina do mouse usando uma ponta de pipeta de 10 μL.
- Coloque o rato na posição supina por 5 minutos antes de administrar o meio de transplante para a outra narina.
- Repita as etapas 5.2 e 5.3 quatro vezes, aplicando um volume total de 20 μL por animal.
NOTA: Deve-se notar que a administração transnasal do meio de transplante (citocinas humanas) é necessária a cada 12h para a viabilidade do iPSMG transplantado até o final do estudo.
Resultados
Esta técnica permite ao pesquisador transplantar iPSMG não invasivamente no hipocampo e cerebelo, mas não no córtex do cérebro do camundongo. Após a conclusão do estudo, os camundongos anestesiados foram submetidos à perfusão transcárdia de PBS gelado(−), seguidos por paraformaldeído de 4% (w/v) paraformal dehydedo em PBS. Os cérebros foram isolados, pós-fixados durante a noite em 4% (w/v) paraformaldeído, e crioprotegidos em uma PBS contendo 30% (w/v) sacarose. Além disso, os cérebros foram congelados em um composto de incorporação e seccionados (seções coronais de 20 μm de espessura) em um criostato. As seções foram lavadas três vezes em PBS(−) (10 min cada) e permeabilizadas e bloqueadas com 0,5% (v/v) Tritão X-100 em soro de cabra normal de 1 h. As seções foram então incubadas com marcador de citoplasma anti-humano específico, STEM121 (1:100) e anti Iba1 (1:1000) por 5 dias. Em seguida, as seções foram lavadas três vezes com PBS(−) por 10 minutos cada e foram incubadas com anticorpos secundários: Alexa Fluor 488-, ou 546-conjugado mouse, ou IgGs coelho (1:1000) por 2 h à temperatura ambiente. Após a lavagem com PBS(-) três vezes, as seções foram montadas em slides usando um meio de montagem antifade. Um microscópio confocal equipado com uma lente objetiva de 40x foi usado para a aquisição de imagens de fluorescência. A viabilidade do iPSMG aos 2 meses após o transplante no hipocampo e no córtex são mostradas na Figura 1. O número de células transplantadas pode ser determinado contando células positivas tanto para anticorpos específicos humanos quanto para marcadores pan-microglial/monícito, enquanto a microglia de camundongos endógenos são positivas para o marcador pan-microglial/monócito apenas como descrito anteriormente18. Os iPSMGs transplantados substituem a microglia do rato, mostram morfologias ramificadas no hipocampo, e não são detectados no córtex18.
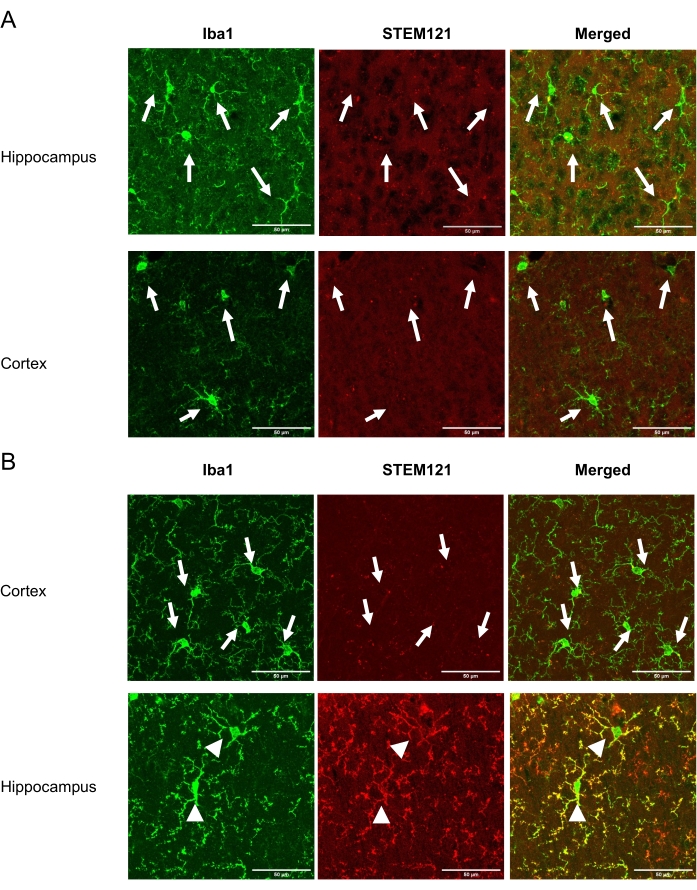
Figura 1: Viabilidade do iPSMG no córtex e no hipocampo em 2 meses após tsn. O painel esquerdo mostra imunostaining com um marcador pan-microglial/monócito, Iba1 (verde). O painel do meio mostra imunosmunagem com marcador de citoplasma específico do homem STEM121 (vermelho). O painel direito mostra uma imagem mesclada de imunostaining Iba1 e STEM121. (A) Em camundongos de controle, apenas microglia de camundongos (Iba1+/STEM121-) foram detectadas tanto no córtex quanto no hipocampo. (B) Em camundongos transplantados iPSMG, no córtex, foram detectadas apenas microglia de camundongos (Iba1+/STEM121-) enquanto no hipocampo iPSMG (Iba1+/STEM121+) foram detectadas. As setas na imagem mostram microglia do mouse, enquanto as pontas de seta mostram iPSMG. Um microscópio confocal equipado com uma lente objetiva de 40x foi usado para aquisição de imagens de fluorescência. Tamanho máximo da imagem: 1024 x 1024 pixels. Fator de zoom: 2. Barras de escala = 50 μm Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo aqui descreve o transplante não invasivo de iPSMG no cérebro do camundongo. A singularidade do protocolo atual é que, combinando métodos farmacológicos PLX ON/OFF e transplante intranasal, o iPSMG pode ser transplantado não invasivamente no cérebro do camundongo imunocompetrente. O iPSMG transplantado formou a maioria das microglias no hipocampo e no cerebelo ocupando o nicho vago por até 60 dias, mas não no córtex.
Os pontos críticos para o Tsn eficiente do iPSMG são (i) eficiência de esgotamento da microglia de camundongos endógenos (ii) a administração de citocinas humanas a cada 12 h. Microglia mantém seu próprio território no cérebro. O esgotamento eficiente da microglia do rato é necessário para fornecer um nicho para o enenxerto de iPSMG transplantado. Quando o esgotamento da microglia do rato endógeno é insuficiente, a colonização do hipocampo do camundongo e do cerebelo pelo iPSMG não são observadas. A viabilidade da microglia depende da sinalização CSF1R e TGFBRde 19,21,22. o hCSF1 é relatado para aumentar seletivamente a viabilidade da microglia humana, e hTGF-β1 é necessário para a viabilidade da microglia, bem como amortece a inflamação quando administrado a cada 12 h 21,23,24. Na ausência de citocinas humanas exógenas, o iPSMG não é observado no cérebro do camundongo. Além disso, deve-se tomar cuidado para não ativar mecanicamente o iPSMG por excesso de pipetação ou por qualquer outro meio antes da Tsn, pois altera irrevogavelmente as características do iPSMG, bem como a eficiência do transplante. Se não for observada a Tsn satisfatória do iPSMG, deve ser determinada a viabilidade do iPSMG antes do transplante, bem como o esgotamento da microglia endógena. Se o esgotamento da microglia do rato endógeno não for superior a 90%, o tempo de alimentação PLX5622 pode ser modificado para aumentar o esgotamento.
Em comparação com um método convencional de transplante cirúrgico que é invasivo e requer equipamentos e treinamento adicionais, tsn permite o transplante de forma não invasiva, simples, estável e fácil. Além disso, este método permite o transplante de iPSMG em cérebros de camundongos imunocompetuntes; assim, camundongos modelo de doença imunocompetente podem ser usados para estudar a resposta do iPSMG.
A maior desvantagem do método atual é a heterogeneidade regional no engrafamento do iPSMG. Se for necessário o transplante iPSMG específico para a região cerebral, o protocolo atual não é adequado, pois o iPSMG transplantado permanece engrafado por 60 dias apenas no hipocampo e no cerebelo, mas não no córtex. Além disso, a necessidade de administrar citocinas humanas exógenas intranasticamente a cada 12 h também é uma limitação do protocolo atual, pois requer mão-de-obra extensiva e é caro.
Em conclusão, é fornecido um protocolo detalhado para Tsn de iPSMG no cérebro de camundongos imunocompetuntes. Quando combinado com on/off farmacológico de microglia de rato por PLX5622, este protocolo permite o enxerto bem-sucedido do iPSMG. Como as células transplantadas podem ser observadas no hipocampo e no cerebelo por um período sustentado de tempo quando citocinas exógenas são aplicadas, o método atual pode ser valioso para avaliar o papel da microglia humana em estados fisiológicos e patológicos nessas regiões.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Patrocinadores de subvenção: Este estudo foi apoiado por JSPS KAKENHI 17K14961 (PB), 20K15899 (PB), JP18K06481 (YS), JP20KK0366 (YS), 20H05902 (SK), 20H050 60 (SK), 19H04746 (SK), 21H04786 (SK), 21K19309 (SK), AMED-CREST (SK), CREST (SK), Mitsubishi Science Foundation (SK), Takeda Science Foundation (SK) e uma Bolsa de Ciência do Cérebro da Fronteira da Universidade de Yamanashi (SK).
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 10566 | |
| AIN 93G | Oriental Yeast Co | ||
| Anti-Iba1 antibody | FUJIFILM | 019–19741 | |
| Anti-STEM121 antibody | Takara Bioscience | Y40410 | |
| Butorphanol tartrate | Kyoritsu Seiyaku | 8019 | |
| Confocal microscope | Olympus | FV1200 | |
| Fetal bovine serum | GE Healthcare Life Sciences | SH30070.03 | |
| Frozen iPSMG | Shionogi & Co., Ltd | Laboratory for Drug Discovery and Disease Research | |
| Human colony stimulating factor 1 (hCSF1) | PeproTech | 300-25 | |
| Hyaluronidase | Sigma-Aldrich | H-3506 | |
| Medetomidine hydrochloride | Meiji Seika | VETLI5 | |
| Midazolam | Astellas | 18005A2 | |
| Paraformaldehyde | Wako Pure Chemical Industries | 162-16065 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Pipette | Eppendorf | 3120000011 | |
| Pipette tip | Eppendorf | 30076028 | |
| PLX5622 | Amadis Chemical | A930097 | |
| Transforming growth factor-β1 (Tgf-b1) | PeproTech | 100-21 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| VECTA SHIELD Hard Set Mounting Medium | Vector Laboratories | H-1400-10 | antifade mounting medium |
Referências
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nature Neuroscience. 10 (11), 1387-1394 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Smith, A. M., Dragunow, M. The human side of microglia. Trends in Neurosciences. 37 (3), 125-135 (2014).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nature Neuroscience. 20 (8), 1162-1171 (2017).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), (2017).
- Abud, E. M., et al. iPSC-derived human microglia-like cells to study neurological diseases. Neuron. 94 (2), 278-293 (2017).
- Brownjohn, P. W., et al. Functional studies of missense TREM2 mutations in human stem cell-derived microglia. Stem Cell Reports. 10 (4), 1294-1307 (2018).
- Douvaras, P., et al. Directed differentiation of human pluripotent stem cells to microglia. Stem Cell Reports. 8 (6), 1516-1524 (2017).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Hasselmann, J., et al. Development of a chimeric model to study and manipulate human microglia in vivo. Neuron. 103 (6), 1016-1033 (2019).
- Mancuso, R., et al. Stem-cell-derived human microglia transplanted in mouse brain to study human disease. Nature Neuroscience. 22 (12), 2111-2116 (2019).
- Muffat, J., et al. Efficient derivation of microglia-like cells from human pluripotent stem cells. Nature Medicine. 22 (11), 1358-1367 (2016).
- Pandya, H., et al. Differentiation of human and murine induced pluripotent stem cells to microglia-like cells. Nature Neuroscience. 20 (5), 753-759 (2017).
- Schetters, S. T. T., Gomez-Nicola, D., Garcia-Vallejo, J. J., Van Kooyk, Y. Neuroinflammation: Microglia and T cells get ready to tango. Frontiers in Immunology. 8, 1905(2017).
- Sulzer, D., et al. T cells from patients with Parkinson's disease recognize alpha-synuclein peptides. Nature. 546 (7660), 656-661 (2017).
- Togo, T., et al. Occurrence of T cells in the brain of Alzheimer's disease and other neurological diseases. Journal of Neuroimmunology. 124 (1), 83-92 (2002).
- Parajuli, B., et al. Transnasal transplantation of human induced pluripotent stem cell-derived microglia to the brain of immunocompetent mice. Glia. 69 (10), 2332-2348 (2021).
- Elmore, M. R., et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 82 (2), 380-397 (2014).
- Zasshi, N. S. Guiding principles for the care and use of animals in the field of physiological sciences. Journal of the Physiologic Society of Japan. 64 (7-8), 143-146 (2002).
- Bohlen, C. J., et al. Diverse requirements for microglial survival, specification, and function revealed by defined-medium cultures. Neuron. 94 (4), 759-773 (2017).
- Butovsky, O., et al. Identification of a unique TGF-beta-dependent molecular and functional signature in microglia. Nature Neuroscience. 17 (1), 131-143 (2014).
- Regateiro, F. S., Howie, D., Cobbold, S. P., Waldmann, H. TGF-beta in transplantation tolerance. Current Opinion in Immunology. 23 (5), 660-669 (2011).
- Yoshimura, A., Muto, G. TGF-beta function in immune suppression. Current Topics in Microbiology and Immunology. 350, 127-147 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados