1. Preparação para o trabalho asséptico
- Obtenha e aplique os seguintes itens epi: jaleco, luvas de látex ou nitríis (livre de lágrimas ou orifícios) e óculos de segurança(Figura 1). Para segurança no caso de usar uma chama aberta, amarre o cabelo comprido.

Figura 1: EPI: Um jaleco, luvas de látex e óculos de segurança.
- Um segundo aspecto importante da técnica asséptica é a esterilização e armazenamento adequados de mídia/reagentes a serem utilizados em laboratório. Prepare o meio de caldo líquido (por exemplo,caldo de soja tripptic) e mídia à base de ágar (porexemplo,R2A) pesando a quantidade adequada de pó de base seca, que é adicionado à quantidade apropriada de água desionizada.
- Para o meio do caldo, dissolva o pó em uma placa quente com fogo baixo aplicado e dispense o líquido em volumes de 100 mL em frascos de vidro ou em volumes de 10 mL em tubos de teste de vidro. Com uma barra de mexida magnética, mexa o meio agarose no agitador de placa quente até que o pó esteja totalmente dissolvido.
- Aplique fita autoclave nos recipientes e autoclave a mídia de acordo com as instruções do fabricante (por exemplo,20 min a 121 °C) (Figuras 2 e 3). Observe que a cor das listras na fita autoclave deve mudar de branco (pré-autoclave) para preto (pós-autoclave). Embora a mudança de cor geralmente indique que a esterilização foi bem sucedida, verificações de esterilidade usando kits de tiras de esporos podem ser realizadas para verificar o processo de autoclavagem.

Figura 2: Fita autoclave sendo aplicada ao material.

Figura 3: Observe a mudança de cor das listras na fita autoclave do branco (pré-autoclave) para o preto (pós-autoclave).
- Esfrie os caldos líquidos à temperatura ambiente e, em seguida, armazene à temperatura ambiente ou refrigerado a 4 °C.
- Esfrie o meio de agarose colocando o recipiente em um banho de água definido para ~50 °C. Uma vez resfriado, a mídia pode ser derramada em pratos petri estéreis. Deixe o meio esfriar e solidificar e, em seguida, consolidar-se para armazenamento em temperaturas especificadas pelo fabricante.
- Existem várias variedades de meios de cultura que não podem ser autoclavadas à medida que as altas temperaturas degradam ingredientes críticos. Esterilização destes requer esterilização de filtros usando um sistema de filtragem de vácuo que emprega um filtro de 0,22 μm, seguido de armazenamento na temperatura apropriada.
- Antes de realizar o trabalho no banco, desinfete a superfície usando uma solução apropriada (por exemplo,alvejante de 500 ppm). Isso reduz o risco de transferência de contaminantes da superfície de trabalho para culturas e mídia estéril.
- Para estabelecer um campo estéril, ligue um bico bunsen. O tipo de chama mais adequado para esterilizar laços de inoculação metálica é uma chama azul intensa, com um cone azul definitivo observado no meio(Figura 4).

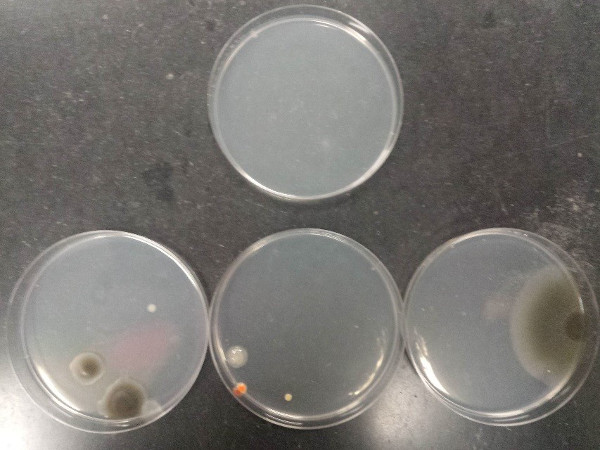
Figura 4: Uma transferência de bactérias de uma placa de Petri mostrando o crescimento de um isolado cultivado para outra placa petri não inoculada contendo um meio de crescimento à base de ágar.
- Passe lentamente o laço inoculante através da parte mais quente da chama (ponta do cone azul). O laço deve ficar vermelho quente para fins de esterilização.
2. Transferências Bacterianas: Da Placa de Petri para a Placa de Petri
- Um cenário de transferência de bactérias é de uma placa de Petri que mostra o crescimento de um isolado cultivado para outra placa Petri estéril contendo um meio de crescimento à base de ágar.
- Para começar, abra ligeiramente a placa de Petri contendo a cultura bacteriana pura, e bata suavemente o laço inoculante quente e esterilizado na superfície do ágar.
- Recupere uma colônia isolada da superfície da placa usando o laço inoculante resfriado e feche a placa de Petri.
- Execute uma raia para isolamento usando uma placa petri fresca contendo meio de cultura, com a tampa ligeiramente entreaberta.
- Para cada porção da raia de isolamento (3 total por placa), esterilizar a alça inoculante pouco antes de ser usada. Além disso, a chama esteriliza o laço logo após a raia final é realizada a fim de evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar ou entrar em contato com os laços inoculadores.
- Coloque as placas listradas em uma incubadora para crescimento durante a noite.
3. Transferências Bacterianas: Da Cultura do Caldo à Placa de Petri
- Um segundo cenário de transferência de bactérias é de uma cultura de caldo que apresenta crescimento, como geralmente observado pela turbidez, para uma placa de Petri estéril contendo meio de crescimento.
- Remova a tampa do tubo de ensaio (ou frasco) contendo a cultura bacteriana pura e passe a abertura do recipiente 2-3x através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente a alça de inoculação esterilizada no tubo/frasco e pressione suavemente contra a lateral do recipiente para esfriar antes de inserir na cultura do caldo.
- Remova um loopful de cultura de caldo(Figura 5),e substitua imediatamente a tampa.

Figura 5: Um loopful de cultura de caldo.
- Execute uma raia para isolamento usando uma placa petri fresca contendo meio de cultura, com a tampa ligeiramente entreaberta.
- Para cada porção da raia (3 total por placa), esterilizar a alça inoculante pouco antes de ser usada. Além disso, a chama esteriliza o laço logo após a raia final é realizada a fim de evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.
- Coloque as placas listradas para isolamento em uma incubadora para crescimento durante a noite.
4. Transferências Bacterianas: Da placa de Petri com crescimento para meio líquido estéril
- Um terceiro cenário de transferência de bactérias é de uma placa de Petri contendo uma raia de cultura isolada para um tubo/frasco contendo meio de crescimento líquido estéril.
- Abra ligeiramente a placa de Petri contendo a cultura bacteriana pura, e esfrie o laço inoculante quente batendo-o suavemente na superfície do ágar.
- Recupere uma colônia isolada da superfície da placa usando o laço inoculante resfriado e feche a placa de Petri.
- Remova a tampa do tubo de ensaio (ou frasco) contendo o meio de crescimento líquido estéril e passe a abertura do recipiente 2 a 3 vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa nobanco.
- Abaixe cuidadosamente a colônia extraída no meio do caldo líquido e agitar suavemente o laço para liberar as bactérias. Substitua imediatamente a tampa.
- Esterilizar a alça inoculante para evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.
- Coloque o frasco em uma incubadora para crescer durante a noite.
- Remova o frasco da incubação no dia seguinte. Realizar uma série de diluição para enumerar a cultura.
- Emplaque as diluições da série para a mídia cultural agarose, e incubar as placas durante a noite.
- Remova as placas no dia seguinte e observe se há alguma contaminação.
5. Transferências Bacterianas: Da Cultura do Caldo ao Meio de Crescimento Líquido Estéril
- Um quarto cenário de transferência de bactérias é de uma cultura de caldo que exibe crescimento para um tubo/frasco contendo meio de crescimento líquido estéril.
- Remova a tampa do tubo de ensaio (ou frasco) contendo a cultura bacteriana pura e passe a abertura do recipiente duas vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente a alça de inoculação no tubo/frasco e pressione suavemente contra a lateral do recipiente para esfriar antes de inserir na cultura do caldo.
- Remova um loopful de cultura de caldo e substitua imediatamente a tampa.
- Remova a tampa do tubo de ensaio (ou frasco) contendo o meio de crescimento líquido estéril e passe a abertura do recipiente duas vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente o loopful extraído no meio de caldo líquido estéril e agitar suavemente o laço para liberar as bactérias. Substitua imediatamente a tampa.
- Esterilizar a alça inoculante(Figura 6)para evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.

Figura 6: Loop inoculante ficando vermelho quente enquanto é esterilizado com um queimador Bunsen.
- Coloque o frasco em uma incubadora para crescer durante a noite.
- Remova o frasco da incubação no dia seguinte. Realizar uma série de diluição para enumerar a cultura.
- Emplaque as diluições da série para a mídia cultural agarose, e incubar as placas durante a noite.
- Remova as placas no dia seguinte e observe se há alguma contaminação.