טכניקה אספטית במדעי הסביבה
Overview
מקור: מעבדות של ד"ר איאן פפר וד"ר צ'ארלס גרבה - אוניברסיטת אריזונה
הפגנה סופרת: לואיזה איקנר
טכניקה אספטית היא מיומנות בסיסית הנהוגה בתחום המיקרוביולוגיה הסביבתית הדורשת איזון של תשומת לב ותרגול במעבדה. שימוש נכון בטכניקה זו מפחית את הסבירות לזיהום חיידקי או פטרייתי של ריאגנטים, מדיה תרבותית ודגימות סביבתיות. טכניקה אספטית חיונית גם כדי להבטיח שלמות נתונים ולשמור על טוהר ספריות התרבות שעשויות להיות מורכבות מטילוקים נדירים וקשים מאוד לתרבות. מקורות הזיהום בסביבת המעבדה כוללים מיקרואורגניזמים מוטסים (כולל אלה הנצמדים לאבק וחלקיקי מוך), חיידקים הנמצאים בסביבת העבודה של ספסל המעבדה או על כלי זכוכית או ציוד לא סטריליים, ומיקרואורגניזמים המועברים מגופו ושיערו של החוקר. השימוש בטכניקה אספטית הוא גם אמצעי בטיחות שמוריד את הפוטנציאל להעברת מיקרואורגניזמים לחוקרים, וזה חשוב במיוחד בעת עבודה עם פתוגנים.
Principles
המטרה של שימוש בטכניקות אספטיות היא ליצור ולתחזק סביבת עבודה סטרילית, ציוד, ריאגנטים, כדי למזער זיהום של דגימות ביולוגיות. כדי לעשות זאת, ניתן לחטא את חלל העבודה וכמה כלים בכימיקלים כגון 70% אתנול ואקונומיקה מדללת. חשוב גם שהחוקר יתאים ציוד מגן אישי (PPE) כגון חלוק מעבדה, כפפות ומשקפי בטיחות.
מדיה וריאגנטים ניתן לעקר באמצעות מנגנוני עיקור מסנן המשתמשים מסנני 0.22-μm, אשר ביעילות להסיר את רוב מיקרואורגניזמים כגון חיידקים. לחלופין, ריאגנטים וציוד רבים יכולים גם להיות מעוקרים בחום גבוה. לדוגמה, חיידקים בכלים, בכלי זכוכית ובאמצעי תקשורת נוזליים יכולים להיהרג בחום ב-autoclave, שהוא תא שמחטא את התוכן באמצעות חשיפה לאדים בלחץ בטמפרטורה גבוהה. בנוסף, כמה כלים יכולים להיות מעוקרים בחום באמצעות מקור להבה, כגון מבער Bunsen.
השימוש במקור להבה הוא גם אחת הדרכים הנפוצות ביותר להקים סביבת עבודה אספטית. החום מהלהבה גורם לזרמת אוויר, יוצר מעלה שמרימה את כל המזהמים המוטסים הרחק בקרבת המבער, ויוצרת "שדה סטרילי" שבו ניתן לבצע עבודה ניסיונית אספטית.
Procedure
1. הכנה לעבודה אספטית
- השגו והחלו את פריטי ה- PPE הבאים: חלוק מעבדה, כפפות לטקס או ניטריל (ללא דמעות או חורים) ומשקפי בטיחות(איור 1). לבטיחות במקרה של שימוש בלהבה פתוחה, לקשור את השיער הארוך.

איור 1: PPE: חלוק מעבדה, כפפות לטקס ומשקפי בטיחות. - היבט חשוב שני של טכניקה אספטית הוא עיקור ואחסון נאותים של מדיה / ריאגנטים לשימוש במעבדה. הכן מדיום מרק נוזלי(למשל,ציר סויה טריפטי) ומדיה מבוססת אגר(למשל,R2A) על ידי שקילה של הכמות הנכונה של אבקת בסיס מיובש, אשר מתווסף לכמות המתאימה של מים דה מיוננים.
- עבור מדיום המרק, להמיס את האבקה על צלחת חמה עם חום נמוך מוחל, ולחלק את הנוזל או בנפחים 100 מ"ל לתוך צלוחיות בורג זכוכית העליון, או בנפחים 10 מ"ל לתוך מבחנות בורג זכוכית העליון. בעזרת מוט ערבוב מגנטי, מערבבים את מדיום האגורוז על מערבל הצלחת החמה עד שהאבקה מתמוססת לחלוטין.
- החלת סרט אוטומטי על הגורמים המכילים, ובודד את המדיה באופן אוטומטי בהתאם להוראות היצרן (למשל,20 דקות ב- 121 °C(איורים 2 ו - 3). שים לב שצבע הפסים בקלטת ההקלבה האוטומטית צריך להשתנות מלבן (טרום-autoclave) לשחור (לאחר ההקלבה האוטומטית). למרות שינוי הצבע בדרך כלל מציין כי עיקור היה מוצלח, בדיקות עיקור באמצעות ערכות רצועת נבג ניתן לבצע כדי לאמת את תהליך autoclaving.

איור 2: הקלטת המוחלת אוטומטית על חומר.
איור 3: שים לב לשינוי הצבע של פסים בקלטת אוטומטית מלבן (טרום-אוטוקלבה) לשחור (לאחר ההקלבה האוטומטית). - מצננים את המרק הנוזלי לטמפרטורת החדר, ואז מאחסנים בטמפרטורת החדר או בקירור בטמפרטורה של 4 מעלות צלזיוס.
- מצננים את מדיום האגורוז על ידי הנחת המיכל באמבט מים מוגדר ~ 50 מעלות צלזיוס. לאחר התקררות, ניתן לשפוך את המדיה למנות פטרי סטריליות. אפשר למדיום להתקרר ולחזק, ולאחר מכן להתאחד לאחסון בטמפרטורות שצוינו על-ידי היצרן.
- ישנם מספר סוגים של מדיה תרבותית כי לא ניתן autoclaved כמו הטמפרטורות הגבוהות להשפיל מרכיבים קריטיים. חיטוי אלה דורשים עיקור מסנן באמצעות מערכת סינון ואקום המשתמשת מסנן 0.22-μm, ואחריו אחסון בטמפרטורה המתאימה.
- לפני ביצוע העבודה על הספסל, לחטא את פני השטח באמצעות פתרון מתאים (למשל,אקונומיקה 500-ppm). זה מוריד את הסיכון להעברת מזהמים משטח העבודה לתרבויות ומדיה סטרילית.
- כדי להקים שדה סטרילי, הפעל מבער בונזן. סוג הלהבה המתאים ביותר לחיטוי לולאות חיטוי מתכת הוא להבה כחולה עזה, עם קונוס כחול מוחלט שנצפו באמצע(איור 4).

איור 4: העברת חיידקים מצלחת פטרי אחת המציגה צמיחה של איזולט בתרבית ללוח פטרי לא מחוסן אחר המכיל מדיום גדילה מבוסס אגר. - לאט לאט להעביר את הלולאה המחסנת דרך החלק החם ביותר של הלהבה (קצה החרוט הכחול). הלולאה צריכה להפוך אדומה חמה לצורך עיקור.
2. העברות חיידקים: מצלחת פטרי לצלחת פטרי
- תרחיש אחד של העברת חיידקים הוא מצלחת פטרי אחת המציגה צמיחה של איזולט בתרבית לצלחת פטרי סטרילית המכילה מדיום צמיחה מבוסס אגר.
- ראשית, פתחו מעט את צלחת הפטרי המכילה את תרבית החיידקים הטהורה, והקשו בעדינות על לולאת החקוס החמה והמיערת על פני השטח של אגר.
- יש לאחזר מושבה מבודדת אחת מפני השטח של הלוח באמצעות לולאת החנק המקוררת, ולסגור את צלחת הפטרי.
- בצע פס לבידוד באמצעות צלחת פטרי טרייה המכילה מדיום תרבות, עם המכסה מעט פתוח.
- עבור כל חלק של פס הבידוד (3 סה"כ לצלחת), לחטא את לולאת החנק רגע לפני השימוש. כמו כן, לחטא את הלולאה מיד לאחר ביצוע הרצף הסופי על מנת למנוע זיהום של משטח הספסל וכשיקול לאחרים במעבדה אשר עשויים מאוחר יותר להשתמש או לבוא במגע עם לולאות הפיקוח.
- מניחים את הצלחות המפוספסות באינקובטור לצמיחה בן לילה.
3. העברות חיידקים: מתרבות מרק לצלחת פטרי
- תרחיש שני של העברת חיידקים הוא מתרבות מרק המציגה צמיחה, כפי שנצפו בדרך כלל על ידי עכוז, לצלחת פטרי סטרילית המכילה מדיום צמיחה.
- הסר את המכסה מן המבחנה (או הבקבוקון) המכיל את התרבות החיידקית הטהורה, ולהעביר את פתיחת המיכל 2-3x דרך החלק החם ביותר של הלהבה. כדי למנוע זיהום, לא להניח את הכובע על הספסל.
- מנמיכים בזהירות את לולאת החנק המעוקרת לתוך הצינור/הבקבוקון, ולחצו בעדינות על צד המיכל כדי להתקרר רגע לפני הכניסה לתרבות המרק.
- הסירו לולאה אחת של תרבות המרק(איור 5)והחליפו מיד את המכסה.

איור 5: לולאה אחת של תרבות מרק. - בצע פס לבידוד באמצעות צלחת פטרי טרייה המכילה מדיום תרבות, עם המכסה מעט פתוח.
- עבור כל חלק של הרצף (3 סה"כ לצלחת), לחטא את לולאת החנק רגע לפני השימוש. כמו כן, לחטא את הלולאה מיד לאחר ביצוע הרצף הסופי על מנת למנוע זיהום של משטח הספסל וכשיקול לאחרים במעבדה אשר עשויים מאוחר יותר להשתמש לולאות חיטוי.
- מניחים את הצלחות המפוספסות לבידוד באינקובטור לצמיחה בן לילה.
4. העברות חיידקים: מצלחת פטרי עם צמיחה לבינוני נוזלי סטרילי
- תרחיש שלישי של העברת חיידקים הוא מצלחת פטרי המכילה פס תרבות מבודד לצינור / בקבוקון המכיל מדיום צמיחה נוזלי סטרילי.
- פתחו מעט את צלחת הפטרי המכילה את תרבית החיידקים הטהורים, וקררו את לולאת החנק החמה על ידי הקשה עליה בעדינות על משטח אגר.
- יש לאחזר מושבה מבודדת אחת מפני השטח של הלוח באמצעות לולאת החנק המקוררת, ולסגור את צלחת הפטרי.
- הסר את המכסה מן המבחנה (או הבקבוקון) המכיל את מדיום הצמיחה הנוזלי סטרילי, ולהעביר את פתיחת המיכל 2 עד 3 פעמים דרך החלק החם ביותר של הלהבה. כדי למנוע זיהום, אל תניח את המכסה על הספסל.
- בזהירות להוריד את המושבה המופקת לתוך מדיום מרק נוזלי, בעדינות להסעיר את הלולאה על מנת לשחרר את החיידקים. החליפו מיד את המכסה.
- עקר להבה את לולאת החנק על מנת למנוע זיהום של משטח הספסל וכשיקול לאחרים במעבדה אשר מאוחר יותר עשויים להשתמש לולאות חיטוי.
- מניחים את הבקבוקון לתוך אינקובטור לצמיחה בן לילה.
- הסר את הבקבוקון מדגירה למחרת. בצע סדרת דילול כדי למנות את התרבות.
- צלחת הדילולים מהסדרה על מדיה תרבות agarose, ודגורת הצלחות בן לילה.
- הסר את הצלחות למחרת, ולהתבונן לכל זיהום.
5. העברות חיידקים: מתרבות מרק למדיום צמיחה נוזלי סטרילי
- תרחיש רביעי של העברת חיידקים הוא מתרבות מרק המציגה צמיחה לצינור / בקבוקון המכיל מדיום צמיחה נוזלי סטרילי.
- הסר את המכסה מן המבחנה (או הבקבוקון) המכיל את התרבות החיידקית הטהורה, ולהעביר את פתיחת המיכל פעמיים דרך החלק החם ביותר של הלהבה. כדי למנוע זיהום, לא להניח את הכובע על הספסל.
- בזהירות להוריד את לולאת החנק לתוך הצינור / בקבוקון, ולחץ בעדינות על הצד של המיכל להתקרר רק לפני הכניסה לתרבות המרק.
- הסר לולאה אחת של תרבות מרק, ומיד להחליף את הכובע.
- הסר את המכסה מן המבחנה (או הבקבוקון) המכיל את מדיום הצמיחה הנוזלי סטרילי, ולהעביר את פתיחת המיכל פעמיים דרך החלק החם ביותר של הלהבה. כדי למנוע זיהום, לא להניח את הכובע על הספסל.
- בזהירות להוריד את הלולאה המופקת לתוך מדיום מרק נוזלי סטרילי, בעדינות להתסיס את הלולאה על מנת לשחרר את החיידקים. החליפו מיד את המכסה.
- עקר את לולאת ההשמדה (איור 6) כדי למנוע זיהום של משטח הספסל וכשיקול לאחרים במעבדה שעשויים מאוחר יותר להשתמש בלולאות המחסנות.

איור 6: לולאה מחסן שהופכת ללחמה אדומה בזמן שהיא מעוקרת עם מבער בונזן. - מניחים את הבקבוקון לתוך אינקובטור לצמיחה בן לילה.
- הסר את הבקבוקון מדגירה למחרת. בצע סדרת דילול כדי למנות את התרבות.
- צלחת הדילולים מהסדרה על מדיה תרבות agarose, ודגורת הצלחות בן לילה.
- הסר את הצלחות למחרת, ולהתבונן לכל זיהום.
Results
התוצאה של ההליך מדגימה טכניקה אספטית נכונה וטכניקה אספטית גרועה. איור 7 ממחיש את הזיהום שיכול לנבוע מטכניקה אספטית גרועה בעת שפיכת לוחות אגרוז (צלחת עליונה: מדיום סטרילי; צלחות תחתונות: מדיה מזוהמת).
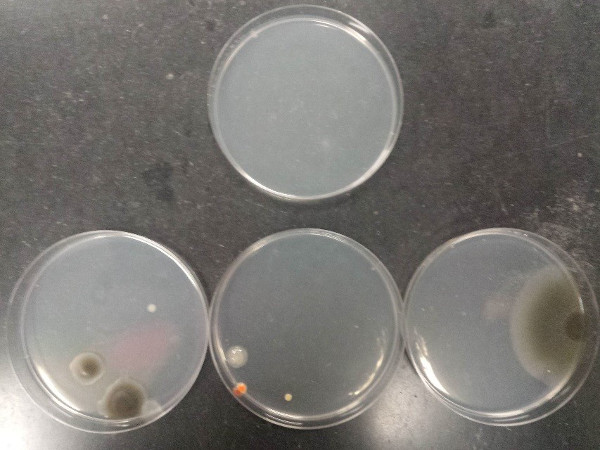
איור 7: זיהום שיכול לנבוע מטכניקה אספטית גרועה בעת שפיכת צלחות אגרוז. צלחת עליונה: מדיום סטרילי; לוחיות תחתונות: מדיה מזוהמת.
Application and Summary
מלבד שימוש במבערי בונסן, סביבות עבודה אספטיות יכולות להישמר גם בתחנות עבודה מיוחדות המכונות ברדסים לזרימת למינאר, המשתמשים בזרימת אוויר מכוונת ומסננים לשמירה על סטריליות.
שימוש נכון בטכניקה אספטית חיוני למיקרוביולוגים סביבתיים בעת דגימה בשטח ובמעבדה בעת עבודה עם מדיה, ריאגנטים ובידודים בתרביתות. טכניקה אספטית גרועה בתחום יכולה לגרום להעברת מיקרואורגניזמים מהטכנאי לדגימות סביבתיות קריטיות, כמו גם לזיהום צולב של חיידקים מדגם אחד למשנהו. אירועים כאלה הם בעלי חשיבות, למשל, במחקרים אקולוגיים מיקרוביאליים המבקשים לזהות ולהשוות אוכלוסיות חיידקיות ופטריות שעשויות להיות קיימות בביומה נתונה. זיהום של דגימות כאלה עלול לגרום לאובדן שלמות הנתונים. טכניקה אספטית היא גם קריטית לשמירה על בידודי תרבית המעבדה שמקורם בדגימת שדה או ממאגרים מבוססים היטב של מיקרוביאלית ותרבות תאים. הזמן, העבודה והעלויות הכספיות שיידרשו ממעבדה במאמץ "לנקות" או להחליף תרבויות מזוהמות, במיוחד מבודדים נדירים מסביבות ייחודיות, עשויים להיות גבוהים מאוד ואסורים, שכן חלק מהבודדים עשויים להיות בלתי ניתנים להחלפה.
Tags
Skip to...
Videos from this collection:

Now Playing
טכניקה אספטית במדעי הסביבה
Environmental Microbiology
126.8K Views

קביעת תכולת הלחות בקרקע
Environmental Microbiology
360.0K Views

כתמי גרם של חיידקים ממקורות סביבתיים
Environmental Microbiology
100.9K Views

הדמיית מיקרואורגניזמים קרקע באמצעות מצג שקופיות מגע ומיקרוסקופיה
Environmental Microbiology
42.8K Views

פטריות נלאמנטיות
Environmental Microbiology
58.7K Views

הפקת דנ"א קהילתי ממושבות חיידקים
Environmental Microbiology
29.1K Views

זיהוי מיקרואורגניזמים סביבתיים עם תגובת שרשרת פולימראז ואלקטרופורזה ג'ל
Environmental Microbiology
44.9K Views

ניתוח RNA של דגימות סביבתיות באמצעות RT-PCR
Environmental Microbiology
40.9K Views

כימות מיקרואורגניזמים סביבתיים ווירוסים באמצעות qPCR
Environmental Microbiology
48.2K Views

ניתוח איכות מים באמצעות אורגניזמים מחוון
Environmental Microbiology
30.1K Views

בידוד חיידקים צואתיים מדגימות מים על ידי סינון
Environmental Microbiology
39.7K Views

זיהוי בקטריופאג'ים בדגימות סביבתיות
Environmental Microbiology
41.0K Views

פולחן ופירום חיידקים מדגימות קרקע
Environmental Microbiology
185.2K Views

ניתוח עקומת גדילה חיידקית והיישומים הסביבתיים שלה
Environmental Microbiology
296.6K Views

1 200 אצות באמצעות מתודולוגיה של Culturable
Environmental Microbiology
14.1K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved