Method Article
Эластомерные PGS Строительные леса в Артериальная тканевой инженерии
В этой статье
Резюме
Эластомерные PGS леса с гладкомышечных клеток сосудов культивировали в биореактор пульсирующего потока может привести к перспективным малого диаметра артериальных конструкций с отечественного производства ЕСМ в относительно короткий период культуры.
Аннотация
Сердечно-сосудистые заболевания является одной из ведущих причин смертности в США и, особенно, ишемической болезни сердца увеличивается с старением населения и увеличением ожирения 1. В настоящее время операции шунтирования использовании аутологичных сосудов, аллотрансплантатов и синтетических трансплантатов известны как обычно используются для артериальной заменители 2. Однако эти трансплантаты имеют ограниченное применение, когда внутренний диаметр артерий менее 6 мм из-за низкой доступности, тромботические осложнения, соответствие несоответствия, и поздно гиперплазии интимы 3,4. Чтобы преодолеть эти ограничения, тканевой инженерии была успешно применена в качестве перспективной альтернативой для развития малого диаметра артериальных конструкций, которые nonthrombogenic, надежные и совместимые. Некоторые предыдущие исследования разработали малого диаметра артериальных конструкций с три-слоистой структуры, отличные механические свойства и давление разрыва сопоставимы с родной артерий 5,6. Хотя высокая прочность на разрыв и давление разрыва за счет увеличения производства коллагена из жесткого материала, или ячейку листа эшафот, эти конструкции еще низкого уровня производства эластина и соблюдения, которая представляет собой серьезную проблему вызывают недостаточность трансплантата после имплантации. Рассматривая эти вопросы, мы предположили, что эластомерный биоматериала в сочетании с механической кондиционирования обеспечит упругость и проведения механических сигналов более эффективно сосудистых клеток, которые увеличивают производство внеклеточной матрицы и поддержку сотовых ориентации.
Цель настоящего доклада заключается во внедрении техники изготовления пористых трубчатых лесов и динамические механические условий для применения их к артериальной тканевой инженерии. Мы использовали биологически эластомера, поли (глицерин sebacate) (PGS) 7 для изготовления пористых трубчатых лесов от метода слияния соли. Взрослый первичной бабуина гладкомышечных клеток (ГМК) были посеяны на просвете леса, которые культивируются в нашей разработан пульсирующего потока биореакторе в течение 3 недель. PGS леса были последовательно толщины и случайным образом распределены макро-и микро-поры. Механические кондиционирования с пульсирующим потоком биореакторе поддерживают SMC ориентации и расширение ECM производства в строительные леса. Эти результаты показывают, что эластомерных лесов и механического кондиционирования биореактор культура может быть перспективным методом артериальной тканевой инженерии.
протокол
1. Трубчатые леса Изготовление
- Подготовка стеклянной трубки (длина = 70 мм, внешний диаметр = 9,0 мм, толщина стенки = 1,0 мм, мелкие детали, Мирамар, штат Флорида) в качестве формы для эшафот.
- Подготовка 1,0 вес / объем% гиалуроновой кислоты (ГК) (Sigma-Aldrich, Сент-Луис, Миссури) путем растворения 100 мг ГК в 10 мл деионизированной воды. Смешайте использовании ротатор ночь, пока Есть нет воздушных пузырьков в растворе.
- Залить 1,0% HA раствора в верхней части стеклянной трубки. Пусть она потока медленно вниз вдоль внутренней стенки пресс-формы. Переверните трубку, когда решение достигла дна формы использования поворотного устройства и повторить этот шаг, пока внутренней стенке формы равномерно покрыта раствором.
- После нанесения покрытия, сухие все стеклянные трубки в вакуумной печи при температуре 37 ° С в течение 24 ч.
- Измельчить и просеять частицы соли (размер = 25-32 мкм) используется в качестве porogens.
- Соберите стеклянных трубок (с покрытием с 1,0% в решение HA), оправки (нержавеющая сталь заключенная на трубки PTFE), термоусадочная (HS) рукав и кольцо PTFE, как описано выше 8.
- Добавить соль частицы нужного размера, чтобы стекла плесень с помощью шпателя через воронку из силиконовой резины. Нажмите плесень осторожно, чтобы обеспечить равномерное распределение частиц соли. Соскоблите избыток частиц соли в верхней части формы использования сторону шпателя.
- Включите гибридизации инкубаторе в течение 30 минут прежде, чем перейти соль упаковке плесени. Выключите гибридизация инкубатора и Положите соль упакованы формы в гибридизации инкубатор для соли синтеза.
- Удалить формы из гибридизация инкубатора и высушите их в вакуумной печи при температуре 37 ° С в течение 24 ч.
- Удалить соли упакованы формы из вакуумной печи и дать им остыть при комнатной температуре. Удалите стержень из нержавеющей стали, нажав на нее вниз с проведением кольцо PTFE. Если оправки слишком плотно прилегает к плесени, использовать иглу плоскогубцами, чтобы вытащить его. Удалите кольцо PTFE из нижней части формы.
- Положите формы в духовку при температуре 120 ° С в течение 5 мин сокращаться HS рукав. Убедитесь, что втулка ГС уменьшились. Удалить рукав HS от соли упакованы пресс-форм и позволяют им остыть при комнатной температуре. Держите формы в эксикаторе, пока они не используются.
- Подготовка PGS решение растворением 3 г PGS в 15 мл тетрагидрофурана (ТГФ) (Sigma-Aldrich, Сент-Луис, Миссури) с образованием 20 вес / объем% раствора.
- Добавить PGS решение просвет соль упакованы формы, понижая его, используя spoid в капюшоне Юма. Lean стеклянные формы около 45 ° и падение PGS решение во внутреннюю полость с вращающимися плесень медленно. Убедитесь, что решение PGS стекает вниз вдоль стены плесени. В сухом месте не наблюдается, добавить больше раствора.
- После добавления раствора PGS, место формы в капюшоне Юм, по крайней мере 30 минут для испарения ТГФ.
- Положите формы в вакуумной печи в течение заранее определенного времени отверждения (например, 24 / 36 / 48 ч) при 100 мторр и 150 ° С для лечения PGS.
- После отверждения, вынуть формы и разместить их при комнатной температуре, чтобы остыть. Dip каждой формы в деионизированной воде с вертикальном положении медленно. Не окунуть в воду, быстро, потому что пузырьки воздуха могут вызвать слезы на эшафот.
- Передача формы для водяной бане тщательно и разместить их под углом в течение 1 ч с использованием кремния трубки распустить HA легко. Проверьте, HA растворяется от плесени. Если нет HA освобождается от плесени, нажмите один конец на эшафот медленно, используя лопаточку, чтобы освободить ее от плесени. Повторите этот шаг на другом конце леса и встряхните форму и обратно медленно в водяной бане. Убедитесь, что эшафот перемещается внутри плесени.
- Передача лесов в другую водяную баню с мешалкой тщательно. Не захватывать леса твердо, которые могли бы трещина эшафот. Место эшафот в водяной бане в течение не менее 3 дней с изменением воды вымываться частицы соли.
- После выщелачивания частицы соли, передача каждого базового интерфейса для 15 мл центрифуге трубки, заполненной деионизованной водой и поместить их в сухой лед поле в течение 1 часа, чтобы заморозить. Положите пробирок в лиофилизатор (все трубки кабины должен быть открыт) и lyophilize их в течение 2 дней.
- Положите все леса в эксикаторе до пока они не используются.
2. Подготовка леса для сотовых Посев
- Выньте из леса эксикаторе и сократить их на 25-30мм длины.
- Приготовьте два силиконовые резиновые пробки (диаметр = 20 мм, толщина стенки = 6,35 мм, средний диаметр отверстия = 3 мм) и подключить два PTFE трубки (наружный диаметр = 3,97 мм, внутренний диаметр = 2,38 мм, толщина стенки = 0,79 мм, длина = 60 мм и 40 мм) через середину отверстия каждой пробки.
- Вырезать кольцо HS как 1,5 мм длины и положил его на вершине одного конца эшафот. Нажмите одну из PTFE трубки (связанные силиконовой резиновой пробкой) в один конец эшафот, как малые части перекрытия насколько это возможно.
- Положите на эшафот и PTFE трубку в духовке при температуре 120 ° С в течение 10 мин сокращаться HS кольцо. Проверьте, HS кольцо уменьшились, а леса связаны с трубки PTFE твердо.
- Выньте эшафот и PTFE трубки и поместить их при комнатной температуре, чтобы остыть. Положите на эшафот-PTFE трубки сборки в трубке поликарбоната (внешний диаметр = 15,5 мм, внутренний диаметр = 9 мм, длина = 50 мм) в качестве биореакторов камеры.
- Подключите другой конец трубки PTFE на эшафот как шаги 2,3) и 2,4).
- Отрегулируйте две пробки силиконовой резины, чтобы приложить их внутренние поверхности к обоим концам трубки из поликарбоната. Прикрепите оба наружных поверхностей пробки силиконовой резины с двумя из алюминиевого сплава пластины (верх и низ, ширина = 20 мм, длина = 70 мм, толщина = 6,35 мм). Поместите два резьбовых шпилек в боковое отверстие пластины и закрепить поликарбонатные трубки (входит в строительные леса внутри) к пластинам, затянув винт большой палец гайку на тарелку.
- Мера seedable длина каждого леса (длина между двумя кольцами HS) и рассчитать площадь внутренней поверхности (π х внутренний диаметр х длина seedable) каждого эшафот для сотовых посева.
- Оберните один биореактор камере блок с алюминиевой фольгой и стерилизовать в автоклаве при температуре 120 ° С в течение 30 мин. Стерилизовать каждой части (средние водохранилища, насосные трубы, газ теплообменник, коллекторы, и игольчатый клапан) из биореактора в автоклаве при температуре 120 ° С в течение 30 мин и собрать их в капот культуре клеток.
- Предварительная обработка и промыть леса с рядом перфузии (70, 50 и 25% этанолом в течение 1 ч, фосфатно-солевом буфере (PBS; Mediatech, Херндон, В. А.) в течение 2 ч, а SMC питательной среде в течение 24 ч с помощью перистальтического насоса в 1,0 мл / мин в потоке цепи.
3. Посев клеток и культуры
- Изоляция первичной артериальной гладкомышечных клеток (ГМК) из сонной артерии молодых самцов бабуинов (Papio Анубис) и характеризовать их в двумерных (2D) культуры до пассажей и посева, как описано выше 9.
- Развернуть ГМК использованием MCDB 131 среды (Mediatech, Херндон, В. А.) с 10% эмбриональной телячьей сыворотки (Lonza, Уолкерсвилл, доктор медицинских наук), 1% L-глутамина (Mediatech), 50 мкг / мл аскорбиновой кислоты (Fisher Scientific, Fair Lawn, Нью-Джерси), и антибиотик-противогрибкового раствора (10 000 МЕ / мл пенициллина, 10 000 мкг / мл стрептомицина и 25 мкг / мл амфотерицина B; Mediatech).
- Отсоедините каждый биореактор камеру от потока замыкание в биореактор. Семенной ГМК (переход 4-6) на эшафот с плотностью 2x10 6 клеток / см 2, вводя подвеска с 5 мл шприца в просвете леса после отключения обоих abluminal (вход) и просвета (выход) потоков.
- Положите все биореактор камер в гибридизации инкубаторе при температуре 37 ° C и поверните их на 2 мин в течение 4 часов, чтобы позволить клеткам, чтобы равномерно распределить на эшафот.
- Выньте из биореактора камер гибридизация инкубатора прикрепить их поток схема биореактора в капюшоне. Перенесите все биореактора системы в культуре клеток инкубатора.
- Подключение насоса трубку (внутренний диаметр 1,6 мм), чтобы хрящ перистальтического насоса и загрузки свежей питательной среды в резервуаре. Начало через стену перфузии (просвета в abluminal) в 1,0 мл / мин в течение 15 мин следует просвета поток только.
- Увеличение скорости потока и давление постепенно с 1,0 мл / мин (просвета напряжения сдвига: 1,1 дин / см 2) и 20 мм рт.ст. в 1 день до 14,2 мл / мин (15,3 дин / см 2) и 120 мм рт.ст. на 21 день, соответственно. Изменение насоса трубку (внутренний диаметр = 3,2 мм) на 4-й день, а средний раз в неделю.
4. Сбор тканей и подготовки образцов для анализа
- После 21-дневной культуре, остановите насос и зажим трубки (вход и выход) среды водоема. Отсоедините трубку от насоса хряща перистальтического насоса и системы передачи биореактор в капюшон.
- Зажим входе и выходе трубки каждого биореактор камеры и отделить ее от потока цикла. Откройте входной трубы и подготовить Петри блюдо на выходе трубы для сбора питательной среды внутри трубки из поликарбоната. Открытые розетки трубы медленно и удалить среды от камеры.
- Отсоедините abluminal иглой просвета трубы и силиконовые из камеры и снимите алюминиевых пластин, освободив винты. Снимите трубку поликарбоната и отделить один конец ткани построить из трубки PTFE.
- Подготовка Петри блюдо, заполненной 10 мл PBS и отделить другом конце построить из трубки PTFE. Положите построить в PBS и полоскать три раза.
- Вырезать построить бритвой, как 5-мм длины. Заморозить его при температуре -80 ° С морозильник для биохимического анализа, перенести ее на 15 мл центрифуге трубки, заполненной 5 мл свежей среды для механических испытаний или оснастки заморозить в ткани-Tek оптимального раскроя соединения температуры (Сакура Finetek Inc, Торранс, Калифорния ) для гистологии / immunofluценции окрашивания.
5. Представитель Результаты:
Трубчатых лесов PGS были изготовлены с использованием биологически эластомера солью метод объединения (рис. 1А). Каждая камера биореакторе при условии, строительные леса и с просвета и abluminal потоков и может быть отделена в виде отдельного блока из основной цикл потока (рис. 1б). Биореактор система была разработана для выращивания леса на четыре времени, используя управление и мониторинг потока, а также давления (рис. 1C & D).
Схема биореактора культуры был показан на рис. 2. После посева ГМК, каждая камера биореактор был повернут на 37 ° С в течение 4 часов, чтобы распространять клетки равномерно в просвете леса. А потом, пульсирующий поток был применен к подмости до 14-й день с постепенным увеличением скорости потока (рис. 2) и давления (рис. 2б). После 14-й день, расход и давление поддерживается постоянным до конца культуры (день 21).
Морфология поверхности PGS эшафот был рассмотрен сканирующей электронной микроскопии (SEM). Сканирующей электронной микроскопии показало, что эшафот был последовательным толщиной стенок (539 ± 18 мкм) (рис. 3А) и случайным образом распределены макро-и микро-поры на поверхности просвета (рис. 3В). Морфометрические параметры эшафот измерялась microcomputed томографии (микро-КТ) и изображений анализа. Средний размер пор 23,3 ± 3,9 мкм и взаимосвязанности пор находится 99,4 ± 0,62%, что означает, что все поры полностью взаимосвязанными в эшафот. Пористость измеряется этанола смещения 75,6 ± 2,7%.
Сотовая морфологии построить PGS был рассмотрен SEM (рис. 4). Многослойные ГМК полностью покрыта просвета поверхность, и они были перпендикулярно ориентированных на направление потока. Эти результаты показывают, что механические кондиционирования с пульсирующим потоком биореакторе поддерживают SMC ориентации в эшафот.
Наличие внеклеточного матрикса (ECM) и эластичных волокон были рассмотрены H & E окрашивания и эластина флуоресценции (рис. 5). H & E окрашивание показало, что клетки и белков ECM полностью покрыта просвет PGS конструкции. Эластин аутофлюоресценция также показал окружности организованной эластичных волокон в просвете поверхности конструкции. Производство белков ЕСМ в конструкции PGS были измерены от биохимических анализов. Нерастворимый эластин и коллаген содержание было 20,2 ± 9,1 мкг / мг ткани и 6,3 ± 1,9 мкг / мг ткани, соответственно.

Рисунок 1. Лесов изготовление и биореактор системы. () Схема трубчатых лесов изготовления. (B) Биореактор камеры. Леса были связаны с трубки PTFE, помещают в трубку сотового поликарбоната, и фиксируется силиконовым резиновыми пробками и плиты из алюминиевого сплава. Каждая камера имеет два потока пути: просвета (на силиконовой трубки) и abluminal (на иглу) потоков. (C) биореактора системы размещены внутри инкубатора. Она включает в себя среду водохранилища, перистальтические модуль насоса, газ теплообменник, датчики давления, два коллектора (верхний и нижний), и игольчатый клапан. (D) биореактора системы расположены вне инкубатора. Она включает в себя датчик давления, блок управления потоком данных, система сбора данных, и компьютер.
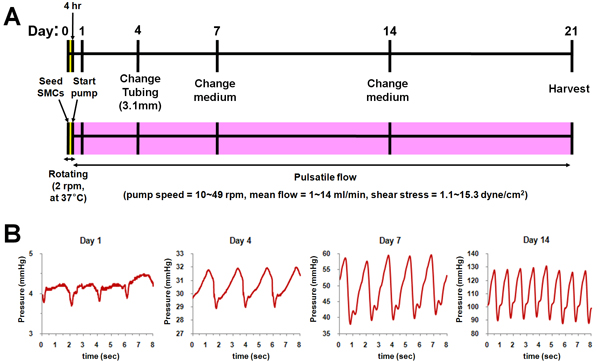
Рисунок 2. Схема биореактора культуры. () Культура протокола. (Б) Прикладные профили давления в каждый момент времени (день 1, 4, 7 и 14).
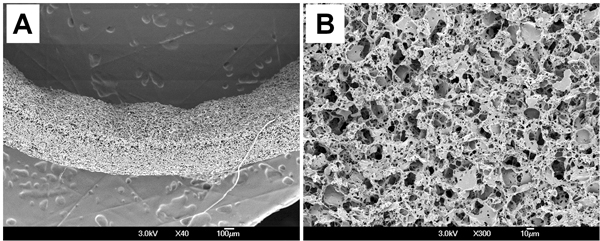
Рисунок 3. Морфология поверхности PGS эшафот. (А) Сечение. (B) Lumen.
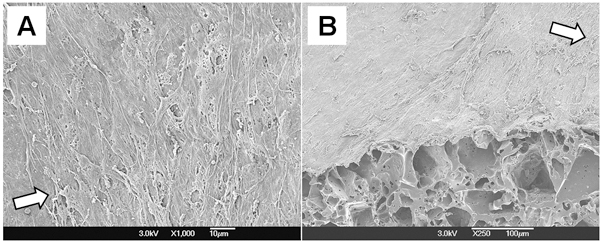
Рисунок 4. Сотовой морфологии PGS конструкции. (А) Lumen. (B) в разрезе 45 ° разреза. Стрелки на обоих рисунках представляют направление потока.
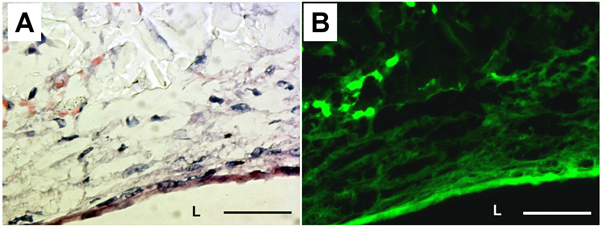
Рисунок 5. Гистологии и эластина аутофлюоресценция из PGS конструкции. () H & E окрашивания. (B) корреспондент аутофлюоресценция эластина. L: просвет. Увеличение: 40Х. Шкала бар: 50 мкм.
Обсуждение
Изготовление технологии с использованием биологически эластомера, описанные здесь есть несколько особенностей. (1) Мы использовали гиалуроновой кислоты (ГК) в качестве формы выпуска. С HA растворяется в воде, эшафот был легко освобождается от стекла форму после замачивания его в воду. В этом отчете мы использовали 1,0 вес / объем% раствора HA потому низких концентрациях (<0,5 вес / объем%) из раствора не вязкая и течет так быстро, когда мы заливки его на верхней части стеклянной трубки. Для пальто решение HA равномерно, мы перевернули стеклянной трубки, когда решение полетел вниз нижней части трубы и повторил этот шаг. Это покрытие ГК решающее значение для нашего производства процедуру выпуска окончательной лесов. (2) Мы использовали термоусаживаемые (HS) рукав для сохранения солей в стеклянных трубок. Так как соли были плотно упакованы в пространство между внутренней стенкой трубы стекло и рукава HS, HS рукав сохранил солей после удаления оправки и PTFE кольцо в нижней части трубы. Мы могли бы удалить HS рукав легко, поставив формы в духовке при 120 ° С в течение 5 мин, а затем получить трубчатых шаблоны соли. (3) Мы использовали метод соль синтеза. Хорошо известно, что метод соль слияние может улучшить пор взаимосвязанности и механических свойств при изменении слияние время 10. Кроме того, поскольку мы использовали PGS, макро-поры были произведены частицы соли во время процесса выщелачивания, а микро-поры, скорее всего, порожденных глицерина паров, образующихся при лечении PGS, как мы описали ранее 11. Таким образом, этот метод имеет потенциал для изготовления пористых трубчатых лесов с различными макро-и микро-структурах посредством изменения частицы соли, а также PGS лечения состояние.
Механические кондиционирования от биореактора предоставил пульсирующей перфузии потока (максимальный средний расход = 14 мл / мин, максимальное касательное напряжение = 15,3 дин / см 2, частота = 0,5 - 1,7 Гц) и физиологически соответствующим давлением с PGS лесов, что привело к SMC роста и ориентации (рис. 4). Эти результаты согласуются с предыдущими исследованиями, сообщает, что циклические растянуть на этой частоте и напряжение сдвига увеличивается распространение SMC 12 и ECM белка 13,14. В дополнение к SMC роста и ориентации, PGS построить поддерживает ECM белка, особенно окружности организованной эластичных волокон (рис. 5) в течение 3-недельного культуры в биореакторе. Некоторые исследования с использованием эластомерных эшафот как малого диаметра артериальных построить продемонстрировали механическую прочность и разрывное давление сравнимо с родной артерий 15 и быстрой интеграции в SMC совместимый леса использованием счетчика колбу 16,17, в то время не эластичные волокна были обнаружены в этих конструкций. Наши результаты показывают, что циклическое растяжение с радиальным биореактор повышенной механической передачи сигнала более эффективно для ГМК в PGS эшафот, что, вероятно, способствовали синтез эластина и организации.
С сосудистых ГМК были только клетки, которые производятся ECM белков в нашем подходе, покоя эндотелия и улучшения механической прочности необходимы для развития клинически успешной малого диаметра артериальных конструкций. Мы сообщили, что эндотелиальные клетки совместно культивировали с ГМК порожденных сливающийся монослой и поддерживается выражением фенотип белка в нашей культуре условий и механических кондиционирования 9. Поэтому, исходя из нашего подхода, описанные здесь, изменение со-культуре условиях эксперимента будет следующим шагом для улучшения функции результирующей конструкции и генерировать nonthrombogenic, надежные и совместимые артериальной построить похож на родной артерий.
Раскрытие информации
Благодарности
Автор благодарит доктора Jin Гао для PGS синтез, д-р Питер Крапо для проницательных обсуждения для биореактора установки, д-ра. Мохамед Ezzelarab и Вэй Ву для культивирующий в искусственной среде бабуина сонных артерий. Это исследование было поддержано грантом Национального института здоровья (R01 HL089658).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| Гиалуроновая кислота натриевая соль | Sigma-Aldrich | H7630 | |
| Тетрагидрофуран | Sigma-Aldrich | 401757 | |
| MCDB 131 | Mediatech | 15-100-CV | |
| Фетальной телячьей сыворотки | Lonza | BW14-502F | |
| L-глютамин | Mediatech | 25-005-CV | |
| Аскорбиновая кислота | Fisher Scientific | А62-500 | |
| Антибиотик-противогрибковым решение | Mediatech | 30-004-ДИ | |
| Фосфатно-солевым буфером (PBS) | Mediatech | 21-031-CV | |
| Ткань-Tek оптимального раскроя соединения температура, 4583 | Сакура Finetek | 25608-930 |
Ссылки
- The American Heart Association Statistics Committee Stroke Statistics Subcommittee. American Heart Association: Heart disease and stroke statistics-2009 update. Circulation. 119, 480-486 (2009).
- Isenberg, B. C., Williams, C., Tranquillo, R. T. Small-diameter artificial arteries engineered in vitro. Circ Res. 98, 25-35 (2006).
- Conte, M. S. The ideal small arterial substitute: a search for the Holy Grail. FASEB J. 12, 43-45 (1998).
- Wang, X., Lin, P., Yao, Q., Chen, C. Development of small-diameter vascular grafts. World J Surg. 31, 682-689 (2007).
- L'Heureux, N., Paquet, S., Labbe, R., Germain, L., Auger, F. A. A completely biological tissue-engineered human blood vessel. FASEB J. 12, 47-56 (1998).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Wang, Y., Ameer, G. A., Sheppard, B. J., Langer, R. A tough biodegradable elastomer. Nat Biotechnol. 20, 602-606 (2002).
- Crapo, P. M., Gao, J., Wang, Y. Seamless tubular poly(glycerol sebacate) scaffolds: high-yield fabrication and potential applications. J Biomed Mater Res A. 86, 354-363 (2008).
- Gao, J., Ensley, A. E., Nerem, R. M., Wang, Y. Poly(glycerol sebacate) supports the proliferation and phenotypic protein expression of primary baboon vascular cells. J Biomed Mater Res A. 83, 1070-1075 (2007).
- Murphy, W. L., Dennis, R. G., Kileny, J. L., Mooney, D. J. Salt fusion: an approach to improve pore interconnectivity within tissue engineering scaffolds. Tissue Eng. 8, 43-52 (2002).
- Gao, J., Crapo, P. M., Wang, Y. Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering. Tissue Eng. 12, 917-925 (2006).
- Wilson, E., Mai, Q., Sudhir, K., Weiss, R. H., Ives, H. E. Mechanical strain induces growth of vascular smooth muscle cells via autocrine action of PDGF. J Cell Biol. 123, 741-747 (1993).
- Leung, D. Y., Glagov, S., Mathews, M. B. Cyclic stretching stimulates synthesis of matrix components by arterial smooth muscle cells in vitro. Science. 191, 475-477 (1976).
- Kim, B. S., Nikolovski, J., Bonadio, J., Mooney, D. J. Cyclic mechanical strain regulates the development of engineered smooth muscle tissue. Nat Biotechnol. 17, 979-983 (1999).
- Yang, J., Motlagh, D., Webb, A. R., Ameer, G. A. Novel biphasic elastomeric scaffold for small-diameter blood vessel tissue engineering. Tissue Eng. 11, 1876-1886 (2005).
- Stankus, J. J., Soletti, L., Fujimoto, K., Hong, Y., Vorp, D. A., Wagner, W. R. Fabrication of cell microintegrated blood vessel constructs through electrohydrodynamic atomization. Biomaterials. 28, 2738-2746 (2007).
- Nieponice, A., Soletti, L., Guan, J., Deasy, B. M., Huard, J., Wagner, W. R., Vorp, D. A. Development of a tissue-engineered vascular graft combining a biodegradable scaffold, muscle-derived stem cells and a rotational vacuum seeding technique. Biomaterials. 29, 825-833 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены