Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изучение Протеолиз циклин B на одном уровне клеток в популяции клеток Всего
В этой статье
Резюме
Метафазы к анафазе переход срабатывает через анафазе способствующих комплекса (APC / C)-зависимых убиквитинирования и последующее уничтожение циклин B. Здесь мы создали систему, которая после импульсно-погоня маркировки, позволяет контролировать протеолиза циклин B во всей популяции клеток и облегчает обнаружение вмешательства митотической контрольно-пропускном пункте.
Аннотация
Equal distribution of chromosomes between the two daughter cells during cell division is a prerequisite for guaranteeing genetic stability 1. Inaccuracies during chromosome separation are a hallmark of malignancy and associated with progressive disease 2-4. The spindle assembly checkpoint (SAC) is a mitotic surveillance mechanism that holds back cells at metaphase until every single chromosome has established a stable bipolar attachment to the mitotic spindle1. The SAC exerts its function by interference with the activating APC/C subunit Cdc20 to block proteolysis of securin and cyclin B and thus chromosome separation and mitotic exit. Improper attachment of chromosomes prevents silencing of SAC signaling and causes continued inhibition of APC/CCdc20 until the problem is solved to avoid chromosome missegregation, aneuploidy and malignant growths1.
Most studies that addressed the influence of improper chromosomal attachment on APC/C-dependent proteolysis took advantage of spindle disruption using depolymerizing or microtubule-stabilizing drugs to interfere with chromosomal attachment to microtubules. Since interference with microtubule kinetics can affect the transport and localization of critical regulators, these procedures bear a risk of inducing artificial effects 5.
To study how the SAC interferes with APC/C-dependent proteolysis of cyclin B during mitosis in unperturbed cell populations, we established a histone H2-GFP-based system which allowed the simultaneous monitoring of metaphase alignment of mitotic chromosomes and proteolysis of cyclin B 6.
To depict proteolytic profiles, we generated a chimeric cyclin B reporter molecule with a C-terminal SNAP moiety 6 (Figure 1). In a self-labeling reaction, the SNAP-moiety is able to form covalent bonds with alkylguanine-carriers (SNAP substrate) 7,8 (Figure 1). SNAP substrate molecules are readily available and carry a broad spectrum of different fluorochromes. Chimeric cyclin B-SNAP molecules become labeled upon addition of the membrane-permeable SNAP substrate to the growth medium 7 (Figure 1). Following the labeling reaction, the cyclin B-SNAP fluorescence intensity drops in a pulse-chase reaction-like manner and fluorescence intensities reflect levels of cyclin B degradation 6 (Figure 1). Our system facilitates the monitoring of mitotic APC/C-dependent proteolysis in large numbers of cells (or several cell populations) in parallel. Thereby, the system may be a valuable tool to identify agents/small molecules that are able to interfere with proteolytic activity at the metaphase to anaphase transition. Moreover, as synthesis of cyclin B during mitosis has recently been suggested as an important mechanism in fostering a mitotic block in mice and humans by keeping cyclin B expression levels stable 9,10, this system enabled us to analyze cyclin B proteolysis as one element of a balanced equilibrium 6.
протокол
1. Посев из U2OS на основе циклин B-SNAP Reporter Cells (клон 11 ячеек 6) на предметные стекла палата
- Trypsinize субконфлюентные SNAP репортер клетки, которые могут расти асинхронно в логарифмической фазе, по крайней мере, 48 часов.
- Работа с 8 хорошо камер микроскопа (постоянное распределение клеток).
Для посева клеток на 8 хорошо камер микроскопа при постоянном распределение по всей поверхности микроскоп камеры, центрифуги 10000 клеток и ресуспендируют в 350 мкл фенола красного без нормального среднего роста (с добавлением 10% эмбриональной телячьей сыворотки, пенициллин / стрептомицин и пируват натрия). Передача клеточной суспензии в микроскоп камеры (рис. 2).
Работа с 8 хорошо камер микроскопа (максимальная плотность клеток в центре).
Для посева клеток при более высокой плотности в центре микроскопа chambэ-э, загрузить камеру с 300 мкл фенола красного без нормального среднего роста. Добавить 5000 клеток тщательно центра микроскоп камеры (рис. 2).
Рабочая, 96 а специальная оптика пластин (постоянное распределение клеток).
Для посева клеток на 96-луночных планшетах при постоянном распределение по всей поверхности хорошо, центрифуги 5000 клеток и ресуспендируют в 300 мкл фенола красного без нормального среднего роста. Передача клеточной суспензии в 96-луночный планшет. В зависимости от общего числа клеточных содержащих скважины требуется, изменить количество клеток и общего объема суспензии среды (рис. 2).
Рабочая, 96 а специальная оптика пластин (максимальная плотность клеток в центре).
Для посева клеток на 96-луночные планшеты, осторожно добавить 1500 клеток в 15 мкл фенола красного без нормального среднего роста маленькийл падение в центр каждой лунки для достижения ограничение роста клеток к центру скважины (рис. 2).
- Разрешить посеянных клеток расти в течение по крайней мере 18 ч при стандартных условиях культуры клеток (37 ° C, 100% влажность воздуха, 5% CO 2).
2. Окрашивание Reporter Клетки с SNAP основания
- За 30 мин до начала процедуры окрашивания позволяют аликвоты фенола красного без нормального среднего роста, чтобы нагреть до 37 ° C.
- Для удобства обращения с SNAP подложки (в нашем случае TMR Star) растворить ПМР звезды в ДМСО, чтобы получить концентрацию в раствор 400 мкм, которые могут храниться при температуре -20 ° C.
- Перед окрашиванием, развести 0,5 мкл ПМР раствора звезды в 200 мкл фенола красного без нормального среднего роста (37 ° С) до получения конечной концентрации маркировка 1 мкм.
- Удалить нормального среднего роста с асинхронным растущие клетки и инкубировать в лabeling среде в течение 25 мин при стандартных условиях культуры.
- Удалите маркировки среднего и мытье клеток в четыре раза с фенолом красным бесплатно нормальной среде роста (37 ° C). Инкубировать клетки в 300 мкл фенола красного без нормального среднего роста (37 ° C) в течение 30 мин. Перед транспортировкой к микроскопу заменить свежей среды с фенолом красным бесплатно нормальной среде роста (37 ° C) для удаления остатков субстрата SNAP несвязанного.
- Транспорт клетки в микроскоп в пенопластовую коробку на подогретого (37 ° C) тепловой блок свести к минимуму изменения температуры.
3. Измерение интенсивности флуоресценции
- За два часа до анализа регулировки температуры воздуха в климатической камере до 37 ° С в сухом режиме для того, чтобы привести всю микроскоп со всеми его компонентами до нужной температуры. Предварительный подогрев перед установкой влажности важна, чтобы избежать конденсации и последующего повреждения микроскопом.
- Отрегулируйте т влажности воздухаили 60% и СО 2 до 5% до начала анализа.
- Запустить сканирование ^ R Приобретение программного обеспечения и определить стандартные параметры (см. таблицу 1).
- Определение позиций скважин для анализа.
- Определить Δt (время цикла опроса) и абсолютное число приобретение циклов.
- Если анализ большего числа скважин необходимо, выберите аппаратное автофокусом, иначе это достаточно использовать программное обеспечение автофокуса в одиночку.
- Начало приобретения и контролировать в течение первых двух циклов приобретения. Микроскоп будет сосредоточено на гистонов H2-GFP сигнала, с последующим приобретением первое изображение этого канала перед фильтром меняется и соответствующий звезды ПМР образ приобрел (рис. 3). Это повторяется по всем позициям в рамках хорошо и для каждой из скважин должны быть рассмотрены, прежде чем повторять снова на следующий цикл.
4. Анализ Протеолитические и профилипеть Scan ^ R
- Запустить сканирование ^ R программного обеспечения для анализа и анализа изображений с ядрах клеток, как визуализация на гистонов H2-GFP, определяемый как главный объект, с использованием порогового уровня на основе интенсивности сигнала и водоразделов алгоритм для оказания помощи в отделение соседних клеток. Подобъекта, состоящие из ядра с цитоплазмой должны быть созданы для анализа TMRstar. (Важно свойств основного объекта X и Y позиции, времени и максимальной и средней интенсивности GFP для основных объектов и суммарной интенсивности делится на области для TMRstar подобъект.) Этот анализ может занять несколько часов из-за большого объема данных количествах.
- Перейдите в режим трассировки для визуализации подобъект среднего ПМР звезды интенсивности флуоресценции с течением времени (ячейка следы), отнесенные к проанализированы основные объекты (рис. 4). Число клеток должны быть рассмотрены может быть сужен путем стробирования на этих измерений длительностью не менее 140 циклов и с высокой максимальной интенсивности H2-GFP. Глядяна большее число клеток позволяет первым представителем и объективный взгляд (рис. 4).
- Выделите ячейку следов интереса к себе гистонов H2-GFP и ПМР звезды флуоресценции одновременно на одном уровне клетки (рис. 5).
- С помощью правой кнопки мыши на ячейку интерес и создать экспортируемый картинной галереи для иллюстрации гистона H2-GFP и циклин B-SNAP ПМР Звезда для каждого момента времени.
- Изменение населения режим сканирования ^ R программного обеспечения для анализа и ворота региона, в котором клетка интерес представляют на X против Y точка сюжета (рис. 5Б).
- Применить новом окне сюжет точка в закрытом региона и визуализировать означает ПМР звезды интенсивности флуоресценции с течением времени (рис. 5С).
- Экспорт данных (время и интенсивность флуоресценции) в Microsoft Excel для дальнейшего расчета.
5. Представитель Результаты
ФигаЮр 5D и 5E изображают циклин B кинетики, в лице ПМР Звезда кривой интенсивности флуоресценции, ячейки, которая протекает через регулярные митоза без признаков хромосомной смещения (рис. 5E). После уплотнения цитоплазмы после ядерного пробоя оболочки (NEBD, как указано в красном треугольнике), TMR звезды интенсивности флуоресценции показывает резкое увеличение до изоморфными окна (светлые участки на схеме) достигается, когда клетка вступает прометафазе 6. Интенсивность флуоресценции остается на стабильном уровне до тех пор, пока клетка проходит через профазе и метафазе, а затем начинает быстро падать, когда все хромосом создали стабильную пластину метафазы (рис. 5D и 5E). Это падение предшествует разделение хромосом в анафазе (синяя точка на кривой). В конце митоза хроматин начинает decondense (синие столбики) и клетка принимает межфазных морфологии в то время как кривая флуоресценции интенсивность приближается кплато, которое ниже, чем на плато перед митоза (рис. 5D и 5E).
| Автофокус настройки | Гистон H2-GFP (приобретение основных параметров объекта) | Циклин B-SNAP помечены ПМР звезды (Приобретение установок) | Приобретение Повторение цикла |
| Грубо автофокусом + / -39 мкм 24 слоев Изобразительное автофокусом + / -5,4 Мкм 14 слоев | GFP набор фильтров: Выдержка: 100 мс Интенсивность света: 25% | TRITC набор фильтров: Выдержка: 150 мс Интенсивность света: 33,3% | От 2 до 5 мин. |
| GFP набор фильтров: Выдержка: 12 мс Интенсивность света: 12,5% | До 48 часов продолжения анализа (ограничен пониженной влажности воздуха 60%) |
Таблица 1. Стандартные настройки, которые используются для анализа протеолиза циклин B. Гистонов H2-GFP был использован в качестве эталона для определения структуры фокальной плоскости для измерения циклин B-SNAP интенсивности флуоресценции. Свет интенсивности при фокусировке процедуру ниже по сравнению с настройками захвата изображения, чтобы избежать кумулятивного фототоксичности.
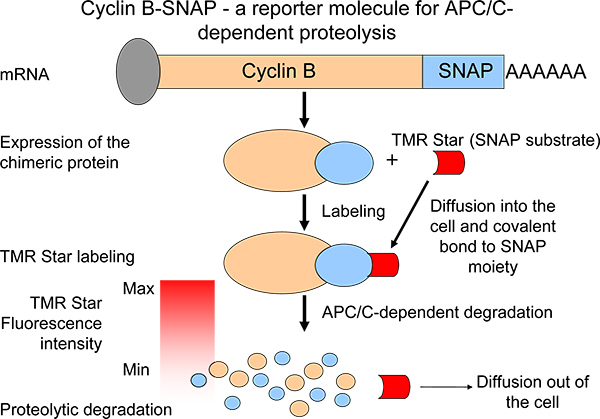
Рисунок 1. Схема измерения протеолиза циклин B по выражению химерных производной B циклин с деградацией характеристиками, аналогичными эндогенного белка. Снижение интенсивности флуоресценции после импульсного погони маркировки является мерой APC / C-деятельности.
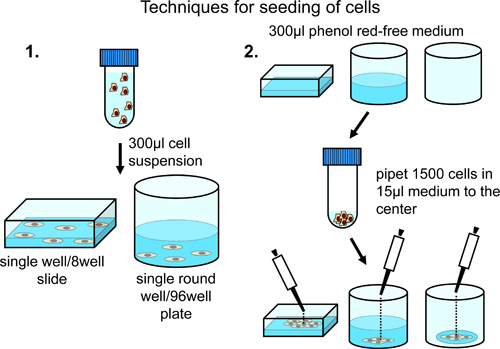
Рисунок 2. Анализ клеток на 8 хорошо слайдов или 96-луночных планшетах. Регулярное распределениеклеток по всей поверхности хорошо достигается за счет ресуспендирования в конечном объеме 300 мкл и рекомендуется, если только одна или несколько позиций вручную, определенных для анализа. Обогащение клеток в центральной области достигается путем добавления клетки к центру предварительно заполненных или пустых скважин. Этот метод рекомендуется в случае автоматизированного получения изображений в различных скважин.

Рисунок 3. Последовательность сбора данных.) Обнаружение гистонов H2-GFP используется для определения плоскости фокуса и мониторинг хромосомных выравнивания во время митоза. B) Интенсивность флуоресценции от интенсивности флуоресценции ПМР звезда является мерой абсолютного количества импульсно-меченых погони циклин B-SNAP.
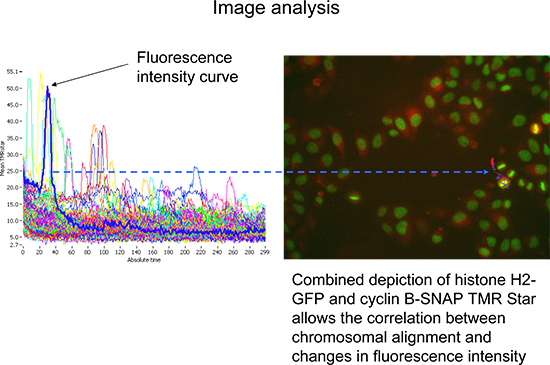
Рисунок 4. Представитель Scan ^ R Анализ программных изображением среднего ПМР звездыинтенсивности флуоресценции (суммарная интенсивность TMRstar разделены по площади) с течением времени. Выбор следом представитель клетки (синие). Соответствующие изображения (показано на рисунке справа) позволяют одновременной визуализации гистонов H2-GFP (зеленый) и циклин B-SNAP (красный). Нажмите, чтобы увеличить показатель .
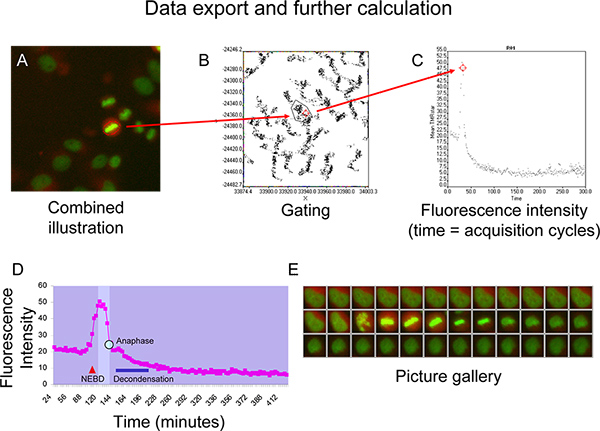
Рисунок 5. A + B) Пример для стробирования точек, представляющих ячейку проценты по XY-точка сюжета. C) Визуализация средней интенсивности флуоресценции TMRstar (суммарная интенсивность TMRstar разделены по области) в течение времени, используя точку сюжета. D + E) представитель флуоресценции кривой интенсивности циклин B-SNAP с изоморфными окна (brigher поля на диаграмме) между NEBD (ядерного пробоя оболочки) и хроматин деконденсации (синяя полоса), а генерируются в Microsoft Excel. Анафаза указывается тОн синяя точка на кривой. Нажмите, чтобы увеличить показатель .
Фильм 1. Щелкните здесь для просмотра дополнительных фильм .
Обсуждение
Мы приведем здесь живой клетке изображений подход, основанный на содействие одновременного мониторинга циклин B протеолиза и хромосомы выравнивания. Такой подход позволяет исследовать митотический управления в невозмущенной клеточных популяций на одном уровне клетки. Cyclin кривые B д?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарны С. Тейлор за предоставление pLPCX-гистонов H2-GFP плазмиды. Мы благодарим Р. Mertelsmann за постоянную поддержку. Эта работа была поддержана Deutsche Forschungsgemeinschaft.
Материалы
| Name | Company | Catalog Number | Comments |
| Наименование продукта | Компания | Номер в каталоге | Комментарии (по желанию) |
| Линии Reporter клетки | генерируется в доме, как описано 6 | клонировать 11 клеток Репортер (U2OS на основе циклин B-клеток, экспрессирующих SNAP) | |
| Ретровирусные циклин B-SNAP вектор экспрессии | генерируется в доме, как описано 6 | pLNCX2-циклин B mut5-SNAP | |
| Phenolred без DMEM | Gibco | 21063-029 | Дополнение с FCS, пируват натрия, пенициллина / стрепто-MYCIN требуется |
| SNAP-Cell TMR-Star | New England Biolabs | S9105S | Со 400 мкМ раствор в ДМСО |
| Специальные пластины Opstics, 96 а | Costar | 3720 | |
| μ-Slide 8 хорошо, ibiTreat | Ibidi | 80826 | |
| Микроскопия блок | Олимп | IX-81 обратного микроскоп с климатической камере | |
| Цель | Олимп | UPLSAPO 20x цели (NA 0,75) | |
| Приобретение программного обеспечения | Олимп | Сканирование ^ R Приобретение программного обеспечения (v.2.2.09) | |
| Анализ программного обеспечения | Олимп | Сканирование ^ R анализа программного обеспечения (v.1.2.0.6) |
Ссылки
- Musacchio, A., Salmon, E. D. The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol. 8, 379-393 (2007).
- Nasmyth, K. Segregating sister genomes: the molecular biology of chromosome separation. Science. 297, 559-565 (2002).
- Cahill, D. P. Mutations of mitotic checkpoint genes in human cancers. Nature. 392, 300-303 (1998).
- Lengauer, C., Kinzler, K. W., Vogelstein, B. Genetic instabilities in human cancers. Nature. 396, 643-649 (1998).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-4892 (2010).
- Schnerch, D. Monitoring APC/C activity in the presence of chromosomal misalignment in unperturbed cell populations. Cell Cycle. 11, (2012).
- Keppler, A. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat. Biotechnol. 21, 86-869 (2003).
- Jansen, L. E., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J. Cell. Biol. 176, 795-805 (2007).
- Malureanu, L. Cdc20 hypomorphic mice fail to counteract de novo synthesis of cyclin B1 in mitosis. J. Cell Biol. 191, 313-329 (2010).
- Mena, A. L., Lam, E. W., Chatterjee, S. Sustained spindle-assembly checkpoint response requires de novo transcription and translation of cyclin B1. PLoS One. 5, (2010).
- Wolthuis, R. Cdc20 and Cks direct the spindle checkpoint-independent destruction of cyclin. A. Mol. Cell. 30, 290-302 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены