Method Article
Мышь Геном Инжиниринг Использование конструктора нуклеаз
В этой статье
Резюме
Дизайнерские нуклеазы, такие как цинкового пальца нуклеаз (ZFNs) и активатор транскрипции, как эффекторных нуклеаз (Таленс) может быть использована для изменения генома эмбрионов предимплантационной мыши, вызывая как негомологичных конец присоединения (NHEJ) и гомологичной рекомбинации (HR) путей. Эти достижения позволяют быструю генерацию мышей с точными генетическими модификациями.
Аннотация
Трансгенные мыши, несущие по конкретным участкам модификации генома (нокаут, нокаут в) имеют жизненно важное значение для рассечения сложных биологических систем, а также для моделирования заболеваний человека и тестирования терапевтических стратегий. Последние достижения в области использования дизайнерских нуклеаз таких как цинкового пальца нуклеаз (ZFNs), активатор транскрипции, как эффекторных нуклеаз (Таленс) и кластерных регулярно interspaced коротких палиндромных повторов (CRISPR) / CRISPR ассоциированных (Cas) 9 системы для сайта- конкретных генной инженерии открывают возможность для выполнения быстрого целевой модификации генома практически любых лабораторных видов без необходимости полагаться на эмбриональных стволовых (ЭС) клеток технологии. Эксперимент редактирование генома обычно начинается с определения дизайнерских нуклеазных целевых сайтов в интересующего гена с последующим строительством пользовательских доменов ДНК-связывающих направить нуклеазную активность следователю определенные геномного локуса. Дизайнер нуклеазы плазмиды в пробирке </ EM> транскрибируется генерировать мРНК микроинъекции оплодотворенных ооцитов мыши. Здесь мы предоставляем протокол для достижения целевой модификации генома путем непосредственного впрыска Talen мРНК в оплодотворенные ооциты мыши.
Введение
Мыши являются на сегодняшний день самой популярной платформой для получения трансгенных животных моделей. Универсальный набор инструментов для генной инженерии эмбриона мыши 1-3 был недавно продлен генома подходов редактирования на основе дизайнерских нуклеаз, таких как цинкового пальца нуклеаз (ZFN) 4-6, активатор транскрипции, как эффекторные нуклеазы (Talen) 7,8, и кластерные регулярно interspaced короткие палиндромные повторы (CRISPR) / CRISPR ассоциированных (Cas) 9 Система 9. ZFN и функция Talen как пары двух специально разработанных ДНК-связывающих доменов на основе белков (массивы из цинковых пальцев белков и повторить переменной ди-остатков (RVDS), соответственно), которые каждый, соединенных с Фоки эндонуклеазы 10-12. С другой стороны, специфичность Cas9-опосредованного расщепления ДНК обеспечивается трансактивации CRISPR РНК (crRNA и tracrRNA, которые также могут быть объединены в единый химерной молекулы РНК называется руководство РНК) 11, которые действуют в комплексе сCRISPR белка.
Таленс с определенной последовательности RVDS можно быстро строится отдельными экспериментаторов с множеством монтажных стратегий на выбор 13-17. CRISPR/Cas9 обещает еще меньше трудоемкий поколение дизайнерских нуклеаз, однако специфика направляющей РНК-ДНК связывания по-прежнему не решен 18,19. Генерация пользовательских ZFNs до сих пор ограничивается специализированных ученых лабораторий и коммерческих поставщиков, таких как Sangamo Biosciences и службой Сигма CompoZr.
В общем, геном редактирования с дизайнером нуклеаз направлена на введение двойных разрывов (ДР) на определенной локусов генома, который впоследствии привлечь негомологичных конец присоединения (NHEJ) или гомологичной рекомбинации (HR) репарации ДНК механизмов 10,12. NHEJ-опосредованной ремонт DSB часто приводит к введению вставки и удаления в непосредственной близости к месту ремонта. Таким образом NHEJ ремонт сбыть использованы для выбивания функцию гена-мишени, вводя сдвига рамки мутации внутри белок-кодирующих генов последовательности 4,7,9. Кроме того, определено добавление или замена генетической информации может быть достигнуто путем предоставления донора ДНК вместе с конструктором нуклеаз. Донор ДНК содержит следователь разработанные последовательности ДНК в окружении регионов гомологии с локуса-мишени, тем самым действуя в качестве шаблона для ремонта DSB по HR. Обе плазмиды 5,6,20 и одноцепочечные олигонуклеотиды 8,9,21 были успешно использованы в качестве доноров. Ни NHEJ-ни HR-опосредованной редактирование геном требуют введения селектируемого маркера в геном эмбриона мыши, что делает эти стратегии особенно хорошо подходит для создания небольших изменений в нуклеотидной последовательности, не нарушая общую генетическую архитектуру.
В этом протоколе описываются все необходимые процедуры для редактирования генома вмышь эмбрион с помощью Talens. К ним относятся: 1) определение целевой сайте Talen 22, 2) строительство Talens на Золотых Ворот клонирования 13, 3) синтез в пробирке Talen мРНК, 4) микроинъекции Talen мРНК в оплодотворенных ооцитов мыши, 5) хирургических процедур для переноса эмбрионов и 6) анализ Talen-индуцированного мутагенеза в основателей животных. Мы делаем ставку на Talen мРНК микроинъекции и скрининга учредителей для NHEJ-индуцированных вставками / удалений. Для этого мы сформировали бифункциональных конструкции Talen, которые позволяют как выражение в клетках млекопитающих при трансфекции как плазмиды и экстракорпоральное синтеза Talen мРНК для микроинъекции в мышиных эмбрионов. Эти конструкции содержат усеченный TALE основа 23 слит с гетеродимерным FokI областей для оптимального 24,25 редактирования генома в клетках млекопитающих. Этот протокол также может быть принята для микроинъекции других дизайнерских нуклеаз или для комбинированных инъекций дизайнерских нуклеази донорских конструкции (дизайн доноров ДНК было описано в превосходных технических публикаций по Wefers др.. 26,27).
Этические себе
Все эксперименты на животных были проведены в соответствии с руководящими принципами и правилами кантона ветеринарной Управления кантона Цюрих.
протокол
1. Идентификация Talen сайтов-мишеней
- Посетите 2.0 сайт ТАЛ Эффектор нуклеотидов Targeter (http://tale-nt.cac.cornell.edu) и выберите "Talen Targeter".
- Введите последовательность гена-мишени. Если выражение pCAG-T7-Talen строит в настоящее время используется (рис. 1С) выберите "Миллер и др.., 2011" в разделе "Использование архитектуры Preset", чтобы предсказать целевые сайты, которые могут быть целевые с оптимальным длины спейсера (15-20 б.п.) и количество Сказка RVDS (15-20) для этой архитектуры Talen.
- Выберите "NN" в разделе "G замену" (Гуанозин конкретных NH RVDS также доступны, но еще не тщательно протестированы для Talen сборки).
- Дополнительно: для других параметров и настроек, пожалуйста, следуйте инструкциям на сайте и ссылки, представленные там.
- Текстовый файл с потенциальными целевыми-сайтов генерируется, которые могут бытьимпортируются в программу электронных таблиц для более удобного просмотра. Выберите пару Talen (ы) для Golden Gate сборки.
- Дополнительно: Последовательность геномной области интереса к линии мышей, который будет использоваться для микроинъекции для выявления возможных одиночных нуклеотидных полиморфизмов (SNP), которые не могут быть учтены в публичных базах данных и потенциально может предотвратить нуклеазу обязательными.
- Дополнительно: См. Таблицу 3 дополнительных дизайнерских нуклеазы связанных интернет-ресурсов.
- Большинство плазмиды, необходимые для ZFN и Talen конструкции могут быть получены из Addgene:
http://www.addgene.org/special-collections/
Addgene идентификаторы для комплекта Золотые ворота Talen и млекопитающих экспрессирующих конструкций Talen приведены в таблице 2.
Кроме того, отдельные функциональные модули, такие как цинкового пальца доменов можно заказать у поставщика услуг синтеза генов.
2. Золотые ворота Talen Ассамблея
В этом разделе описываются сборку Talens использованием протокола опубликованные Чермак и др.. 13 Полнометражные Talens построены с использованием двух последующих Золотые ворота стадий клонирования (рис. 1). Такой подход позволяет включение любого количества RVDS между 12 и 31 в заключительных конструкций экспрессии. Протокол сборка была адаптирована для векторов назначения, предназначенных для генерирующих мРНК (рис. 1в), которые выражают высокоактивные Talens следующие ооцитов микроинъекции. Пожалуйста, обратитесь к онлайн-протокола комплекте Золотые ворота Talen за установление и поддержание библиотеки плазмиды ( http://www.addgene.org/TALeffector/goldengateV2/ ).
- День 1 - Золотые ворота Реакция № 1 - Сборка РВД массивов в Pfus векторы
- Дополнительно: Для каждой пары Talen разработан в Рrotocol 1, введите последовательность ДНК из двух сайтов-мишеней (в том числе начальной Т, 5 'к 3') в TALEN_Voytas_Pipetting таблицы для генерации схемы пипетирования для каждой реакции Golden Gate (также ввести концентрации всех плазмид, используемых для сборок ). Таблица также обеспечивает ожидаемую последовательность ДНК всех RVDS которые могут быть использованы для выравнивания результатами секвенирования в разделе 2.5.2.
- Для каждого уникальный Talen разработан в Протоколе 1:
Если длина Talen является 12-21 (стандарт), выберите повторите переменная ди-остатки (RVDS) 1-10 и вектор назначения pFUS_A. Выберите оставшиеся RVDS и назначения вектор pFUS_B, например на Talen с 15 RVDS (в том числе последнего повторения, который будет добавлен к окончательной сборки в разделе 2.3.3, выберите RVDS 11-14 и вектора назначения pFUS_B4 (рис. 1А).
Если длина Talen является 22-31, использование RVDS 1-10 и назначения вет е р pFUS_A30A. Pick RVDS 11-20 и вектор назначения pFUS_A30B. Выберите оставшиеся RVDS и вектор pFUS_Bdestination, например, для Talen с 24 RVDS выбрать RVDS 21-23 и вектор назначения pFUS_B3. - Настройка Golden Gate реакции № 1 для каждого Pfus + комбинация РВД отдельно, то есть 1-10 + pFUS_A и остальные RVDS + соответствующий pFUS_B векторные или Talen дольше, чем 21 RVDS, 1-10 + pFUS_A30A, 11-20 pFUS_A30B и оставшихся RVDS + соответствующий pFUS_B вектор. Используйте 150 нг каждого вектора РВД, 150 нг Pfus вектора, 1 мкл BsaI, 1 мкл T4 ДНК-лигазы, 2 мкл 10х T4 ДНК-лигазы буфера, и H 2 O в 20 мкл общий объем реакционной смеси. (Использование свежих аликвоты Т4 лигазы буфера для каждого раунда Золотые ворота сборок рекомендуется, поскольку повторный оттаивание / замораживание Т4 лигазы буфера может снизить эффективность реакций.)
- Наведите Золотые ворота реакций в термо циклере.
Программа:
37 ° C 5 мин
16 ° C 10 мин
10 циклов
50 ° C 5 мин
80 ° C 5 мин - Добавить 1 мкл 10 мМ АТФ и 1 мкл безопасная для плазмиды нуклеазы в каждой смеси и инкубируют при 37 ° С в течение 1 часа. Эта обработка будет удалить линейные неполные лигирования продуктов, которые могут быть клонированы в векторах назначения на в естественных условиях гомологичной рекомбинации в трансформированных бактерий.
- Трансформации E. палочка с отдельными реакций лигирования (Электрокомпетентные или химически компетентные клетки Е.coli, которые облегчают α-комплементацию, таких как XL1-Blue или DH5α может быть использован здесь и в последующих превращений).
- Пластинчатые бактерии на спектиномицина (50 мкг / мл) пластины с X-Gal и IPTG (40 мкг / мл каждый) для синий / белый отбора колонии.
- День 2 - подтверждение правильного Pfus-RVDS Ассамблеи
- С помощью ПЦР колоний с праймерами pCR8_F1 и pCR8_R1 (См. Таблицу 1 для последовательностей праймеров) экран 1-3 белыйколоний из каждой пластины. Правильные Pfus-RVDS сборки обычно показывают полосу, соответствующую суммарной длине всех RVDS клонированных (например, вокруг 1.1 Кбайт для 10 RVDS) и «лестница» из более мелких менее известных групп (рис. 1В).
ПЦР программа:
95 ° C 3 мин
95 ° C 30 сек
55 ° C 30 сек
72 ° С 1 мин 45 сек
30-35 циклов
72 ° С 10 мин - Использование подтвердил клонов, чтобы начать ночной культуры (2-5 мл LB с 50 мкг / мл спектиномицина).
- С помощью ПЦР колоний с праймерами pCR8_F1 и pCR8_R1 (См. Таблицу 1 для последовательностей праймеров) экран 1-3 белыйколоний из каждой пластины. Правильные Pfus-RVDS сборки обычно показывают полосу, соответствующую суммарной длине всех RVDS клонированных (например, вокруг 1.1 Кбайт для 10 RVDS) и «лестница» из более мелких менее известных групп (рис. 1В).
- День 3 - Золотые ворота Реакция № 2 - РВД Массивы в Talen векторов экспрессии,
- Выполните "минипрепараты" изолировать Pfus-РВД в сборе (в зависимости от количества RVDS либо pFUS_A и pFUS_B или pFUS_A30A, pFUS_A30B и pFUS_B).
- Дополнительно: Последовательность отдельные Pfus векторы с использованием праймеров pCR8_F1, pCR8_R1 (см. Таблицу 1 для последовательностей праймеров). Секвенирование также может быть выполнена на еИнал Talen строит (раздел 2.5.2); Однако, на более длительный Talens комплектные читает всех RVDS не может быть возможно с помощью Sanger последовательности.
- Настройка Golden Gate реакции № 2 для каждого отдельного Talen. 150 нг каждого вектора Pfus, 150 нг PLR-HD, PLR-NG, PLR-NI, PLR-НН (в прошлом "наполовину повторите") в соответствии с проектом последовательности РВД и л EFT Talen использовать 75 нг из pCAG-T7-Talen-ELD-назначения и на право Talen использовать 75 нг pCAG-T7-Talen-KKR-назначения (или наоборот). Добавить 1 мкл Esp3I, 1 мкл Т4 ДНК-лигазы, 2 мкл 10x T4 ДНК-лигазы буфера, H 2 O до 20 мкл Общий объем реакционной смеси.
- Наведите Золотые ворота реакций в термо циклере.
Программа:
37 ° C 5 мин
16 ° C 10 мин
10 циклов
37 ° C 15 мин
80 ° C 5 мин - Используйте реакцию со разделе 2.3.4 для трансформации E. палочка.
- <сильный> День 4 - подтверждение правильного Talen Ассамблеи
- Экран 1-3 белые колонии из каждой чашки на ПЦР колоний с праймерами TAL_F1 и TAL_R2 (см. Таблицу 1 для последовательностей праймеров). Правильно собранные Talens показывают, ПЦР-продукт с длиной, соответствующей общему количеству объединенных RVDS (рис. 1D, эта группа иногда бывает трудно обнаружить в то время как "лестница эффект» представляет собой надежный показатель успешного сборки).
ПЦР программа:
95 ° C 3 мин
95 ° C 30 сек
55 ° C 30 сек
72 ° C 3 мин
30-35 циклов
72 ° С 10 мин - Использование подтвердил правильные клоны, чтобы начать ночной бактериальной культуры (2-5 мл LB с 100 мкг / мл ампициллина).
- Экран 1-3 белые колонии из каждой чашки на ПЦР колоний с праймерами TAL_F1 и TAL_R2 (см. Таблицу 1 для последовательностей праймеров). Правильно собранные Talens показывают, ПЦР-продукт с длиной, соответствующей общему количеству объединенных RVDS (рис. 1D, эта группа иногда бывает трудно обнаружить в то время как "лестница эффект» представляет собой надежный показатель успешного сборки).
- День 5 - подтверждение правильного Talen Ассамблеи
- Выполните "минипрепараты" изолировать pCAG-T7-Talen плазмиды.
- Если последовательность не была выполнена в SEводств 2.3.2, использование грунтовки TAL_Seq_5-1 и TAL_R2 (см. Таблицу 1 для последовательностей праймеров), чтобы определить правильную сборку РВД в полнометражном Talen.
3. Нуклеазы мРНК Синтез
- Генерирование матрицы ДНК
- Подготовка высокое качество миди или maxipreps из pCAG-T7-Talen плазмид для синтеза мРНК.
- Линеаризовать 10 мкг Talen или ZFN мРНК синтеза с использованием плазмиды рестриктазой, которые предпочтительно расщепляет вниз по течению и в непосредственной близости от нуклеазы стоп-кодона (для pCAG-T7-Talen векторов использовать SacI). синтез мРНК плазмиды обычно включают Т7 или SP6 промотор фага вверх по течению от кодирующей последовательности нуклеазой.
- Запустите 200-500 нг сброженного плазмиды на 0,7-1% агарозном геле для проверки полного переваривания.
- Удаление солей из плазмиды переваривают осаждением ДНК ацетатом 0,1 объем натрия и 3 объемов этанола в течение 1 часа при комнатной темперэ. Гранул ДНК центрифугированием при 14000 х г или более в течение 10 мин, промывают осадок 200 мкл 70% этанола, вращение еще 5 мин, удалить этанол, воздух сухой гранул и ресуспендируют в соответствующем объеме РНКазы свободной воды. Очистка линеаризованной плазмиды также возможно с помощью системы столбца на основе, например, QIAquick ПЦР набора для очистки.
- Определить концентрацию линейного шаблона и использовать 1 мкг создать в пробирке транскрипции.
- мРНК Синтез и Полиаденилирование
- Для транскрипции в пробирке pCAG-T7-Talen плазмиды использовать Ультра Kit mMESSAGEmMACHINE Т7. Настройте реакцию транскрипции для каждого Talen на льду: до 20 мкл с нуклеазы без воды, 10 мкл Т7 2х NTP / ARCA, 2 мкл 10x Т7 реакционного буфера, 1 мкг ДНК-матрицы, 2 мкл Т7 ферментной смеси. Смешайте реакцию и инкубировать в течение 1-2 ч при 37 ° С.
- Используйте полный 20 мкл транскрипцииТион реакционную массу, чтобы настроить реакцию полиаденилирования на льду: 36 мкл нуклеазы без воды, 20 мкл 5x EPAP буфера, 10 мкл 25 мМ MnCl2, 10 мкл 10 мМ АТФ. Перемешать и снять 2,5 мкл реакционной смеси, а контрольные образцы L1 и R1 (для левого и правого нуклеазы, соответственно). Добавить 4 мкл E-PAP фермента и инкубировать реакцию в течение 45-60 мин при 37 ° С Удалить еще 2,5 мкл реакционной смеси, как контрольные образцы L2 и R2.
- Очистка мРНК
- Используйте NucAway Spin Columns для очистки мРНК (буфер обмена и удаление без образования юридического лица нуклеотидов). Нажмите столбцы урегулировать сухой гель в нижней колонны. Гидрат колонка с 650 мкл РНКазы буфера микроинъекции (1 мМ Трис-Cl, 0,1 ЭДТА, рН 7,5). Крышка, вихрь, вытряхнуть пузырьки воздуха, и гидрат в течение 5-15 мин при комнатной температуре.
- Поместите колонку в пробирку и спинапри 750 х г, 4 ° С в течение 2 мин, чтобы удалить избыток интерстициальной жидкости. Откажитесь коллекция трубок и место колонку в 1,5 мл элюирования трубки.
- Применение полную реакционной смеси с разделе 3.2.2 на колонке и спина при 750 мкг, 4 ° С в течение 2 мин. Нуклеазы мРНК теперь будет растворяли в буфере микроинъекции. Удаление 2,5 мкл очищенных образцов L3 и R3.
- Магазин мРНК при -80 ° С до тех пор, микроинъекции аликвоты не готовы.
- мРНК гель-электрофореза
- Очистите геля камеру для удаления ДНК-азу загрязнения применяют 10% раствор SDS или RNaseZAP.
- Подготовьте 1% агарозном геле в 1xTBE рабочем буфере.
- Смешайте каждого образца L1/R1 РНК, L2/R2, L3/R3 3 объемами NorthernMax формальдегида нагрузки Dye и инкубировать в течение 15 мин при 65 ° С
- Образцы нагрузки и размер РНК лестницы (например, РНК тысячелетия размер маркера) на гелеи запустить гель при 10 В / см в 1x КЭ до загрузки краситель не достигнет конца гел.
- Пятно гель с использованием SYBR зеленый раствор (Invitrogen) в течение 30-60 мин при перемешивании при комнатной температуре.
- Изображение гель и сравнить размеры L1/R1 с L2/R2 и L3/R3. Образцы L2/R2 и L3/R3 должен показать полосы увеличенный размер относительно L1/R1 об успешной полиаденилирование в (рис. 2).
- Определить концентрацию мРНК с использованием спектрофотометра.
- Подготовка мРНК аликвоты для микроинъекций путем смешивания левую и правую нуклеазы нуклеазам мРНК в соотношении 1:1. Мы рекомендуем подготовки аликвоты с общей концентрации 200 нг / мкл (100 нг / мкл каждого нуклеазы) путем разбавления микроинъекции буфера. Магазин мРНК аликвоты при -80 ° С
4. Эмбрион Выделение и Микроинъекция
- Эмбрион Изоляция. Этот протокол был успешно использован с C57BL/6J и деформации BDF1с и наиболее вероятно могут быть адаптированы к другим штаммам, обычно используемых в экспериментах микроинъекции, таких как FVB или CBF1. Мышей содержали в 12-часовом-12 ч цикле свет-темнота в температурном-и контролируемой влажностью объекта с пищей и воде.
- Superovulate самки-доноры увеличить выход эмбрионов. 16 женщин (4 недели) являются superovulated интраперитонеальными (IP) инъекции сыворотки гонадотропина 5 МЕ беременной кобылы (PMSG), а затем внутрибрюшинно инъекции 5 МЕ хорионического гонадотропина человека (ХГЧ) при 48-часовом позже.
- Mate в 16 superovulated самок до 16 разведения возраста (2-8 месяцев) самцы сразу после ХГЧ инъекции.
- Жертвоприношение самок с использованием утвержденной протокол эвтаназии, таких как CO 2 ингаляции.
- Восстановление оплодотворенные ооциты. Ооциты собраны из маточных труб на следующее утро, а затем освобождены от любых оставшихся кучевые клеток путем обработки 3-5 мин в 0,1% бычьего гиалуронидазы, растворенного в М2 среды. В зависимости от производительности спаривания и используемого штамма выход эмбриона могут отличаться. 16 C57BL/6J самки обычно производят 150-250, в то время как BDF1 дают 300-400 оплодотворенных яйцеклеток, соответственно.
- Эмбрион Микроинъекция
- Введите нуклеазе мРНК. Пронуклеусов этап ооциты, как правило, вводят в начале дня. Цитоплазматической мРНК микроинъекции осуществляется в среде М2 под минеральным маслом использованием инвертированного микроскопа, снабженного Nomarski ДВС с использованием 20X цели и с эмбриона микроманипуляторов а также узлом впрыска. Мы рекомендуем, начиная с инъекции мРНК Talen в концентрации 10 нг / мкл (20 нг / мкл всего).
- Аспирируйте яйцеклетки с холдинговой капилляра и внедрить нуклеазе мРНК в цитоплазме эмбриона избегая контакта с пронуклеусов. Инъекция должна быть мелкой, близко к мембране. Объем впрыска следует опустить и микроинъекции иглы должен быть остроумиеhdrawn при первых признаках цитоплазматической живота. Серия микроинъекции обычно состоят из 100-300 яйцеклеток. Как правило, по крайней мере, 80-90% эмбрионов должны выжить без непосредственного впрыска лизиса.
- После микроинъекции, поместите эмбрионы в течение 1 часа в M16 (Sigma) среде при 37 ° С и 5% СО 2 и передачи живых эмбрионов в псевдобеременных приемных матерей.
5. Хирургическое Эмбрионов
- Подготовка псевдобеременных получателям эмбрионов (приемные матери) за один день до мРНК микроинъекции. Взрослые самки (3-6 месяцев) из прочного беспородных деформации, например CD-1, хорошо подходят для этой роли. Вызвать Псевдобеременность в результате скрещивания самок в предыдущий день либо хирургическим путем или генетически вазэктомии мужчин 28. Только 0,5 DPC самки с четкой копулятивного вилки используются в качестве эмбрионов реципиентам. В неиспользуемых женщин ложная беременность исчезает после примерно 3 пикс, позволяющие их повторное использование.
- Анестезировать 0,5 DPC приемной матери самок внутрибрюшинной инъекции кетамина, ксилазин (120 мг / кг и 16 мг / кг, соответственно). Такая формулировка гарантии ~ 30 мин хирургическое время толерантность является более чем достаточным для прогнозируемого времени работы 5-10 мин.
- Расположите анестезированы животное на его животе на теплую поверхность и дезинфицировать площадь разреза с соответствующим дезинфицирующим средством 70% этанола или хлоргексидин и спиртовой смеси.
- Надрезать кожу на спине животного и открыть брюшную полость стерильными ножницами.
- Визуализация и воплощать рог матки, потянув за жировой ткани, прикрепленной к яичника. Держите органы влажной теплой 0,9% раствор NaCl. Имейте в виду, что место операции, возможно, придется быть задрапированы стерильной повязкой или побрился, чтобы соответствовать местным ветеринарных руководящих принципов.
- Остановите репродуктивные органы, закрепляя яичника жировой ткани с бульдог зажимом.
- Аккуратно понять яйцевод только вверх по течению от ампулы с часовщик пинцетом и использовать 30 G иглу для подкожных инъекций, чтобы создать небольшое отверстие в яйцевода стене.
- Вывод иглу и вставьте тонкий стеклянный капилляр, содержащий эмбрионов в отверстие, позволяющей размещение эмбрионов в ампуле по нежно дует в мундштук держателя капилляра. Вывод капилляр раз эмбрионы хранятся в ампуле и заменить репродуктивные органы еще в полости тела.
- Закройте брюшную полость с серией стерильных шовных материалов (Prolene 6-0).
- Закройте кожу с помощью 1-2 раны клипов (AutoClip 9 мм) в зависимости от размера отверстия.
- После операции вернуть животных в родную клетку и контролировать их, пока эффект обезболивания не смягчаются.
- Чтобы свести к минимуму стресс, дом мышей в стабильных социальных групп (2-4 особей / Тип III клетку), когда это возможно.
- Применить послеоперационную анальгетикс в виде Dafalgan добавлен в питьевой воде (Парацетамол 200 мг / кг массы тела) в течение 3 дней после операции.
6. Анализ учредителей с помощью ПЦР и Т7 эндонуклеазой или ферментами рестрикции
- Дизайн праймеров для амплификации района между 200-700 б.п. вокруг нуклеазной сайта связывания. Расстояния прямой праймер-нуклеазы прокладка область и нуклеазы прокладка региона обратный праймер должен быть достаточно отличается, чтобы позволить обнаружение двух отдельных полос для переваренных продуктов на агарозном геле (см. рисунки 3 и 4 для примеров).
- Запуск ПЦР с оптимальных условиях. Проверьте ПЦР размер Amplicon на агарозном геле.
- Дополнительно: продукты Purify ПЦР, например, с QIAquick ПЦР набора для очистки для удаления солей и нуклеотидов из смеси ПЦР. Многие ферменты рестрикции активность в образцах PCR, дополненных с соответствующим буфером рестриктазы и очистки не требуется. У нас есть также successfuLLY используется Т7 эндонуклеаза в QiagenTaq ПЦР буфера дополняется NEBuffer 2.
- Т7 эндонуклеаза анализ. Смешайте 17 мкл ПЦР-продукта с 2 мкл NEBuffer 2 и запустить гетеродуплексной образование (рис. 3б) программа в амплификаторе:
95 ° С 2 мин
95 ° C до 85 ° C (-2 ° C / сек)
85 ° C до 25 ° C (-0,1 ° C / сек)
4 ° C удержания.
Добавить 1 мкл Т7 эндонуклеазой к каждому образцу и инкубируют при 37 ° С в течение 20 мин. (Инспектор анализ (Transgenomic), которая опирается на КВЖД 1 нуклеазы, также могут быть использованы здесь. Пожалуйста, обратитесь к инструкциям производителя.) - Ограничение дайджест продукта ПЦР. Смешать 17 мкл ПЦР-продукта с 2 мкл 10Х рестрикционного фермента буфера и 1 мкл рестриктазы. Дайджест в соответствующей температуре в течение 1 часа или более.
- Т7 эндонуклеаза анализ. Смешайте 17 мкл ПЦР-продукта с 2 мкл NEBuffer 2 и запустить гетеродуплексной образование (рис. 3б) программа в амплификаторе:
- Добавить ДНК красителем для образцов и работать на 2% агарозном геле, чтобы обнаружить отчетливый пищеварениешаблоны для животных дикого типа и учредителей, несущих мутантные аллели. См. рисунки 3 и 4 для ожидаемых результатов.
- Клон ПЦР продукты основателей положительных для мутировавших аллелей Sanger последовательности (например, из-за TA-клонирования в pGEM-T Easyor непосредственно последовательность смеси продуктов ПЦР с помощью следующего поколения секвенирования.
Результаты
Мы построили назначения плазмиды, совместимые со сборкой Golden GateTALEN опубликованной Сермак соавт. 13, которые позволяют экспрессию Talens в клетках млекопитающих, а также в пробирке синтез мРНК из фага Т7 промотора (рис. 1в). Эти плазмиды несут гетеродимерные Фоки доменов (ELD или KKR мутации), которые были показаны, чтобы уменьшить мимо ворот эффекты относительно Фоки гомодимеров и повышения расщепления активность по сравнению с первым поколением FokI Гетеродимеры 25,29. Реакции монтажные Золотые ворота # 1 и # 2, как правило, очень эффективным и каждый белый колонией, при анализе с помощью ПЦР колоний, показывает ожидаемый образец для конкретного количества RVDS клонированных (фиг.1В и 1D).
Гель анализ в пробирке синтезированных мРНК (рис. 2) должен выявить единый различимая полоса практически без мазка на каждом анализируемого образца. Там должно быть ясно, размер сдвиг между образцов L1/R1 и L2/R2, L3/R3, что свидетельствует успешное полиаденилирование.
Основатель животные могут быть подвергнуты скринингу на NHEJ-индуцированных мутировавших аллелей с использованием генотипирования ПЦР с последующим либо Т7 эндонуклеазой (рис. 3) или ограничение дайджест с использованием фермента, который расщепляет последовательность дикого типа в разделительном области пары нуклеазы (рис. 4). T7 эндонуклеазы анализ применим к любому виду мутации независимо от конкретной геномной последовательности в спейсерной области пары нуклеазы впрыскиваемого; Однако, он обнаруживает только несоответствия между нитей ДНК в гетеродуплексной продуктов ПЦР. Таким образом, в редких случаях, когда учредителем несет две одинаково мутировавших аллелей, ПЦР-продукты не показать бы любой Т7 пищеварения шаблон. Такое различие, однако, всегда возможно, когда конкретный сайт рестрикции находится в пределах нуклеазы спейсерной области, которые будут устранены NHEJВызванной вставок / удалений (рис. 5). Здесь, непереваренные полосы указывают на наличие мутаций, и отсутствие каких-либо переваренных продуктов наводит на мысль, основатель, несущих мутации в обеих аллелей гена-мишени (отмечены звездочками на рисунке 4, б).
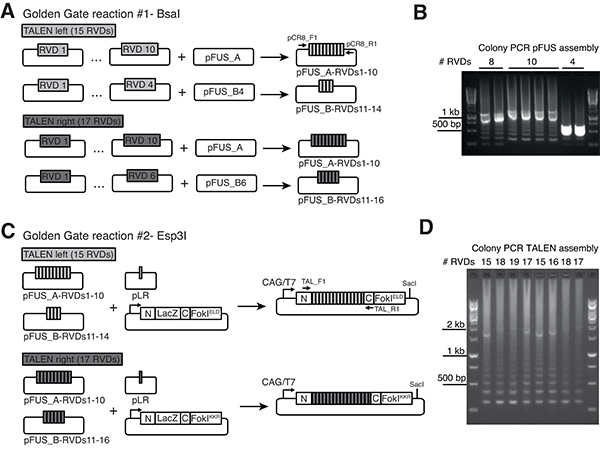
Рисунок 1. Золотые ворота клонирование Talen RVDS в гетеродимерных векторов pCAG-T7-назначения.) Ассамблея РВД массивов в Pfus векторов. Здесь показан пример для пары Talen с отдельными массивами СКАЗКА в составе 15 RVDS и 17 RVDS, соответственно (для сказки массивов больше чем 21 RVDS, три Pfus-RVDS сборки требуются, не показаны). Стрелки указывают праймеров для Pfus конкретных колония ПЦР-реакции. B) продуктов ПЦРусиливается от правильных сборок Pfus обычно показывают полоса, соответствующая суммарной длине всех RVDS клонированных (например, вокруг 1.1 Кбайт для 10 RVDS) и "Лестница" из более мелких менее известных групп из-за повторяющегося характера массивов РВД. C) Окончательная сборка из Pfus-РВД массивов и плазмиды, содержащей последний повтор (PLR) в гетеродимерных Talen векторов экспрессии с FokIELD и FokIKKR вариантов, соответственно. Talen основой (аннотированный как N и С) напоминает архитектуру опубликованные Миллер и др.. 23 CAG (ЦМВ рано усилитель элемент / курица бета-актина) промоутер гарантирует высоких уровней экспрессии в трансфицированных клетках млекопитающих, в то время как фага Т7 промотор позволяет в синтез мРНК пробирке (SacI использовать для линеаризации вектора ниже по потоку от нуклеазы стоп-кодон). D) Colony ПЦР с использованием праймеров, указанных стрелками на C) позволяет идентифицировать правильно собранном Talens. Полная Lengtпродукты ч ПЦР часто менее заметным в то время как "лестнице эффект" представляет собой надежного показателя успешного сборки. Нажмите здесь, чтобы увеличить изображение .
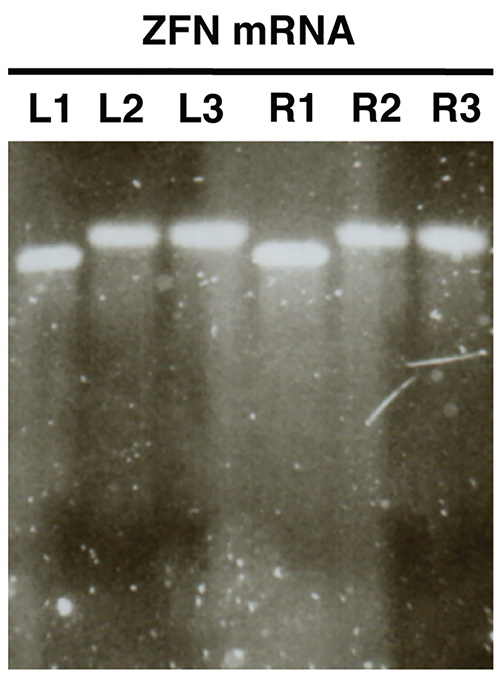
Рисунок 2. . Контроль качества нуклеазы мРНК в пробирке синтеза с использованием электрофореза в агарозном геле ZFN мРНК в качестве примера (L, левый ZFN, R, прямо ZFN). Образцы L1/R1 показать мРНК до полиаденилирование, образцы L2/R2 шоу полиаденилированию мРНК и L3/R3 показать очищенной полиаденилированной мРНК. Нажмите здесь, чтобы увеличить изображение .
альт = "Рисунок 3" FO: контент-ширины = "6 дюймов" FO: Пребывание "/ files/ftp_upload/50930/50930fig3highres.jpg" Первоначально "/ files/ftp_upload/50930/50930fig3.jpg" ширина = "600" />
Рисунок 3. Пример Т7 эндонуклеазой анализа, используемого для идентификации учредителей животных, несущих нуклеазам индуцированных мутаций локуса-мишени. А) Пара Talen был разработан, чтобы расщеплять в кодирующей области гена прионного белка мыши (PRNP, Talen последовательность-мишень может быть предоставлена по запросу). Продукт ПЦР генерируется с использованием прямого праймера (F), расположенный вверх по течению 110 п.н. и обратного праймера (R) 250 п.н. ниже по течению от сайта расщепления Talen. Б) ПЦР-продукт затем подвергают гетеродуплексе формирование и Т7 эндонуклеазой. С) Talen-индуцированного мутагенеза в адресной геномной области одиночных основателей раскрывается присутствием полнометражного продукта ПЦР с продукты расщепления 250 и 110 бит.50930/50930fig3highres.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть увеличенное изображение.

Рисунок 4. Пример ограничения дайджест продуктов ПЦР, используемых для идентификации учредителей животных, несущих нуклеазам индуцированных мутаций локуса-мишени. ZFN конкретные для локуса 29 мишени мыши Rosa26 ограничение сайте XbaI в интрона 1. A) Учредители были обследованы путем генотипирования ПЦР с использованием Прямой праймер (F) расположен 500 п.н. выше и обратного праймера (R) 250 п.н. ниже по течению от сайта расщепления. B) Переваривание продуктов ПЦР с XbaI раскрывает закономерности пищеварения, указывающие мышей с би-аллельных мутаций (отмечены звездочками), моно -аллельные мутации (перевариваются и непереваренные ленты, например, животное 2)и мышей дикого типа (в комплекте пищеварение, например животных 21). C) Секвенирование мышей с потенциальными би-аллельный модификаций отображает до 3 (животное 24) различных вставок / удалений. Нажмите здесь, чтобы увеличить изображение .
| Название Primer | Последовательность 5 'к 3' |
| pCR8_F1 | ttgatgcctggcagttccct |
| pCR8_R1 | cgaaccgaacaggcttatgt |
| TAL_F1 | ttggcgtcggcaaacagtgg |
| TAL_R2 | ggcgacgaggtggtcgttgg |
| TAL_Seq_5-1 | catcgcgcaatgcactgac |
Таблица 1. Последовательности праймеров, используемых для колонии ПЦР и секвенирования в сборке Золотые ворота TalenПротокол.
| Плазмиды / Коллекция | Участник | Addgene ID | Комментарии |
| Золотые ворота Talen и ТАЛ Эффектор Комплект 2.0 | Voytas лаборатория | 1000000024 | Содержит все плазмиды, необходимые для Золотые ворота Talen сборки |
| pCAG-T7-Talen -KKR/ELD векторы назначения | Pelczar лаборатория | 40131, 40132 | Дополнений плазмид для экспрессии Talen в клетках млекопитающих и в пробирке синтеза мРНК |
Таблица 2. Плазмиды и коллекции плазмиды, необходимые для Золотые ворота Talen сборки могут быть получены из Addgene ( www.addgene.org ).
| ОнлайнРесурс | Комментарии |
| http://tale-nt.cac.cornell.edu | Дизайн Talen; Talen мимо ворот предсказание |
| http://zifit.partners.org/ZiFiT/ | Дизайн Talen, откройте ZFN, Coda ZFN, CRISPR/Cas9 |
| http://www.genome-engineering.org | Дизайн Talen, CRISPR/Cas9; CRISPR/Cas9 мимо ворот предсказание |
| http://baolab.bme.gatech.edu/Research/BioinformaticTools/assembleTALSequences.html | Ассамблея Talen последовательностей для подтверждения результатов секвенирования |
| http://pgfe.umassmed.edu/ZFPmo dularsearchV2.html | Проектирование модульной сборки ZFN |
| www.genomecenter.ucdavis.edu/s egallab / segallabsoftware | Проектирование модульной сборки ZFN |
Таблица 3. Интернет-ресурсы для проектирования ZFN, Talen и CRISPR/Cas9.
Обсуждение
Дизайнерские нуклеазы приводом генома подходы редактирования значительно расширили спектр видов поддающихся целевых модификаций своих геномов 10,12. У мышей, ген-таргетинга в ЭС клеток был стандартный метод на протяжении более двух десятилетий; однако, это оказалось трудно адаптироваться к ЭС клеток из других, чем мыши видов, хотя были некоторые недавние успехи в крыс ЭС клеток. Даже при наличии "вне-шельфа" ген-направленных мыши ES клеточных клонов, предоставляемых консорциумов, таких как EUCOMM, KOMP или NorCOMM 3 редактирования генома по ZFN и Talen обеспечивает более высокую точность и гибкость в отношении спектра модификаций, которые могут быть вводят в геном мыши. Основатель животные, несущие нуклеазам опосредованного мутации кажутся весьма зародышевой линии компетентным 4-6,20,21, который не всегда имеет место для химер, происходящих из бластоцисты инъекций ЭС клеток. Таким образом, в некоторых случаях, микроинъекции DESigner нуклеазы может привести к значительно более быстрому поколения новых линий мышей с целевыми модификаций генома.
Успешное поколение мышей с инъекцией ZFN и Talen зависит в значительной степени от активности закачиваемой нуклеазной пары. Таленс уже было показано, что высокий уровень успеха в планировании широкий спектр генов в ряде организмов; Однако, недавние исследования показывают, что связывание Talen чувствителен к цитозин метилирования 30,31. Таким образом, вновь создаваемые нуклеазы пары, например Talens клонировали в pCAG-T7 векторов, можно трансфицировать временно в линию мыши клеток, таких как NIH-3T3 или Нейро -2a, которые имитируют хроматина состояние эмбриона мыши в некоторой степени. Здесь, нуклеазы деятельности может быть оценена с помощью Т7 эндонуклеазной анализа или ограничение дайджест продукта ПЦР, как описано в разделе 5 до синтеза мРНК и микроинъекции. Мы рекомендуем секвенирования геномной области интереса к отношениюив линию клеток и штамма мыши, используемый для микроинъекции экспериментов.
В зигот мыши, различные Talen или ZFN пар будет работать оптимально при различных концентрациях мРНК и, следовательно, оптимальное рабочее концентрация микроинъекции нуклеазы мРНК может должны быть определены экспериментально. В зависимости от пары нуклеазы, слишком низкая концентрация приведет к отсутствию расщепления в то время как слишком высока может привести к эмбриональной летальности. В зависимости от пары нуклеазы, мы имели успех, используя общую концентрацию мРНК столь же низко как 2 нг / мкл и выше, чем 200 мкг / ул. Эти эффекты трудно предсказать из экспериментов в культуре клеток и концентрации, оптимальной для нуклеазы и выживаемость эмбрионов и скорость модификация локуса-мишени должна быть определена эмпирически.
Высокоактивная ZFN или Talen может расщеплять их последовательности-мишени за пределы стадии одной клетки в микроинъецировали эмбриона и тем самым вызвать сложные схемы мутагенеза апг мозаичность в основателей. Мы и другие 4 наблюдали три или более различных мутантных аллелей в одном учредителя (Рисунок 5С). Таким образом, при создании новой линии мыши из этих основателей, потомство должно быть тщательно просеивают с помощью секвенирования на наличие благоприятной мутации с пищеварением анализы свидетельствуют лишь о том, что определено мутация присутствует.
Одно из критических замечаний часто высказывается против систем ZFN и Talen возможность того, что эти нуклеазы также способны расщеплять последовательности, присутствующие в другом месте в геноме, которые похожи на целевые сайты. Такие мимо ворот эффекты наблюдались с реагентами рано поколения используя домен гомодимерное Фоки, и гетеродимером конструкции были предназначены для облегчения и от ворот эффекты 25. Потенциальные вне сайты-мишени могут быть предсказаны в некоторой степени в кремнии 32,33 и отбор ПЦР и секвенирования. Очевидным преимуществом ое использованием ZFNs и Talens для генерации мышей, а не клеточных линий является возможность снятия мимо ворот мутации несвязанные до желаемой модификации генома, выполняя несколько беккроссов к штамма дикого типа выбора. Для анализа большого числа основателей мышей, следующего поколения глубокого секвенирования продуктов ПЦР, полученных от нуклеазы целевой локусе и в кремнии предсказанных мимо ворот локусы могут предложить альтернативный качественный и количественный считывания для расщепления анализах ПЦР-продуктов.
В вспомогательные репродуктивные методы, описанные в данном протоколе оптимизированы для стандартных линий мышей, используемых для микроинъекции экспериментов, таких как C57Bl/6J или B6D2F1. Мыши из различных источников, таких как беспородных штаммов, в принципе, может быть использован для редактирования геном подходов и может обеспечить более подходящий генетический фон для конкретных исследовательских вопросов. Производительность вспомогательных репродуктивных технологий, таких как суперовуляции может быть накладываемымиИДКТК по ряду штаммов 34-36, но может потребовать дальнейшей оптимизации нестандартных штаммов для того, чтобы получить достаточное количество эмбрионов для нуклеазы микроинъекции.
Кроме ZFN и Talen, новые дизайнерские нуклеазы, такие как РНК-направленной системы CRISPR/Cas9 9,37,38 уже были введены для редактирования генома приложений. Все методы микроинъекции и анализа учредителей животных, описанных здесь, также применимы к CRISPR/Cas9 и будущих режимов редактирования генома.
Раскрытие информации
Авторы заявляют никакого конкурирующие интересы.
Благодарности
Мы хотели бы поблагодарить Monika Tarnowska, Корнелия Альбрехт и Ewa Skoczylas за отличную техническую помощь. Это исследование было профинансировано ОЯТ Синергия гранта CRSI33-125073 для ПП.
Материалы
| Name | Company | Catalog Number | Comments |
| BsaI | NEB | R0535S or L | |
| Esp3I | Thermo Scientific | ER0451 | |
| T4 Ligase | NEB | M0202S or L | |
| Spectinomycin | Sigma | S0692-1ML | |
| Ampicillin | Sigma | A0166 | |
| X-Gal | Sigma | B4252 | |
| IPTG | Sigma | I6758 | |
| Plasmid-Safe nuclease | Epicentre | E3101K | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| mMESSAGE mMACHINE T7 Ultra Kit | Invitrogen | AM1345 | |
| NucAway Spin Columns | Invitrogen | AM10070 | |
| RNaseZAP | Sigma | R2020-250ML | |
| NorthernMax Formaldyde Load Dye | Invitrogen | AM8552 | |
| RNA Millennium Markers | Invitrogen | AM7150 | |
| 10x TBE buffer | Thermo Scientific | B52 | |
| T7 endonuclease | NEB | M0302S or L | |
| pGEM-T EasyVector System I | Promega | A3600 | |
| SYBR Green I Nucleic Acid Gel Stain | Invitrogen | S-7563 | |
| pregnant mare's serum gonadotrophin (PMSG) | Sigma | G4877 | |
| human chorionic gonadotropin (hCG) | Sigma | CG5 | |
| M2 embryo culture medium | Sigma | M7167 | |
| M16 embryo culture medium | Sigma | M7292 | |
| Mineral oil, embryo tested | Sigma | M8410 | |
| Ketamine | CentraVet | Ket 201 | |
| Xylazine | Sigma Aldrich | 46995 | |
| Equipment/Tools | |||
| Inverted microscope with Nomarski DIC optics (for example Nikon Eclipse TE200) | Nikon | ||
| Micromanipulator units (for example Narishige, NT88NF) | Narishige | ||
| Embryo holding capillaries | Sutter Instruments | B100-75-10 | |
| Embryo injection capillaries | Narishige | GD-1 | |
| Capillary puller (for example Sutter P97) | Sutter Instruments | ||
| Microforge (for example Narishige MF-900) | Narishige | ||
| Walton skin scissors | FST | 14077-10 | |
| Surgical scissors | FST | 14041-10 | |
| Surgical probe | FST | 10140-03 | |
| Reflex wound clip system (9 mm) | FST | 12031-09 | |
| Reflex wound clips (9 mm) | FST | 12032-09 | |
| Dumont fine forceps 5 | FST | 11254-20 | |
| Moria curved forceps | FST | 11370-31 | |
| Moria fine forceps | FST | 11399-80 | |
| Dietrich bulldog clamp | FST | 18038-45 | |
| C57BL/6J mice | Jackson Labs | strain code 000664 | |
| CD-1 mice | Charles River | strain code 000664 | |
Ссылки
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat. Rev. Genetics. 6, 507-512 (2005).
- Johansson, T., et al. Building a zoo of mice for genetic analyses: a comprehensive protocol for the rapid generation of BAC transgenic mice. Genesis. 48, 264-280 (2010).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Carbery, I. D., et al. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186, 451-459 (2010).
- Meyer, M., de Angelis, M. H., Wurst, W., Kuhn, R. Gene targeting by homologous recombination in mouse zygotes mediated by zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 107, 15022-15026 (2010).
- Cui, X., et al. Targeted integration in rat and mouse embryos with zinc-finger nucleases. Nat. Biotechnol. 29, 64-67 (2011).
- Sung, Y. H., et al. Knockout mice created by TALEN-mediated gene targeting. Nat. Biotechnol. 31, 23-24 (2013).
- Wefers, B., et al. Direct production of mouse disease models by embryo microinjection of TALENs and oligodeoxynucleotides. Proc. Natl. Acad. Sci. U.S.A. 110, 3782-3787 (2013).
- Wang, H., et al. One-Step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat. Rev. Genetics. 11, 636-646 (2010).
- ZFN, T. A. L. E. N. CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31, 397-405 (2013).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nat. Rev. Mol. Cell Biol. 14, 49-55 (2013).
- Cermak, T., et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic Acids Res. 39, (2011).
- Reyon, D., et al. FLASH assembly of TALENs for high-throughput genome editing. Nat. Biotechnol. 30, 460-465 (2012).
- Sanjana, N. E., et al. A transcription activator-like effector toolbox for genome engineering. Nat. Protoc. 7, 171-192 (2012).
- Kim, Y., et al. A library of TAL effector nucleases spanning the human genome. Nat. Biotechnol. 31, 251-258 (2013).
- Schmid-Burgk, J. L., Schmidt, T., Kaiser, V., Honing, K., Hornung, V. A ligation-independent cloning technique for high-throughput assembly of transcription activator-like effector genes. Nat. Biotechnol. 31, 76-81 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat. Biotechnol. 31, 822-826 (2013).
- Hermann, M., et al. Evaluation of OPEN zinc finger nucleases for direct gene targeting of the ROSA26 locus in mouse embryos. PLoS ONE. 7, (2012).
- Meyer, M., Ortiz, O., Hrabe de Angelis, M., Wurst, W., Kuhn, R. Modeling disease mutations by gene targeting in one-cell mouse embryos. Proc. Natl. Acad. Sci. U.S.A. 109, 9354-9359 (2012).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nat. Biotechnol. 29, 143-148 (2011).
- Guo, J., Gaj, T., Barbas, C. F. Directed evolution of an enhanced and highly efficient FokI cleavage domain for zinc finger nucleases. J. Mol. Biol. 400, 96-107 (2010).
- Doyon, Y., et al. Enhancing zinc-finger-nuclease activity with improved obligate heterodimeric architectures. Nat. Methods. 8, 74-79 (2011).
- Wefers, B., et al. . Current Protocols in Mouse Biology. , (2011).
- Wefers, B., Wurst, W., Kühn, R. . Current Protocols in Mouse Biology. , (2011).
- Haueter, S., et al. Genetic vasectomy-overexpression of Prm1-EGFP fusion protein in elongating spermatids causes dominant male sterility in mice. Genesis. 48, 151-160 (2010).
- Perez-Pinera, P., Ousterout, D. G., Brown, M. T., Gersbach, C. A. Gene targeting to the ROSA26 locus directed by engineered zinc finger nucleases. Nucleic Acids Res. 40, 3741-3752 (2012).
- Bultmann, S., et al. Targeted transcriptional activation of silent oct4 pluripotency gene by combining designer TALEs and inhibition of epigenetic modifiers. Nucleic Acids Res. 40, 5368-5377 (2012).
- Valton, J., et al. Overcoming TALE DNA binding domain sensitivity to cytosine methylation. J. Biol. Chem. 287, 38427-38432 (2012).
- Cradick, T. J., Ambrosini, G., Iseli, C., Bucher, P., McCaffrey, A. P. ZFN-Site searches genomes for zinc finger nuclease target sites and off-target sites. BMC Bioinform. 12, (2011).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Byers, S. L., Payson, S. J., Taft, R. A. Performance of ten inbred mouse strains following assisted reproductive technologies (ARTs). Theriogenology. 65, 1716-1726 (2006).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. J. Am. Assoc. Lab. Animal Sci. 50, 471-478 (2011).
- Pease, S., Saunders, T. L. . International Society for Transgenic Technologies. Advanced protocols for animal transgenesis : an ISTT manual. , (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339, 819-823 (2013).
- Mali, P., et al. RNA-Guided human genome engineering via Cas9. Science. 339, 823-826 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены