Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
От быстрого флуоресценции визуализации к молекулярной диффузии Закона о живых клеточных мембран в торговом микроскоп
В этой статье
Резюме
Spatial distribution and temporal dynamics of plasma membrane proteins and lipids is a hot topic in biology. Here this issue is addressed by a spatio-temporal image fluctuation analysis that provides conceptually the same physical quantities of single particle tracking, but it uses small molecular labels and standard microscopy setups.
Аннотация
Это становится все более очевидным, что пространственное распределение и движение мембранных компонентов, таких как липидов и белков являются ключевыми факторами в регуляции многих клеточных функций. Однако в связи с быстрым динамики и крошечных структур, вовлеченных, очень высокой пространственно-временное разрешение требуется, чтобы поймать реальное поведение молекул. Здесь мы представляем экспериментальный протокол для изучения динамики флуоресцентно меченных плазмы мембраны белков и липидов в живых клетках с высокой пространственно-временной резолюции. Следует отметить, что этот подход не требует, чтобы отслеживать каждую молекулу, но он вычисляет поведение населения, использующего все молекулы в данной области мембраны. Отправной точкой является быстрый визуализация данного региона на мембране. Впоследствии, полный пространственно-временной автокорреляционной функции рассчитывается корреляции полученных изображений на повышение временные задержки, например каждые 2, 3, N повторений. Можно показать, что ширинапика пространственных увеличивается автокорреляционной функции при увеличении времени задержки в зависимости от движения частиц за счет диффузии. Поэтому, фитинг серии функций автокорреляции позволяет извлечь фактический белка средний квадрат смещения от изображения (IMSD), здесь представлены в виде кажущегося коэффициента диффузии против среднего водоизмещения. Это дает количественную вид средних динамики одиночных молекул с нанометровой точностью. При использовании GFP-меченый вариант рецептора трансферрина (СКР) и ATTO488 меченого 1-пальмитоил-2-гидрокси-SN глицеро-3-фосфоэтаноламин (ИСЗ), то можно заметить, пространственно-временной регуляции липидного и белкового диффузии на микронных мембранных регионы в диапазоне времени микро-к-милли-второй.
Введение
Начиная с первоначального "мозаики жидкости" модели Зингера и Николсона, картина сотовой мембране постоянно обновляется в течение последних десятилетий, чтобы включить возрастающую роль цитоскелета и липидных доменов 1,2.
Первые наблюдения были получены методом флуоресцентной восстановления после фотообесцвечивания (FRAP) открытие, что значительная часть мембранных белков неподвижен 3-5. Эти пионерские исследования, хотя и очень информативным, пострадали от относительно низкого разрешения в пространстве (микрон) и время (в секундах) FRAP установок. Кроме того, будучи ансамбля измерение усреднения, FRAP не хватает в предоставлении информации о поведении одной молекулы.
В этом контексте, возможность специально маркировать одну молекулу с очень яркими тегов (позволяющих изучение процесса диффузии одной молекулы в то время) был очень успешным. В частности, нажаввременное разрешение на Одноместный Отслеживание частиц (SPT) подхода к шкале времени микросекунд, Кусуми и др. получили доступ к неизвестных особенностей динамики липидных и белковых что значительный вклад в признание роли актина основе мембранной скелета в мембранной физиологии 6 , 7. Эти данные генерируются так называемый "пикет и забор 'модель, в которой липидов и белков диффузии регулируется актина на основе скелета. Тем не менее, для того чтобы иметь доступ к огромному количеству информации, представленной ППП многих экспериментальных вопросов должны решаться. В частности, процедура маркировки, как правило, состоит из многих шагов, таких как производства, очистки и введения меченых видов в системе. Кроме того, большие наклейки, как квантовых точек или металлических наночастиц, часто требуется, чтобы достичь доли миллисекунды, временные рамки и сшивание молекул-мишеней по этикетке не можно было бы избежать во многих случаях. Наконец, многие траекториикоторые должны быть записаны в соответствии статистические критерии, и одновременно низкой плотности этикетки необходимо, чтобы отслеживать.
По сравнению с SPT, корреляционной спектроскопии флуоресценции (ФТС), преодолевая многие из этих недостатков, представляет собой очень перспективный подход к изучению молекулярной динамики. На самом деле, ФТС работает хорошо и с тусклыми и плотных этикеток, что позволяет изучать динамику флуоресцентных белков с метками молекул в временно трансфицированных клеток. Кроме того, это позволяет достичь высоких статистики в ограниченный период времени. Наконец, несмотря на "высокий" плотности этикеток FCS обеспечивает Одиночные молекулы информацию. Благодаря всем этим свойствам, ФТС представляет собой очень простой подход и широко применяется для изучения динамики липидов и белков как в модельных мембран и живых клеток 8-10. Многие различные подходы были предложены для повышения способности ФТС раскрыть детали молекулярной диффузии. Например, это было SHсамостоятельно, что, выполняя FCS на разного размера смотровых площадок можно определить "закону диффузии FCS" просветительских скрытые черты молекулярного движения 11,12. Помимо того, что изменились в размере, фокусное район был также дублируется 13, перемещается в пространстве по линиям 14-20 или сопряженных с быстрыми камерами 21,22. Использование этих "пространственно-временной" корреляцию подходы, соответствующие биологические параметры нескольких мембранных компонентов были количественно описаны на обеих модельных мембран и фактических биологических, получая таким образом понимание мембраны пространственной организации.
Тем не менее, во всех FRAP и приложений ФТС описанные до сих пор размер фокальной области представляет собой предел в пространственным разрешением, что не могут быть преодолены. Несколько методов визуализации супер-разрешения были недавно разработаны, чтобы обойти это ограничение. Некоторые из них основаны на точность локализации, такие как стохастической оптической микроскопии реконструкции (STORM) <вир> 23,24, локализация фотоактивация микроскопии (PALM) 25, флуоресценции PALM (FPALM) 26, и отслеживание PALM одночастичное (sptPALM) 27: относительно большое количество фотонов, необходимых на каждом снимке, однако, ограничивает временное разрешение эти методы, по крайней мере несколько миллисекунд, тем самым, препятствуя их применимость в естественных условиях.
В отличие от этого, перспективной альтернативой для визуализации суперразрешением были открыты пространственно модуляции флуоресцентное излучение с стимулированных методов истощения выбросов (STED или обратимых насыщающихся оптических переходов флуоресценции (RESOLFT)) 28,29. Эти подходы сочетают формирование объема наблюдательной скважине ниже дифракционного предела с возможностью использования быстрого сканирования микроскопы и системы обнаружения. В сочетании с анализом флуоресценции флуктуации, STED микроскопии позволило непосредственно исследовать наноуровне пространственно-временные динамику липидов и рroteins в живых клеточных мембран 30,31.
Те же физические величины STED основе микроскопии можно получить с помощью модифицированной пространственно-временной корреляции изображения спектроскопии (Stics 32,33) метод, который подходит для изучения динамики флуоресцентно-меченых мембранных белков и / или липидов в живых клетках и коммерческой микроскопом. Экспериментальный протокол, представленный здесь состоит несколько шагов. Первый требует быстрого получения изображения области интереса на мембране. Затем полученный Стек изображений используется для вычисления средних пространственно-временные корреляционные функции. Установив серию корреляционные функции, молекулярная 'диффузия закон' могут быть получены непосредственно из изображений в виде кажущейся диффузии (D приложения) - против усредненный участка смещения. Этот участок критически зависит от окружающей среды изучены молекулами и позволяет признавая непосредственно фактические режимы диффузиилипидной / интересующего белка.
Более подробно, как было показано ранее 34, пространственно-временное авто-корреляционная функция приобретенной серии изображений критически зависит от динамики молекул, движущихся в серии собраны изображения (обратите внимание, что те же самые рассуждения могут быть применены в приобретении линии где лишь одна в пространстве считается). В частности, мы определяем функцию корреляции, так:
 (1)
(1)
где  представляет измеренное интенсивности флуоресценции в положении х, у и в момент времени т,
представляет измеренное интенсивности флуоресценции в положении х, у и в момент времени т, ![]() и
и ![]() представляет собой расстояние по оси х иу направления соответственно,
представляет собой расстояние по оси х иу направления соответственно, ![]() представляет собой временной лаг, и
представляет собой временной лаг, и ![]() представляет собой среднее. Эта функция может быть выражена как:
представляет собой среднее. Эта функция может быть выражена как:
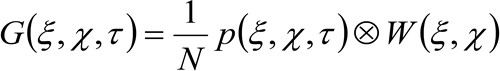 (2)
(2)
где 'N' представляет собой среднее число молекул в зоне наблюдения, ![]() представляет операцию свертки в пространстве, и
представляет операцию свертки в пространстве, и 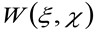 представляет автокорреляции инструментальной талии. Этот последний может быть интерпретирована как мера того, насколько фотоны одной излучателя разбросаны в пространстве за счет оптического / Recording Setup (так называемый функция рассеяния точки, PSF, генРалли хорошо аппроксимируется функцией Гаусса). И, наконец,
представляет автокорреляции инструментальной талии. Этот последний может быть интерпретирована как мера того, насколько фотоны одной излучателя разбросаны в пространстве за счет оптического / Recording Setup (так называемый функция рассеяния точки, PSF, генРалли хорошо аппроксимируется функцией Гаусса). И, наконец, 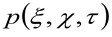 представляет собой вероятность найти частицу на расстоянии
представляет собой вероятность найти частицу на расстоянии ![]() и
и ![]() после задержки времени
после задержки времени ![]() . Если учесть, диффузным динамику, в котором частицы движутся беспорядочно во всех направлениях и чистые потоки не присутствуют, эта функция также хорошо аппроксимируется функцией Гаусса, где дисперсия может быть идентифицирован как средний квадрат смещения (MSD) движущейся частицы . Таким образом, талия корреляционной функции (также упоминается как
. Если учесть, диффузным динамику, в котором частицы движутся беспорядочно во всех направлениях и чистые потоки не присутствуют, эта функция также хорошо аппроксимируется функцией Гаусса, где дисперсия может быть идентифицирован как средний квадрат смещения (MSD) движущейся частицы . Таким образом, талия корреляционной функции (также упоминается как ![]() ), Может быть определен как сумма опорно частиц и инструментальной талии и может быть измерена с помощью гауссовой подгонкитин корреляционной функции для каждого времени задержки. Измеренное я МСД может быть использована для расчета кажущейся диффузии подвижных молекул
), Может быть определен как сумма опорно частиц и инструментальной талии и может быть измерена с помощью гауссовой подгонкитин корреляционной функции для каждого времени задержки. Измеренное я МСД может быть использована для расчета кажущейся диффузии подвижных молекул ![]() и среднее смещение
и среднее смещение ![]() как:
как:
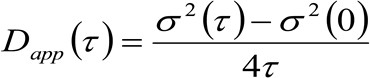 (3)
(3)
 (4)
(4)
Несколько соображений по экспериментальной установки можно вести читателя на протяжении следующих разделах. Для того, чтобы избирательно возбуждать флуорофоры на базальной мембране живой клетки мы будем использовать полное внутреннее отражение (TIR) освещение, используя коммерческий флуоресценции МДП (TIRF) микроскоп (подробности можно найти в разделе материалов). Кроме того, для того, чтобы собрать йэлектронной флуоресценции мы будем использовать большом увеличении цели (100X NA 1,47 высокой числовой апертурой требуется для освещения TIRF) и EMCCD камеры (физический размер пикселя на чип 16 мкм). Чтобы достичь размер пикселя 100 нм мы применяем дополнительную увеличением объектива фактор 1.6. Как будет показано ниже, временное разрешение ниже 1 мс необходимо будет правильно описывать динамику быстрых липидов мембран ниже 100 нм. Для того, чтобы достичь этой временное разрешение нам нужно выбрать область процентной (ROI) меньше, чем всего чипа камеры (512 х 512). Таким образом, камера будет читать уменьшенное количество линий увеличения временного разрешения. Тем не менее, в этом считывания режима сроки будет ограничено на время, необходимое для сдвига зарядов от воздействия на чип считывания на камеру и, как правило, в порядке миллисекундах для 512 х 512 пикселей EMCCD. Чтобы побить этот предел, новая технология позволяет сдвига ROI-линии только вместо целого кадра, жIth практической эффективного снижения открытой размеров кристалла (так называемый режим Обрезанные Датчик в нашей EMCCD). Для этой конфигурации, чтобы быть эффективным, чип за пределами ROI должны быть покрыты пару прорезей, установленных в оптическом пути. Благодаря этой установке временным разрешением до 10 -4 секунд может быть достигнуто. Пожалуйста, обратите внимание, однако, что этот подход может быть связан с различными экспериментальных установок, как описано в разделе «обсуждение».
Демонстрация метода будут представлены в живых клетках, с использованием как ATTO488 помечены 1-пальмитоил-2-гидрокси-Sn глицеро-3-фосфоэтаноламин (ATTO488-PPE) и GFP-меченых вариант рецептора трансферрина (GFP- TfR). В случае ATTO488-PPE этот подход может успешно восстанавливать почти постоянное D приложение в зависимости от среднего смещения, указывающего в основном свободную диффузию, как сообщалось ранее 30,35. В отличие от этого, TFR-GFP показывает убывающую D приложение в зависимости от среднего водоизмещения, предлагая частично ограниченном диффузию 6. Более того, в последнем случае можно дать количественную оценку локального коэффициента диффузии и среднюю области удержания в течение многих мкм на плоскости мембраны.
протокол
1 Система калибровки
- Функция рассеяния точки (PSF) калибровка
- Развести 10 мкл 30 нМ раствора флуоресцентного шарик (около 5 мкм) в 90 мкл дистиллированной воды, а затем разрушать ультразвуком раствора в течение 20 мин. Сокращение площади (1 см х 1 см) кусок агарозном геле (3%) и депозит 10 мкл раствора в верхней части геля. Переверните кусок геля на нижней стекле 2 см чашку Петри и выжать каплю на стекле.
- Включите настройки приобретения, положить образец в держатель, установить экспозицию камеры и EMgain (100 мс и 1000 хорошие параметры, но оптимизировать в соответствии с системой) и ждать камере остыть.
- Установите экспозицию камеры до 100 мс, камеры EMgain к 1000, режим приобретения в кадр трансфер, 100 повторение и автоматического сохранения настройки.
- Используя окуляр и проходящем свете фокус на границе геля, а затем перейти цели к центру геля, регулировать фокус и START процедуры регулировки лазера (в LAS AF, выберите 'Setup TIRF "и следуйте процедуру выравнивания авто).
- Найти поле зрения с выделенной отдельной пятен, точно сфокусироваться на яркой месте (что, как правило, представляет шарики агрегат) в качестве эталона, приобрести 100 кадров и повторите шаг 5-6 раз, чтобы приобрести несколько одиночных пятен.
- Импорт приобретенные серию на программы обработки данных и в среднем пачку в момент (рисунок 1а) и выбрать один изолированный шарик. Позаботьтесь, чтобы выбрать самые маленькие, чтобы избежать агрегатов частиц.
- Установите выбранный распределение интенсивности (пример одного профиля бисером представлено на рисунке 1b) с функцией Гаусса, используя команду "gaussfit" (в инструменты ICS-Matlab в материалах в Matlab). Убедитесь, благость подгонки путем проверки полученных остатков (пример оборудованная гауссова профиля с соответствующими остатков представлена Iн фиг.1В).
- Калибровки камеры
- Включите камеру и подождите, пока камера остынет. Установите для параметра приобретение камеры, (то есть, для используемого камеры мы установить экспозицию до 0,5 мс, камеры EMgain к 1000, режим приобретения до Обрезанное режиме размер ROI до 32 х 128, 10 000 повторений) и запустить сканирование фона камеры сигналов.
- Импорт приобрела серию кадров с программой обработки данных. Рассчитать и проверить среднюю интенсивность в каждом пикселе, чтобы убедиться, что фон камеры приблизительно равна квартиру в выбранной области чипа. В Обрезанное режиме, удалить первый и последние несколько горизонтальных линий (от 3 до 10 в зависимости от размера ROI) для каждого кадра, потому что фон камера обычно смещена в приграничных линий.
- Создать гистограмму значений (также определены Digital Уровень, DL) в полученных изображений стека (с помощью команды 'Hist' в Matlab) и построить логарифмрезультирующего частоту (с помощью semilogy команду в Matlab). Пример распределения DL для фона камеры представлена на рисунке 2.
ПРИМЕЧАНИЕ: Если камера работает хорошо, сюжет покажет примерно Gaussian пик (параболический профиль в логарифмической шкале), представляющую распределение ценностей, связанных с нулевой фотона с последующим экспоненциальное (в соответствии с отрицательным наклоном в логарифмической шкале ), который представляет собой распределение значений, связанных с 1 фотона (рисунок 2). В частности, центр и дисперсия функции Гаусса представляют камеру смещения и ошибок, соответственно, в то время как постоянная распада экспоненциальной части представляет собой оценку DL, присвоенный камере каждому одного фотона. В Matlab использовать раздел «CalibrateCamera" сценария в сопутствующих материалов. - Повторите операцию для всех выбранных камер EMGain и Gain.
2 МаркированныйПодготовка Сотовый
- Для получения липосом, необходимые для включения липидов 36, растворяют отдельно 1 мг DOPE (1,2-dioleoyl- SN глицеро-3-фосфоэтаноламин), 1 мг DOTAP (1,2-диолеоил-3-триметиламмоний-пропан), и 1 мг СИЗ-ATTO488 в 1 мл хлороформа. Смешать 0,5 мл прядильного раствора, 0,5 мл раствора DOTAP и 25 мкл PPE-ATTO488 решения и сушат в вакууме в течение 24 часов. Добавить 0,5 мл HEPES буфера 20 мм, вихревые в течение 15 мин и разрушать ультразвуком в течение 15 мин при 40 ° С.
- Чтобы подготовить клетку, промыть 3 раза PBS с p100 блюдо сливной СНО-К1 (яичника китайского хомячка), добавить 1 мл трипсина и хранить в инкубаторе в течение 5 мин. Приостановка отдельные клетки добавление 9 мл DMEM / F12, дополненной 10% FBS из семян и 150 мкл раствора клеток в чашке Петри, содержащей 800 мкл той же самой среды.
- Хранить в инкубаторе в течение 24 ч при 37 ° С и 5% СО 2. Для липидного включения, заменить клеточной среде с 500мкл бессывороточной среды; через 30 мин, добавляют 2 мкл раствора липосом; Через 15 мин смывают ПСБ и добавить новый DMEM / F12 среду для работы с изображениями.
- Для трансфекции, трансфекции клеток в соответствии с протоколом Lipofectamine (инструкциями производителя) с использованием TfR-GFP плазмиды и магазин с 24 часами в инкубаторе до визуализации.
3 сбора данных
- Подготовка установки
- Для того, чтобы термостат микроскопа, 24 ч до эксперимента включить в инкубатор.
- Для того чтобы применить наиболее быстро достижимое время захвата, работа в режиме Обрезанное Sensor (см введение) и использовать первую камеру для получения изображения (камеры 1) и второй камерой для выбора клеток (камера 2). Схема конфигурации установки представлена на рис дополнительного S1. Тогда, чтобы выровнять ход две камеры на микроскоп и ждать камеры, чтобы остыть.
- Установите на обеих камер параметры для проходящего света визуализации (т.е. , 20 мс для времени экспозиции, 1 для EM Gain) и поставить микроскопа в режиме светлого поля.
- Положите образцы в держатель и сфокусироваться с помощью окуляра, посылать свет в камеру 1 и аккуратно нажмите щели, позволяющие свет только на ROI, используемого для клеток томографии (здесь 32 х 32 пикселей ROI).
- Перемещение ячейки в выбранной области и посылать свет в камеру 2, а затем провести ROI в программном обеспечении, которые контролируют камеру 2 для того, чтобы иметь ссылку.
- Томография (3А)
- Прежде всего, выровнять TIRF лазер в соответствии с процедурой настройки вашей системы. В нашей установке, выберите 'Setup TIRF' и начать процедуру автоматического выравнивания. Когда выравнивается лазер установлен 70 нм глубины проникновения (около 70 °).
- Установите время экспозиции до 70 мс и EMGain до 100 на обоих камеры 1 и камеры 2; затем выберите ячейку с помощью камеры 1, а затем отправить свет на камере 2 и точно сфокусировать клеточную мембрану. Установить минимальное воздействие на окрой 2, 1000 EMGain, режим Обрезанные Датчик, 10 5 повторений и установить автосохранение как умещается файлы (Гибкий изображения транспортной системы, формат, который можно легко управлять).
- Начните приобретение для записи серии изображений. Отпустите усиления и обрезанной режим, позволяющий стабилизацию температуры до приобретения новой ячейки, а затем повторите последние два шага, чтобы приобрести 8-10 клеток.
4 Расчет средний квадрат смещения от визуализации (я MSD)
ПРИМЕЧАНИЕ: Следующий протокол может быть непосредственно применены к необработанным данным. В то же время, весь протокол действует для приобретения данных моделируемых как в Matlab и SimFCS. Ссылка на соответствующих учебников можно найти в разделе «Материалы».
- Расчет по Matlab
- Импорт приобретенные серию к Matlab, используя ImportImageSeries сценарий. Рассчитать среднюю интенсивность каждого изображения во времени с помощью сотрудничестваmmand значит на первых 2-х измерениях и использовать участок, чтобы увидеть результирующий вектор.
- Если более 10% из фотообесцвечивания присутствует, отбросить ряд или удалить первую часть из них. Если она ниже, попытаться устранить влияние на функцию корреляции путем вычитания к каждому изображению его среднюю интенсивность, как было показано выше 37.
- Рассчитать среднюю интенсивность каждого пикселя с помощью среднего на третьем измерении и увидеть результирующее изображение.
Примечание: Особое внимание необходимо для того, чтобы избежать артефактом корреляции. На самом деле, как было показано ранее для подобных методов 38, границ ячеек, а также из фокус-пузырьков может ввести сильную корреляцию. Если при осмотре средней изображение показывает границы ячеек или не в фокусе пузырьков, попробуйте исключить области, участвующей в противном случае отказаться от приобретения. Чтобы исправить эффект этого неподвижных структур вычесть среднюю временную интенсивность от каждого пикселя 39. - Рассчитать тон пространственно-временной корреляции (G (ξ, χ, τ)), используя функцию CalculateSTICScorrfunc. Удалить G (ξ, χ, 0), потому что корреляция в связи с дробового шума в условиях низкой освещенности режима доминирует G (0,0,0); корреляция в связи с детектором доминирует G (± 1,0,0), и движение частиц во время экспозиции может привести к деформации G (ξ, χ, τ) для τ = 0 за счет увеличения измеренного талии (этот эффект исчезает τ > 0) 34.
- Средний G (ξ, χ, τ> 0) с помощью логарифмической время-бен для снижения шума, используя функцию "LogBinStack" в вспомогательные материалы, а затем установите в результате G (ξ, χ, τ) с помощью функции "gaussfit" из инструменты ICS-Matlab в материалах для восстановления I MSD (второй столбец полученного массива).
- Участок полученный талии σ (τ) 2 (I MSD) в виде функции времени. Если данные слишком шумно, попробуйте увеличить количество acquIRED кадры, увеличить мощность лазера, средняя более G (ξ, χ, τ) вместе.
- Расчет по SimFCS
- Откройте приобретенные файлы с ImageJ помощью BioFormat плагин импортер и сохранить приобретенную серии как Tiff последовательности.
- Открыть SimFCS и выберите RICS инструмент и выберите Файл> Импорт нескольких изображений (Дополнительный Рис S2).
- Выберите Fit, вставить нужные параметры измерения и закройте размеру окна (Дополнительный Рис S3).
- Выберите Дисплей> средней интенсивности> CH1 и проверить наличие фотообесцвечиванию (Дополнительный Рис S4).
- Если более 10% из фотообесцвечивания присутствует отбросить ряд или, если это возможно нагрузка снова последовательность изображений удаления первую часть серии.
- Если отбеливания его ниже, чем 10% выберите Сервис> я MSD> Установка параметров, проверить 'Использование скользящей средней », устанавливается на панели ROI слевахариус рамы для скользящей средней обращая внимание, что время корреспондент выше, чем характерное время диффузии (для частицы, движущейся на 1 мкм 2 с -1 время 10 сек хорошая скользящая средняя)
- Выберите Инструменты> IMSD> Рассчитать я MSD (Дополнительный рисунок S5) и подходят и экспортировать Я MSD из блокнота (Дополнительный Рис S6).
5 Расчет Закона Diffusion от I MSD
- Установите первые несколько пунктов, чтобы экстраполировать перехват (σ 0 2) (5 баллов как правило, достаточно, но больше очков могут быть установлены, если они показывают линейное поведение) и сравнить это значение с ранее измеренной PSF 2. Если они сопоставимы, следят динамика изолированных флуорофорами. Напротив, если σ 0 2 >> PSF 2 попытка приобрести быстрее для того, чтобыникаких скрытых динамика присутствуют 34.
- Рассчитайте кажущуюся диффузии (D приложения) и среднее смещение (R), используя уравнения 3 и 4 (см Введение).
- Участок D приложения в виде функции R, чтобы получить диффузионный закон, сравнимую с тем, что измеряется с изменением точечной основе ФТС 12 (Рисунок 3D).
Результаты
Для калибровки инструментальную талию, образ одной люминесцентной нано-шарик может быть мера, как описано в протоколе стадии 1.1. Типичный флуоресцентное изображение этих шариков представлена на рисунке 1. Место распределения интенсивности по 2D-функции Гаусса отдает хорош?...
Обсуждение
Одноместный отслеживания частиц (SPT) представляет собой одну из наиболее распространенных стратегий для изучения молекулярной динамики и он имеет большое преимущество измерения траектории частиц. Это, в свою очередь, позволяет зондирующего поведение даже несколько меченых частиц в с...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work is supported in part by NIH-P41 P41-RRO3155 and NIH P50-GM076516 (grant to EG), and Fondazione Monte dei Paschi di Siena (grant to FB).
Материалы
| Name | Company | Catalog Number | Comments |
| iXon Ultra 897 | Andor | DU-897U-CS0 | |
| Solis | Andor | ||
| CHO-K1 | ATCC | CCL-61 | |
| ATTO 488 labeled PPE | ATTO-TEC GmbH | AD 488-151 | |
| DOPE | Avanti Polar Lipids, Inc. | 850725 | |
| DOTAP | Avanti Polar Lipids, Inc. | 890890 | |
| 100x Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | |
| DMEM/F-12 | Gibco | 21331 | |
| FBS | Gibco | 10082147 | |
| HEPES | Gibco | 15630-106 | |
| PBS | Gibco | 10010-023 | |
| SimFCS 3.0 | Globals Software | the software can be downloaded here: http://www.lfd.uci.edu/globals/ | |
| DMI6000 with TIRF modulus | Leica | ||
| LAS AF | Leica | ||
| Lipofectamine 2000 | Lipofectamine | 11668019 | |
| Matlab | MathWork | ||
| ImageJ | NIH | ||
| [header] | |||
| C-terminal GFP tagged Tranferrin Receptor | OriGene | RG200980 | |
| Agar | Sigma Aldrich | A5306 | |
| Chloroform | Sigma Aldrich | 528730 | |
| Latex beads, fluorescent yellow-green, 30 nm | Sigma Aldrich | L5155 | |
| SONICA Ultrasonic Cleaners | SOLTEC | ETH S3 | |
| Petri Dishes | Willco | GWSt-3522 | |
| Bio-Format importer for Matlab | http://www.openmicroscopy.org/site/support/bio-formats5/users/matlab/ | ||
| ICS-MatLab Tools | https://www.cellmigration.org/resource/imaging/software/ICSMATLAB_28-02-06.zip | ||
| Simulation by Matlab Tutorial | https://www.cellmigration.org/resource/imaging/icsmatlab/ICSTutorial.html | ||
| Simulation by SimFCS Tutorial | https://www.cellmigration.org/resource/imaging/ppt-pdf/RICS%20Simulations.ppt | ||
Ссылки
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Vereb, G., et al. yet structured: The cell membrane three decades after the Singer-Nicolson model. Proc. Natl. Acad. Sci. U. S. A. 100 (14), 8053-8058 (1073).
- Ishihara, A., Hou, Y., Jacobson, K. The Thy-1 antigen exhibits rapid lateral diffusion in the plasma membrane of rodent lymphoid cells and fibroblasts. 84 (5), 1290-1293 (1987).
- Axelrod, D., et al. Lateral motion of fluorescently labeled acetylcholine receptors in membranes of developing muscle fibers. Proc. Natl. Acad. Sci. U. S. A. 73 (12), 4594-4598 (1976).
- Jacobson, K., Derzko, Z., Wu, E. S., Hou, Y., Poste, G. Measurement of the lateral mobility of cell surface components in single, living cells by fluorescence recovery after photobleaching. J. Supramol. Struct. 5 (4), 10-1002 (1976).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annu. Rev. Biophys. Biomol. Struct. 34, 351-378 (2005).
- Kusumi, A., Ike, H., Nakada, C., Murase, K., Fujiwara, T. Single-molecule tracking of membrane molecules: plasma membrane compartmentalization and dynamic assembly of raft-philic signaling molecules. Semin. Immunol. 17 (1), 3-21 (2005).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36, 176-182 (1999).
- Gielen, E., et al. Diffusion of sphingomyelin and myelin oligodendrocyte glycoprotein in the membrane of OLN-93 oligodendroglial cells studied by fluorescence correlation spectroscopy. C. R. Biol. 328 (12), 1057-1064 (2005).
- Weiss, M., Hashimoto, H., Nilsson, T. Anomalous protein diffusion in living cells as seen by fluorescence correlation spectroscopy. Biophys. J. 84, 4043-4052 (2003).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophys. J. 89 (6), 4029-4042 (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO J. 25 (14), 3245-3256 (2006).
- Ries, J., Schwille, P. Studying slow membrane dynamics with continuous wave scanning fluorescence correlation spectroscopy. Biophys. J. 91 (5), 1915-1924 (2006).
- Ruan, Q., Cheng, M. A., Levi, M., Gratton, E., Mantulin, W. W. Spatial-temporal studies of membrane dynamics: scanning fluorescence correlation spectroscopy (SFCS). Biophys. J. 87 (2), 1260-1267 (2004).
- Berland, K. M., So, P. T., Chen, Y., Mantulin, W. W., Gratton, E. Scanning two-photon fluctuation correlation spectroscopy: particle counting measurements for detection of molecular aggregation. Biophys. J. 71, 410-420 (1996).
- Heinemann, F., Betaneli, V., Thomas, F. A., Schwille, P. Quantifying lipid diffusion by fluorescence correlation spectroscopy: a critical treatise. Langmuir. 28 (37), 13395-13404 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Capturing directed molecular motion in the nuclear pore complex of live cells. Proc. Natl. Acad. Sci. U. S. A. 109 (25), 9863-9868 (2012).
- Sanchez, S. A., Tricerri, M. A., Gratton, E. Laurdan generalized polarization fluctuations measures membrane packing micro-heterogeneity in vivo. Proc. Natl. Acad. Sci. U. S. A. 109 (19), 7314-7319 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Fluorescence correlation spectroscopy of intact nuclear pore complexes. Biophys. J. 101 (4), 27-29 (2012).
- Di Rienzo, C., et al. Unveiling LOX-1 receptor interplay with nanotopography: mechanotransduction and atherosclerosis onset. Sci. Rep. 3, 10-1038 (2013).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophys. J. 95 (11), 5385-5398 (2008).
- Kannan, B., et al. Electron multiplying charge-coupled device camera based fluorescence correlation spectroscopy. Anal. Chem. 78 (10), 3444-3451 (2006).
- Jones, S. A., Shim, S. H., He, J., Fast Zhuang, X. three-dimensional super-resolution imaging of live cells. Nat. Methods. 8 (6), 499-508 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy. 3 (10), 793-795 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Klar, T. A., Hell, S. W. Subdiffraction resolution in far-field fluorescence microscopy. Opt. Lett. 24 (14), 954-956 (1999).
- Eggeling, C., et al. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457 (7233), 1159-1162 (2009).
- Hedde, P. N., et al. Stimulated emission depletion-based raster image correlation spectroscopy reveals biomolecular dynamics in live cells. Nat. Commun. 4, .
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88 (5), 3601-3614 (2005).
- Brown, C. M., et al. Probing the integrin-actin linkage using high-resolution protein velocity mapping. J. Cell Sci. 119, 5204-5214 (2006).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proc. Natl. Acad. Sci. U. S. A. 110 (30), 12307-12312 (2013).
- Mueller, V., et al. STED nanoscopy reveals molecular details of cholesterol- and cytoskeleton-modulated lipid interactions in living cells. Biophys. J. 101 (7), 1651-1660 (2011).
- Kleusch, C., Hersch, N., Hoffmann, B., Merkel, R., Csiszar, A. Fluorescent lipids: functional parts of fusogenic liposomes and tools for cell membrane labeling and visualization. Molecules. 17 (1), 1055-1073 (2012).
- Ries, J., Chiantia, S., Schwille, P. Accurate determination of membrane dynamics with line-scan FCS. Biophys. J. 96 (5), 1999-2008 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49 (3), 141-164 (2007).
- Digman, M. A., et al. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89 (2), 1317-1327 (2005).
- Ritchie, K., et al. Detection of non-Brownian diffusion in the cell membrane in single molecule tracking. Biophys. J. 88 (3), 2266-2277 (2005).
- Voie, A. H., Burns, D. H., Spelman, F. A. Orthogonal-plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J. Microsc. 170, 229-236 (1993).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Wohland, T., Shi, X., Sankaran, J., Stelzer, E. H. Single plane illumination fluorescence correlation spectroscopy (SPIM-FCS) probes inhomogeneous three-dimensional environments. Opt. Express. 18 (10), 10627-10641 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены