Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Facile Получение 4-замещенных производных хиназолина
В этой статье
Резюме
A protocol for facile preparation of 4-substituted quinazoline derivatives from 2-aminobenzophenones, thiourea and dimethyl sulfoxide is presented.
Аннотация
Отмеченные в данной работе является очень простой метод для прямого получения 4-замещенных производных хиназолина от реакции между замещенных 2-aminobenzophenones и тиомочевиной в присутствии диметилсульфоксида (ДМСО). Это уникальный комплементарной реакционную систему, в которой тиомочевины претерпевает термическое разложение с образованием карбодиимида и сероводород, в котором бывшие реагирует с 2-аминобензофенона образовывать 4-фенилхиназолин-2 (1H) -imine промежуточное, в то время как сероводород реагирует с ДМСО с получением метантиол или другой серосодержащих молекула, которая затем функционирует как комплементарной восстановителем, чтобы уменьшить 4-фенилхиназолин-2 (1H) -imine промежуточное в 4-фенил-1,2-дигидрохиназолин-2-амина. Впоследствии, устранение аммиака из 4-фенил-1,2-дигидрохиназолин-2-амина дает замещенный хиназолина. Эта реакция обычно дает производное хиназолина в виде одного продукта, возникающего из 2-аминобензофенона что контролируют с помощью ГХ / МСАнализ, наряду с небольшим количеством серосодержащих молекул, таких как диметилдисульфид, диметиловый трисульфида и т.д. Реакцию обычно завершает в 4-6 ч при 160 ° С в небольшом масштабе, но может длиться в течение 24 ч при осуществляться в больших масштабах. Продукт реакции может быть легко очищен путем смывания ДМСО водой с последующей хроматографией на колонке или тонкослойной хроматографии.
Введение
Замещенные хиназолины, в качестве уникального типа гетероциклов, были известны в течение различных биологических активностей, в том числе антибиотиков, 1 антидепрессант, 2 противовоспалительным, 3,4 антигипертензивный препарат, 3 противомалярийное, 5 и противоопухолевое, 6 среди других , Более того, 4-замещенных хиназолины, например, 4-арил-хиназолины, с анти-плазмодия деятельности 7 были признаны рецептор эпидермального фактора роста (EGFR) ингибиторов тирозинкиназы, 8 депрессантов ЦНС, 9 и антибиотики против метициллин-устойчивый золотистый стафилококк и ванкомицин-устойчивые Enterococcus фекальный. 10 из-за своего широкого спектра биологической активности, методы синтеза замещенных хиназолинов были в значительной степени изучены. В качестве примера, более 25 синтетические методы уже сообщалось для приготовления 4-phenylquinazolines. 11 Repпредставительную методы включают образование 4-phenylquinazolines из 2-aminobenzophenones и формамида в присутствии бора трифторида бора (BF 3 · Et 2 O) 12 или муравьиную кислоту, 13 или по реакции 2-aminobenzophenones с уротропина и этилбромацетата, 14 или реакция с альдегидом и ацетатом аммония в присутствии окислителя. 15
В отличие от описанных выше реакций с использованием чувствительного к влаге реагента (например, BF 3 · Et 2 O) или дорого реагент (например, уротропина и этилбромацетата), A поверхностное метод, который можно легко конвертировать 2-aminobenzophenones в соответствующие 4-phenylquinazolines в диметилсульфоксиде ( ДМСО) в присутствии тиомочевины была изучена. Широко механистические исследования по этой реакции указывают, что это является дополнительным реакцию, в которой тиомочевины претерпевает термическое разложение с образованием карбодиимида исероводород, где карбодиимид реагирует с 2-аминобензофенона с образованием 4-фенилхиназолин-2 (1H) -imine промежуточное, в то время как используется ДМСО не только как растворитель, но и реагента, чтобы генерировать серосодержащих восстанавливающим реагентом, когда он вступает в реакцию с водородом сульфид (также вытекающие из тиомочевины). Затем серосодержащие восстанавливающие агенты уменьшают 4-фенилхиназолин-2 (1H) -imine промежуточного чтобы сформировать 4-фенил-1,2-дигидрохиназолин-2-амин, который подвергается устранение аммиаком с образованием 4-фенилхиназолина. Эту реакцию обычно проводят при температуре от 135-160 ° С, и может быть легко выполнена посредством традиционных нагрева на масляной бане на плите или в условиях микроволнового излучения. Эту реакцию обычно показано на рисунке 1 ниже.
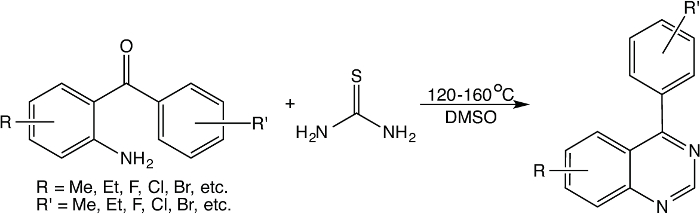
Рисунок 1: Общая реакция между 2-аминобензофенона итиомочевины в ДМСО. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
протокол
Внимание: Пожалуйста, обратитесь все соответствующие паспорта безопасности материала (MSDS) перед использованием. Хотя 2-aminobenzophenones не имеют запаха, некоторые серосодержащие молекулы образуются в этой реакции. Поэтому всегда следует использовать хорошее состояние вентиляции. Пожалуйста использовать всю соответствующую практику безопасности при выполнении реакции при температуре выше 140 ° С, а давление может пойти выше 5 бар, как записано в условиях микроволнового излучения. Когда температура устанавливается на 160 ° C, максимальное давление записанная 21 бар, что почти верхний предел СВЧ реактор может работать. Хотя давление не является проблемой, когда реакцию проводят в масляной ванне при кипячении, хорошая вентиляция всегда должны быть использованы.
1. Получение 4-фенилхиназолина в Малый при микроволновом облучении
- Получение реакционной смеси
- Добавить совместимый магнитной мешалкой, чтобы микроволновая реакционную трубку 2-5 мл.
- Используйте аналитические весы и взвешивают 0.0866 г 2-аминобензофенона (желтый порошок), 0.0988 г тиомочевины (белого кристалла, 3 экв) в вышеуказанной реакционной трубки.
Примечание: Оптимальное соотношение между 2-аминобензофенона и тиомочевины составляет 1: 3. - Передача 5 мл ДМСО к реакционной трубки.
Примечание: Количество ДМСО является достаточно гибким, 5 мл ДМСО почти достаточно для удовлетворения минимальных требований к объему для правильного поглощения микроволновой печью в соответствии с руководством изготовителя. Тем не менее, при термическом состоянии, гораздо меньше растворителя необходим для реакции такого масштаба. - Уплотнение реакционной трубки с совместимым алюминиевой крышкой, содержащей резиновую мембранным впускным приспособлением.
- Энергично встряхните трубки на вихревом смесителе в течение 1-2 мин, чтобы растворить реагенты.
Примечание: Тиомочевина не может полностью растворить в ДМСО при комнатной температуре, но она будет полностью растворяются при применении тепла. - Используйте микро-шприц вывести 5 мкл реакционной смеси к 2 мл стеклянный хampling трубки, содержащей 0,35 мл этилацетата (EtOAc) для газовой хроматографии / масс-спектрометрии (ГХ / МС) анализа, прежде чем начала реакции.
- Формирование 4-фенилхиназолина при микроволновом облучении
- Включите микроволновом реакторе, поставить реакционную трубку микроволновую в одном из держателей труб восьми.
- Параметры реакции Настройка через сенсорный экран, такие как расположение трубки (например, от скважины 1 до 8), тип трубы (например, 2-5 мл), температура реакции (при 150 ° С), предварительно перемешивании длительности (1 мин), уровень микроволновое поглощение (высокий), скорости перемешивания (600 оборотов в минуту), и время реакции (5 ч).
- После того как все параметры настройки правильно, нажмите кнопку "Выполнить", робот автоматически подобрать реакционную трубку из держателя трубки (или же) и поместить его внутри нагревательной отверстие. Затем микроволновом реакторе будет запускать реакцию в соответствии с параметрами, установленными до ранее.
- Когда микроволновое облучение завершения жайт до температуры падает почти до 30 ° С, робот будет забрать реакционной трубки и положить его обратно в исходное держателя.
- Используйте микро-шприц вывести 5 мкл реакционной смеси (прозрачный желтый раствор, нет нерастворимое вещество наблюдалось) и добавить его к другому 2 мл пробирке для отбора образцов стекла, содержащего 0,35 мл EtOAc для анализа GC / MS.
- Как показал анализ ГХ / МС показывает, что реакци не закончено, настроить микроволновую реакцию той же пробирке в течение еще 5 ч при той же температуре.
Примечание: Время реакции изменяется в зависимости от количества используемого исходного материала, концентрация реакционного раствора, замещающие группы на 2-aminobenzophenones, и что более важно, температуру реакции. Например, реакция 0,3 г 2-аминобензофенона в 3 мл ДМСО завершит в 6 ч при 160 ° С, но длится более 14 ч при 140 ° С под воздействием микроволнового излучения обоих и плитой нагрева. Рекомендуется также, чтобы контролировать реакции рeriodically с ГХ или ГХ анализа / MS. Люди, не имеющие доступа к ГХ или ГХ / МС должен затем использовать тонкослойной хроматографии (ТСХ), чтобы следить за реакцией, хотя это не самый лучший инструмент.
- ГХ / МС анализ реакционной смеси
- Убедитесь ГХ / МС, правильно ли установлена в соответствии с протоколом производителя.
- Поместите трубки отбора проб стекла на авто-сэмплер лоток.
- Нажмите кнопку "GCMS_3" ярлык на мониторе, чтобы начать программу сбора данных, который управляет и координирует функции инжектора ГХ и масс-спектрометра. Загрузите правильный метод, нажав кнопку "Метод" в раскрывающемся меню и выделив "метод загрузки." Выбранный метод содержит все необходимые параметры для обоих GC и четырехместные масс-спектрометр для анализа целевые выборки. Если нет такой метод, создать нужный метод.
- Для нового образца, если изменить некоторые параметры GC в соответствии с определенным образец, выделить "Редактировать Entirе Метод ", нажав кнопку" Метод "из выпадающего меню и изменить соответствующие параметры соответственно. Параметры GC, которые часто изменяются являются начальная температура и продолжительность, чтобы удерживать эту температуру, скорость повышения температуры, конечная температура и продолжительность чтобы поддерживать температуру, количество впрыска, времена мыть инъекционной иглой до и после инъекции, времени выравнивания и пост во время выполнения, а температура после запуска.
- Для этого эксперимента, установить начальную температуру GC при 70 ° С (1 мин), с увеличением скорости от температуры при 20 ° С / мин, и конечной температуры на 250 ° C (5 мин). Используйте общее время работы 15 мин. Используйте вводимый объем 2 мкл, с 4 предварительной стирки и 4 после-моет иглы. Используйте чистый гелий в качестве газа-носителя, используемого при таком условии.
Примечание: метод анализа ГХ / МС содержит параметры заданные для запуска как GC и MS инструменты. Параметры FOг ГХ включают начальную температуру печи для нагрева колонки ГХ и количество минут, чтобы сохранить эту температуру, скорость, чтобы повысить температуру печи, конечная температура печи, а количество минут, чтобы сохранить конечную температуру до того, ГХ анализ завершается; количество образца впрыскивают; раскол скорость газа-носителя; количество раз, чтобы промыть иглу до того пробу вводят; и количество раз, чтобы промыть иглу после того как образец впрыскивается; т.д. Выбор начальных и конечных температурах, а также скорость повышения температуры зависит от характера анализируемого образца. В общем, неполярные молекулы низкокипящих анализируются при относительно низкой начальной температуре.
- Настройте Масс-спектрометр в соответствии с протоколом производителя.
- После того, как метод работает выбран, нажмите кнопку "Инструмент" в верхней части выпадающего меню, и изюминка "Tune MSD». Затем другое окнопоявляется в передней части окна сбора данных. Можно выбрать "Tune MSD" или "QuickTune", и нажмите кнопку "OK", чтобы начать процесс настройки из масс-спектрометра. Опция "QuickTune" занимает около 3 минут, чтобы закончить, в то время как опция "Tune MSD" работает около 10 мин. В обычной ситуации, опция "QuickTune" достаточно хорош, чтобы откалибровать масс-спектрометра с точностью до 0,1 Далтон. Процесс настройки будет измерять относительное обилие пика 69 219 и 502 перфтортрибутиламин (PFTBA), а также на сумму N 2, O 2, H 2 O, CO 2, и т.д.
Примечание: Масс-спектрометр должен быть откалиброван каждый день, чтобы иметь точное измерение массы. Настройка настроить параметры для масс-спектрометр работал правильно, такие как напряжения четверки, вакуума массового детектора, фоновый шум, стандартные пики оценить масс-спектрометра,и т.д. Можно выбрать либо автонастройки или ручной режим мелодия для калибровки масс-спектрометра, то есть путем выбора "QuickTune" или опцию "Настройка МСД".
- После того, как метод работает выбран, нажмите кнопку "Инструмент" в верхней части выпадающего меню, и изюминка "Tune MSD». Затем другое окнопоявляется в передней части окна сбора данных. Можно выбрать "Tune MSD" или "QuickTune", и нажмите кнопку "OK", чтобы начать процесс настройки из масс-спектрометра. Опция "QuickTune" занимает около 3 минут, чтобы закончить, в то время как опция "Tune MSD" работает около 10 мин. В обычной ситуации, опция "QuickTune" достаточно хорош, чтобы откалибровать масс-спектрометра с точностью до 0,1 Далтон. Процесс настройки будет измерять относительное обилие пика 69 219 и 502 перфтортрибутиламин (PFTBA), а также на сумму N 2, O 2, H 2 O, CO 2, и т.д.
- Приобретение GC / MS Data
- Редактировать последовательность сбора данных. Нажмите «последовательность» в верхней части выпадающего меню, чтобы выделить "Редактировать последовательность", и новое окно, в котором информация о пробах должны быть введены, например, типа образца (образца, пустой, калибровки, QC и т.д.), расположение образца флаконе (от 1 до 100), имя образца, имя файла данных, замечаний образца, и т.д. Когда все образцы информация была введена, нажмите кнопку "ОК". Затем нажмите «последовательность» в верхней части выпадающего меню, чтобы выделить "Сохранить последовательности, как .." и введите название последовательность в соответствующей папке.
- Приобретение / MS данные GC. Нажмите «последовательность» в верхней части выпадающего меню, чтобы выделить "Последовательность выполнения", выберитенадлежащее "Справочник файла данных", чтобы сохранить полученные данные, а затем нажмите кнопку "Выполнить последовательность", чтобы начать процесс сбора данных.
- Анализ ГХ / МС Результаты
Примечание: Молекулы могут быть охарактеризованы минут они элюированных из колонки ГХ, так называемый время удерживания. При этом же условии GC (т.е. вышеупомянутые параметры GC), время удерживания определенной молекулы очень воспроизводимым. Соединение может быть дополнительно подтверждена ее масс-спектра. Можно легко определить соединения с точки зрения времени удерживания и масс-спектр, и проверки чистоты соединения, а также.- Дважды нажмите кнопку "GCMS_3 Анализ данных" ярлык на мониторе, чтобы открыть программное обеспечение, которое намеренно обрабатывает полученные данные от GC / MS машине.
- В процессе сбора данных, чтобы увидеть мгновенный результат анализируемого образца, нажмите кнопку "Файл" из выпадающего меню и highligHT "Сделать снимок", чтобы получить синхронизированную GC спектр образца. Часто, люди будут обрабатывать данные после завершения процесса приобретения. В этом случае, нажмите кнопку "Файл" из выпадающего меню, чтобы выделить "Load File Data" и выберите нужный файл данных, или просмотреть каталог данных и дважды щелкните файл данных, чтобы показать всю GC спектр образца. Вертикальная линия появляется в месте, где мышь указал на внутри окна ГК спектра.
- Перемещение мыши к центру пика, где вертикальная линия упирается самую высокую точку пика, а затем дважды нажмите правую кнопку мыши для вызова масс-спектр образца в новом окне под окном ГК спектра. Можно увеличить спектр масс, удерживая левую кнопку и выберите регион для увеличения для детализации спектра масс.
- Определить соединения, дважды щелкнув правой кнопкой мыши внутри окна Масс-спектр для получения двух новых окон. Маленькийпереднего стекла с именем "РВМ Результаты поиска: C: Database W8N08.L" воспитывает 20 молекул из базы данных, что, скорее всего, соответствует анализируемый масс-спектр, и ранжирует 20 молекул в порядке их сходства. Большое заднее окно содержит две панели, из которых верхняя панель отображает исходное масс-спектр анализируемого пика внутри спектра ГХ, и нижняя панель отображает спектр масс выбранной молекулы из списка небольшой витрине. Часто, обычные органические соединения может быть подтверждена сравнением его масс-спектр со стандартным масс-спектра, собранной в базе данных. Хотя новые соединения или молекулы не собранные в базе данных не могут быть непосредственно подтверждены, их личности могут быть получены путем согласования ожидаемой молекулярной массы и возможных фрагментов с их структурами.
- Определить же соединение в различных образцах путем сравнения его времени удержания на спектре ГХ. В рамках этого же состояния acqu данныхisition, и то же соединение должно появиться с той же временем удерживания на спектр ГХ.
- Анализ чистоты образца, нажав кнопку "хроматограмме" в выпадающем меню, выделив либо "Интеграция" или "AutoIntegrate", и выбрав "процент отчет".
- Печать как спектр ГХ и масс-спектры, соответствующие пикам внутри спектра ГХ в любой портрет или альбомном формате, выбрав "Настройка принтера", когда один щелчок "Файл" в раскрывающемся меню. Кроме того, печать спектров непосредственно в формате PDF, выбрав Converter PDF.
- Экстракция реакционной смеси
Примечание: Процесс изоляции была проведена в вытяжном шкафу, а небольшое количество серосодержащих молекул с неприятным запахом генерируются в этой реакции.- Открыть микроволновая реакционную трубку с изготовлением условии плоскогубцев, и передавать реакционной смеси в 125 мл делительную воронку.дд 20 мл EtOAc к этой воронке следуют 10 мл воды.
Примечание: Если реакционный раствор выдерживали при комнатной температуре в течение одного дня, формой кристаллов длиной иглы могут появиться в растворе в зависимости от концентрации раствора. Таким образом, имеет смысл оставить крупномасштабную реакционной смеси при комнатной температуре с образованием кристалл и выделения продукта из кристалла непосредственно, если время не является фактором. - Встряхнуть делительную воронку энергично, и слейте нижний водный слой. Затем добавить еще 10 мл воды к делительной воронке, и повторить этот процесс.
- Концентрат оставшийся раствор EtOAc до примерно 1 мл путем вращательного испарения.
- Открыть микроволновая реакционную трубку с изготовлением условии плоскогубцев, и передавать реакционной смеси в 125 мл делительную воронку.дд 20 мл EtOAc к этой воронке следуют 10 мл воды.
- Очистка 4-фенилхиназолина с помощью препаративной ТСХ
- Перенести концентрированный раствор EtOAc с пипетки Пастера до 20 см х 20 см препаративной ТСХ пластину таким образом, что полоса образца на ТСХ-пластинку шириной менее 1 см и составляет около 1 см от края. Dip эту пластину к GLAсс камеру, содержащую 150 мл гексана и EtOAc (2: 1). Смотрите движение границы растворителя, приближающейся к верхней части пластины ТСХ и вынуть пластину, когда граница растворителя составляет около 1 см от верхнего края.
- Нарисуйте две прямые линии на пластине ТСХ с карандашом, чтобы отметить место перед загрузкой образца. Кроме того, окунуть пластины тонкослойной хроматограммы в стеклянную камеру таким образом, что полоса образца находится на дне, но все еще около 2 мм над уровнем растворителя.
- Под ультрафиолетовым (УФ), используйте карандаш, чтобы отметить группу с зеленой флуоресценции, а сотрите заметное группу на пластине ТСХ на взвешивающей бумаге (с относительной подвижности R F = 0,68, гексан / этилацетат = 2 : 1).
Примечание: Из-за высокой чувствительности УФ-поглощению, можно наблюдать несколько слабые полосы на пластине. Тем не менее, в самом верху группы часто соответствуют серосодержащих молекул, таких как диметиловый дисульфид, диметиловый трисульфида; другие полосы ниже 4-фенилхиназолина являются visiblе но их количество слишком мало, чтобы быть выделен и охарактеризован. - К стеклянной пипетки, заполненной стекловатой, передать поцарапанные порошкообразного силикагеля с пипеткой путем складывания весом бумаги по диагонали, чтобы порошок силикагеля падает в пипетку, и нажмите пипетки на твердую поверхность, чтобы упаковать кремнегель плотный , Промыть пипетку с ацетоном (8-15 мл) в сцинтилл ционный флакон на 2-барабана.
- Передача 0,35 мл элюированной раствором ацетона в другую 2 мл стеклянной трубки отбора проб для ГХ анализа / MS, а непосредственно высушить оставшийся раствор ацетона на роторном испарителе. Поместите всю сцинтилляционный флакон, содержащий очищенного соединения в вакуумном эксикаторе для дальнейшей сушки.
Примечание: До этой стадии, продукт очищают и могут быть использованы для дальнейшей характеристики (например, ядерный магнитный резонанс (ЯМР)) или дополнительных преобразований.
- Перенести концентрированный раствор EtOAc с пипетки Пастера до 20 см х 20 см препаративной ТСХ пластину таким образом, что полоса образца на ТСХ-пластинку шириной менее 1 см и составляет около 1 см от края. Dip эту пластину к GLAсс камеру, содержащую 150 мл гексана и EtOAc (2: 1). Смотрите движение границы растворителя, приближающейся к верхней части пластины ТСХ и вынуть пластину, когда граница растворителя составляет около 1 см от верхнего края.
2. Получение 4-фенилхиназолина яп Малый помощью конфорка Отопление
Примечание: Процедуры GC / MS анализа реакционной смеси, экстракции реакционной смеси, и очистка продукта реакции очень похожи на те, которые описаны в разделе 1 (1.1.1-1.3.4, 1.4.1-1.4.3 и 1.5.1-1.5.5, соответственно), так что большинство из этих шагов ниже будет опущено.
- Получение реакционной смеси для конфорки нагрева
- Взвесить 0,0240 г 2-аминобензофенона и 0,0280 г тиомочевины в стеклянную пробирку 2 мл, а затем перенести 0,5 мл ДМСО в той же пробирке, и закройте пробирку с завинчивающейся крышкой.
Примечание: Сумма ДМСО использовали при этом условии намного меньше, чем тот, в условиях микроволнового излучения. Благодаря небольшому размеру этого реакции, магнитное перемешивание больше не нужен, так что для вихревого перемешивания раствора, чтобы растворить реагенты. Тем не менее, в относительной большой масштаба реакции, например, в 2-барабана сцинтилляционный сосуд или круглодонную колбу, магнитной мешалкипо-прежнему необходима.
- Взвесить 0,0240 г 2-аминобензофенона и 0,0280 г тиомочевины в стеклянную пробирку 2 мл, а затем перенести 0,5 мл ДМСО в той же пробирке, и закройте пробирку с завинчивающейся крышкой.
- Получение 4-фенилхиназолина помощью конфорка Отопление
- Внутри вытяжном шкафу, положить нагревательный блок сверху плиты, и установленной температуры до 160 ° C.
- Когда температура достигает 160 ° C, вставить стеклянный пузырек в одной из скважин в блоке нагрева. С примерно полчаса интервала, вынуть из флакона и встряхните его рука в течение 2-3 сек, и положил его обратно в скважину снова. После 6 часов, вынуть из флакона и оставить его внутри вытяжного шкафа, чтобы остыть.
- Передача 5 мкл реакционной смеси в другую 2 мл пробоотборной трубке стекла, содержащего 0,35 мл EtOAc и представить образец для анализа ГХ / МС.
- Как только реакция завершается, выработать продукт, как описано в разделе 1. Подробности смотрите в разделе 1.1.1-1.3.4, 1.4.1-1.4.3, 1.5.1-1.5.5 и для GC / MS анализа, извлечение реакционной смеси и очистки продукта, соответственно.
Результаты
ГХ анализ реакционной смеси перед реакцией, 5 ч после реакции в условиях микроволнового излучения, и 10 ч после реакции в условиях микроволнового облучения при 150 ° С представлены на рисунке 2, в которой четко иллюстрирует процесс этой аккуратной реакции. В масс...
Обсуждение
Это чистой реакцией (как показано на рисунке 2) появляется очень интригующим в начале, как молекулярная масса продукта увеличивается только на 9 по отношению к тому исходного материала (как показано на рисунках 3 и 4). Это звучит невозможно, потому что атомный в?...
Раскрытие информации
Except for the contents described in patent (pending), the authors have nothing else to disclose.
Благодарности
The financial support from the National Science Foundation (NSF, grant number 0958901), the Robert Welch Foundation (Welch departmental grant BC-0022 and the Principal Investigator grant BC-1586), and the University of Houston-Clear Lake (FRSF grant) are greatly appreciated.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Aminobenzophenone | Alfa Aesar | A12580 | 98% purity, with tiny impurity as seen on Figure 1(A) in the manuscript. |
| Thiourea | Acros | 138910010 | 1 kg package, 99%, extra pure |
| Dimethyl Sulfoxide | Acros | 326880010 | Methyl sulfoxide, 99.7+%, Extra Dry, AcroSeal® |
| N,N-Dimethylformamide | Acros | 348430010 | N,N-Dimethylformamide, 99.8%, Extra Dry over Molecular Sieve, AcroSeal® |
| Ethyl Acetate | Acros | 610170040 | Ethyl acetate, used as solvent for GC/MS analysis |
| Preparative TLC plate | Sigma-Aldrich | Z740216 SIGMA | PTLC (Preparative TLC) Glass Plates from EMD/Merck KGaA |
| Rotavapor | Buchi | Rotavapor R-205 | Use to dry solvent |
| Microwave Reactor | Biotage | Initiator+ | Use to carry out chemical reaction under microwave irradiation |
| Hotplate | IKA | RCT basic | use to carry out thermal chemical reaction |
Ссылки
- Kamal, A., Reddy, K. L., Devaiah, V., Shankaraiah, N., Rao, M. V. Recent Advances in the Solid-Phase Combinatorial Synthetic Strategies for the Quinoxaline, Quinazoline and Benzimidazole Based Privileged Structures. Mini-Rev. Med. Chem. 6 (1), 71-89 (2006).
- Spirkova, K., Stankovsky, S. Some Tricyclic Annelated Quinazolines. Khim. Geterotsikl. Soedin. (10), 1388-1389 (1995).
- Connolly, D. J., Cusack, D., O'Sullivan, T. P., Guiry, P. J. Synthesis of Quinazolinones and Quinazolines. Tetrahedron. 61 (43), 10153-10202 (2005).
- Baba, A., et al. Studies on Disease-Modifying Antirheumatic Drugs: Synthesis of Novel Quinoline and Quinazoline Derivatives and Their Anti-Inflammatory Effect. J. Med. Chem. 39 (26), 5176-5182 (1996).
- Gama, Y., Shibuya, I., Simizu, M. Novel and Efficient Synthesis of 4-Dimethylamino-2-Glycosylaminoquinazolines by Cyclodesulfurization of Glycosyl Thioureas with Dimethylcyanamide. Chem. Pharm. Bull. 50 (11), 1517-1519 (2002).
- Wakeling, A. E., et al. Specific Inhibition of Epidermal Growth Factor Receptor Tyrosine Kinase by 4-Anilinoquinazolines. Breast Cancer Res Treat. 38 (1), 67-73 (1996).
- Verhaeghe, P., et al. Synthesis and Antiplasmodial Activity of New 4-Aryl-2-Trichloromethylquinazolines. Bioorg. Med. Chem. Lett. 18 (1), 396-401 (2008).
- Kitano, Y., Suzuki, T., Kawahara, E., Yamazaki, T. Synthesis and Inhibitory Activity of 4-Alkynyl and 4-Alkenylquinazolines: Identification of New Scaffolds for Potent Egfr Tyrosine Kinase Inhibitors. Bioorg. Med. Chem. Lett. 17 (21), 5863-5867 (2007).
- Goel, R. K., Kumar, V., Mahajan, M. P. Quinazolines Revisited: Search for Novel Anxiolytic and Gabaergic Agents. Bioorg. Med. Chem. Lett. 15 (8), 2145-2148 (2005).
- Parhi, A. K., et al. Antibacterial Activity of Quinoxalines, Quinazolines, and 1,5-Naphthyridines. Bioorg. Med. Chem. Lett. 23 (17), 4968-4974 (2013).
- Brown, D. J. . Chemistry of Heterocyclic Compounds, Volume 55: Quinazolines, Supplement I. , (1996).
- Yang, C. -. H., et al. Color Tuning of Iridium Complexes for Organic Light-Emitting Diodes: The Electronegative Effect and -Conjugation Effect. J. Organomet. Chem. 691 (12), 2767-2773 (2006).
- Byford, A., Goadby, P., Hooper, M., Kamath, H. V., Kulkarni, S. N. O-Aminophenyl Alkyl/Aralkyl Ketones and Their Derivatives. Part V. An Efficient Synthetic Route to Some Biologically Active 4-Substituted Quinazolines. Ind. J. Chem. B. 27 (4), 396-397 (1988).
- Blazevic, N., Oklobdzija, M., Sunjic, V., Kajfez, F., Kolbah, D. New Ring Closures of Quinazoline Derivatives by Hexamine. Acta Pharmaceut. Jugo. 25 (4), 223-230 (1975).
- Panja, S. K., Saha, S. Recyclable, Magnetic Ionic Liquid Bmim[Fecl4]-Catalyzed, Multicomponent, Solvent-Free, Green Synthesis of Quinazolines. RSC Adv. 3 (34), 14495-14500 (2013).
- Wang, Z. D., Eilander, J., Yoshida, M., Wang, T. Mechanistic Study of a Complementary Reaction System That Easily Affords Quinazoline and Perimidine Derivatives. Eur. J. Org. Chem. (34), 7664-7674 (2014).
- Wang, D. Z., Yoshida, M., George, B. Theoretical Study on the Thermal Decomposition of Thiourea. Comput. Theoret. Chem. 1017, 91-98 (2013).
- Zhang, P., et al. Inhibitory Effect of Hydrogen Sulfide on Ozone-Induced Airway Inflammation, Oxidative Stress, and Bronchial Hyperresponsiveness. Am. J. Respir. Cell Mol. Biol. 52 (1), 129-137 (2015).
- Yan, J., et al. One-Pot Synthesis of Cdxzn1-Xs-Reduced Graphene Oxide Nanocomposites with Improved Photoelectrochemical Performance for Selective Determination of Cu2+. RSC Adv. 3 (34), 14451-14457 (2013).
- Keith, J. D., Pacey, G. E., Cotruvo, J. A., Gordon, G. Experimental Results from the Reaction of Bromate Ion with Synthetic and Real Gastric Juices. Toxicology. 221 (2-3), 225-228 (2006).
- Timchenko, V. P., Novozhilov, A. L., Slepysheva, O. A. Kinetics of Thermal Decomposition of Thiourea. Russ. J. Gen. Chem. 74 (7), 1046-1050 (2004).
- Wang, S., Gao, Q., Wang, J. Thermodynamic Analysis of Decomposition of Thiourea and Thiourea Oxides. J. Phys. Chem. B. 109 (36), 17281-17289 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены