Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фагосоме Миграция и скорость, измеренная в живых первичных макрофагах человека, инфицированных ВИЧ-1
В этой статье
Резюме
We describe a method to measure the velocity of phagosomes moving towards the cell center in living cells infected with or without the human immunodeficiency virus (HIV) type 1, using spinning disk confocal fluorescence microscopy to identify fluorescent infected cells and bright field microscopy to detect phagosomes.
Аннотация
Macrophages are phagocytic cells that play a major role at the crossroads between innate and specific immunity. They can be infected by the human immunodeficiency virus (HIV)-1 and because of their resistance to its cytopathic effects they can be considered to be persistent viral reservoirs. In addition, HIV-infected macrophages exhibit defective functions that contribute to the development of opportunistic diseases.
The exact mechanism by which HIV-1 impairs the phagocytic response of macrophages was unknown. We had previously shown that the uptake of various particulate material by macrophages was inhibited when they were infected with HIV-1. This inhibition was only partial and phagosomes did form within HIV-infected macrophages. Therefore, we focused on analyzing the fate of these phagosomes. Phagosome maturation is accompanied by migration of these compartments towards the cell center, where they fuse with lysosomes, generating phagolysosomes, responsible for degradation of the ingested material. We used IgG-opsonized Sheep Red Blood Cells as a target for phagocytosis. To measure the speed of centripetal movement of phagosomes in individual HIV-infected macrophages, we used a combination of bright field and fluorescence confocal microscopy. We established a method to calculate the distance of phagosomes towards the nucleus, and then to calculate the velocity of the phagosomes. HIV-infected cells were identified thanks to a GFP-expressing virus, but the method is applicable to non-infected cells or any type of infection or treatment.
Введение
Macrophages play a major role in the innate immune system and in homeostasis. They are professional phagocytes that internalize and eliminate pathogens and debris by a process called phagocytosis 1,2. The phagosome, the closed compartment that forms after the engulfment of particulate material, undergoes a series of fusion and fission events with endocytic compartments, leading to a degradative compartment called the phagolysosome. This compartment has an acidic pH, due to the acquisition of proton-pumping v-ATPases, contains hydrolytic enzymes and is enriched in lysosomal-associated membrane proteins (LAMPs). The maturation of phagosomes is accompanied by their migration on microtubules 3,4 towards the cell center to reach a perinuclear location where lysosomes are accumulated.
Many pathogens have been reported to hijack phagosome maturation, including bacteria with intracellular lifestyles that modify the vacuolar environment where they reside 5. The Human Immunodeficiency Virus (HIV)-1 targets macrophages in addition to T cells. As macrophages are resistant to the cytopathic effects of the virus, unlike T cells, they can be considered as a reservoir for the virus. In addition, macrophages infected with HIV-1 show defective phagocytic functions and contribute to the emergence of opportunistic diseases. In particular, severe invasive non-typhoidal Salmonella disease caused by Salmonella Typhimurium ST313 has been prevalent for the last three decades in sub-Saharan African children or adults infected with HIV 6. It has been estimated that the risk of developing tuberculosis is more than 20 times greater in people living with HIV than among those without HIV infection.
For all these reasons, it is important to better define the molecular mechanisms underlying the phagocytic defects in HIV-infected macrophages. We have shown that the uptake of particulate material, opsonized particles, bacteria or fungi, was inhibited in HIV-infected macrophages 7. Given that this inhibition is partial, we then set out to analyze the fate of the internalized phagosomes in HIV infected human macrophages 8. Because phagosome maturation is tightly connected with migration to the cell center and fusion with lysosomes, a defect in phagosomal maturation can be due to modifications of the trafficking modalities in the infected cell. The method described here uses IgG-opsonized Sheep Red Blood Cells (IgG-SRBCs) as a model to target receptor-mediated phagocytosis and in particular receptors for the Fc portion of immunoglobulins (FcR). These particles are easier to image in bright field (BF) than latex beads because extracellular and intracellular SRBCs show different refraction properties 9. To measure the velocity of phagosomes moving towards the nucleus in HIV-infected macrophages, we used a fluorescent virus 10 and set up a simple manual tracking method that is described here. The method does not require advanced programming and simply uses ImageJ. It is amenable to adherent cells and any type of particle or pathogen that can be visualized with bright field microscopy or with fluorescent imaging.
протокол
Протокол должен осуществляться в строгом соответствии с национальным и международным законодательством и местными правилами. Кровь от здоровых доноров, которые дали свое согласие сдавать кровь для исследовательских целей, была получена из переливанию центров крови, с которыми институты подписали соглашение. Специальные средства защиты должны быть приняты при использовании человеческой крови. Эксперименты с ВИЧ-1, должны быть выполнены в уровне биологической безопасности 3 или 2 (BSL-3 или 2) Laboratory в соответствии с местным законодательством.
1. Подготовка человеческих моноцитов макрофаги (hMDMs) по плотности градиентное центрифугирование и селекции адгезией
- Начнем с свежей крови здоровых доноров (9 мл). Развести весь объем свежей крови стерильной 1х фосфатно - солевым буфером (PBS) без Са 2+ и Mg 2+ , для получения конечного объема 70 мл и осторожно добавить разбавленную кровь в две 50 мл конические пробирки (35 мл на пробирку) , на вершине 15 мл смесиeutral, сильно разветвленные, с высокой массой, гидрофильный полисахарид в растворе уже в каждой пробирке.
- Центрифуга обе трубки крови при 537 мкг в течение 20 мин при 20 ° C без тормоза. Затем собирают мононуклеарные клетки периферической крови (МНПК) , содержащихся в пасмурную кольце клеток на границе раздела фаз и перенести их в новый 50 мл пробирку , содержащую 15 мл 1x PBS без Са 2+ и Mg 2+.
- Центрифуга клетки при 218 мкг в течение 5 мин при 20 ° С и ресуспендируют осадок в 45 мл 1x PBS без Са 2+ и Mg 2+.
- Центрифуга клетки при 218 мкг в течение 5 мин при температуре 20 ° С, вновь суспендируют таблетку в 10 мл 1x PBS без Са 2+ и Mg 2+, и подсчитывать клетки путем разбавления до окончательного разведения 1/200 в трипановым синим.
- Центрифуга клетки при 218 х г в течение 5 мин при 20 ° С и ресуспендируют осадок в среде RPMI (Roswell Park Memorial Institute) 1640, дополненной 2 мМ L-глутамина и 100 мкг / мл PenicIllin-стрептомицин иметь 7 х 10 6 РВМС на лунку в объеме 2 мл среды в каждую лунку 6 луночного планшета.
- Инкубируйте пластин при 37 ° С с 5% CO 2 в течение 2 часов. Через 2 ч моноциты будет приклеен к пластмассе.
- Для того, чтобы позволить свеже-изолированные моноциты дифференцируются в hMDMs, аспирата среду и заменить его на 2 мл hMDM среды (RPMI 1640, 10% decomplemented фетальной телячьей сыворотки (FCS), 2 мМ L-глутамина и 1% пенициллин-стрептомицин), дополненной рекомбинантный человеческий колониестимулирующий фактор макрофагов (RHM-CSF), в конечной концентрации 10 нг / мл.
- Инкубируйте клетки при 37 ° С с 5% СО 2 в течение 11 дней (Рисунок 1).
- На 11-й день удалить среду и промывки 2 раза 2 мл холодной hMDM среды на лунку. Затем промыть каждую лунку 2 раза 1 мл холодной 1x PBS.
- Чтобы отделить полностью дифференцированные hMDMs, промойте каждую лунку 1 раз с 1 мл холодной 1x PBS с 2 мМ ethylenediaminetetraacetatic кислоты (ЭДТА) и инкубировать клетки в 2 мл холодной 1x PBS с 2 мМ ЭДТА на лунку в течение 15-60 мин при температуре 4 ° С.
Примечание: Альтернативные методы для отсоединения существуют клетки (например, трипсин или трипсиноподобной деятельность) , которые могли бы дать хорошие результаты 11. - После того, как отряд (завершенного пипеткой осторожно вверх и вниз в скважине), собирают клетки и поместить их в 50 мл пробирку на льду, содержащую 10 мл холодной hMDM среды.
- Центрифуга клетки при 218 мкг в течение 5 мин при температуре 20 ° С, вновь суспендируют таблетку в 10 мл холодной hMDM среды, и подсчет клеток путем разбавления 1/20 в трипановым синим.
- Семенной клеток в количестве 1 х 10 6 hMDMs на 35 мм микроскопию класса со стеклянным дном тарелки и инкубировать пластин при 37 ° С с 5% СО 2 в течение 1 дня.
2. Производство и Количественное ВИЧ-1 Вирусные запасов
Примечание: NLR4.3 ВИЧ-1 Gag-iGFP (зеленый флуоресцентный белок), несущий R5-тропные конверт, подарок от М. ШиндльER 10 используют для инфицирования макрофагов и видеть инфицированных клеток в режиме реального времени.
- Продуцировать вирусные запасы путем трансфекции клеток эмбриональной почки человека 293T (2 х 10 6 в 100 мм чашку) с 6 мкг соответствующего провирусной ДНК с использованием коммерческого реагента для трансфекции.
- Количественно инфекционность вируса натуральной оспы с использованием индикаторных клеток HeLa ПЗМ-бл (несущий ген бета-галактозидазы под контролем LTR HIV-1) с использованием серийных разведений вирусных акций, за которыми следует бета-галактозидазы окрашиванию клеток и подсчета голубые клетки 12.
3. Заражение hMDMs с ВИЧ-1
- Добавьте вирус при множественности инфекции (MOI) 0,02-0,03 в 1 мл среды hMDM к hMDMs (посеянных клеток в 1.13). Для того, чтобы контролировать лунки добавляют только 1 мл hMDM среды и инкубировать блюда при температуре 37 ° С с 5% СО 2 в течение 2 -х дней (рисунок 1).
- В день 2 мыть клетки с hMDM медНМУ 3 раза и добавляют 1 мл свежей среды hMDM на чашку. Инкубируйте клетки при 37 ° С с 5% СО 2 в течение 6 дней (рисунок 1).
4. Опсонизация овец Эритроциты
- Для приготовления 7 х 10 6 SRBCs на чашку, промойте SRBCs два раза в 100 мкл раствора , содержащего 0,1% бычьего сывороточного альбумина (BSA) в PBS с 1х центрифугированием при 600 х г в течение 4 мин.
- Ресуспендируют отмытых SRBCs в 500 мкл 1X PBS / БСА 0,1% кроличьим IgG анти-SRBCs на суб-агглютинации концентрации на 5 мкл SRBCs и инкубировать с вращением при комнатной температуре в течение 30 мин.
Примечание: Чтобы определить суб-агглютинации концентрации анти-IgG SRBCs, готовят серийные разведения IgG (концентрации акций по 13,1 мг / мл) от 1/50 до 1/25600 в 20 мкл в 96-луночный планшет. Добавить 2 × 10 6 SRBCs в 20 мкл в каждую лунку и положить пластину в темной комнате в течение нескольких часов. Концентрация суб-агглютинированная являетсяразведение скважины непосредственно перед хорошо агглютинации (IgG + SRBCs формирования сети). - После того, как вращение, центрифугировать IgG-опсонированных-SRBCs при 600 х г в течение 4 мин и промывают 100 мкл 1X PBS / БСА 0,1% с центрифугированием при 600 х г в течение 4 мин.
- Ресуспендируют IgG-опсонированных-SRBCs в предварительно нагретый среде без фенолового красного RPMI, дополненной 2 мМ L-глутамина и 1% пенициллина-стрептомицина (1 мл / чашку).
5. Живая Cell видеомикроскопия Фагоцитоз Assay
- С помощью конфокальной системы формирования изображения , таких как система , вращающийся диск , снабженный нагревательной камере при температуре 37 ° С с помощью СО 2 проходит через бутылку с водой для увлажнения воздуха.
- Включите камеру нагрева до эксперимента, чтобы иметь предметный столик микроскопа при 37 ° C перед началом анализа фагоцитоза. Включите микроскоп и компьютер, и загрузить программное обеспечение визуализации.
- Оптимизация параметров обработки изображений, такие как скорость сканирования, Магнификатаион, разрешение и т.д. , чтобы иметь по меньшей мере одну ячейку на поле и изображения по одному кадру каждую минуту от 60 до 120 мин.
Примечание: В данном случае образец проецируется на один кадр каждую минуту в течение 60 мин с 63x объективом. - Поместите блюдо на изображения столик микроскопа. Отрегулируйте фокусировку и место, чтобы найти только одно целое инфицированных ВИЧ-1 макрофагов в поле. Используйте соответствующие параметры возбуждения / выбросов на основе используемой системы формирования изображения и зонда. Включите канал светлого поля (BF) для наблюдения фагосомах (рис 1II). Оптимизация внешнего вида различных изображений каналов, регулируя процент пропускаемого света и времени экспозиции.
Примечание: Здесь NLR4.3 ВИЧ-1 Gag-iGFP был возбужден с использованием 491 нм лазер с 50 мс выдержки времени с 20% лазера (рис 1i). - Удалить блюдо изображений и добавить 1 мл ЭБ суспензии при 7 × 10 6 SRBCs / мл на блюдо (рисунок 1).
- Центрифуга при 500 мкг в течение2 мин при комнатной температуре, чтобы синхронизировать фагоцитоз, записывать время в конце этого центрифугирования и вернуть блюдо на сцену.
- Оптимизация фокусировки и съемки GFP и BF изображения в Z-стеки (по всей толщине ячейки с шагом расстояния 0,3 мкм - как правило, 20 самолетов) каждую минуту в течение не менее 1 ч. Сохраните замедленную видео в родном файле формата используемой системы формирования изображения.
Примечание: Здесь, покадровой фильмы были сохранены в собственном формате, * .stk файлы.
6. Анализ ЗАМЕДЛЕННАЯ Фильмы
- Для редактирования видео, нажмите на выпадающее меню "Приложения" и на вкладке "Обзор многомерные данные" в программное обеспечение для редактирования видео.
- Чтобы открыть файл, нажмите на кнопку "Select Base File", а затем на "Select Directory". В "наборы данных" окне выберите приобретение для анализа (на .nd формате) и нажмите на кнопку "View". Данные представлены в виде таблицы с течением времени в колонкуd Z-план в линии.
- Для того, чтобы представить инфекцию в Z-проекции (рис 2, левые панели), выберите 491 нм в поле "Wavelengths" и нажмите на вкладку "проекции Z" с "всех плоскостей».
- Для анализа временной последовательности, выберите BF длину волны в поле "Длины" и выбрать оптимальную плоскость на Z-оси , чтобы различать внешние SRBCs (рисунок 2, красный Arrowhead), внутренние SRBCs (рисунок 2, красный круг) и ядро ( Рисунок 2, синий круг).
- Для сохранения видео монтажи, нажмите на вкладку "Выбор [Х]", а затем на "Load Image (ы)". И, наконец, сохранить загруженные изображения в формате .tif и открывать их рядом на программное обеспечение ImageJ.
- Используйте плагин "Manual Tracking" на программное обеспечение ImageJ для измерения положения ядра и различные фагосомах наблюдаемые в BF канала (рисунок 3).
- Доуnload "Ручной отслеживания" плагин на веб-сайте ImageJ. На ImageJ, откройте плагин и последовательность изображений для анализа (рисунок 3, шаг 1 и 2).
- Введите параметры , такие как "интервал времени" , который представляет количество времени между соседними кадрами, а "х / у калибровки" , которая представляет собой расстояние на пиксель (рисунок 3, стадия 3).
Примечание: Здесь, сохранить последовательность изображений с временным интервалом 1 мин между каждым кадром и х / у калибровки 0,205 мкм , так как масштабирование 63X и камеру с размером пикселя 6,45 х 6,45 мкм 2 используются. - Чтобы начать отслеживание, нажмите на кнопку "Добавить трек" (рисунок 3, стадия 4) и нажмите на ЭБ центре в первый раз , когда она была усвоена. Следующий кадр появляется автоматически.
- Продолжайте нажимать на ЭБ центра во всех кадрах , чтобы иметь различные позиции в течение времени (рисунок 3, пункт 6 в красной коробке).
- Начните отслеживать ядро, чтобы иметь свою позицию во всех кадрах, щелкнув по его центру. Далее отслеживать фагосомах (щелкнув по его центру) один за другим, в то время (кадр) их интернализации, различны в зависимости от SRBCs. Для удобства , чтобы увидеть SRBC на BF канале, используйте окно "Яркость и контрастность" во время отслеживания (рисунок 3, шаг 5).
- Между каждым ЭБ слежения, нажмите на кнопку "Добавить трек" (рисунок 3, стадия 4) , чтобы иметь новый трек. Номер отслеживания будет изменен во второй колонке, "Трек N °" из таблицы результатов (рис 3, стадия 6).
- Сохранение данных в электронной таблице, чтобы перейти к следующему этапу анализа.
- Используйте программное обеспечение работы с электронными таблицами для расчета пройденного расстояния фагосомах , содержащих SRBCs к ядру и скорости фагосомах в течение первых 5 мин после интернализации SRBCs (Fi4 цифра).
- Откройте электронную таблицу и новый файл электронной таблицы. Переход в этот новый файл только следующие параметры, время, х- и у- координаты ядра и всех SRBCs (рис 4а).
- Для того, чтобы вычислить расстояние между SRBCs и ядром только с их координатами, рассмотрим ядро и SRBC в XY-координатной плоскости (рис 4В).
Примечание: Расстояние между двумя точками является длина пути, соединяющего их. В плоскости, расстояние между ЭБ и ядром дается теоремой Пифагора.- Если с (расстояние между ядром и ЭБ) обозначает длину гипотенузы и а и Ь обозначают длины двух других сторон, выражают теорему Пифагора в качестве Пифагора уравнения:

Примечание: В то же время, на ортонррмированными, расстояние по горизонталиа есть (х ядро -х ЭБ) и вертикальное расстояние Ь (у ядра -y ЭБ). - Таким образом, вычислить расстояние между ядром и ЭБ (рис 4A, фиолетовый коробка) путем:
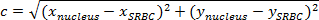
Примечание: Умножьте полученное значение расстояния (в пикселях) при калибровке х / у, чтобы расстояние в мкм. Здесь, калибровка х / у составляет 0,205 мкм. - В каждый момент времени, вычесть расстояние между ядром и ЭБ до начального расстояния (рис 4в).
- Участок измерения от времени, в течение первых 5 мин. Применить линейный тренд-линии (рис 5А) на участке и определить наклон линейного тренда линией , которая представляет скорость фагосоме к ядру в течение первых 5 мин после ЭБ интернализации.
- Разобрать данные для расчета средней и статистическую погрешностьзначения скорости и построить их в соответствующей форме с использованием соответствующего программного обеспечения (Рисунок 5Б).
- Если с (расстояние между ядром и ЭБ) обозначает длину гипотенузы и а и Ь обозначают длины двух других сторон, выражают теорему Пифагора в качестве Пифагора уравнения:
Результаты
FCR-опосредованный фагоцитоз ВИЧ-1-инфицированных и неинфицированных hMDMs описано здесь с использованием IgG-опсонированных SRBCs в качестве модельных целей (Рисунок 1). Критические шаги этого протокола являются подготовка hMDMs и инфекция ВИЧ-1. Действительно, урожай...
Обсуждение
Этот метод имеет несколько важных шагов. Во-первых, подготовка hMDMs и их заражение ВИЧ-1 является критическим, поскольку процент заражения зависит от донора. Следует отметить, что мы решили использовать макрофаги, которые не поляризован в пробирке до инфицирования, поскольку статус ...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank Dr Jamil Jubrail for reading the manuscript. This work was supported by grants from CNRS, Inserm, Université Paris Descartes, Agence Nationale de la Recherche (2011 BSV3 025 02), Fondation pour la Recherche Médicale (FRM DEQ20130326518 including a doctoral fellowship for GLB) and Agence Nationale de Recherche sur le SIDA et les hépatites virales (ANRS, including a post-doctoral fellowship for CD) to FN. A. Dumas was supported by doctoral fellowships from Université Paris Descartes and Sidaction.
Материалы
| Name | Company | Catalog Number | Comments |
| Falcon 100mm TC-Treated Cell Culture Dish | Corning | 353003 | For viral production |
| Glass Bottom Dishes 35 mm uncoated 1.5 | MatTek corporation | P35G-1.5-14-C Case | For acquisition |
| Falcon Tissue Culture Plates 6-well | Thermo Fischer Scientific | Corning. Inc. 353934 | For human monocyte-derived macrophages |
| Ficoll-Plaque PLUS | Dominique Dutscher | 17-1440-03 | a neutral, highly branched, high-mass, hydrophilic polysaccharide in solution for density centrifugation |
| DPBS, no calcium, no magnesium | Thermo Fischer Scientific | 14190-094 | Room temperature |
| Dulbecco's Modified Eagle Medium (DMEM) 1X, liquid (High Glucose) | GIBCO, Molecular probes | 31966-021 | Conserved at 4°C ; for HEK cells culture |
| RPMI 1640 medium GLUTAMAX Supplement | Life technologies | 61870-010 | Conserved at 4°C; for hMDMs culture |
| Fœtal Calf Serum (FCS) | Eurobio | CVFSVF0001 | Conserved at -20°C ; decomplemented |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fischer Scientific | 15140-122 | Conserved at -20°C ; for hMDMs culture |
| RPMI 1640 medium, no phenol red (10x500 ml) | Life technologies | 11835-105 | Warm in 37°C water bath before use ; for phagocytosis assay |
| FuGENE6 Transfection Reagent | Promega | E2692 | Conserved at 4°C ; for viral production |
| Sheep red blood cells (SRBCs) | Eurobio | DSGMTN00-0Q | Conserved in Alsever buffer at 4°C before use |
| Anti-sheep red blood cells IgG | MP Biomedicals | 55806 | Conserved at 4°C |
| Bovine Serum Albumin heat shock fraction, pH 7, ≥98% | Sigma | A7906 | Conserved at -20°C |
| Inverted microscope DMI600 | Leica | ||
| Confocal Spinning Disk Unit CSU-X1M1 | Yokogawa | ||
| 491 nm 50mW laser | COBOLT CALYPSO | ||
| HCX PL APO CS Objectif | Leica | Objective lens ; Magnification 100x ; Numerical aperture 1.40 ; Immersion oil | |
| CoolSnap HQ2 (FireWire) Camera | Photometrics | Pixel size 6.45 x 6.45 µm ; Definition 1392 x 1040 ; Encoding the image in 14 Bit | |
| Metamorph 7.7.5 software | Molecular Devices | For the control of the microscope | |
| GraphPad Prism software | For the statistics analysis |
Ссылки
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annu. Rev. Pathol. 7, 61-98 (2012).
- Niedergang, F. . Encyclopedia of Cell Biology. 2, 751-757 (2016).
- Blocker, A., Griffiths, G., Olivo, J. C., Hyman, A. A., Severin, F. F. A role for microtubule dynamics in phagosome movement. J Cell Sci. 111 (Pt 3), 303-312 (1998).
- Blocker, A., et al. Molecular requirements for bi-directional movement of phagosomes along microtubules. J Cell Biol. 137, 113-129 (1997).
- Flannagan, R. S., Cosio, G., Grinstein, S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies. Nat Rev Microbiol. 7, 355-366 (2009).
- Feasey, N. A., Dougan, G., Kingsley, R. A., Heyderman, R. S., Gordon, M. A. Invasive non-typhoidal salmonella disease: an emerging and neglected tropical disease in Africa. Lancet. 379, 2489-2499 (2012).
- Mazzolini, J., et al. Inhibition of phagocytosis in HIV-1-infected macrophages relies on Nef-dependent alteration of focal delivery of recycling compartments. Blood. 115, 4226-4236 (2010).
- Dumas, A., et al. The HIV-1 protein Vpr impairs phagosome maturation by controlling microtubule-dependent trafficking. J Cell Biol. 211, 359-372 (2015).
- Greenberg, S., el Khoury, J., Kaplan, E., Silverstein, S. C. A fluorescence technique to distinguish attached from ingested erythrocytes and zymosan particles in phagocytosing macrophages. J. Immunol. Methods. 139, 115-122 (1991).
- Koppensteiner, H., Banning, C., Schneider, C., Hohenberg, H., Schindler, M. Macrophage internal HIV-1 is protected from neutralizing antibodies. J Virol. 86, 2826-2836 (2012).
- Gartner, S. The macrophage and HIV: basic concepts and methodologies. Methods Mol Biol. 1087, 207-220 (2014).
- Wei, X., et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob Agents Chemother. 46, 1896-1905 (2002).
- Harrison, R. E., Bucci, C., Vieira, O. V., Schroer, T. A., Grinstein, S. Phagosomes fuse with late endosomes and/or lysosomes by extension of membrane protrusions along microtubules: role of Rab7 and RILP. Mol Cell Biol. 23, 6494-6506 (2003).
- Toyohara, A., Inaba, K. Transport of phagosomes in mouse peritoneal macrophages. J Cell Sci. 94 (Pt 1), 143-153 (1989).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены