JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
HIV-1 감염 라이브 차 인간 대 식세포에서 측정 Phagosome 마이그레이션 및 속도
요약
We describe a method to measure the velocity of phagosomes moving towards the cell center in living cells infected with or without the human immunodeficiency virus (HIV) type 1, using spinning disk confocal fluorescence microscopy to identify fluorescent infected cells and bright field microscopy to detect phagosomes.
초록
Macrophages are phagocytic cells that play a major role at the crossroads between innate and specific immunity. They can be infected by the human immunodeficiency virus (HIV)-1 and because of their resistance to its cytopathic effects they can be considered to be persistent viral reservoirs. In addition, HIV-infected macrophages exhibit defective functions that contribute to the development of opportunistic diseases.
The exact mechanism by which HIV-1 impairs the phagocytic response of macrophages was unknown. We had previously shown that the uptake of various particulate material by macrophages was inhibited when they were infected with HIV-1. This inhibition was only partial and phagosomes did form within HIV-infected macrophages. Therefore, we focused on analyzing the fate of these phagosomes. Phagosome maturation is accompanied by migration of these compartments towards the cell center, where they fuse with lysosomes, generating phagolysosomes, responsible for degradation of the ingested material. We used IgG-opsonized Sheep Red Blood Cells as a target for phagocytosis. To measure the speed of centripetal movement of phagosomes in individual HIV-infected macrophages, we used a combination of bright field and fluorescence confocal microscopy. We established a method to calculate the distance of phagosomes towards the nucleus, and then to calculate the velocity of the phagosomes. HIV-infected cells were identified thanks to a GFP-expressing virus, but the method is applicable to non-infected cells or any type of infection or treatment.
서문
Macrophages play a major role in the innate immune system and in homeostasis. They are professional phagocytes that internalize and eliminate pathogens and debris by a process called phagocytosis 1,2. The phagosome, the closed compartment that forms after the engulfment of particulate material, undergoes a series of fusion and fission events with endocytic compartments, leading to a degradative compartment called the phagolysosome. This compartment has an acidic pH, due to the acquisition of proton-pumping v-ATPases, contains hydrolytic enzymes and is enriched in lysosomal-associated membrane proteins (LAMPs). The maturation of phagosomes is accompanied by their migration on microtubules 3,4 towards the cell center to reach a perinuclear location where lysosomes are accumulated.
Many pathogens have been reported to hijack phagosome maturation, including bacteria with intracellular lifestyles that modify the vacuolar environment where they reside 5. The Human Immunodeficiency Virus (HIV)-1 targets macrophages in addition to T cells. As macrophages are resistant to the cytopathic effects of the virus, unlike T cells, they can be considered as a reservoir for the virus. In addition, macrophages infected with HIV-1 show defective phagocytic functions and contribute to the emergence of opportunistic diseases. In particular, severe invasive non-typhoidal Salmonella disease caused by Salmonella Typhimurium ST313 has been prevalent for the last three decades in sub-Saharan African children or adults infected with HIV 6. It has been estimated that the risk of developing tuberculosis is more than 20 times greater in people living with HIV than among those without HIV infection.
For all these reasons, it is important to better define the molecular mechanisms underlying the phagocytic defects in HIV-infected macrophages. We have shown that the uptake of particulate material, opsonized particles, bacteria or fungi, was inhibited in HIV-infected macrophages 7. Given that this inhibition is partial, we then set out to analyze the fate of the internalized phagosomes in HIV infected human macrophages 8. Because phagosome maturation is tightly connected with migration to the cell center and fusion with lysosomes, a defect in phagosomal maturation can be due to modifications of the trafficking modalities in the infected cell. The method described here uses IgG-opsonized Sheep Red Blood Cells (IgG-SRBCs) as a model to target receptor-mediated phagocytosis and in particular receptors for the Fc portion of immunoglobulins (FcR). These particles are easier to image in bright field (BF) than latex beads because extracellular and intracellular SRBCs show different refraction properties 9. To measure the velocity of phagosomes moving towards the nucleus in HIV-infected macrophages, we used a fluorescent virus 10 and set up a simple manual tracking method that is described here. The method does not require advanced programming and simply uses ImageJ. It is amenable to adherent cells and any type of particle or pathogen that can be visualized with bright field microscopy or with fluorescent imaging.
프로토콜
이 프로토콜은 국내 및 국제 법규 및 지역 규정에 엄격한에 따라 수행되어야한다. 연구 목적으로 혈액을 기증 동의를 준 건강한 기증자로부터 혈액이 기관이 계약을 체결 한있는 수혈 센터에서 얻을 수있다. 인간의 혈액을 사용하는 경우 특별 보호는주의해야합니다. HIV-1과 실험은 3 또는 2 (BSL-3 또는 2) 연구소는 현지 법률에 따라 바이오 안전성 수준에서 수행해야합니다.
접착에 의한 밀도 구배 원심 분리 및 선택에 의해 인간 단핵구 유래 대 식세포 (hMDMs) 1. 준비
- 건강한 기증자 (9 ㎖)에서 신선한 혈액으로 시작합니다. 70 ml의 최종 용적을 수득 칼슘 및 마그네슘 2+없이 멸균 1X 인산 완충 생리 식염수 (PBS)와 신선한 혈액의 전체 부피를 희석하고 부드럽게 개의 50 ㎖ 원뿔형 튜브에 희석 된 혈액을 추가 (튜브 당 35 mL) 중 , 15 ml의 상단에eutral가 높은 각 튜브 이미 용액에 높은 질량 친수성 다당류 지형.
- 브레이크없이 20 ° C에서 20 분 동안 537 XG에 혈액을 원심 분리기는 모두 튜브. 그런 계면 흐린 셀 링에 포함 된 말초 혈액 단핵 세포 (PBMC)를 수집하고 칼슘 및 마그네슘 2+없이 1X PBS 15 ml를 함유하는 새로운 50 ㎖ 튜브로 옮긴다.
- 원심 분리기 20 ° C에서 5 분 동안 218 XG에 세포와 칼슘 및 마그네슘없이 1X PBS 45 ml의에서 펠렛을 재현 탁 2+.
- 원심 분리는 20 ℃에서 5 분 동안 218 XG에서 세포는 칼슘 및 마그네슘 2+없이 1X PBS 10ml에 펠렛을 재현 탁하고 트리 판 블루에 1/200의 최종 희석액으로 희석하여 세포 수를 계산.
- 20 ° C에서 5 분 동안 218 XG에 세포를 원심 분리기 1640 배지 2 mM의 L- 글루타민 및 100 μg의 / ㎖로 보충 된 RPMI penic (로스웰 파크 메모리얼 연구소)에 펠렛을 재현 탁illin - 스트렙토 6 웰 - 플레이트의 각 웰에서 배지 2 ㎖에 웰 당 7 × 106 PBMC를가하도록.
- 2 시간 동안 5 % CO 2와 37 ° C에서 접시를 품어. 2 시간 후 단핵구는 플라스틱에 부착 된 것입니다.
- 갓 절연 단핵구가 hMDMs로 분화 배지를 흡인하고 보충 2ml의 hMDM 배지 (RPMI 1640, 태아 송아지 혈청 (FCS를 decomplemented 10 %), 2 mM L- 글루타민, 1 % 페니실린 - 스트렙토 마이신)로 교체 할 수 있도록하려면 재조합 인간 대 식세포 콜로니 자극 인자 10 ng를 / ml의 최종 농도 (RHM-CSF).
- 십일일 (그림 1)에 대한 5 % CO 2와 37 ° C에서 세포를 품어.
- 하루에 11에서 매체를 제거하고 잘 따라 차가운 hMDM 매체의 2 ㎖로 2 회 씻는다. 다음 차가운 1X PBS 1 ml의 각 웰을 2 회 반복한다.
- (2 mM의 ethylenediaminetetraacetatic 산 차가운 1X PBS 1 ml의 각 웰에 1 시간을 씻어 완전히 차별화 된 hMDMs를 분리하려면EDTA) 및 4 ℃에서 15 내지 60 분 동안 잘 당 2 mM의 EDTA와 차가운 1X PBS 2 ㎖에 세포를 배양한다.
참고 : 세포가 존재 분리하는 다른 방법 (예를 들면, 트립신 또는 트립신 같은 활동) 좋은 결과 (11)을 줄 수 있습니다. - (상하 웰 부드럽게 피펫 완료) 분리 후, 세포를 수집하고 차가운 hMDM 배지 10 ㎖를 함유하는 얼음에 50 ㎖ 튜브에 넣어.
- 원심 분리는 20 ℃에서 5 분 동안 218 XG에 세포를 차가운 hMDM 배지 10ml에 펠렛을 재현 탁하고 트리 판 블루로 1/20 희석하여 세포 수를 계산.
- 35mm 현미경 수준의 유리 바닥 접시 당 1 × 10 6 hMDMs에서 세포를 시드 및 1 일 5 % CO 2와 37 ° C에서 접시를 품어.
HIV-1 바이러스 성 주식의 2. 생산 및 정량화
참고 : NLR4.3 HIV-1 개그 - iGFP (녹색 형광 단백질) M. Schindl에서 R5-열대 봉투, 선물을 들고ER 10 마크로파지를 감염 실시간으로 감염된 세포를 참조하는 데 사용된다.
- 상업 형질 전환 시약을 사용하여 해당 프로 바이러스 DNA의 6 μg의 인간 배아 신장 293T 세포 (2 × 106에서 100mm 요리)의 형질 전환에 의해 바이러스 주식을 생성합니다.
- 세포 및 계수의 베타 갈 락토시다 착색 이어 바이러스 주식의 희석액을 사용하여 (HIV-1 LTR의 제어하에 베타 갈 락토시다 제 유전자를 함유) 헬라 TZM-BL 인디케이터 세포를 사용하여 바이러스 주식의 감염성 정량화 의 파란색 셀 (12)는.
HIV-1 hMDMs 3. 감염
- hMDMs (1.13 도금 세포)에 감염 (MOI)의 다양성에 hMDM 매체의 0.02-0.03 1 ml에 바이러스를 추가합니다. 우물 hMDM 매체의 1ml를 추가 제어하고 이일 (그림 1)에 대한 5 % CO 2와 37 ° C에서 요리를 부화합니다.
- 하루에 2 hMDM 의대로 세포를 씻어3 회 IUM과 접시 당 신선한 hMDM 매체의 1ml를 추가합니다. 육일 (그림 1)에 대한 5 % CO 2와 37 ° C에서 세포를 품어.
양 적혈구 4. 옵 소닌
- 접시 당 7 × 106 SRBCs의 제조를위한 4 분 동안 600 × g으로 원심 분리로 1X PBS에 0.1 % 소 혈청 알부민 (BSA)을 함유하는 용액 100 ㎕에 SRBCs 두 번 세척 하였다.
- SRBCs 5 μL 당 서브 응집 농도 토끼 IgG 형 SRBCs와 PBS / 0.1 % BSA 500 ㎕의 1X에서 세정 SRBCs을 재현 탁하고 실온에서 30 분 동안 회전 배양한다.
주 : 안티 SRBCs의 IgG 서브 응집 농도를 측정 96 웰 플레이트에 20 ㎕의 1 / 25,600로 1/50에서 (13.1 ㎎ / ㎖ 농도에서 스톡)의 IgG의 희석액을 제조 하였다. 각 웰에 20 μl를 2 × 10 6 SRBCs을 추가하고 몇 시간 동안 어두운 방에서 접시를 넣어. 서브 응집 농도 인직전 잘 응집 (IgG를 + SRBCs 네트워크를 형성)로 잘 희석. - 회전 후 4 분 동안 600 XG에서의 IgG-옵 소닌 - SRBCs을 원심 분리하고 4 분 동안 600 XG에서 원심 분리하여 1X PBS / BSA 0.1 % 100 ㎕로 씻는다.
- 2 mM의 L- 글루타민 및 1 % 페니실린 - 스트렙토 마이신 (1 ㎖ / 접시)이 보충 된 예비 가온 된 페놀 레드없는 RPMI 배지에서의 IgG - 옵 소닌-SRBCs를 재현 탁.
5. 라이브 셀 비디오 현미경 탐식의 분석
- 이러한 CO 2의 가습을위한 물이 병을 통과하여 37 ℃의 가열 챔버를 구비 한 회전 디스크 시스템과 같은 촛점 이미징 시스템을 사용한다.
- 식세포 분석의 시작 전에 37 ℃에서 현미경 스테이지를 가지고 실험 전에 가열 실 켜기. 현미경과 컴퓨터를 켜고, 및 이미징 소프트웨어를로드합니다.
- 이러한 주사 속도 MAGNIFICAT로서 촬상 설정을 최적화이온, 해상도 등은 60 ~ 120 분 사이에 매 분마다 필드 당 이미지 한 프레임에 적어도 하나의 셀을 가지고 있습니다.
참고 : 여기에, 샘플 63X 렌즈와 함께 60 분 동안 하나의 프레임 분마다 이미징된다. - 현미경 무대에 영상 접시를 놓습니다. 초점을 조정하고 위치는 필드에 하나의 전체 HIV-1에 감염된 대 식세포를 찾을 수 있습니다. 사용 된 영상 시스템 및 프로브에 따라 적합한 여기 / 방출 설정을 사용합니다. phagosomes을 관찰 밝은 필드 (BF) 채널을 포함합니다 (그림 1II). 투과광 노광 시간의 비율을 조정함으로써, 상이한 채널 이미지의 모양을 최적화한다.
참고 : 여기에, NLR4.3 HIV-1 개그 - iGFP 레이저의 20 % (그림 1I)와 노출 시간의 50 밀리 초와 491 nm의 레이저를 사용하여 흥분했다. - 이미징 접시를 제거하고 접시에 7 × 10 6 SRBCs / ㎖ (그림 1)에서 SRBC 현탁액 1 ㎖를 추가합니다.
- 500 XG에 원심 분리기RT에서 2 분, 식균 작용이 동기화 원심의 끝 시간을 기록하고, 상기 스테이지에 접시를 반환한다.
- 적어도 1 시간 동안 매분 - (통상 20 평면 0.3 ㎛의 스텝 거리, 셀의 두께에 걸쳐) Z-스택의 초점 캡처 GFP 및 BF 이미지를 최적화한다. 사용 된 영상 시스템의 기본 파일 형식으로 시간 경과 비디오를 저장합니다.
참고 : 여기에, 시간 경과 영화가 네이티브 형식으로 저장된 * .stk 파일.
시간 경과 영화 6. 분석
- 비디오 편집 메뉴 '앱'다운 비디오 편집 소프트웨어의 탭에 "검토 다중 차원 데이터"에 드롭을 클릭합니다.
- 파일을 열려면 다음 "디렉토리 선택"에서 "선택 자료 파일"을 클릭합니다. "데이터가 설정"상자에서 (.nd 형식)을 분석하고 '보기'를 클릭 인수를 선택합니다. 데이터는 열 경시 표로 표현라인에서 D의 Z-계획.
- A ~ Z 프로젝션 (그림 2, 왼쪽 패널)에 감염을 표현하려면 "파장"상자에 491 nm 파장을 선택하고 "모든면"와 "Z 투사"탭을 클릭합니다.
- (시간 순서 분석은 "파장"상자에 BF 파장을 선택하고 외부 SRBCs (그림 2, 빨간색 화살표), 내부 SRBCs (그림 2, 빨간색 원)과 핵을 구별하기 위해 Z 축에 최적의 평면을 선택합니다 그림 2, 파란색 원).
- 비디오 몽타주을 저장하려면, "선택 [X]의"탭을 누른 다음 "로드 이미지 (들)"을 클릭합니다. 마지막으로,이 .tif 형식으로로드 된 이미지를 저장하고 ImageJ에 소프트웨어에 다음을 엽니 다.
- 핵의 위치와 BF 채널에서 관찰 된 다른 phagosomes (그림 3)을 측정하기 위해 ImageJ에 소프트웨어를 플러그인 "수동 추적"를 사용합니다.
- 다우ImageJ에 웹 사이트의 "수동 추적"플러그인을 nload. ImageJ에에서 (그림 3, 1 단계 및 2) 플러그인 및 이미지 시퀀스를 분석 할 엽니 다.
- 이러한 인접 프레임 사이의 시간의 양을 나타낸다 "시간 간격", 픽셀 당 거리를 나타내는 "X / Y 보정"(그림 3, 3 단계)로 설정을 입력합니다.
주 : 63X 크게하고 6.45 X 6.45 μm의 (2)의 화소 크기를 갖는 카메라를 사용하기 때문에 여기서, 각 프레임 및 0.205 ㎛, X / Y의 교정과 1 분의 시간 간격으로 화상 시퀀스를 저장한다. - 추적을 시작하려면 (그림 3, 4 단계) "트랙 추가"를 클릭하고이 내면화 될 때 제 시간에 SRBC 센터를 클릭합니다. 다음 프레임이 자동으로 나타납니다.
- 시간 동안 다른 위치 (그림 3, 빨간색 상자에 6 단계)가 모든 프레임에서 SRBC 센터를 클릭하여 계속합니다.
- 그 중심을 클릭하여 모든 프레임에서의 위치를 가지고 핵을 추적하기 시작합니다. 다음 시간 SRBCs의 기능에서 다른 자신의 내면화의 (프레임)에서 하나 하나 (중심을 클릭하여) phagosomes를 추적 할 수 있습니다. 편의 BF 채널에 SRBC를 참조하려면, 추적 (그림 3, 5 단계) 동안 "밝기 및 명암 대비"창을 사용합니다.
- 각 SRBC 추적 사이에 새로운 트랙을 가지고 (그림 3, 4 단계) "트랙 추가"를 클릭합니다. 추적의 수는 두 번째 열에서 변경되며, 그 결과 테이블의 "트랙 N °"(도 3, 단계 6).
- 분석의 다음 단계를 계속하기 위해 스프레드 시트의 데이터를 저장합니다.
- (핵 및 SRBCs의 국제화 후 첫 5 분 동안 phagosomes의 속도를 향해 SRBCs를 포함하는 phagosomes의 이동 거리를 계산하기 위해 인터넷을 스프레드 시트 소프트웨어를 사용하여gure 4).
- 스프레드 시트 테이블과 새 스프레드 시트 파일을 엽니 다. 이 새로운 다음 매개 변수 전용 파일, 시간, x 축에 전송하고 핵 및 모든 SRBCs (그림 4A)의 좌표 Y-.
- , 그들의 좌표 SRBCs과 핵 사이의 거리를 계산 XY 좌표 평면 (그림 4B)에서 핵 및 SRBC을 고려합니다.
주 : 두 점 사이의 거리를 연결 경로의 길이이다. 평면에서 SRBC과 핵 사이의 거리는 피타고라스의 정리에 의해 주어진다.- C (핵과 SRBC 사이의 거리) 및 빗변의 길이를 나타내고, (B) 다른 두 변의 길이를 나타내는 경우, 피타고라스 식은 피타고라스 정리를 표현 :

주 : 동시에, 직교에서 수평 거리A는 (X 핵 -x SRBC)는 수직 거리 (B)는 (SRBC -y Y 핵)이다. - 따라서, 핵 및 SRBC (도 4a, 퍼플 박스)에 의해 사이의 거리를 계산한다 :
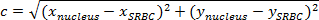
주 : μm의의 거리를 갖고, X / Y 교정하여 픽셀 단위로 획득 된 거리 값을 곱한다. 여기서, X / Y의 교정은 0.205 μm의 것이다. - 각 시간에서, 핵 초기 위치 (도 4C)에 SRBC 사이의 거리를 뺀다.
- 처음 5 분 동안 측정 시간에 대하여 플롯. 플롯에 선형 트렌드 라인 (그림 5A)를 적용하고 SRBC 국제화 후 첫 5 분 동안 핵을 향해 phagosome 속도를 나타내는 선형 트렌드 라인의 기울기를 결정한다.
- 평균 오차 통계를 계산하는 데이터를 대조속도 값을 적절한 소프트웨어 (도 5B)를 사용하여 적절한 형태로 이들을 플롯 및.
- C (핵과 SRBC 사이의 거리) 및 빗변의 길이를 나타내고, (B) 다른 두 변의 길이를 나타내는 경우, 피타고라스 식은 피타고라스 정리를 표현 :
결과
HIV-1 감염과 감염되지 않은 hMDMs 의해 식세포 작용의 FcR 매개 초상권 타겟으로의 IgG - 옵 소닌 SRBCs (도 1)를 사용하여 여기에서 설명된다. 이 프로토콜의 중요한 단계는 hMDMs의 준비 및 HIV-1 감염이다. 실제로, 차별화 된 대 식세포의 수율과 품질은 도너 사이 변화뿐만 아니라 10~40% 범위의 효율성과 감염율. 또한, IgG의-옵 소닌 - SRBCs의 준비는 이것이 그들의 인식?...
토론
이 기술은 몇 가지 중요한 단계가 있습니다. 감염의 백분율 도너 의존하기 때문에 우선, HIV-1에 의한 hMDMs의 제조 및 감염은 매우 중요하다. 잠재적으로 생체 내에서 바이러스에 의해 발생하는 대 식세포의 상태가 아니라 지금까지 특징되지 않았기 때문에 참고로, 우리는 이전에 감염 체외에서 편광되지 않은 대 식세포를 사용하기로 결정했습니다. 우리는 대 식세포는도없고 M1 M2임을...
공개
The authors have nothing to disclose.
감사의 말
We thank Dr Jamil Jubrail for reading the manuscript. This work was supported by grants from CNRS, Inserm, Université Paris Descartes, Agence Nationale de la Recherche (2011 BSV3 025 02), Fondation pour la Recherche Médicale (FRM DEQ20130326518 including a doctoral fellowship for GLB) and Agence Nationale de Recherche sur le SIDA et les hépatites virales (ANRS, including a post-doctoral fellowship for CD) to FN. A. Dumas was supported by doctoral fellowships from Université Paris Descartes and Sidaction.
자료
| Name | Company | Catalog Number | Comments |
| Falcon 100mm TC-Treated Cell Culture Dish | Corning | 353003 | For viral production |
| Glass Bottom Dishes 35 mm uncoated 1.5 | MatTek corporation | P35G-1.5-14-C Case | For acquisition |
| Falcon Tissue Culture Plates 6-well | Thermo Fischer Scientific | Corning. Inc. 353934 | For human monocyte-derived macrophages |
| Ficoll-Plaque PLUS | Dominique Dutscher | 17-1440-03 | a neutral, highly branched, high-mass, hydrophilic polysaccharide in solution for density centrifugation |
| DPBS, no calcium, no magnesium | Thermo Fischer Scientific | 14190-094 | Room temperature |
| Dulbecco's Modified Eagle Medium (DMEM) 1X, liquid (High Glucose) | GIBCO, Molecular probes | 31966-021 | Conserved at 4°C ; for HEK cells culture |
| RPMI 1640 medium GLUTAMAX Supplement | Life technologies | 61870-010 | Conserved at 4°C; for hMDMs culture |
| Fœtal Calf Serum (FCS) | Eurobio | CVFSVF0001 | Conserved at -20°C ; decomplemented |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fischer Scientific | 15140-122 | Conserved at -20°C ; for hMDMs culture |
| RPMI 1640 medium, no phenol red (10x500 ml) | Life technologies | 11835-105 | Warm in 37°C water bath before use ; for phagocytosis assay |
| FuGENE6 Transfection Reagent | Promega | E2692 | Conserved at 4°C ; for viral production |
| Sheep red blood cells (SRBCs) | Eurobio | DSGMTN00-0Q | Conserved in Alsever buffer at 4°C before use |
| Anti-sheep red blood cells IgG | MP Biomedicals | 55806 | Conserved at 4°C |
| Bovine Serum Albumin heat shock fraction, pH 7, ≥98% | Sigma | A7906 | Conserved at -20°C |
| Inverted microscope DMI600 | Leica | ||
| Confocal Spinning Disk Unit CSU-X1M1 | Yokogawa | ||
| 491 nm 50mW laser | COBOLT CALYPSO | ||
| HCX PL APO CS Objectif | Leica | Objective lens ; Magnification 100x ; Numerical aperture 1.40 ; Immersion oil | |
| CoolSnap HQ2 (FireWire) Camera | Photometrics | Pixel size 6.45 x 6.45 µm ; Definition 1392 x 1040 ; Encoding the image in 14 Bit | |
| Metamorph 7.7.5 software | Molecular Devices | For the control of the microscope | |
| GraphPad Prism software | For the statistics analysis |
참고문헌
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annu. Rev. Pathol. 7, 61-98 (2012).
- Niedergang, F. . Encyclopedia of Cell Biology. 2, 751-757 (2016).
- Blocker, A., Griffiths, G., Olivo, J. C., Hyman, A. A., Severin, F. F. A role for microtubule dynamics in phagosome movement. J Cell Sci. 111 (Pt 3), 303-312 (1998).
- Blocker, A., et al. Molecular requirements for bi-directional movement of phagosomes along microtubules. J Cell Biol. 137, 113-129 (1997).
- Flannagan, R. S., Cosio, G., Grinstein, S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies. Nat Rev Microbiol. 7, 355-366 (2009).
- Feasey, N. A., Dougan, G., Kingsley, R. A., Heyderman, R. S., Gordon, M. A. Invasive non-typhoidal salmonella disease: an emerging and neglected tropical disease in Africa. Lancet. 379, 2489-2499 (2012).
- Mazzolini, J., et al. Inhibition of phagocytosis in HIV-1-infected macrophages relies on Nef-dependent alteration of focal delivery of recycling compartments. Blood. 115, 4226-4236 (2010).
- Dumas, A., et al. The HIV-1 protein Vpr impairs phagosome maturation by controlling microtubule-dependent trafficking. J Cell Biol. 211, 359-372 (2015).
- Greenberg, S., el Khoury, J., Kaplan, E., Silverstein, S. C. A fluorescence technique to distinguish attached from ingested erythrocytes and zymosan particles in phagocytosing macrophages. J. Immunol. Methods. 139, 115-122 (1991).
- Koppensteiner, H., Banning, C., Schneider, C., Hohenberg, H., Schindler, M. Macrophage internal HIV-1 is protected from neutralizing antibodies. J Virol. 86, 2826-2836 (2012).
- Gartner, S. The macrophage and HIV: basic concepts and methodologies. Methods Mol Biol. 1087, 207-220 (2014).
- Wei, X., et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob Agents Chemother. 46, 1896-1905 (2002).
- Harrison, R. E., Bucci, C., Vieira, O. V., Schroer, T. A., Grinstein, S. Phagosomes fuse with late endosomes and/or lysosomes by extension of membrane protrusions along microtubules: role of Rab7 and RILP. Mol Cell Biol. 23, 6494-6506 (2003).
- Toyohara, A., Inaba, K. Transport of phagosomes in mouse peritoneal macrophages. J Cell Sci. 94 (Pt 1), 143-153 (1989).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유