Method Article
Простой фракционированный метод экстракции для комплексного анализа метаболитов, липидов и белков из одного образца
В этой статье
Резюме
Представлен протокол комплексной экстракции липидов, метаболитов и белков из биологических тканей с использованием одного образца.
Аннотация
Понимание сложных биологических систем требует измерения, анализа и интеграции нескольких составных классов живой клетки, обычно определяемых транскриптомическими, протеомными, метаболическими и липидомическими измерениями. В этом протоколе мы вводим простой способ воспроизводимой экстракции метаболитов, липидов и белков из биологических тканей с использованием одной аликвоты на образец. Метод экстракции основан на системе метил- трет -бутиловый эфир: метанол: вода для жидкостного разделения жидкости гидрофобных и полярных метаболитов на две несмешивающиеся фазы вместе с осаждением белков и других макромолекул в виде твердого осадка. Таким образом, этот метод обеспечивает три различные фракции определенного молекулярного состава, которые полностью совместимы с общими технологиями «омики» с высокой пропускной способностью, такими как жидкостная хроматография (LC) или газовая хроматография (GC), связанная с масс-спектрометрами. Хотя метод был initРазработанный для анализа образцов различных тканей растений, он оказался полностью совместимым для экстракции и анализа биологических образцов из таких разнообразных систем, как водоросли, насекомые, ткани млекопитающих и клеточные культуры.
Введение
Системная биология, возникшая в середине прошлого века 1 и продвигаемая крупномасштабным анализом геномных и транскриптомических наборов данных 2 , 3 , превратилась в новый и незаменимый подход для анализа сложных биологических систем 4 , 5 . Основная цель системной биологии - расшифровать взаимодействия компонентов и зависимости в биологических системах и увязать связь между генотипами, их реализацией, молекулярными превращениями и возникающими фенотипами. Соответственно, интеграция комплексных наборов данных, созданных различными крупномасштабными аналитическими подходами, а именно геномика, транскриптомика, метаболизм, липидомика и протеомика и их вычислительный анализ, стала предпосылкой для описания и понимания сложных биологических систем.
Bas На огромном химическом разнообразии и сложности биологических компонентов в любой живой системе, производство больших и всеобъемлющих наборов данных «omics» сильно зависит от качества применяемого метода извлечения 9 . В дополнение к качеству метода извлечения важна экономия метода; Это означает, что было бы желательно получить как можно больше молекулярной информации с минимального количества входных данных. Часто количество проб может быть предельным, и поэтому крайне желательно использовать способ экстракции, который может выводить столько молекулярных классов из одной экстракции данного образца. Это означает, что вместо использования нескольких специализированных методов экстракции для экстракции различных классов соединений из разных аликвот образца одного и того же образца применяется метод последовательной экстракции, который фракционирует молекулярные составляющие одной аликвоты в разные молекулярные фракции.
_content "> Общий метод, используемый для этих фракционированных методов экстракции, основан на двухфазном способе экстракции липидов от Folch и др., Разработанном в 1957 г. 10. Этот метод основан на разделении хлороформ: метанол / вода полярных и гидрофобных метаболитов и был Предназначенный для очистки и декомпозиции образцов для высококачественного липидного анализа. С развитием биологии систем с несколькими омиками метод Folch далее, поэтапно, улучшался путем использования его для разделения образцов белков и полярных метаболитов и липидов для Газовой и жидкостной хроматографии и липидомики полярных и гидрофобных соединений, в дополнение к протеомике на основе жидкостной хроматографии 11 , 12 , 13 , 14. К сожалению, все эти методы основаны на методе экстракции на основе хлороформа, который не только Приводит к нежелательнымВ качестве интерфазы между полярной и липидной фазами, но также является нежелательным растворителем с точки зрения зеленой химии 15 , 16 . Однако растворитель метил- трет -бутиловый эфир (МТБЭ) преодолевает обе указанные выше проблемы и является подходящей заменой хлороформа. Исходя из этих требований, мы решили создать метод извлечения МТБЭ: метанол: вода на основе воды, который удовлетворяет всем вышеперечисленным спецификациям и, следовательно, является идеальной отправной точкой для всестороннего многоомического анализа 16 .Этот протокол каждый шаг направляет пользователя через простой, быстрый и воспроизводимый рабочий процесс подготовки проб, включая устранение проблем, которые обычно наблюдаются. Кроме того, мы вкратце представим примерные аналитические данные из сверхэффективной жидкостной хроматографии-масс-спектрометрии (UPLC-MS) -basЛипидомики, метаболомики и протеомики, профилирующие образцы растений. Несмотря на то, что данные примеры получены из 50 мг образца ткани листьев Arabidopsis thaliana , этот протокол использовался для нескольких других биологических образцов и тканей, включая водоросли 17 , 18 , насекомые 19 и клетки млекопитающих, органы и ткани 20 , 21 , 22 . Объем представленного протокола извлечения заключается в том, чтобы предоставить четкое и подробное описание обработки проб предварительной экстракции и самой процедуры извлечения. Несмотря на то, что мы приводим три кратких примера аналитического приложения, подробную информацию о до- и пост-аналитической обработке данных можно получить из наших предыдущих публикаций 16 , 23 , 24 , 25 , 26 .
протокол
Осторожно : метанол (MeOH) и метил- трет -бутиловый эфир (MTBE), используемый во время экстракции, являются легковоспламеняющимися и могут при длительном воздействии и / или контакте вызвать раздражение органов дыхания, глаз или кожи. Обращайтесь с ними осторожно только в вытяжном шкафу и используйте соответствующие процедуры безопасности во время извлечения (лабораторное покрытие, защитные очки, перчатки и т . Д.). Жидкий азот и сухой лед, используемый в нескольких этапах этого протокола, могут вызвать сильные ожоги при длительном контакте с кожей. Обращайтесь с ними осторожно, надев защитные перчатки и очки. Пользователи могут использовать различные химикаты, реагенты или внутренние стандарты для анализа проб, некоторые из которых могут быть токсичными. Пожалуйста, изучите соответствующие листы химической безопасности для всего используемого материала.
1. Сбор и сбор биологических образцов
- Подготовьте маркированные уборочные трубы.
ПРИМЕЧАНИЕ. Здесь собирают биологические образцы в меченых, 2 мл, круглодонном, безопасном местеK микроцентрифужных пробирок, содержащих два диаметра 5 мм, металлические шарики для тканевого гомогенизатора. - Подготовьте заполненный жидкий азот-дьюар.
- Убирайте биологический образец и замораживайте ткань в жидком азоте. Выполните этот шаг как можно быстрее в течение нескольких секунд, чтобы избежать метаболических изменений, вызванных ранами.
Примечание. Для демонстрации используйте листья розетки из 30-дневного Arabidopsis thaliana дикого типа (Col-0), выращенного на почве в условиях длительного дня. - Храните собранные образцы на сухом льду для кратковременных перерывов или храните их при -80 ° C в течение более длительных периодов времени.
2. Разрушение и разрушение тканей
- Предварительно охладите держатели пробирок тканевого гомогенизатора в жидком азоте в течение не менее 10 мин. Если тканевый гомогенизатор недоступен, используйте чистые и предварительно охлажденные растворы и пестики.
- Возьмите образцы из жидкого азота, сухого льда или морозильника -80 ° C и поместите их в предварительно охлажденныйДержатели труб.
- Быстро вставьте держатели труб в тканевый гомогенизатор.
- Измельчите биологический материал в мелкий и однородный порошок. Используйте 20 Гц в течение 1 мин для листьев.
Заметка; Время гомогенизации и скорость могут варьироваться в зависимости от ткани, убедитесь, что образец гомогенизирован в мелкий порошок и этот порошок замораживается на каждой стадии гомогенизации. - Возьмите биологические образцы из держателей труб и держите их замороженными до дальнейшей экстракции.
3. Взвешивание тканей
- Используйте аналитический баланс с достаточной точностью для требуемых количеств проб.
- Приготовьте помеченную 2-миллилитровую микроцентрифужную пробирку с круглым дном.
- Предварительно охладите трубки и шпатели в жидком азоте.
- Выровняйте необходимое количество тканевого порошка в 2 мл микроцентрифужную пробирку с защитным замком.
Внимание: избегайте размораживания растительного материала, минимизируя время, затрачиваемое на wПо образцам. - Верните образцы аликвоты сразу после взвешивания до жидкого азота.
- Запишите для каждого образца точный вес. Используйте 10-50 мг ± 10% для большинства растительных тканей.
- Храните аликвотные образцы при -80 ° C до дальнейшей экстракции.
4. Настройка реагента
- Используйте экстракционную смесь метил- трет -бутилового эфира (МТБЭ) / метанола (МеОН).
- Для приготовления 100 мл экстракционного растворителя добавьте 75 мл МТБЭ до 25 мл МеОН, чтобы получить смесь МТБЭ: МеОН (3: 1, об. / Об.).
- Добавить внутренние стандарты для нормализации постанализа в соответствии с аналитическими потребностями. Как правило, добавляют 50 мкл 1,2-дигептадеканоил- sn -гликоцеро-3-фосфохолина (1 мг / мл в хлороформе) в качестве внутреннего стандарта для анализа липидов на основе UPLC-MS, добавляя 50 мкл 13 C-сорбита ( 1 мг / мл в воде) в качестве внутренних стандартов для анализа на основе ГХ-МС первичныхметаболиты. Внутренние стандарты анализа метаболитов на основе UPLC-MS составляют 50 мкл кортикостерона (1 мг / мл в метаноле) и 25 мкл ампициллина (1 мг / мл в метаноле).
- Перенесите растворитель в чистую стеклянную бутылку, которую промывают смесью МТВЕ: МеОН.
- Храните экстракционную смесь в течение 1 недели при температуре 4 ° C.
ПРИМЕЧАНИЕ. Не храните экстракционную смесь в течение более длительных периодов времени для сохранения воспроизводимых результатов.
- Чтобы вызвать разделение фаз, используйте воду (H 2 O) / метанол (MeOH).
- Для получения 100 мл H 2 O: MeOH добавляют 75 мл H 2 O до 25 мл MeOH для получения H 2 O: MeOH (3: 1, об. / Об.).
- Перенесите растворитель в чистую стеклянную бутылку, которую промывают смесью H 2 O: MeOH. Этот растворитель можно хранить в течение нескольких недель при комнатной температуре.
5. Извлечение образцов
- Предварительно охладить экстракцию m(MTBE: MeOH, 3: 1, об. / Об.) До -20 ° C с использованием жидкостной системы охлаждения или морозильника -20 ° C.
- Выньте аликвотные образцы один за другим и добавьте 1 мл предварительно охлажденной экстракционной смеси в каждую пробирку для образцов. Внимание: быстро выполните этот шаг из-за низкой вязкости MTBE.
- Немедленно перемешайте на вихревом смесителе, пока ткань не будет хорошо гомогенизирована в экстракционной смеси.
ПРИМЕЧАНИЕ. Этот этап очень важен, так как требуется осаждение белков и инактивация их ферментативной активности. - Инкубируйте все образцы на орбитальном шейкере со скоростью 100 об / мин в течение 45 минут при 4 ° C.
- Проориентируйте образцы в течение 15 минут на охлажденной льдом бане с ультразвуком.
6. Фракционирование путем разделения фаз
- Добавьте 650 мкл H 2 O: MeOH (3: 1, об. / Об.) В каждую пробирку.
- Хорошо перемешать, встряхивая в течение 1 мин.
- Центрифугируйте образцы со скоростью 20000 x g в течение 5 минут при 4 ° C.
ПРИМЕЧАНИЕ. После этого этапа в нижней части трубки имеются две несмешивающиеся жидкие фазы с твердым гранулом.
Внимание: Обращайтесь с трубками с осторожностью, чтобы избежать смешивания двух жидких фаз и избежать разрушения осажденного осадка.
7. Аликвотирование полярных и гидрофобных фракций
- Перенесите 500 мкл растворителя из верхней липидсодержащей фазы в меченую микроцентрифужную пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ. Аликвотные образцы липидов могут быть непосредственно сконцентрированы для немедленного анализа UPLC-MS (этап 8.1) или сохранены в течение нескольких недель при -80 ° C. - Как только 500 мкл удаляются из образца, удалите оставшуюся липидную фазу с помощью пипетки 200 мкл.
- Перенесите 400 мкл растворителя из нижней фазы (полярные и полуполярные метаболиты) в меченую микроцентрифужную пробирку объемом 1,5 мл. Аликвотные полярные образцы могут быть непосредственно сконцентрированы для непосредственного анализа UPLC-MS (этап 8.2) или сохранены дляR несколько недель при -80 ° C.
- Возьмите дополнительную аликвоту в 200 мкл для проведения дополнительного анализа, например, анализ метаболитов на основе газовой хроматографии, как описано в таблице 16 .
- Удалите оставшуюся часть водной фазы путем пипетирования избыточного объема.
- Промыть полученный белок, крахмал, осадок клеточной стенки с помощью 500 мкл метанола, тщательно встряхивая его в течение 1 мин.
- Центрифугируйте образцы со скоростью 10 000 x g в течение 5 минут при 4 ° C.
- Выполните экстракцию белка и переваривание (этап 11) или анализ на крахмал / клетку, как описано ранее 16 .
ПРИМЕЧАНИЕ. Если их не использовать немедленно, эти гранулы можно хранить в течение нескольких недель при -80 ° C.
8. Концентрация и хранение фракций
- Выпаривают растворитель из образцов липидов (из стадии 7.1) в вакуумном концентраторе без нагревания (в течение 1-2 часов) или предпочтительно используют нитрИспарителя потока кислорода, чтобы избежать окислительных модификаций липидов.
ПРИМЕЧАНИЕ. Сухие образцы следует анализировать немедленно. Для хранения оставляйте образцы в растворе MTBE, в идеале, в стеклянных флаконах (шаг 7.1). - Выпаривают растворитель из водных образцов (из стадии 7.3 или 7.4) в течение ночи в вакуумном концентраторе без нагревания. ПРИМЕЧАНИЕ: высушенные образцы можно хранить в течение нескольких недель при -80 ° C перед анализом.
9. Анализ липидов с использованием UPLC-MS 24
- Повторно суспендируют высушенные липидные фракции (из стадии 8.1) в 400 мкл ацетонитрила: 2-пропанола (7: 3, об. / Об.).
- Транспортируйте достаточное количество жидкости в стеклянные флаконы и плотно закрывайте колпачок.
- Поместите стеклянные флаконы в охлажденный автосамплер (4 ° C).
- Внесите 2 мкл на образец и отделите липиды на колонке с обращенной фазой (RP) C 8, удерживаемой при 60 ° C, с использованием системы UPLC, работающей при скорости потока 400 мкл / мин.
- Использовать мобильныйФаз, описанных в таблице 1 для хроматографического разделения.
- Приобретите масс-спектры в режиме положительной и отрицательной ионизации с использованием подходящего прибора MS, охватывающего диапазон масс от 150 до 1500 м / с.
10. Анализ полярных и полуполярных метаболитов с использованием UPLC-MS 25 .
- Повторно суспендируйте полярную фазу (из шага 8.2) в 200 мкл метанола: UPLC (1: 1, об. / Об.).
- Транспортируйте достаточное количество жидкости в стеклянные флаконы и плотно закрывайте колпачок.
- Поместите стеклянные флаконы в охлажденный автосамплер (4 ° C).
- Внесите 2 мкл из каждого образца и отделите метаболиты на колонке RP C 18, удерживаемой при 40 ° C, с использованием системы UPLC, работающей при скорости потока 400 мкл / мин.
- Используйте подвижные фазы для хроматографического разделения с параметрами, приведенными в таблице 2 .
- Приобретать полные спектры сканирования в режиме положительной и отрицательной ионизацииИспользуя подходящий масс-спектрометр, охватывающий диапазон масс от 50 до 1500 м / с.
11. Экстракция белка, вываривание и анализ 16.
- Повторно суспендируйте промытый осадок белка / крахмала / клеточной стенки (из стадии 7.8) в 200 мкл буфера экстракции белка. Примечание. Мы используем буфер мочевины / тиомочевины (5 М мочевины, 2 мМ тиомочевины, 15 мМ ДТТ, 2% CHAPS и ингибиторы протеазы и фосфатазы). 27 .
- Сонатируйте образцы в течение 10 минут в охлаждаемой льдом звуковой ванне.
- Инкубируйте образцы в течение 30 мин на орбитальном шейкере (100 об / мин) при комнатной температуре.
- Центрифугировать растворенные белки при 10000 мкг в течение 5 мин.
- Соберите супернатант белка в новой пробирке.
- Определите концентрацию белка из собранного супернатанта 28 .
- Дайджест 50 мкг белка в растворе с протоколом выбора. Как правило, используйте трипсин / Lys-C mix accordiВ руководстве по эксплуатации.
- После переваривания проводят обессоливание пептидов до масс-спектрометрии с использованием кончиков С 18- й стадии и элюируют переваренные пептиды 29 .
- Сконцентрируйте образцы до почти сухости в вакуумном концентраторе без нагрева.
- Повторно суспендируйте образцы в соответствующем загрузочном буфере (например, 5% ацетонитрила, 0,5% муравьиной кислоты) и проанализируйте смеси пептидов с помощью ЖХ-МС / МС с использованием масс-спектрометра высокого разрешения, подключенного к системе наноцентров.
ПРИМЕЧАНИЕ. В примерном наборе данных протеомики, представленном в этом протоколе, мы использовали градиент, как описано в таблице 3 . - Установите масс-спектрометр, используя стратегию 15-го уровня, где за одним полным сканированием (FS) следовали до 15 зависимых от MS / MS сканирующих данных, до следующих параметров: FS находился в диапазоне масс 200-2000 м / с при Разрешение 70 000 с целевым значением ионов 3 × 10 6 . Получите данные MS / MS, зависящие от данных, более высокого уровняRgy столкновительной диссоциации (HCD). Задайте целевые значения для ионов MS / MS для ионов 1e 5 с максимальным временем заполнения ионов 50 мс, окно изоляции 4.0 m / z, нормализованная энергия столкновения (NCE) 30% и коэффициент недополнения 1%. Измерьте ионы MS / MS с разрешением 17,500, а динамическое исключение - 60 с.
Результаты
Всесторонние массивы данных с несколькими омиками неоценимы для понимания сложных биологических систем. Стратегия успешного биологического эксперимента обычно начинается с значимого экспериментального проектирования, настройки эксперимента и производительности, за которым следует сбор образцов, извлечение, аналитическое получение данных, обработка необработанных данных, анализ статистических данных, идентификация соответствующего метаболита и интерпретация биологических данных Включая отображение и визуализацию путей ( рис. 1 ).
В представленном здесь протоколе экстракции мы фокусируемся на этапах сбора выборки, обработки и -экстракции, которые показаны в подробном обзоре рабочего процесса на рисунке 2 . Для демонстрационных целей было выбрано 50 мг ткани листьев Arabidopsis. Этот материал собирали, измельчали и извлекали перед тем, как подвергнуть его воздействию трехОбразцовые аналитические платформы UPLC-MS, предоставляющие данные, которые могут быть использованы для целенаправленного и нецелевого липидного, метаболомического и протеомического анализа. На рисунках 2 и 6 дополнительно представлены репрезентативные изображения того, как в стандартных условиях должен проявляться растворитель для экстракции. Кроме того, показаны примеры образцов, содержащих избыточные количества осажденных макромолекул (белки и крахмал), и образцы с неуместной гомогенизацией образцов ( рисунок 3 ). Устранение неполадок для этих двух общих проблем кратко изложено на рисунке 3, но это также обсуждается более подробно в нашей предыдущей публикации 16 .
На рисунках 4 и 5 представлены примеры трех аналитических хроматограмм, полученных из липидов, полярных / семиI-полярные метаболиты и анализ белков. Липиды, которые были взяты из верхней фазы МТВЕ ( рис. 2 ), анализировали с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (RP) C 8, связанной с масс-спектрометрией высокого разрешения. Липиды могут быть получены с использованием положительных и отрицательных режимов ионизации МС ( рис. 4 , верхняя панель) 16 , 24 .
Полярные и полуполярные первичные и вторичные метаболиты анализировали на полярной (вода / метаноле) фазе ( рис. 2 ) с обращенной фазой (RP) C 18 UPLC-MS 25 . Иллюстрированный метод, использующий обращенно-фазовую хроматографию, очень совместим с анализом полуполярных метаболитов (а именно метаболитов вторичного метаболизма растений), которые могут быть проанализированы с использованием положительных и отрицательных режимов ионизации в MS( Рисунок 4 , нижняя панель) 16 . Более гидрофильные метаболиты из этой фракции (сахара, полярные аминокислоты и т. Д.), Которые не показывают хорошего удержания на материале с обращенной фазой, могут быть проанализированы другими аналитическими методами, такими как ГХ-МС 16 или жидкостная хроматография гидрофильного взаимодействия 30 .
Белки, которые были извлечены из твердого осадка на дне экстракционной трубки ( фиг. 2 ), были расщеплены и проанализированы с помощью дробилки LC-MS ( рис. 5 ), тогда как протокол для извлечения крахмала и клеточной стенки Материал может быть получен из нашего ранее опубликованного протокола 16 .
Таким образом, более 200 видов липидов, 50 аннотированных полуполярных метаболитов и несколько тысяч протеиновNs можно регулярно идентифицировать из образцов типа, используемого в нашем примере. Кроме того, этот метод показал широкую применимость с использованием различных тканей, органов и клеточного материала ( рис. 6 ).

Рисунок 1: Общий рабочий процесс для крупномасштабного анализа нецелевых омиков. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2 : Процесс подготовки проб и экстракции для анализа липидов, метаболитов и белков из одной аликвоты биологического образца.Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
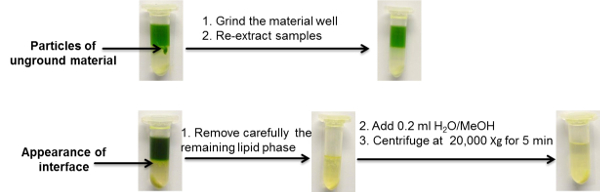
Рисунок 3 : Иллюстративные примеры обычно наблюдаемых проблем с использованием двухфазных протоколов извлечения секционирования. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
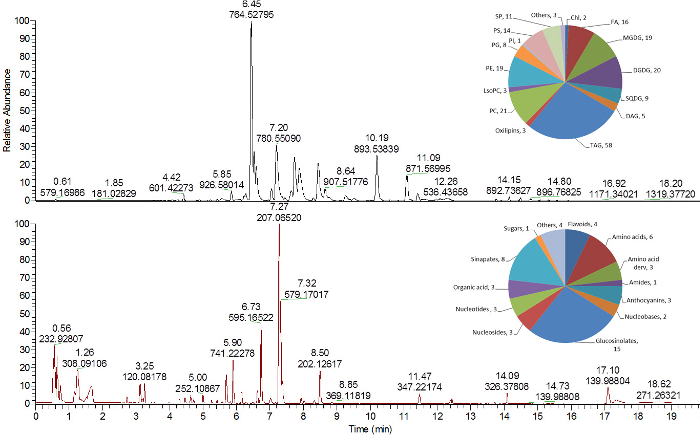
Рисунок 4 : Представительские хроматограммы липидных и полуполярных метаболитов из экстрактов листьев Arabidopsis thaliana . Базовая пиковая хроматограммаС липидов (верхняя панель) и полуполярных метаболитов (нижняя область), проанализированных в режиме положительной ионизации 16 . Круговые диаграммы в верхнем правом углу каждой хроматограммы показывают количество идентифицированных липидов и метаболитов, назначаемых различным химическим классам. Chl, хлорофиллы; ДАГ, диацилглицерид; DGDG, дигалактозилдиацилглицерин; FA, жирная кислота; LysoPC, лизофосфатидилхолин; MGDG, моногалактозилдиацилглицерин; ПК, фосфатидилхолин; PE, фосфатидилэтаноламин; PG, фосфатидилглицерин; PI, фосфатидилинозитол; PS, фосфатидилсерин; SP, сфинголипид; SQDG, сульфохиносозилдиацилглицерин; TAG, триацилглицерид. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
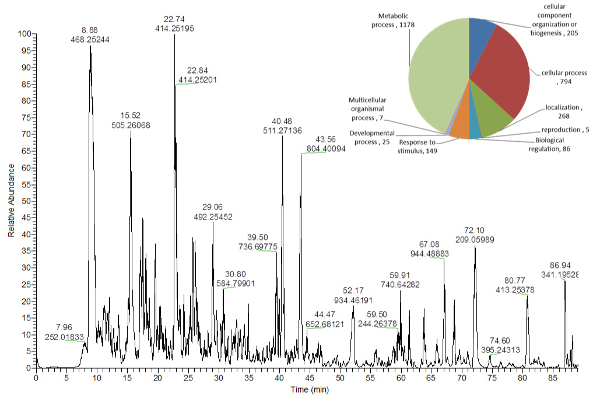
Рисунок 5 Trong>: Репрезентативная базовая пиковая хроматограмма пептидов из экстрактов листьев Arabidopsis thaliana .
Круговая диаграмма в верхнем правом углу указывает количество идентифицированных белков, назначенных для разных биологических процессов 16 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6 : Типичные примеры экстракции различных типов тканей из Arabidopsis thaliana дикого типа .
Все образцы экстрагировали, используя 50 мг свежего веса из указанных тканей."> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Время (мин) | % Буфер A до буфера B | |
| От 0 до 1 мин | 45% A | Буфер A: 1% 1M NH4-ацетат, 0,1% уксусная кислота в воде UPLC MS |
| От 1 до 4 минут | Линейный градиент от 45% А до 25% А | Буфер B: 1% 1M NH4-ацетат, 0,1% уксусная кислота в ацетонитриле / изопропаноле 7: 3, (v: v) |
| От 4 до 12 минут | Линейный градиент от 25% А до 11% А | Расход 400 мкл / мин |
| От 12 до 15 минут | Линейный градиент от 11% А до 0% А | Объем впрыска 2 мкл |
| 15-19,5 мин | Промойте колонку в течение 4,5 минут с помощью 0% A | |
| Установите обратно на 45% A | ||
| 19,51-24 мин | Уравнивать с помощью 45% A |
Таблица 1: Градиентные параметры для RP-UPLC Разделение липидов. RP, обратная фаза. UPLC, ультраэффективная жидкостная хроматография.
| Время (мин) | % Буфер A до буфера B | |
| От 0 до 1 мин | 99% A | Буфер A: 0,1% муравьиная кислота в воде UPLC |
| От 1 до 11 минут | Линейный градиент от 99% А до 60% А | Буфер B: 0,1% муравьиная кислота в UPLC-градуировании ацетонитрила |
| От 11 до 13 минут | Линейный градиент от 60% А до 30% А | Расход 4001; л / мин |
| 13-15 минут | Линейный градиент от 30% А до 1% А | Объем впрыска 2 мкл |
| 15-16 минут | Промойте колонку в течение 1 минуты с помощью 1% A | |
| От 16 до 17 минут | Линейный градиент от 1% А до 99% А | |
| От 17 до 20 минут | Уравнить в течение 3 мин при 99% А |
Таблица 2: Градиентные параметры для RP-UPLC-разделения полярных и полуполярных метаболитов. RP, обратная фаза. UPLC, ультраэффективная жидкостная хроматография.
| Время (мин) | % Буфер B в буфер A | |
| От 0 до 5 минут | Линейный градиент от 0 до 10% | Буфер A: 0,1% муравьиная кислота в воде UPLC |
| От 5 до 80 минут | Линейный градиент от 10% до 40% | Буфер B: 0,1% муравьиная кислота в 60% ацетонитриле UPLC |
| От 80 до 85 минут | Линейный градиент от 40% до 60% | Расход 300 нл / мин |
| От 85 до 86 мин | Линейный градиент от 60% до 95% | Объем впрыска 5 мкл |
| От 86 до 91 мин | Промойте колонку в течение 5 мин с 95% | |
| От 91 до 92 мин | Линейный градиент от 95% до 0% | |
| От 93 до 110 мин. | Уравновешивают колонку в течение 17 мин при 0% |
Таблица 3: Градиентные параметры для отделения Nano-LC пептидов. LC, жидкостная хроматография.
Обсуждение
В этой статье мы описываем и иллюстрируем простой и весьма применимый протокол экстракции для комплексного липидного, метаболомического и протеомического анализа из одного образца листьев 50 мг. Этот метод ранее использовался в нескольких исследованиях, которые были опубликованы в различных статьях 17 , 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 , 31 , 32 , 33 , 34 , 35 , 36 , 37 И доказал, что в дополнение к прямомуРабочий процесс и высокая применимость, чтобы быть надежными и воспроизводимыми.
Приведенные здесь приложения показывают некоторые рутинные методы для первоначального скрининга сложного биологического образца. Эти иллюстрированные крупномасштабные комплексы метаболомических и липидомических данных могут предоставить исчерпывающую информацию о широких или специфических изменениях метаболизма анализируемой биологической системы, в то время как данные, полученные при анализе белков, дают представление о количественном (изобилие) и качественном (модификации ) Изменения ферментов, структурных белков или транскрипционных факторов (ТФ), контролирующих клеточные функции и механизмы. Соответственно, данные интегративной омики могут выявить исходную информацию о возможных изменениях, вызванных генетическими или биотическими и / или абиотическими возмущениями биологической системы, путем выяснения молекулярных изменений различных молекул, связанных с конкретными метаболическими путями или клеточными процессами.
Конечно, В долгосрочной перспективе для успешного анализа системной биологии крайне важно максимально увеличить количество анализируемых и аннотированных молекулярных объектов, позволяя максимально полно контролировать клеточные функции и действия. Для этой цели полученные фракции могут быть дополнительно применены к различным аналитическим методам, ориентированным на другие соединения или сложные классы ( рисунок 4 ).
Сказав это, следует упомянуть, что стратегия глобального анализа полученных данных может зависеть от двух разных стратегий: с одной стороны, мы подчеркивали выяснение клеточных функций путем количественного определения известных соединений. С другой стороны, многие измеренные метаболиты и липиды еще не известны или не аннотируются. Эти, но не аннотированные измерения соединений также содержат много значимой информации, которая может быть использована статистическими методами для классификации или дискриминации bМежду группами или обработками 20 , 21 , 22 .
Тем не менее, эти неизвестные соединения, особенно те, которые относятся к групповой классификации или служат в качестве биомаркеров, должны быть идентифицированы. Этот процесс идентификации, к сожалению, довольно утомительный и не может быть достигнут без дополнительных аналитических измерений или стратегий. Как видно из рисунка 4 , количество не аннотированных соединений довольно велико (на самом деле подавляющее большинство). Тем не менее, как упомянуто выше, эти хроматографические пики могут обрабатываться в рамках анализа данных, и поэтому существенные затронутые объекты могут быть выяснены и подвергнуты дальнейшим стратегиям идентификации.
Таким образом, мы можем заключить, что представленный здесь протокол обеспечивает несколько преимуществ для биологии экспериментальных систем, а также для классического статистического примененияations.
Во-первых, поскольку все фракции извлекаются из одного образца, вариация между различными наборами экспериментальных данных (липиды, метаболиты, белки) значительно снижается, поскольку каждый набор данных получен из одной и той же аликвоты образца. Это, несомненно, приводит к увеличению сопоставимости полученных результатов.
Во-вторых, этот метод легко масштабируется и поэтому он очень совместим с малыми и большими объемами проб. Мы регулярно используем 10-100 мг образцов тканей, но успешные липидомические исследования также выполнялись всего на 20 семечках Arabidopsis 31 . Особенно совместимость с небольшими количествами проб делает этот метод применимым, если доступно ограниченное количество биологических тканей или образцов. Тем не менее, даже если имеется достаточный образец материала, представленный здесь метод дает преимущество использовать эти образцы в большем количестве экспериментальных реплик вместо uПеть их для различных процедур экстракции. Это позволяет улучшить и уточнить статистический анализ данных.
В-третьих, поскольку метод основан на жидкофазном фракционировании полярных и неполярных молекул, он обеспечивает, в отличие от простых однофазных методов экстракции ( например, экстракции метанолом) значительную стадию декомплексации в процедуре. Эта эффективная декомпозиция образца приводит к частичной очистке отдельных фракций за счет разделения химически мешающих молекул друг от друга. Соответственно, процесс химического разделения не только дает практическое преимущество для систематической аликвотации извлеченных образцов в разные химические классы, но также улучшает отдельные аналитические измерения, поскольку он удаляет загрязняющие соединения из разных фракций. Ясно, что мы можем заметить, что особенно липиды, которые разделены на органическую фазу и которые обычно отрицательно влияют наХроматографический анализ полярных соединений, будет почти полностью отсутствовать в полярной фракции. То же самое относится и к анализу гидрофобных липидов, которые будут истощены полярными соединениями. Помимо очистки полярных и неполярных соединений друг от друга, мы истощаем и собираем белки и другие макромолекулы из образца, который не только обеспечивает отдельную фракцию, которая может быть использована для анализа белка, крахмала и клеточной стенки 16 , но также Приводит к более чистым образцам в отдельных фракциях. Это особенно важно, поскольку известно, что наличие больших макромолекул приводит к повреждению или, по меньшей мере, более короткому времени жизни аналитических колонок.
И последнее, но не менее важное: описанный метод извлечения МТБЭ, который опирается на менее опасный и более благоприятный растворитель для замены хлороформа 15 , уже был показан несколькими исследованиями из нашей группы, которые будут широко применятьсяПригодность для различных биологических образцов из растений 16 , водорослей 17 , 18 , мух 19, а также нескольких тканей, органов или клеток млекопитающих 20 , 21 , 22 .
Раскрытие информации
Авторам нечего раскрывать
Благодарности
MS поддерживается полной стипендией PhD от программы GERLS-DAAD. Мы хотели бы поблагодарить д-ра Эндрю Вишневского за доказательство чтения и комментирования рукописи. Мы очень благодарны всем членам лаборатории Giavalisco в Институте физиологии молекулярных растений им. Макса Планка, Голм, Германия за их помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents and standards | |||
| Ampicillin | Sigma Aldrich | A9393-5G | Internal standard for metabolites |
| Corticosterone | Sigma Aldrich | 27840-500MG | Internal standard for metabolites, HPLC grade |
| 13C Sorbitol | Sigma Aldrich | 605514 | Internal standard for metabolites, ISOTEC® Stable Isotopes |
| 1,2-diheptadecanoyl-sn-glycero-3-phosphocholine (17:0 PC) | Avanti Polar Lipids | 850360P | Internal standard for lipids |
| Methanol (MeOH) | Biosolve Chemicals | 13684102 | ULC-MS grade |
| Water | Biosolve Chemicals | 23214102 | ULC-MS grade |
| Methyl tert-butyl ether (MTBE) | Biosolve Chemicals | 13890602 | HPLC grade |
| Trypsin/Lys-C mix | Promega | V5072 | Enzymatic digestion of proteins |
| Equipment | |||
| Balance | Sartorius Corporation | 14 557 572 | |
| Tissue grinding mixer mill | Retsch, Mixer Mill MM 300 | 20.746.0001 | |
| Mortar and pestle | Sigma Aldrich | Z247464-1EA | |
| Vortex mixer | Vortex-Genie 2, Model G560 | SI-0236 | |
| Vacuum concentrator | Scan Speed Maxi Vac Alpha Evaporators | 7.008.500.002 | |
| 2 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120094 | Used for sample extarction |
| 1.5 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120086 | Used for fractions |
| Shaker | Eppendorf Thermomixer 5436 | 2050-100-05 | |
| Sonicator | USC 300 TH | 142-0084 | |
| Refrigerated microcentrifuge | Eppendorf, model 5427R | 22620701 | |
| UPLC system | Waters Acquity UPLC system (Waters, Machester, UK) | ||
| MS system | Exactive, Orbitrap-type, MS (Exactive, Thermo-Fisher, Bremen, Germany). | ||
| Reversed Phase (RP) Bridged Ethyl Hybrid (BEH) C8 column (100 mm × 2.1 mm containing 1.7 μm diameter particles) | Waters, Machester, UK | 186002878 | Analysis of lipids |
| RP High Strength Silica (HSS) T3 column (100 mm × 2.1 mm containing 1.8 μm diameter particles) | Waters, Machester, UK | 186003539 | Analysis of metabolites |
| Q ExactivePlus high resolution mass spectrometer connected to an EASY-nLC 1000 system | Thermo-Fisher, Bremen, Germany | Analysis of peptides |
Ссылки
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 117 (4), 500-544 (1952).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Yang, M. Q., et al. The emerging genomics and systems biology research lead to systems genomics studies. BMC Genomics. 15, 1 (2014).
- Sheth, B. P., Thaker, V. S. Plant systems biology: insights, advances and challenges. Planta. 240 (1), 33-54 (2014).
- Ideker, T., Galitski, T., Hood, L. A new approach to decoding life: Systems biology. Annu Rev Genom Hum G. 2, 343-372 (2001).
- Somvanshi, P. R., Venkatesh, K. V. A conceptual review on systems biology in health and diseases: from biological networks to modern therapeutics. Syst Synth Biol. 8 (1), 99-116 (2014).
- Oliver, S. G., Winson, M. K., Kell, D. B., Baganz, F. Systematic functional analysis of the yeast genome. Trends Biotechnol. 16 (9), 373-378 (1998).
- Tweeddale, H., Notley-McRobb, L., Ferenci, T. Effect of slow growth on metabolism of Escherichia coli, as revealed by global metabolite pool ("metabolome") analysis. J Bacteriol. 180 (19), 5109-5116 (1998).
- Kim, H. K., Verpoorte, R. Sample preparation for plant metabolomics. Phytochemical analysis : PCA. 21 (1), 4-13 (2010).
- Folch, J., Lees, M., Stanley, G. H. S. A Simple Method for the Isolation and Purification of Total Lipides from Animal Tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Weckwerth, W., Wenzel, K., Fiehn, O. Process for the integrated extraction, identification and quantification of metabolites, proteins and RNA to reveal their co-regulation in biochemical networks. Proteomics. 4 (1), 78-83 (2004).
- Wienkoop, S., et al. Integration of metabolomic and proteomic phenotypes: analysis of data covariance dissects starch and RFO metabolism from low and high temperature compensation response in Arabidopsis thaliana. Mol Cell Proteomics. 7 (9), 1725-1736 (2008).
- Valledor, L., et al. A universal protocol for the combined isolation of metabolites, DNA, long RNAs, small RNAs, and proteins from plants and microorganisms. Plant J. 79 (1), 173-180 (2014).
- Nakayasu, E. S., et al. MPLEx: a Robust and Universal Protocol for Single-Sample Integrative Proteomic, Metabolomic, and Lipidomic Analyses. mSystems. 1 (3), (2016).
- Alfonsi, K., et al. Green chemistry tools to influence a medicinal chemistry and research chemistry based organisation. Green Chem. 10 (1), 31-36 (2008).
- Salem, M. A., Juppner, J., Bajdzienko, K., Giavalisco, P. Protocol: a fast, comprehensive and reproducible one-step extraction method for the rapid preparation of polar and semi-polar metabolites, lipids, proteins, starch and cell wall polymers from a single sample. Plant Methods. 12, 45 (2016).
- Hemme, D., et al. Systems-wide analysis of acclimation responses to long-term heat stress and recovery in the photosynthetic model organism Chlamydomonas reinhardtii. Plant Cell. 26 (11), 4270-4297 (2014).
- Sharma, D. K., et al. UPLC-MS analysis of Chlamydomonas reinhardtii and Scenedesmus obliquus lipid extracts and their possible metabolic roles. J Appl Phycol. 27 (3), 1149-1159 (2015).
- Delgado, R., Munoz, Y., Pena-Cortes, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Bozek, K., et al. Organization and evolution of brain lipidome revealed by large-scale analysis of human, chimpanzee, macaque, and mouse tissues. Neuron. 85 (4), 695-702 (2015).
- Khrameeva, E. E., et al. Neanderthal ancestry drives evolution of lipid catabolism in contemporary Europeans. Nat Commun. 5, 3584 (2014).
- Bozek, K., et al. Exceptional evolutionary divergence of human muscle and brain metabolomes parallels human cognitive and physical uniqueness. PLoS Biol. 12 (5), 1001871 (2014).
- Krueger, S., Steinhauser, D., Lisec, J., Giavalisco, P. Analysis of subcellular metabolite distributions within Arabidopsis thaliana leaf tissue: a primer for subcellular metabolomics. Methods Mol Biol. 1062, 575-596 (2014).
- Hummel, J., et al. Ultra performance liquid chromatography and high resolution mass spectrometry for the analysis of plant lipids. FrontPlant Sci. 2, 54 (2011).
- Giavalisco, P., et al. Elemental formula annotation of polar and lipophilic metabolites using (13) C, (15) N and (34) S isotope labelling, in combination with high-resolution mass spectrometry. Plant J. 68 (2), 364-376 (2011).
- Caldana, C., et al. Systemic analysis of inducible target of rapamycin mutants reveal a general metabolic switch controlling growth in Arabidopsis thaliana. Plant J. 73 (6), 897-909 (2013).
- Giavalisco, P., et al. Proteome analysis of Arabidopsis thaliana by two-dimensional gel electrophoresis and matrix-assisted laser desorption/ionisation-time of flight mass spectrometry. Proteomics. 5 (7), 1902-1913 (2005).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature protocols. 2 (8), 1896-1906 (2007).
- Spagou, K., et al. Hydrophilic interaction chromatography coupled to MS for metabonomic/metabolomic studies. J Sep Sci. 33 (6-7), 716-727 (2010).
- Hauck, O. K., et al. Uric acid accumulation in an Arabidopsis urate oxidase mutant impairs seedling establishment by blocking peroxisome maintenance. Plant Cell. 26 (7), 3090-3100 (2014).
- Avin-Wittenberg, T., et al. Global analysis of the role of autophagy in cellular metabolism and energy homeostasis in Arabidopsis seedlings under carbon starvation. Plant Cell. 27 (2), 306-322 (2015).
- Watanabe, M., et al. Comprehensive dissection of spatiotemporal metabolic shifts in primary, secondary, and lipid metabolism during developmental senescence in Arabidopsis. Plant physiol. 162 (3), 1290-1310 (2013).
- Lambers, H., et al. Proteaceae from severely phosphorus-impoverished soils extensively replace phospholipids with galactolipids and sulfolipids during leaf development to achieve a high photosynthetic phosphorus-use-efficiency. New Phytol. 196 (4), 1098-1108 (2012).
- Degenkolbe, T., et al. Differential remodeling of the lipidome during cold acclimation in natural accessions of Arabidopsis thaliana. Plant J. 70, 972-982 (2012).
- Bromke, M. A., et al. Liquid chromatography high-resolution mass spectrometry for fatty acid profiling. Plant J. 81 (3), 529-536 (2015).
- Li, N., et al. FAX1, a novel membrane protein mediating plastid fatty acid export. PLoS Biol. 13 (2), 1002053 (2015).
- Kueger, S., Steinhauser, D., Willmitzer, L., Giavalisco, P. High-resolution plant metabolomics: from mass spectral features to metabolites and from whole-cell analysis to subcellular metabolite distributions. Plant J. 70 (1), 39-50 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены