Method Article
Заражение мышей с Malassezia spp. для изучения взаимодействия гриба-хозяина
В этой статье
Резюме
Этот протокол описывает создание мышиной модели для изучения взаимодействия Malassezia-хозяинав коже. Он описывает выращивание Malassezia in vitro, инфекции кожи морин с Malassezia, и последующий анализ воспаления и грибковой нагрузки в ткани кожи.
Аннотация
Модели животных имеют решающее значение для исследований инфекционных заболеваний. Они обеспечивают важную основу для анализа всего спектра взаимодействий, которые происходят между микробами и их хозяина in vivo в ткани-специфическим образом. Патогенные грибы все чаще признаются в качестве серьезной угрозы для людей и эксплуатации таких моделей инфекции значительно улучшили наше понимание грибковой патогенности. Виды рода Malassezia являются наиболее распространенными грибами микробиоты кожи человека, и они также связаны с развитием тяжелых воспалительных кожных заболеваний, таких как себорейный дерматит и атопический дерматит. Тем не менее, причинно-следственная связь между Malassezia и патогенез болезни остается неизвестным, факт, который может быть связано с плохим знанием сложного перекрестного разговора Malassezia с иммунной системой кожи. Этот протокол описывает создание экспериментальной модели мыши, которая позволяет изучать взаимодействие Malassezia с кожей млекопитающих in vivo. В нем излагается метод выращивания Malassezia spp. в лабораторных условиях, как заразить кожу мурин с помощью Malassezia spp. и как оценить исход инфекции с помощью воспаления кожи и грибковых анализов бремени. Описанная здесь модель работает у полностью иммунокомпетентных животных и не полагается на иммунную супрессивную или антибиотиковую предварительную обработку животных. Кроме того, он адаптируется практически ко всем генетически модифицированным штаммам мыши и может быть объединен с другими моделями кожных заболеваний. Эти особенности делают эту модель инфекции очень мощным инструментом для детального изучения врожденного и адаптивного иммунного ответа хозяина против Malassezia в коже in vivo.
Введение
Кожа населена множеством различных микробов. Постоянное воздействие кожи на микробиоту способствует формированию и обучению иммунной системы хозяина. Грибы все чаще признаются как жизненно важная часть микробиоты, и они выполняют важную роль для принимающей физиологии и иммунитета, похожие на бактерии и вирусы1. Виды рода Malassezia на сегодняшний день являются наиболее распространенными грибами колонизации кожи теплокровных позвоночных, и они составляют более 90% человеческой кожи микобиом2,3. Восемнадцать различных видов Malassezia до сих пор были определены из человека и животного кожи4.
Различные патологии кожи, как полагают, возникают, по крайней мере частично, в результате диссбалансированного состава микробиоты. Дисбактериоз может привести к разрастанию видов с патогенным потенциалом, что приводит к оппортунистическим инфекциям и болезни5. Последовательно, есть все больше доказательств того, что Malassezia, помимо его сословия образа жизни, способствует развитию различных патологий кожи, начиная от перхоти и pityriarsis versicolor к более тяжелым воспалительным расстройствам, такие как как себорейный дерматит и атопический дерматит4,6. Хотя причинно-следственная связь между Malassezia и pityriarsis versicolor была установлена, патофизиологическая роль гриба в более тяжелых патологий кожи остается в значительной степени неизвестно.
Определение роли Malassezia в гомеостазе кожи и болезни требует более углубленного знания о взаимодействии гриба с кожей и кожной иммунной системы. Следует отметить, что исследования по Malassezia, по сравнению с другими человеческими грибковых патогенов (например, Candida albicans или Aspergillus fumigatus), все еще в молодой стадии. Это можно объяснить трудностями в выращивании Malassezia в лабораторных условиях и отсутствием соответствующих экспериментальных моделей для изучения гриба в контакте с хозяином in vivo. Предыдущие эксперименты с изолированными клетками в культуре показали широкий спектр прямых и косвенных взаимодействий между Malassezia и различных иммунных и неиммунных клеток7. Тем не менее, эти эксперименты in vitro лишь частично резюмируют ситуацию сложной среды кожи in vivo, где одновременно происходят многочисленные клеточные и молекулярные события между грибком и различными типами клеток.
В этом случае мы наметили протокол для экспериментальной модели инфекции кожи Malassezia у мышей, которую мы недавно установили, для изучения взаимодействия гриба-хозяина in vivo7. Это включает в себя процедуры для (1) успешного выращивания Malassezia in vitro, (2) эпикутанеозное применение Malassezia на кожу уха, и (3) технические детали того, как анализировать Маласезияиндуцированной кожи воспаление и грибковое бремя инфицированной кожи. Важно отметить, что эта модель не опирается на иммуносупрессию (например, кортикостероиды) или лечение антибиотиками мышей до инфекции, как это практикуется в других моделях мыши грибковой инфекции8,9. В свою очередь, это позволяет изучать весь спектр врожденного и адаптивного иммунного ответа против Malassezia в нормальной коже. Следует отметить, что инбредные мыши дикого типа, соблюдаемые в специфических условиях без патогена (SPF), естественным образом не колонизированы с Малассезией и, следовательно, их воздействие гриба не приводит к постоянной колонизации, но очищается от хозяина внутри около 1,5 недель. Однако модель позволяет изучать механизмы инициирования и регуляции реакции противогрибкового хозяина, что, в свою очередь, является основой того, как генерируется иммунная память. Модель является универсальной в том, что она может быть легко применена к широкому спектру генетически модифицированных штаммов мыши и может быть объединена с другими существующими моделями кожных заболеваний, таких как модели барьерного дефицита, для изучения воздействия Malassezia под патологические и воспалительные заболевания кожи7. Таким образом, описанная модель экспериментальной инфекции кожи Malassezia у мышей обеспечивает высокую степень гибкости для исследования взаимодействия гриба с иммунной системой кожи в контексте гомеостаза и болезни.
Этот протокол описывает экспериментальную инфекцию кожи мышей с Malassezia spp. Из-за его патогенного потенциала, Malassezia spp. классифицируются как ПАтогенные микроорганизмы BSL2 в некоторых странах, включая Швейцарию. Пожалуйста, проверьте местные руководящие принципы и следуйте правилам местных властей. BSL2 классифицированных организмов должны обрабатываться квалифицированным персоналом в соответствии с BSL2 сертифицированных биобезопасности кабинета (BSC). Биологические отходы, загрязненные организмами, классифицированными BSL2, а также туши мышей, инфицированных такими организмами, должны быть аутоклавированы до их удаления. Для экспериментов с мышами необходимо приложить все усилия, чтобы свести к минимуму страдания и обеспечить высочайшие этические и гуманные стандарты в соответствии с принципами 3R (заменить, уточнить, уменьшить)10. Эксперименты, описанные в этом протоколе, были проведены с Помощью M. pachydermatis (ATCC 14522), M. furfur (ATCC 14521) и M. sympodialis (ATCC 42132)7.
протокол
Все процедуры, описанные в настоящем протоколе, были проведены в соответствии с постановлением об обращении с организмами в содержащихся в системах Федерального управления по окружающей среде Швейцарии (www.bafu.admin.ch). Эксперименты на мышах проводились в строгом соответствии с руководящими принципами Швейцарского закона о защите животных и проводились в соответствии с протоколами, утвержденными Ветеринарным управлением кантона Цюрих, Швейцария (лицензия No 168/2018).
1. Культивирование Малассезии в лабораторных условиях
ПРИМЕЧАНИЕ: Храните все реагенты и носители, используемые для этого протокола при комнатной температуре (RT, 20 - 25 градусов по Цельсию), если не указано иное, так как более низкая температура может препятствовать грибковому росту.
- Подготовьте жидкое модифицированное средство Dixon (mDixon) для роста Малассезии. Для приготовления 500 мл жидкой среды mDixon, растворите 18 г солодового экстракта, 10 г высохлого бычьего желчи, 5 мл Tween-40, 3 г Пептоне, 1 мл глицерола и 1 мл олеиновой кислоты в 500 мл дистиллированной H2O (dH2O). Отрегулируйте среднюю до pH 6 с HCl и автоклавом. Храните средство на RT.
- Подготовка mDixon агар пластины, добавив 7,5 г агара до 500 мл мДиксон среды до autoclaving. Медленно охладить агар mDixon после автоклавирования с помощью рулевого руля и магнитной нагревательной пластины, чтобы избежать частичного затвердевания среды при охлаждении.
- После того, как агар остыл до 50 - 60 градусов по Цельсию, распределить жидкость в чашку Петри в ламинарный капот потока и дайте им высохнуть на RT на ночь.
ПРИМЕЧАНИЕ: Агар пластины могут храниться при 4 градусах Цельсия в течение нескольких недель, когда завернутые и хранятся с ног на голову, чтобы избежать испарения. - Получить Malassezia изолирует и возродить лиофилизированных запасов Malassezia в соответствии с инструкциями, полученными поставщиком.
- Прививать 10 мл жидкой мДиксон среды в стерильной 100 мл Эрленмайер колбу с возрожденной подвеской Malassezia в соответствии с инструкциями, полученными поставщиком. Инкубировать культуру в трясущегося инкубатора при 30 градусах Цельсия и 180 об/мин.
- Регулярно проверяйте рост культуры Малассезии, проверяя внешний вид кремового цвета и мутности. Кинетика роста зависит от вида и штамма Malassezia и может быть особенно медленным, когда Malassezia только что возродился из лиофилизированного запаса. (Рисунок 1А).
- Подготовка глицерола запасов путем смешивания 3 части плотно выращенных культуры Malassezia в mDixon среде с 1 частью стерильных 99% глицерола. Aliquot Malassezia/glycerol смесь в стерильные трубки винт-крышка и хранить при -80 градусов по Цельсию.
- Для распространения in vitro, пластины Malassezia от жидкой культуры в mDixon или из замороженных глицерола фонда на mDixon агар пластины (принес ею от 4 кВ) с помощью прививочной петли.
ПРИМЕЧАНИЕ: Передача mDixon агар пластин rt от 4 кC до использования, так как холодный mDixon агар подавляет грибковый рост. - Инкубировать агар пластины (ы) с Malassezia с ног на голову в (не тряски) инкубатор при 30 градусах Цельсия. Регулярно осматривайте рост колоний Малассезии.
ПРИМЕЧАНИЕ: Маласезия колоний на mDixon агар пластины появляются в течение 3 - 5 дней и кремового цвета скучно, гладкой с выпуклой высоты (Рисунок 1B). - Храните колонии Malassezia на тарелках агара mDixon на RT в течение 2 недель. После этого, подготовить новый mDixon агар пластины полос Маласезия из замороженных глицерола фонда, как описано в 1.7.
2. Подготовка инокулума для экспериментальной инфекции Малассезии мышей
- Прививать 10 мл жидкой мДиксон среды в стерильной 100 мл Берленмейер колбу с 3 - 5 отдельных колоний Malassezia из mDixon агар пластины (см. шаг 1, Рисунок 1B).
- Инкубировать культуру Malassezia для 48 до 96 ч при 30 градусах по Цельсию и 180 об/мин до тех пор, пока культура не будет кремового цвета и мутной(рисунок 1А).
ПРИМЕЧАНИЕ: Время, необходимое для роста Malassezia зависит от вида Malassezia и деформации и количество гриба, используемого для прививки. - Передача 2 мл культуры Малассезии в стерильную микроцентрифугую трубку 2 мл и центрифугу в течение 1 мин при 10 000 х г.
- Откажитесь от супернатанта и промойте гранулы, приостановив его в 1 мл фосфатно-буферизированного солевого раствора (PBS). Центрифуга снова в течение 1 мин при 10 000 х г.
- После стирки приостанавливают гранулы в 1 мл PBS путем энергичного пайпетирования и измеряйте оптическую плотность раствора на уровне 600 Нм (ODA600)с помощью спектрометра. Разбавить подвеску Malassezia 20 - 50 x с PBS для измерения OD для того чтобы обеспечить что чтение между 0.1 и 1.
ПРИМЕЧАНИЕ: Плотность 3-дневной культуры Malassezia обычно варьируется от 15 до 30 ODA600, в зависимости от вида Malassezia и деформации и от количества дрожжевых клеток, используемых для прививки культуры (шаг 2.1). Malassezia имеет тенденцию к форме агрегатов, поэтому, энергичный пипетка необходимо для обеспечения однородности подвески. - Aliquot объем подвески Malassezia в PBS, что соответствует плотности 4 ODA600 в стерильной трубке 2 мл. Подготовьте 1 трубку на животное для заражения.
- Центрифуга трубки, содержащие Malassezia в течение 1 мин на 10000 х г.
- Откажитесь от супернатанта и приостановить Гранулы Malassezia в 200 злитровых местных оливкового масла (соответствующие 2 ODA600 дрожжевых клеток / 100 л оливкового масла).
ПРИМЕЧАНИЕ: Оливковое масло было установлено, что хорошее средство для эпикутанезной инфекции с Malassezia, как Malassezia является липофильной и липид-зависимых дрожжей. Оливковое масло лучше усваивается кожей, чем PBS. Однако, имейте в виду, что это не легко приостановить Malassezia в оливковом масле. Улучшение Malassezia/ оливковое масло подвески путем вихря. Держите подвеску на RT, пока он не используется для инфекции. - Подготовка трубки с оливковым маслом только для макет инфекции контрольных животных.
3. Заражение мышей Малассезией
- Закажите самки мышей C57BL/6 в возрасте от 6 до 8 недель и дайте им акклиматизироваться в экспериментальном животном объекте, по крайней мере одну неделю. Рассчитайте 3 - 5 мышей на группу, включая неинфицированную контрольную группу.
- Приготовьте стерильный анестезируетовый коктейль, содержащий 1,3 мг/мл ксилазина и 6,5 мг/мл кетамина в PBS. 5 мл анестезируемого коктейля достаточно, чтобы обезобезожнести 20 животных. Отрегулируйте объем коктейля в зависимости от количества животных, которые будут обезобезысабливаться.
- Анестезия животных путем введения 10 Л /г массы тела анестезирующего коктейля интраперитонелически (соответствующие 65 мг кетамина и 13 мг ксилазин на кг массы тела) и поместить обезболированных животных на грелку при 37 градусах Цельсия.
ПРИМЕЧАНИЕ: В указанной дозе животные обычно остаются обезоживаемыми в течение 30 - 60 мин.
- Анестезия животных путем введения 10 Л /г массы тела анестезирующего коктейля интраперитонелически (соответствующие 65 мг кетамина и 13 мг ксилазин на кг массы тела) и поместить обезболированных животных на грелку при 37 градусах Цельсия.
- Проверьте рефлексы, щипать заднюю ногу щипками, чтобы гарантировать, что животные полностью под анестетом.
- Нанесите крем для глаз на глаза, чтобы предотвратить обезвоживание во время анестезии.
- Дополнительно измерьте толщину уха обоих ушей с помощью калипера (диапазон от 0 до 5 мм). Измерьте две разные области каждого уха и рассчитайте среднюю толщину уха на ухо.
ПРИМЕЧАНИЕ: Измерение толщины уха является необязательным и зависит от исследовательского вопроса. Однако, если толщина уха используется в качестве считывателя для воспаления кожи, необходимо измерить базовую толщину уха до инфекции. (см. Шаг 4). - Дополнительно нарушить эпидермальный барьер кожи сосна втертанного уха мягкой лентой зачистки: вручную нанесите небольшой кусочек ленты на кожу и удалите его снова. Повторите в течение 5 последовательных раундов, используя свежий кусок ленты для каждого раунда.
ПРИМЕЧАНИЕ: Malassezia вызывает более выраженное воспаление кожи в барьерной нарушенной кожи по сравнению с невозмутимым кожи (Рисунок 2)7. - Местно применять 100 кЛ (2 ODA600) из Malassezia/ оливковое масло подвески на тонусовой стороне каждого уха с помощью стерильной пипетки. Включите контрольную группу животных, которые обрабатываются только оливковым маслом (управляекец).
ПРИМЕЧАНИЕ: Vortex Malassezia/ оливковое масло подвески энергично, чтобы обеспечить однородную подвеску Malassezia непосредственно перед применением. - Оставьте обезболированных животных на грелке, чтобы избежать переохлаждения, пока они не проявят признаки выздоровления (движение висы, повышенная частота дыхания и т.д.).
- Вводят 200 л стерильного и предварительно разогретого 2% раствора глюкозы подкожно в нучаловую складку, чтобы поддержать их метаболизм и регидратацию.
ПРИМЕЧАНИЕ: Чтобы подготовить стерильный 2% раствор глюкозы, растворите 1 мг глюкозы в 50 мл PBS и фильтруем его с помощью фильтра 0,2 мкм. Раствор можно хранить при 4 градусах Цельсия. - Перенесите животных обратно в клетку.
4. Анализ малассезии-индуцированноговоспаления кожи
ПРИМЕЧАНИЕ: Эта процедура описывает анализ Malassezia-индуцированнойотек уха во время инфекции, которая служит параметром воспаления кожи. Предпосылкой для анализа грибок индуцированной отек уха является измерение базовой толщины уха до ленты-зачистки и / или инфекции (Шаг 3.5).
- Подготовка изофруран камеры для краткосрочной анестезии Malassezia-инфицированныхи контроля животных.
- Перенесите одно животное в камеру и ждите, пока животное будет полностью обезглавлено.
ПРИМЕЧАНИЕ: Признаки надлежащей анестезии включают полное расслабление тела, а также медленное и тяжелое (фланговое) дыхание. Тщательно следите за анестезией, так как длительное воздействие изофлюранов может привести к летальному исходу. - Выньте животное из камеры и поместите его на ткань.
- Измерьте толщину уха (ы) с помощью кадетских калибровок (диапазон от 0 до 5 мм). Измерьте две разные области каждого уха и вычислите среднюю толщину на ухо (см. шаг 3.5).
- Перенесите животное обратно в клетку.
ПРИМЕЧАНИЕ: Изофлюранская анестезия очень недолговечна, и животные восстанавливаются в пределах 30 с после удаления из изофрурановой камеры. - Рассчитайте увеличение толщины уха путем вычитания средней базовой толщины уха, измеренной до зачистки ленты и/или инфекции, от средней толщины уха, измеренной в каждый момент после заражения.
- Участок рассчитанных значений, как увеличение толщины уха или, в качестве альтернативы, как общая толщина уха с течением времени для каждого животного или группы животных (Рисунок 2B).
5. Анализ грибковой нагрузки на зараженную кожу
- Подготовьте стерильную микроцентрифугную трубку 2 мл для каждого уха, содержащую 0,5 мл стерильных 0,05% NP40 в dH2O и автоматический стальной шар (диаметр 5 мм).
- Взвесьте трубки с помощью точного баланса и запишите точный вес.
- Эвтаназия мышей CO2 асфиксии.
- Удалите ухо (ы) у основания и перенесите в трубку, содержащую 0,5 мл стерильных 0,05% NP40 в dH2O, как описано в шагах 5.1 - 5.2.
- Взвесьте трубку, содержащую ушную ткань, и вычислите фактический вес каждого образца, вычитая вес трубки без органа из веса трубки с органом.
- Гомогенизировать ушную ткань в течение 6 мин при 25 Гц с помощью ткани гомогенизатора. Убедитесь, что ткань хорошо гомогенизирована.
- Плита 100 л каждого образца (соответствует 1/5 каждого гомената, фактор разбавления No 5) на тарелки агара mDixon и инкубирует пластины вверх дном в инкубаторе 30 градусов по Цельсию.
ПРИМЕЧАНИЕ: Количество гомегената покрытием должны быть скорректированы в соответствии с грибковой нагрузкой следует ожидать. Убедитесь в том, чтобы пластины достаточно гомегената, чтобы получить по крайней мере 10 и не более 250 колоний на пластину, чтобы легко перечислить. Дополнительно, пластины несколько пластин на образец с различными разбавленияго гомената. - Регулярно осматривайте рост колоний Малассезии.
ПРИМЕЧАНИЕ: Колонии обычно становятся видимыми через 2 - 3 дня. Время, необходимое для малассезии колоний расти зависит от вида и штамма Malassezia. - Посчитайте колонии на тарелку.
- Рассчитайте количество ткани CFU/g с помощью следующей формулы:
CFU/g ткань ю (количество колоний/пластины) x (фактор разбавления) / (вес образца кожи в g).
ПРИМЕЧАНИЕ: Приблизительный минимальный предел обнаружения может быть оценен по следующей формуле: минимальный предел обнаружения - (1 колония/пластина) x (фактор разбавления) / (средний вес всех образцов кожи в г). - Грибковые нагрузки обычно накладываются по логарифмической шкале(рисунок 2C).
Результаты
В пробирке выращивания Malassezia
По сравнению с другими более часто используемыми грибковыми патогенами модели, такими как C. albicans или A. fumigatus, Malassezia труднее культивировать в пробирке. Это можно объяснить тем фактом, что Malassezia полагается на экзогенные липидные источники для своих питательных потребностей, из-за его неспособности синтезировать жирные кислоты11. Среда mDixon подходит для культивирования нескольких видов Малассезии, включая M. pachydermatis, M. furfur, M. sympodialis, M. slooffiae, M. globosa и M. yamatoensis in vitro7 ,12. На рисунке 1 показаны репрезентативные изображения для роста M. sympodialis в жидкой среде mDixon и на агаре mDixon, как описано в шаге 1 и шаге 2.
Анализ воспаления кожи и грибкового бремени воспаления кожи Малассезии
Воздействие Malassezia на кожу мыши уха, которая была барьер нарушается лентой-зачистки до инфекции приводит к обострению воспаления кожи, характеризуется эпидермальной и дермальной гиперплазии и развития отеков7. Шаг 4 и 5 наметить методы для анализа Malassezia-индуцированнойотек уха и грибковое бремя кожи. Оба параметра представляют собой ключевые считывания для мониторинга течения инфекции. Рисунок 2иллюстрирует увеличение толщины уха, которое можно наблюдать после воздействия М. фуры на кожу, которая была нарушена по сравнению с невозмутимым кожей мышей WT C57BL/6. На рисунке 2B показан репрезентативный сводный график увеличения толщины уха с течением времени. Рисунок 2C отображает грибковое бремя в коже уха на второй день после заражения M. pachydermatis.
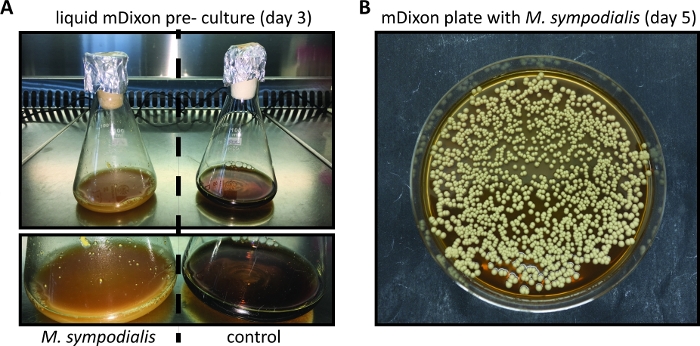
Рисунок 1: В пробирке выращивания Malassezia.
(A) M. sympodialis штамм ATCC 42132 выросли в течение 3 дней при 30 градусах По кв и 180 об/мин в жидком мДиксон среды (слева) рядом с контролем Erlenmeyer колбу, содержащую mDixon среды, которая не была привита (справа). (B) Колонии M. sympodialis штамм ATCC 42132 на mDixon агар после 5 дней инкубации при 30 градусах Цельсия. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
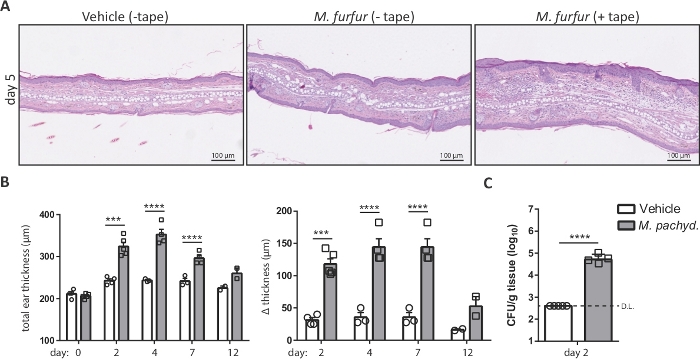
Рисунок 2: Анализ инфекции кожи Малассезии на основе толщины уха и грибковой нагрузки.
(A) Гистология ушных секций, полученных от мышей C57BL/6, которые лечились оливковым маслом (автомобиль, слева) или заражены штаммом M. furfur JPLK23 в течение 5 дней (средний и правый). Справа, ухо кожи была лентой-полосатый до инфекции. Разделы были окрашены гематоксилин и эозин (H и E). (B) Резюме графики, показывающие увеличение толщины уха с течением времени для C57BL/6 мышей, которые подверглись воздействию Malassezia или оставили неинфицированных в качестве контроля. Абсолютная толщина штамма M. pachydermatis ATCC 14522-экспонированных или транспортных средств обработанных ухо кожи в каждый момент времени отображается слева; увеличение толщины уха в указанные временные точки относительно базовой линии на 0 день показано справа. (C) Грибковое бремя в коже C57BL/6 мышей, которые были инфицированы штаммом M. pachydermatis ATCC 14522 или обработаны оливковым маслом в качестве контроля (транспортного средства). В обоих случаях кожа была обрезана лентой. Каждый символ в сводных графиках B и C представляет собой одно животное. Статистическая значимость различий между группами была рассчитана с использованием одностороннего ANOVA (B) или студенческого t-теста (C). р lt;0.001, "p йlt;0.0001, D.L.: Ограничение обнаружения Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот протокол описывает инфекцию кожи широко используемого инбредного штамма мыши C57BL/6 Malassezia spp. Адаптация этого протокола к другим штаммам мыши с другим генетическим фоном (например, Balb/c) или генетически модифицированной мышью штаммы могут нуждаться в корректировке дозы инфекции, точечный момент (ы) анализа и т.д. Для обеспечения воспроизводимости, группы мышей всегда должны быть одного возраста и пола. Источник мышей должен быть стабильным, так как даже незначительные изменения в генетическом фоне и различия в микробиоте, которые существуют между поставщиками и могут существовать даже между различными единицами одного племенного предприятия, могут иметь непредсказуемое воздействие на инфекции. При настройке модели инфекции Malassezia, описанной в данном протоколе, рекомендуется провести экспериментальное исследование, чтобы тщательно контролировать ход инфекции, включая степень колонизации, кинетику грибкового зазора и степень воспаление и патология, которые могут быть индуцированы (например, если ухо кожи барьер-нарушендо до инфекции), чтобы определить оптимальные условия проверки.
Для обеспечения воспроизводимости и надежного выявления различий между экспериментальными группами количество животных, используемых в группе, должно быть рассчитано на основе статистического анализа. Размер выборки рассчитывается на основе размера эффекта, частоты ошибок и мощности, которые учитывают биологические и экспериментальные вариации (например, из-за изменения в иммунной системе). По этическим соображениям избегайте использования неоправданно большого количества животных. Что касается malassezia инфекции кожи, лечение только одно ухо с грибком и с помощью другого уха в качестве контроля в той же мыши, не рекомендуется, потому что мыши могут распространить грибок на оба уха при уходе. Тем не менее, использование 1 / 2 уха для различных методологических читать выходы, такие как определение грибковой нагрузки, изоляция иммунных клеток или гистологический анализ часто достаточно и приводит к значительному сокращению численности животных, используемых для экспериментов.
На сегодняшний день описано 18 различных видов малассезии. Меж- и внутривидовые вариации в роде Malassezia могут повлиять на взаимодействие с хозяином, как мы также узнали из исследований по другим человеческим патогенным грибам13. Различные виды и штаммы малассезии различаются по происхождению (например, M. pachydermatis является наиболее частым видом, изолированным от животных, в то время как M. restricta, M. globosa и M. sympodialis являются наиболее видных членов грибковой микробиом кожи у людей с переменным распределением этих видов между различными участками кожи). Некоторые виды были связаны с комменсализмом, в то время как другие считаются более патогенными, хотя подробные данные остаются относительно слабыми. Важно отметить, что некоторые виды и штаммы по своей сути труднее расти, чем другие. Таким образом, решение о том, какие виды/деформации использовать для инфекции, должно основываться на исследовательском вопросе.
Экспериментальная инфекция кожи мурин с некоторыми микробными организмами, такими как Candida albicans или золотистый стафилококк требуют нарушения эпидермального барьера до инфекции, например, с песчаной бумагой14, 15,16. В отличие от этого, модель инфекции Malassezia описано здесь одинаково эффективно с и без барьера нарушения7. Степень воспаления, вызванного грибком, значительно усиливается, если кожа лента раздели до инфекции7. Поэтому, следует ли манипулировать кожей до применения Malassezia зависит от вопроса исследования. Существуют различные модели хронического и острого воспаления кожи (например, модели для гиперчувствительности отложенного типа (DTH) и контактной гиперчувствительности (CHS)) и модели барьерного дефицита, которые могут представлять интерес для исследования вклада сопутствующих дрожжей к кожных патологиям.
Инбреты мышей поддерживается в соответствии с конкретными патогена свободных (SPF) условия (насколько нам известно) не естественно колонизированы с Malassezia. Таким образом, экспериментальное применение Malassezia на кожу мыши ухо представляет собой первичное воздействие грибка, который вызывает острую реакцию у хозяина, который, в свою очередь, приводит к грибкового зазора в течение 1 - 2 недель7. Хотя модель, описанная в этом протоколе, поэтому лишь частично отражает ситуацию в иммунокомпетентных людей или других организмов хозяина, которые постоянно колонизированы с Malassezia, экспериментальная инфекция позволяет достаточно окно возможность изучения противогрибкового иммунитета и клеточных и молекулярных механизмов, лежащих в основе этой реакции. Он также позволяет исследовать различия в реакции на различные виды малассезии и штаммы в различных экспериментальных условиях (например, с и без барьера нарушения кожи).
Изучение Malassezia - взаимодействия хозяина были ограничены в прошлом, чтобы в пробирке эксперименты с изолированными типами клеток в культурах (например, кератиноцитов клеточных линий, PBMCs). Хотя эти исследования пролили некоторый свет на грибковые и принимающие детерминанты, которые формируют взаимодействие между Malassezia и принимающей17, они не позволяют получить полное понимание гриба - принимающей взаимодействия в комплексе окружающей среды кожи, которая включает в себя несколько типов клеток, которые находятся в постоянной связи, таких как кератиноциты, фибробласты и ткани-резидентиммунных иммунных клеток, но и лейкоцитов населения, которые проникают в ткани только при микробной встрече Кожи. Эта многоклеточная сеть не может быть полностью воспроизведена в моделях in vitro, даже с самыми передовыми органоидными системами. Таким образом, экспериментальная инфекция мышей по-прежнему представляет собой золотой стандарт в иммунологии и инфекционных заболеваний исследований, и наличие модели, описанной здесь представляет собой прорыв в области исследований Malassezia. Важно отметить, что эта модель опирается на эпикутанеозное применение Malassezia на иначе невозмутимой кожи мыши уха, и это не подразумевает прививку грибка путем инъекции в ткани, например, подкожно или интраперитоне, как Предыдущие исследования сообщили18, оба из которых более далеки от ситуации в естественно колонизированных хостов.
Возможность совместить модель инфекции Malassezia, описанную в этом протоколе, с другими доступными моделями мыши значительно увеличивает объем и гибкость применения. Последние включают в себя различные модели специфических кожных заболеваний, таких как модель барьерного дефицита, который имитирует важные особенности атопического дерматита, болезни, связанной с Malassezia у людей и собак. Кроме того, эпикутанетная инфекция кожи с Malassezia может быть легко применена к мышам с генетическими дефектами в генах-хозяинах, представляющих интерес, или мышей, в которых тип интереса клетки генетически удалены или могут быть фармакологически истощены (например, с помощью средств введения дифтерии токсина в дифтерии токсина рецепторов-выражающих мышей). Такие модели представляют собой неизбежный инструмент для вскрытия принимающей реакции на сопутствующие и патогенные микробы, в том числе Malassezia, и оценить роль этих генов и типа клеток в взаимодействии гриба-хозяина. Анализ взаимодействия кожи Малассезия-хозяинаможет быть расширен далеко за пределы того, что описано в этом протоколе. К ним относятся анализы гистологии (например, для определения степени патологии кожи или эпидермального утолщения, индуцированного грибком), иммуногистохимией или иммунофлуоресцентным окрашиванием секций тканей с использованием антител, направленных против клеточного типа конкретные маркеры или другие молекулы, представляющие интерес. Это также может включать в себя изоляцию клеток (например, ткани резидентов или ткани инфильтрации лейкоцитов подмножества) от инфицированных тканей кожи для изучения поляризации, регулирования и динамики иммунного ответа на Malassezia в большой глубине.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Цюрихским университетом, Швейцария.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar | Sigma-Aldrich | A1296-1KG | |
| Attane Isoflurane | Piramal Healthcare | - | |
| Biosaftey cabinet (BSC) Faster Ultra Safe | DASIT GROUP | TEC 5594 | BSL2 certified |
| Centrifuge | Eppendorf | 5415D | compatible with 2ml Eppendorf tubes |
| Dessicated Ox-bile | Sigma-Aldrich | 70168-100G | |
| Eppendorf Tubes (2 ml) | Eppendorf | 0030 120.094 | |
| Glucose | Sigma-Aldrich | 49159-5KG | |
| Gylcerol (99 %) | Honeywell | 10314830 | |
| Heating pad | Eickenmeyer | 648048 | |
| Incubator Hereaus B20 | Heraeus | 412047753 | BSL2 certified |
| Ketasol (100 mg) | Graeub AG | 6680416 | |
| Magentic heating plate MR Hei-Standard | Heidolph Instruments | 442-1355 | |
| Malassezia spp. | ATCC | 14522, 14521, 42132 | |
| Malt extract | Sigma-Aldrich | 70167-500G | |
| Multiply Biosphere Tubes (200 µl) | Sarstedt AG | 7084211 | Safelock |
| Native olive oil | - | - | commerc. available |
| Nonidet P40 | Axon Lab | A1694,0250 | |
| Oditest measurment devise | Kroeplin | S0247 | range 0-5 mm |
| Oleic Acid | Sigma-Aldrich | 75090-5ML | |
| Peptone | Oxoid | LP0037 | |
| Petri dishes | Sarstedt AG | 82.1473 | |
| Phosphat buffered salt solution (PBS, 1x) | Amimed/Bioconcept | 3-05F39 | |
| Rompun (2 %) | Bayer | KP0BFHR | |
| Shaking incubator Infors Minitron | Infors | - | BSL2 certified |
| Spectrometer | Jenway | 20308 | optical density measurement at 600nm |
| Spectrometer Cuvettes | Greiner Bio-One | 613101 | |
| Stainless Steel balls (5mm) | ABF | KU.5G80 1.3541 | |
| Syringes 1 ml Sub-Q | BD Bioscience | 305501 | |
| Tissue Lyzer II | Quiagen | 85300 | |
| Transpore Hypoallergic Tape | 3M | 1527-1 | |
| Tween 40 | Sigma-Aldrich | P1504-100ML | |
| Vitamin A Retinoli Palmitas Eye Cream | BAUSCH & LOMB | commerc. available |
Ссылки
- Iliev, I. D., Leonardi, I. Fungal dysbiosis: immunity and interactions at mucosal barriers. Nature Reviews Immunology. 17 (10), 635-646 (2017).
- Findley, K., et al. Topographic diversity of fungal and bacterial communities in human skin. Nature. 498 (7454), 367-370 (2013).
- Gemmer, C. M., DeAngelis, Y. M., Theelen, B., Boekhout, T., Dawson, T. L. Fast, noninvasive method for molecular detection and differentiation of Malassezia yeast species on human skin and application of the method to dandruff microbiology. Journal of Clinical Microbiology. 40 (9), 3350-3357 (2002).
- Theelen, B., et al. Malassezia ecology, pathophysiology, and treatment. Medical Mycology. 56, 10-25 (2018).
- Williams, M. R., Gallo, R. L. The role of the skin microbiome in atopic dermatitis. Current Allergy and Asthma Reports. 15 (11), 65 (2015).
- . . Malassezia and the Skin. , (2010).
- Sparber, F., et al. The Skin Commensal Yeast Malassezia Triggers a Type 17 Response that Coordinates Anti-fungal Immunity and Exacerbates Skin Inflammation. Cell Host Microbe. 25 (3), 389-403 (2019).
- Koh, A. Y. Murine models of Candida gastrointestinal colonization and dissemination. Eukaryotic Cell. 12 (11), 1416-1422 (2013).
- Solis, N. V., Filler, S. G. Mouse model of oropharyngeal candidiasis. Nature Protocols. 7 (4), 637-642 (2012).
- Russel, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Wu, G., et al. Genus-Wide Comparative Genomics of Malassezia Delineates Its Phylogeny, Physiology, and Niche Adaptation on Human Skin. PLoS Genetics. 11 (11), 1005614 (2015).
- Leong, C., Buttafuoco, A., Glatz, M., Bosshard, P. P. Antifungal Susceptibility Testing of Malassezia spp. with an Optimized Colorimetric Broth Microdilution Method. Journal of Clinical Microbiology. 55 (6), 1883-1893 (2017).
- Schonherr, F. A., et al. The intraspecies diversity of C. albicans triggers qualitatively and temporally distinct host responses that determine the balance between commensalism and pathogenicity. Mucosal Immunology. 10 (5), 1335-1350 (2017).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Liu, H., et al. Staphylococcus aureus Epicutaneous Exposure Drives Skin Inflammation via IL-36-Mediated T Cell Responses. Cell Host Microbe. 22 (5), 653-666 (2017).
- Nakagawa, S., et al. Staphylococcus aureus Virulent PSMalpha Peptides Induce Keratinocyte Alarmin Release to Orchestrate IL-17-Dependent Skin Inflammation. Cell Host Microbe. 22 (5), 667-677 (2017).
- Sparber, F., LeibundGut-Landmann, S. Host Responses to Malassezia spp. in the Mammalian Skin. Frontiers in Immunology. 8, 1614 (2017).
- Yamasaki, S., et al. C-type lectin Mincle is an activating receptor for pathogenic fungus, Malassezia. Proceedings of the National Academy of Sciences of the United States of America. 106 (6), 1897-1902 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены