Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Характеристика внутри хрящевых транспортных свойств катиоических пептидных носителей
В этой статье
Резюме
Этот протокол определяет равновесное поглощение, глубину проникновения и не равновесную скорость диффузии для катионных носителей пептида в хряще. Характеристика транспортных свойств имеет решающее значение для обеспечения эффективного биологического реагирования. Эти методы могут быть применены для разработки оптимально заряженных носителей наркотиков для ориентации отрицательно заряженных тканей.
Аннотация
Несколько отрицательно заряженных тканей в организме, как хрящ, представляют вроде барьера для целевой доставки лекарств из-за их высокой плотности отрицательно заряженных аггреканов и, следовательно, требуют усовершенствованных методов таргетинга для увеличения их терапевтической реакции. Поскольку хрящ имеет высокую отрицательную плотность фиксированного заряда, препараты могут быть изменены с положительно заряженных носителей наркотиков, чтобы воспользоваться электростатических взаимодействий, что позволяет для повышения внутри хряща наркотиков транспорта. Поэтому изучение транспортировки носителей наркотиков имеет решающее значение для прогнозирования эффективности лекарственных средств для индуцирования биологической реакции. Мы показываем дизайн трех экспериментов, которые могут количественно равновесного поглощения, глубины проникновения и не равновесной скорости диффузии катионных пептидных носителей в хряще explants. Эксперименты по поглощению равновесия обеспечивают меру концентрации раствора в хряще по сравнению с окружающей его ванной, что полезно для прогнозирования потенциала носителя препарата в повышении терапевтической концентрации наркотиков в хрящевой ткани. Глубина исследования проникновения с использованием конфокальные микроскопии позволяют визуальное представление 1D растворимой диффузии от поверхностной до глубокой зоны хряща, что важно для оценки того, растворы достигают их матрицы и клеточных целевых участков. Не равновесные исследования скорости диффузии с использованием специально разработанной транспортной камеры позволяет измерять прочность связывающих взаимодействий с матрицей тканей, характеризовав скорость диффузии флуоресцентно помеченных растворов по всей ткани; это полезно для проектирования носителей оптимальной прочности связывания с хрящом. В совокупности результаты трех транспортных экспериментов дают руководство по разработке оптимально заряженных носителей наркотиков, которые используют слабые и обратимые взаимодействия с зарядами для применения лекарственных средств. Эти экспериментальные методы также могут быть применены для оценки транспортировки наркотиков и спряжения носителей наркотиков. Кроме того, эти методы могут быть адаптированы для использования в ориентации других отрицательно заряженных тканей, таких как мениск, роговица и стекловидного юмора.
Введение
Доставка лекарств в отрицательно заряженные ткани в организме остается проблемой из-за неспособности препаратов проникать глубоко в ткани, чтобы достичь клеток и матрицы целевыхучастков 1. Некоторые из этих тканей состоят из плотно упакованных, отрицательно заряженных аггреканов, которые создают высокую отрицательную плотность фиксированного заряда (FCD)2 в тканях и выступают в качестве барьера для доставки большинства макромолекул3,4. Однако, с помощью положительно заряженных носителей наркотиков, этот отрицательно заряженный барьер ткани действительно может быть преобразован в депо наркотиков через электростатические взаимодействия заряда для устойчивойдоставки наркотиков 1,5,6,7(Рисунок 1).
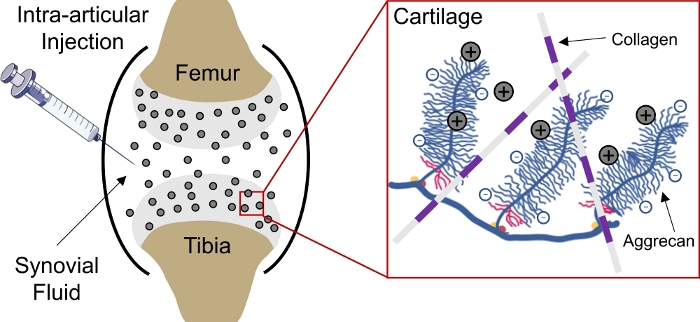
Рисунок 1: Зарядка на основе внутри хрящевой доставки КПК. Внутрисумаскулярная инъекция КПК в пространство коленного сустава. Электростатическое взаимодействие между положительно заряженными КЦК и отрицательно заряженными аггреканическими группами обеспечивает быстрое и полное проникновение через хрящ. Эта цифра была изменена из Vedadghavami идр. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Недавно, короткой длины катиотических носителей пептида (CPCs) были разработаны с целью создания небольших катиотических доменов, способных нести больших размеров терапии для доставки в отрицательно заряженныйхрящ 4. Для эффективной доставки препарата в хрящ длялечения распространенных 8,9 и дегенеративных заболеваний, таких как остеоартрит (ОА)10, очень важно, чтобы терапевтические концентрации наркотиков проникают глубоко в ткани, где большинство клеток хряща (хондроциты)лежат 11. Хотя Есть несколько потенциальных заболеваний изменения лекарств, ни один из них получили одобрение FDA, потому что они не в состоянии эффективноцелевой хрящ 12,13. Поэтому оценка транспортных свойств носителей наркотиков необходима для прогнозирования эффективности препаратов при индуцировании терапевтического ответа. Здесь мы разработали три отдельных эксперимента, которые могут быть использованы для оценки равновесного поглощения, глубины проникновения и не равновесной скорости диффузииКПК 4.
Для обеспечения достаточной концентрации препарата в хряще, который может обеспечить оптимальный терапевтический ответ, эксперименты поглощения были разработаны для количественной оценки равновесной концентрации КТК вхряще 4. В этой конструкции, следуя равновесию между хрящом и окружающей его ванной, общее количество раствора внутри хряща (либо привязанного к матрице, либо свободного) может быть определено с помощью коэффициента поглощения. Это соотношение рассчитывается путем нормализации концентрации растворим внутри хряща к концентрации равновесия в ванне. В принципе, нейтральные растворы, диффузии которых через хрящ не помогает заряда взаимодействия, будет иметь коэффициент поглощения менее 1. И наоборот, катиотические растворы, транспортировка которых усиливается с помощью электростатических взаимодействий, показывают коэффициент поглощения, более 1. Однако, как показано с CPCs, использование оптимального положительного заряда может привести к гораздо более высоким коэффициентам поглощения (больше, чем 300)4.
Хотя высокая концентрация наркотиков в хряще имеет важное значение для достижения терапевтической пользы, также важно, чтобы препараты рассеиваются через полную толщину хряща. Таким образом, исследования, показывающие глубину проникновения необходимы для обеспечения того, чтобы наркотики достигают глубоко внутри хряща, так что матрицы и клеточных целевых сайтов могут быть достигнуты, тем самым обеспечивая более эффективную терапию. Этот эксперимент был разработан для оценки одной из способов диффузии растворим через хрящ, имитируя диффузию наркотиков в хрящ после внутрисумочковой инъекции in vivo. Флуоресценция изображения с помощью конфокальные микроскопии позволяет для оценки глубины проникновения в хрящ. Чистый заряд частиц играет ключевую роль в модерации, как глубокие наркотики могут распространяться через матрицу. Оптимальный чистый заряд, основанный на ткани FCD, необходим для того, чтобы обеспечить слабо обратимое связывающее взаимодействие между катическими частицами и матрицей анионых тканей. Это означает, что любое взаимодействие достаточно слабо, так что частицы могут отмежеваться от матрицы, но обратимы в природе, так что он может связываться с другой матрицы связывания сайта глубже вткани 4. И наоборот, чрезмерный положительный чистый заряд частицы может быть пагубным по отношению к диффузии, так как слишком сильная матричная привязка предотвращает отслоение частиц от первоначального места связывания в поверхностной зоне хряща. Это приведет к недостаточной биологической реакции, как большинство целевых участков лежат глубоко в ткани11.
Для дальнейшей количественной оценки прочности связывающих взаимодействий, анализ наркотиков диффузии ставки через хрящ является выгодным. Не равновесные исследования диффузии позволяют сравнивать показатели диффузии в режиме реального времени между различными растворами. Поскольку препараты рассеиваются через поверхностные, средние и глубокие зоны хряща, наличие связывающих взаимодействий может значительно изменить скорость диффузии. При взаимодействии между препаратами и матрицей хряща, он определяется как эффективная диффузивность (DEFF). В этом случае, как только все связывающие сайты были заняты, уровень диффузии наркотиков регулируется устойчивым состоянием диффузии (DSS). Сравнение DEFF различных растворов определяет относительную связывающую прочность растворов с матрицей. Для данного раствора,если D EFF и DSS находятся в пределах одного порядка величины, это означает, что существует минимальное связывание настоящее время между препаратом и матрицы во время диффузии. Однако,если D EFF больше, чем DSS, существенное связывание частиц с матрицей существует.
Разработанные эксперименты индивидуально позволяют характеристику растворимого транспорта через хрящ, однако, целостный анализ с включением всех результатов требуется для разработки оптимально заряженных наркотиков перевозчика. Слабый и обратимый характер взаимодействия заряда контролирует скорость диффузии частиц и обеспечивает высокое равновесное поглощение и быстрое полное проникновение глубины через хрящ. Через эксперименты по равновесному поглощению, мы должны искать носителей, которые показывают высокое поглощение в результате взаимодействия заряда, которые могут быть проверены с помощью не равновесных исследований скорости диффузии. Тем не менее, эти связывающие взаимодействия должны быть слабыми и обратимыми по своему характеру, чтобы обеспечить полно толщину проникновения раствора через хрящ. Идеальный препарат перевозчик будет обладать оптимальным зарядом, который позволяет достаточно сильным связывания для поглощения и высокой концентрации внутри хряща наркотиков, но не слишком сильны, чтобы препятствовать полной толщиныдиффузии 4. Представленные эксперименты помогут в разработке характеристик для на основе заряда ткани ориентации носителей наркотиков. Эти протоколы были использованы для характеристики транспортировки КПКчерез хрящ 4, однако, они также могут быть применены к различным препаратам и носителей наркотиков через хрящ и другие отрицательно заряженные ткани.
протокол
Университет получил разрешение на проведение экспериментов с мертвыми тканями. Бычьи суставы были получены на коммерческой основе с скотобойни.
1. Извлечение хряща explant
- Использование скальпеля (#10 лезвия), вырезать и удалить жир, мышцы, связки, сухожилия и все другие соединительной ткани подвергать хрящ из бедренной канавки суставов коленного сустава.
- Используя 3 мм и 6 мм кожные удары, сделать перпендикулярные удары в хрящ для извлечения цилиндрических пробок. Немедленно поместите пробки в отдельных скважинах 48-хорошо пластины, содержащей 500 МКЛ 1x фосфат буферного солевого раствора (PBS) дополняется 1% V / V антибиотик-антимикотический.
- Поместите поверхностную сторону хряща штепсельная вилка лицом вниз в колодец в нарезке приспособление (Рисунок 2). Используя лезвие бритвы, нарежьте штепсельную вилку вдоль поверхности нарезки приспособления, чтобы получить 1 мм толщиной хряща explant, который находится включительно поверхностной зоны. Повторите для каждого хряща штепсельной вилки.
- Храните хрящ explants индивидуально в полипропилевых трубках, содержащих 500 МКЛ 1x PBS, дополненных ингибиторами протеазы (PBS-PI, 1 PI мини-таблетка на 50 мл 1x PBS) при -20 градусов по Цельсию.
- Перед проведением каждого из следующих транспортных экспериментов, оттепель эксплантсодержащих флаконов в течение 30 минут в водяной бане 37 градусов по Цельсию.
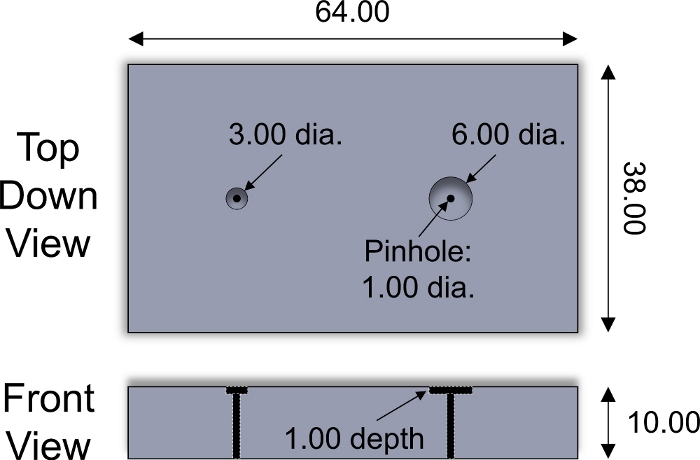
Рисунок 2: Специально разработанный нарезки приспособление. Параметры конструкции нарезающего прибора из нержавеющей стали, используемого для нарезки хряща explants диаметром 3 и 6 мм. Пластиковые вставки различной толщины были размещены внутри колодцев для регулировки толщины нарезанных эксплантов. Цилиндрическая булавка из нержавеющей стали диаметром 1 мм использовалась для выталкивать эксплант из арматуры. Все численные значения представлены в мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Равновесное поглощение КПК в хрящевой ткани
- Аккуратно мазок хряща explants (3 мм диа. X 1 мм толщиной.) с деликатной задачей протрите, чтобы удалить избыток 1x PBS от explant поверхности. Используя баланс, быстро записывать мокрый вес каждого explant, а затем сразу же поместить в ванну 1x PBS для предотвращения обезвоживания.
- Подготовь 30 решений мкм (300 йл на эксплант) флуоресцентно помеченных КПК в 1x PBS-PI. Для восстановления используйте полипропиленые трубки без RNase.
- В пластине из 96 скважин пипетка 300 МКЛ каждого 30 КТК раствора в отдельные скважины. Избегайте использования скважин вблизи края пластины, чтобы предотвратить испарение. Используя шпатель, перенесите каждый эксплант в раствор, содержащий скважины.
- Заполните окружающие скважины 300 МКЛ 1x PBS и накройте плиту скважины крышкой. Печать края пластины с гибкой пленкой, чтобы свести к минимуму испарение.
- Внутри инкубатора 37 градусов по Цельсию поместите пластину на шейкер пластины, чтобы ограничить осаждение частиц. Инкубация в течение 24 ч при мягком вращении (50 об/мин с орбитой 15 мм), чтобы обеспечить равновесное поглощение КФУ вхряще (рисунок 3).
- Создание стандартной кривой корреляции флуоресценции с концентрацией КТК
- Подготовка серийных разбавлений растворов КТК от 30 МКМ - 0 МКМ (10 2-кратного разбавления) в 1x PBS-PI в полипропилевых трубках. Убедитесь, что по крайней мере 500 йл каждого разбавления присутствует.
- Добавьте 200 мкл каждого разбавления к последовательным скважинам в черной пластине 96 скважин. Дублируйте в другом ряду, чтобы увеличить размер выборки.
- Получить показания флуоресценции каждого образца с помощью считывателя пластин на возбуждение и выброс длин волн флуоресцентной этикетки с помощью считывателя пластин.
- Участок флуоресценции чтения против концентрации КПК и получить уравнение для линейной части кривой.
ПРИМЕЧАНИЕ: Чтобы ограничить изменчивость показаний флуоресценции, инкубировать cpc фондовый раствор в тех же условиях, что и образец пластины до генерации стандартной кривой.
- После 24 ч инкубации, собирать равновесную ванну из каждой хорошо в отдельных полипропилевых труб.
- Перенесите 200 мкл каждого раствора в отдельные скважины из черной пластины из 96 скважин. Получение показаний флуоресценции каждого образца в тех же флуоресцентных настройках, что и для стандартной кривой. При необходимости разбавляйте образец в 1x PBS-PI, чтобы показания подпадают под линейную часть стандартной кривой.
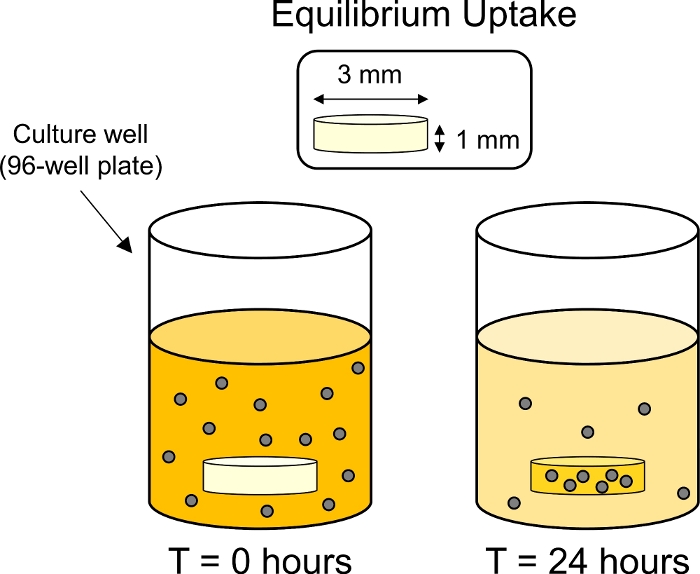
Рисунок 3: Схема экспериментов по равновесному поглощению. Хрящ explants (3 мм диа. х 1 мм толщиной) были помещены в отдельных скважин в 96-хорошо пластины, содержащие флуоресцентно помечены раствор КТК. После 24 ч КПК были поглощены хрящом, тем самым уменьшая флуоресценцию окружающей ванны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
3. Глубина проникновения КПК в хрящ
- Подготовь 30 решений мкм (300 йл на эксплант) флуоресцентно помеченных КПК в 1x PBS-PI. Для восстановления используйте полипропиленые трубки без RNase.
- Используя скальпель, вырезать хрящ explants (6 мм диаметром х 1 мм толщиной) пополам, чтобы сделать половину дисков. Держите explant гидратированных с слоем 1x PBS-PI при резке.
- Клей половину диска explant в середине одного колодец специально разработанных 1-мерной транспортной камеры с использованием эпоксидной смолы (Рисунок 4, Рисунок 5). Убедитесь, что эпоксидная смола наносится на окружной (изогнутой) стороне экспланта. Удалить избыток клея из колодец, чтобы предотвратить контакт с областью поверхности диффузии хряща и сделать к сведению поверхностную сторону explant.
- Добавьте 80 МКЛ 1x PBS-PI к обеим сторонам экспланта. Pipette жидкости вверх и вниз с одной стороны explant, чтобы проверить на утечку на другую сторону. Если утечка происходит, скорректировать explant и применять эпоксидной смолы по мере необходимости.
- Замените 1x PBS-PI сбоку, обращенной к поверхности хряща (вверх по течению) с 80 йл 30 КТК раствора. Поддерживайте 80 мкл 1x PBS-PI на стороне, обращенной к глубокой зоне хряща (вниз по течению).
- Аккуратно поместите транспортную камеру в покрываемый контейнер. Накройте основание контейнера слоем 1x PBS, чтобы избежать испарения растворов. Убедитесь, что нет прямого контакта между решениями из камер вверх по течению и вниз по течению.
- Поместите крытый контейнер на шейкер тарелки, чтобы ограничить осаждение частиц. Инкубация для 4 или 24 ч при комнатной температуре при мягком вращении (50 об/мин с орбитой 15 мм).
- После инкубации снимите эксплант из камеры и вырежьте ломтик 100 мкм из центра экспланта.
ПРИМЕЧАНИЕ: Это сечение включено в поверхностные, средние и глубокие зоны хряща. - Поместите ломтик между стеклянной горкой и крышкой. Гидрат ломтик слоем 1x PBS-PI.
- При увеличении в 10 раз, изображение через полную толщину ломтика, чтобы получить z-стек флуоресцентных изображений с помощью конфокального микроскопа.
- С помощью ImageJ проецируйте среднюю интенсивность изображений в z-стеке, чтобы определить глубину проникновения КПК в хрящ.
- Откройте стек изображений, нажав на файл Открыто.
- Нажмите на' Изображение' на планку задач и нажмите изображение Стеки Проект из меню высадки.
- Ввод среза номера от 1 до окончательного ломтика. Выберите'Средняя интенсивность'под типом проекции. Нажмите'OK.'
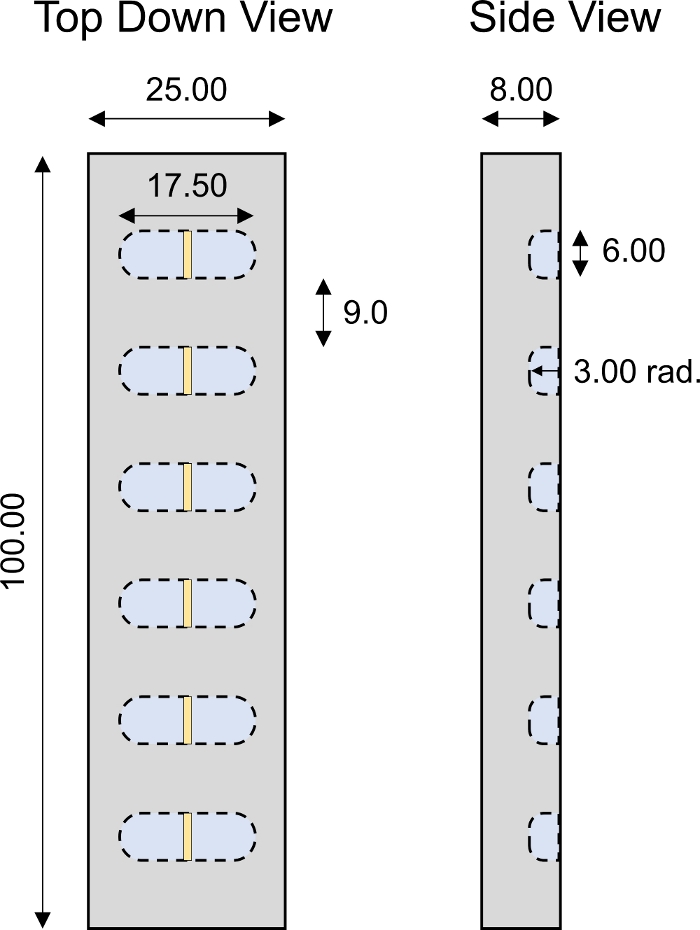
Рисунок 4: Специально разработанная 1-D транспортная камера. Параметры проектирования транспортной камеры PMMA 1D с 6 отдельными скважинами. Все численные значения представлены в мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
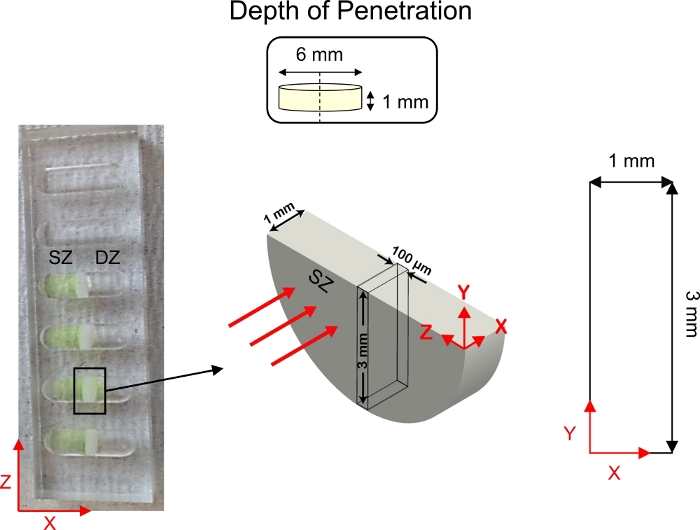
Рисунок 5: Схема глубины исследований проникновения. Хрящи explants (6 мм диаметром х 1 мм толщиной) были разрезаны пополам и закреплены в центре 1-D диффузных транспортных скважин. Флуоресцентно помеченный раствор КТК был добавлен в сторону колодеца в контакте с поверхностной зоной (СЗ) хряща. 1x PBS-PI был добавлен в сторону хорошо в контакте с глубокой зоной (D) хряща. После диффузии поперечное сечение хряща (3 мм х 1 мм) было изображено с помощью конфокальные микроскопии. Эта цифра была изменена с Vedadghavami et al.4 и Bajpayee et al.3 Пожалуйста, нажмите здесь,чтобы просмотреть более широкую версию этой цифры.
4. Не равновесный уровень диффузии КПК в хряще
- Принесите две половинки специально разработанной транспортной камеры(рисунок 6) вместе, чтобы собрать и закрыть камеру. Используйте шайбы, гайки и болты, чтобы плотно закрыть камеру гаечным ключом.
ПРИМЕЧАНИЕ: Транспортная камера должна быть полупрозрачной, чтобы не вмешиваться в флуоресцентные показания. Транспортные камеры, используемые в этом протоколе, изготовлены из полиметилметакрилата (PMMA). - Пальто внутреннее пространство камеры с 0,5% ж / в обезжиренное бычье молоко раствор в 1x PBS (2 мл для каждой камеры) в течение 15 минут, чтобы предотвратить неспецифическое связывание CPCs к стенкам камеры. Затем промойте камеру 1x PBS (2 мл для каждой камеры).
- Используя специально разработанный нарезки приспособление (Рисунок 2) и лезвие бритвы, ломтик 6 мм диаметром хряща explant (поперечная плоскость) до толщины 500-800 мкм, включая поверхностную зону. Держите explant гидратированных с 1x PBS.
- Используя управляемые молотком и кожные удары, создавайте прокладки из резиновых листов, как показано на рисунке 7.
- Соберите каждую половину транспортной камеры, чтобы включить 1 большую резиновую прокладку, 1 вставку PMMA и 1 небольшую резиновую прокладку каждый. Поместите explant в колодцы пластиковой вставки, с поверхностной зоной, обращенной к камере вверх по течению. Сэндвич две половинки вместе, чтобы завершить сборку и винт плотно с помощью гаечного ключа (Рисунок 7).
- Заполните вверх по течению камеры с 2 мл 1x PBS-PI и наблюдать вниз по течению камеры для утечки жидкости из вверх по течению камеры. При необходимости утечки собери камеру, регулируя положение прокладки и герметичность винтов. Если нет утечки, заполните вниз по течению камеры с 2 мл 1x PBS-PI, а также.
- Добавьте мини-бар как вверх, так и вниз по течению камеры и поместите камеру на тарелку перемешать. Выровняйте камеру так, чтобы лазер из спектрофотометра был направлен к центру камеры ниже по течению. Поместите часть приемника сигнала спектрофотометра за камерой вниз по течению(рисунок 8).
ПРИМЕЧАНИЕ: Лазер и приемник спектрофотометра должны быть оснащены соответствующими фильтрами для возбуждения, испускают и передают сигналы от флуоресцентно помеченного белка. Защитите транспортную камеру от света с помощью черного ящика во время экспериментов, чтобы избежать вмешательства в сигнал флуоресценции. Это лучшая практика, чтобы запечатать отверстия на верхней части камеры с гибкой пленкой, чтобы избежать испарения. - Соберите в режиме реального времени вниз по течению показания выбросов флуоресценции и обеспечить стабильный сигнал, по крайней мере 5 мин.
ПРИМЕЧАНИЕ: Aliquots из камеры вниз по течению могут быть получены и оценены для флуоресценции с помощью считывателя пластин, если специально разработанный спектрофотометр или полупрозрачная транспортная камера не доступна. - Pipette предварительно рассчитанный объем запасного раствора флуоресцентно помеченных КПК в камеру вверх по течению, чтобы обеспечить окончательную концентрацию 3 МКМ внутри камеры вверх по течению. Наблюдайте сигнал флуоресценции вниз по течению и позвольте растворить транспорт для достижения устойчивого увеличения наклона.
ПРИМЕЧАНИЕ: толще хряща explant потребуется больше времени, чтобы достичь стабильного состояния. - Как только устойчивое состояние будет достигнуто, возьмите 20 МКЛ из камеры вверх по течению и добавьте в камеру вниз по течению ("тест шипа").
ПРИМЕЧАНИЕ: Будет наблюдаться всплеск флуоресценции ниже по течению. Это позволит обеспечить корреляцию между показаниями флуоресценции и концентрацией КПК. - Сбор в режиме реального времени вниз по течению флуоресценции показания.
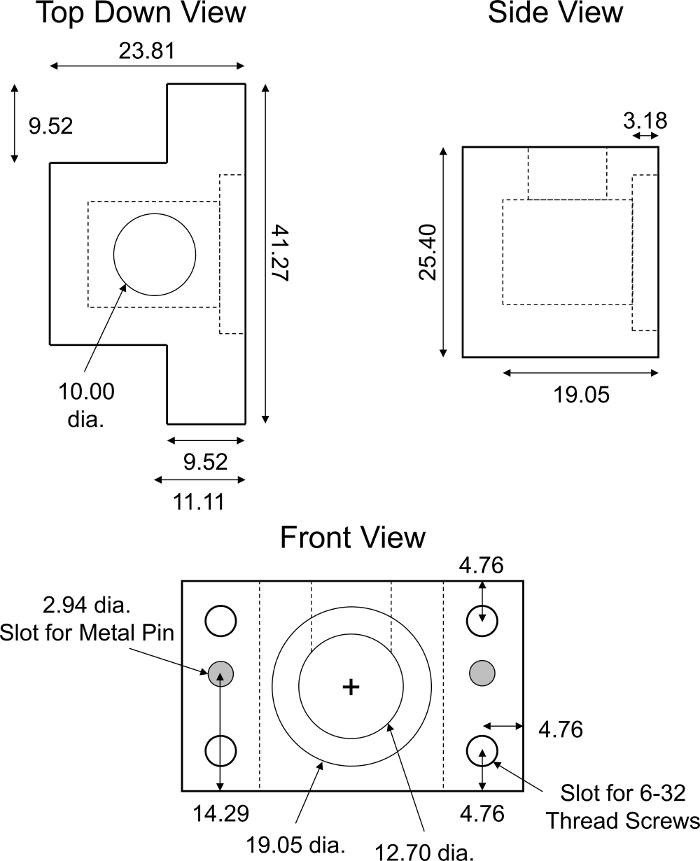
Рисунок 6: Специально разработанная не равновесная транспортная камера диффузии. Параметры проектирования транспортной камеры PMMA, не равновесной диффузии. Камера должна быть полупрозрачной, чтобы не вмешиваться в показания флуоресценции. Полная транспортная камера состояла из двух одинаковых половинок показанного прибора. Для обеспечения выравнивания и полного закрытия половинок камеры требовалось два цилиндрических штыря из нержавеющей стали диаметром 2,94 мм, длиной 18 мм. Четыре одинаковых слота для 6-32 нитей винты были сделаны в каждом углу камеры для винта жесткой сборки. Все численные значения представлены в миллиметрах. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
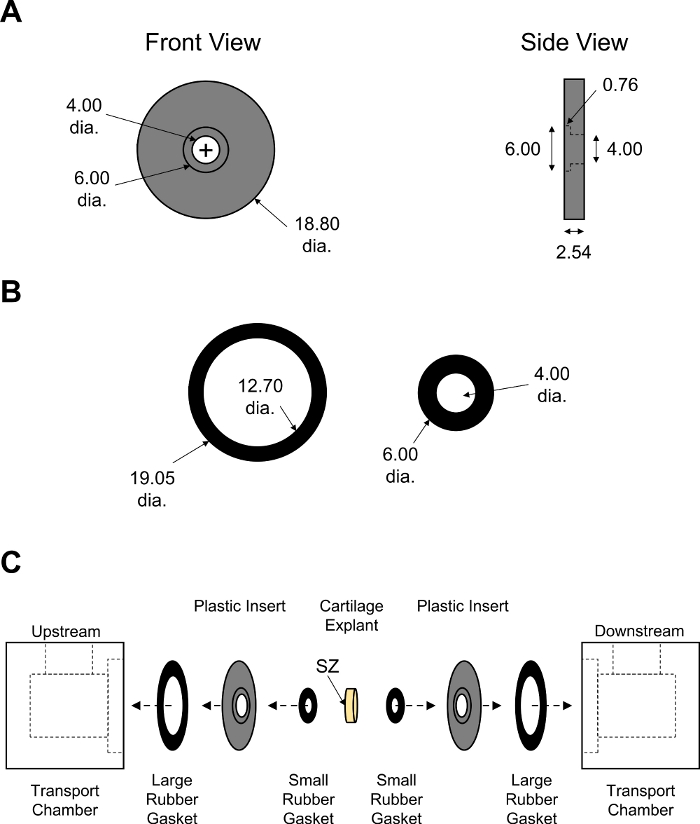
Рисунок 7: Ассамблея не равновесной диффузионные транспортные камеры. Параметры конструкции (A ) черныевставки PMMA и ( B )большиеи малые резиновые прокладки. Толщина резиновых прокладок была скорректирована, чтобы обеспечить плотное закрытие камеры. Все численные значения представлены в мм.(C) Схема,показывающая порядок сборки для двух половинок транспортной камеры с хрящевым эксплантом, помещенным в центр. СЗ указывает на поверхностную зону хряща, которая обращена к камере вверх по течению. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
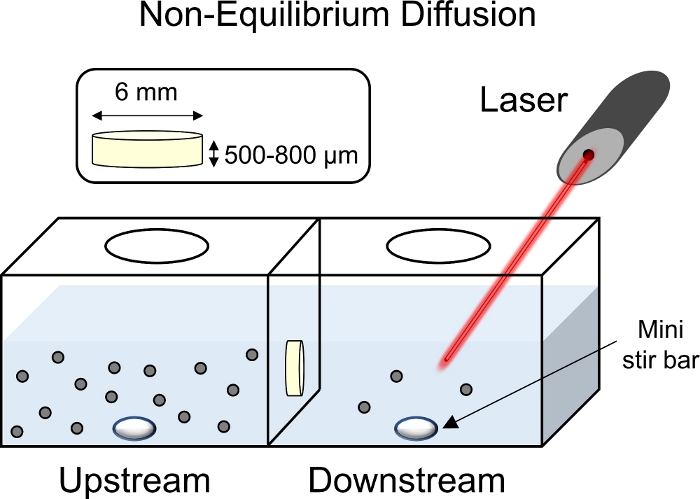
Рисунок 8: Схема не равновесных экспериментов по диффузии. В центре транспортной камеры были размещены экспланты хряща (6 мм диаметром х 1 мм толщиной) с поверхностной поверхностью, обращенной к камере вверх по течению. Оба вверх и вниз по течению стороны камеры были заполнены 1x PBS-PI и смешанные с помощью мини-бар перемешать. С лазером указал на камеру вниз по течению для сбора флуоресцентных показаний, флуоресцентно помечены решение КТК был добавлен в вверх по течению камеры. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
После равновесного поглощения КФУ хрящом, флуоресценция ванны уменьшается, когда раствор был поглощен тканью. Однако, если значение флуоресценции конечной ванны остается похожим на начальное, это указывает на отсутствие/минимального раствора поглощения. Еще одним подтверждением solute ...
Обсуждение
Описанные здесь методы и протоколы имеют важное значение для области целевой доставки лекарств в отрицательно заряженные ткани. Из-за высокой плотности отрицательно заряженных аггреканов, присутствующих в этих тканях, создается барьер, тем самым предотвращая наркотики от достижения ...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа финансировалась Министерством обороны США в рамках программ медицинских исследований Конгресса (CDMRP) по контракту W81XWH-17-1-0085 и Национального института здравоохранения R03 EB025903-1. AV финансировался стипендией инженерного декана в Северо-Восточном университете.
Материалы
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Ссылки
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены