È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Caratterizzazione delle proprietà di trasporto intra-cartilagine dei portatori di peptidi cationici
In questo articolo
Riepilogo
Questo protocollo determina l'assorbimento dell'equilibrio, la profondità di penetrazione e il tasso di diffusione non di equilibrio per i portatori di peptidi cationici nella cartilagine. La caratterizzazione delle proprietà di trasporto è fondamentale per garantire una risposta biologica efficace. Questi metodi possono essere applicati per la progettazione di un vettore di droga carica in modo ottimale per indirizzare i tessuti caricati negativamente.
Abstract
Diversi tessuti caricati negativamente nel corpo, come la cartilagine, presentano una barriera alla consegna mirata del farmaco a causa della loro alta densità di aggrecans caricati negativamente e, quindi, richiedono metodi di targeting migliorati per aumentare la loro risposta terapeutica. Poiché la cartilagine ha un'alta densità di carica fissa negativa, i farmaci possono essere modificati con vettori di farmaci caricati positivamente per sfruttare le interazioni elettrostatiche, consentendo un migliore trasporto di farmaci intra-cartilagine. Studiare il trasporto dei portatori di farmaci è quindi fondamentale per prevedere l'efficacia dei farmaci nell'indurre una risposta biologica. Mostriamo la progettazione di tre esperimenti che possono quantificare l'assorbimento dell'equilibrio, la profondità di penetrazione e il tasso di diffusione non di equilibrio dei portatori di peptidi cationici negli espianti della cartilagine. Gli esperimenti di assorbimento dell'equilibrio forniscono una misura della concentrazione soluta all'interno della cartilagine rispetto al bagno circostante, che è utile per prevedere il potenziale di un vettore di farmaci nell'migliorare la concentrazione terapeutica di farmaci nella cartilagine. La profondità degli studi di penetrazione mediante microscopia confocale consente la rappresentazione visiva della diffusione del soluto 1D dalla zona superficiale a quella profonda della cartilagine, che è importante per valutare se i soluti raggiungono la loro matrice e i siti di destinazione cellulare. Gli studi sul tasso di diffusione non-equilibrio utilizzando una camera di trasporto progettata su misura consentono di misurazione della forza delle interazioni leganti con la matrice tissunte caratterizzando i tassi di diffusione dei soluti fluoreescenti etichettati attraverso il tessuto; questo è utile per la progettazione di vettori di forza di legame ottimale con cartilagine. Insieme, i risultati ottenuti dai tre esperimenti di trasporto forniscono una linea guida per la progettazione di vettori di farmaci a pagamento in modo ottimale che sfruttano interazioni di carica deboli e reversibili per le applicazioni di consegna di farmaci. Questi metodi sperimentali possono anche essere applicati per valutare il trasporto di farmaci e coniugati porta-droga. Inoltre, questi metodi possono essere adattati per l'uso nel targeting di altri tessuti caricati negativamente come menisco, cornea e l'umorismo vitreo.
Introduzione
La consegna di farmaci a tessuti caricati negativamente nel corpo rimane una sfida a causa dell'incapacità dei farmaci di penetrare in profondità nel tessuto per raggiungere i siti di destinazione delle cellule e dellematrici 1. Molti di questi tessuti comprendono aggrecans densamente imballati e caricati negativamente che creano un'alta densità di carica fissa negativa (FCD)2 all'interno del tessuto e fungono da barriera per la consegna della maggior parte delle macromolecole3,4. Tuttavia, con l'assistenza di portatori di farmaci caricati positivamente, questa barriera tissunte carica negativamente può effettivamente essere convertita in un deposito di farmaci tramite interazioni di carica elettrostatica per la consegna sostenutadi farmaci 1,5,6,7( Figura1).
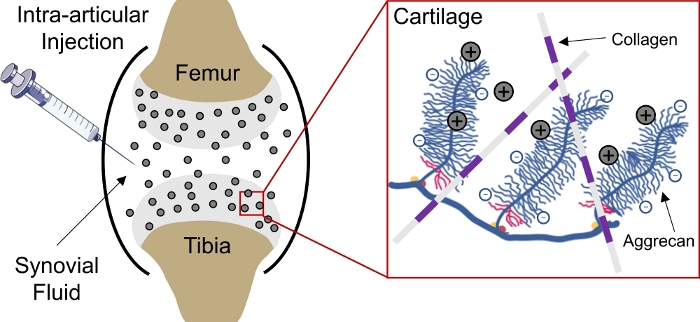
Figura 1: Consegna intra-cartilagine basata sulla carica di CPC. Iniezione intra-articolare di CPC nello spazio dell'articolazione del ginocchio. Le interazioni elettrostatiche tra CPC caricati positivamente e gruppi aggrecan caricati negativamente consentono una penetrazione rapida e completa della profondità attraverso la cartilagine. Questa cifra è stata modificata da Vedadghavami et al4. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Recentemente, i portatori di peptidi cationici di breve lunghezza (CPC) sono stati progettati con l'obiettivo di creare piccoli domini cationici in grado di trasportare terapie di dimensioni maggiori per la consegna alla cartilagine4. Per la consegna efficace di farmaci alla cartilagine per il trattamento prevalente8,9 e malattie degenerative come l'osteoartrite (OA)10, è fondamentale che le concentrazioni terapeutiche dei farmaci penetrino in profondità all'interno del tessuto, dove la maggior parte delle cellule della cartilagine (condrociti)si trovano 11. Anche se ci sono diversi potenziali farmaci di modifica della malattia disponibili, nessuno ha ottenuto l'approvazione FDA perché questi non sono in grado di indirizzare efficacemente lacartilagine 12,13. Pertanto, la valutazione delle proprietà di trasporto dei portatori di farmaci è necessaria per prevedere l'efficacia dei farmaci nell'indurre una risposta terapeutica. Qui, abbiamo progettato tre esperimenti separati che possono essere utilizzati per valutare l'assorbimento dell'equilibrio, la profondità di penetrazione e il tasso di diffusione non di equilibrio dei CPC4.
Per garantire una concentrazione di droga sufficiente all'interno della cartilagine in grado di fornire una risposta terapeutica ottimale, sono stati progettati esperimenti di assorbimento per quantificare la concentrazione di CPC di equilibrio nella cartilagine4. In questo disegno, a seguito di un equilibrio tra la cartilagine e il bagno circostante, la quantità totale di soluto all'interno della cartilagine (sia legata alla matrice o libera) può essere determinata utilizzando un rapporto di assorbimento. Questo rapporto viene calcolato normalizzando la concentrazione di solute all'interno della cartilagine a quella del bagno di equilibrio. In linea di principio, i solute neutri, la cui diffusione attraverso la cartilagine non è assistita da interazioni di carica, avrebbero un rapporto di assorbimento inferiore a 1. Al contrario, i solti cationici, il cui trasporto è migliorato tramite interazioni elettrostatiche, mostrano un rapporto di assorbimento maggiore di 1. Tuttavia, come mostrato con i CPC, l'uso di una carica positiva ottimale può comportare rapporti di assorbimento molto più elevati (maggiori di 300)4.
Anche se l'alta concentrazione di farmaci all'interno della cartilagine è importante per ottenere benefici terapeutici, è anche fondamentale che i farmaci si diffondano attraverso l'intero spessore della cartilagine. Pertanto, gli studi che mostrano la profondità di penetrazione sono necessari per garantire che i farmaci raggiungano in profondità all'interno della cartilagine in modo che la matrice e siti bersaglio cellulare possono essere raggiunti, fornendo così una terapia più efficace. Questo esperimento è stato progettato per valutare la diffusione a senso unico dei soluti attraverso la cartilagine, simulando la diffusione dei farmaci nella cartilagine a seguito di iniezione intra-articolare in vivo. L'imaging a fluorescenza mediante microscopia confocale consente di valutazione della profondità di penetrazione nella cartilagine. La carica netta di particelle gioca un ruolo chiave nel moderare il modo in cui i farmaci profondi possono diffondersi attraverso la matrice. È necessaria una carica netta ottimale basata su un FCD di tessuto per consentire interazioni di legame debole reversibile tra particelle cationiche e la matrice del tessuto aninico. Ciò implica che qualsiasi interazione è abbastanza debole in modo che le particelle possano dissociare dalla matrice ma reversibile in natura in modo che possa legarsi a un altro sito di legame di matrice più in profondità all'internodel tessuto 4. Al contrario, un'eccessiva carica netta positiva di una particella può essere dannosa per la diffusione, poiché un legame di matrice troppo forte impedisce il distacco delle particelle dal sito di legame iniziale nella zona superficiale della cartilagine. Ciò comporterebbe una risposta biologica insufficiente in quanto la maggior parte dei siti di destinazione si trovano in profondità all'interno del tessuto11.
Per quantificare ulteriormente la forza delle interazioni vincolanti, l'analisi dei tassi di diffusione dei farmaci attraverso la cartilagine è vantaggiosa. Gli studi di diffusione non di equilibrio consentono di confrontare i tassi di diffusione in tempo reale tra i diversi solute. Poiché i farmaci si diffondono attraverso le zone superficiali, medie e profonde della cartilagine, la presenza di interazioni vincolanti può alterare notevolmente i tassi di diffusione. Quando sono presenti interazioni vincolanti tra i farmaci e la matrice della cartilagine, è definita come la diffusione effettiva (DEFF). In questo caso, una volta che tutti i siti di rilegatura sono stati occupati, il tasso di diffusione dei farmaci è regolato dalla diffusione a stato costante (DSS). Il confronto tra ilFEP D di soluto diverso determina l'intensità di legame relativo dei solute con la matrice. Per un dato soluto, se ilD EFF e DSS sono all'interno dello stesso ordine di grandezza, implica che vi è un legame minimo presente tra il farmaco e la matrice durante la diffusione. Tuttavia, se DEFF è maggiore di DSS, esiste un sostanziale legame delle particelle alla matrice.
Gli esperimenti progettati individualmente consentono la caratterizzazione del trasporto soluto attraverso la cartilagine, tuttavia, è necessaria un'analisi olistica che include tutti i risultati per la progettazione di un vettore di farmaci a carica ottimale. La natura debole e reversibile delle interazioni di carica controlla il tasso di diffusione delle particelle e consente un elevato assorbimento dell'equilibrio e una rapida penetrazione della profondità completa attraverso la cartilagine. Attraverso esperimenti di assorbimento dell'equilibrio, dovremmo cercare i vettori che mostrano un elevato assorbimento a seguito di interazioni di carica che possono essere verificate utilizzando studi sul tasso di diffusione non-equilibrio. Tuttavia, queste interazioni vincolanti dovrebbero essere deboli e reversibili in natura per consentire una penetrazione a pieno spessore del soluto attraverso la cartilagine. Un vettore di droga ideale sarebbe in possesso di una carica ottimale che consente un legame abbastanza forte per l'assorbimento e alte concentrazioni di farmaci intra-cartilagine, ma non troppo forte da ostacolare la diffusione a pieno spessore4. Gli esperimenti presentati aiuteranno nelle caratteristiche progettuali per i vettori di farmaci basati sulla carica. Questi protocolli sono stati utilizzati per caratterizzare il trasporto CPC attraverso la cartilagine4, tuttavia, questi possono essere applicati anche a una varietà di farmaci e portatori di farmaci attraverso la cartilagine e altri tessuti caricati negativamente.
Protocollo
Sono state ottenute approvazioni universitarie per condurre gli esperimenti con tessuti morti. Le articolazioni bovine sono state ottenute commercialmente da un macello.
1. Estrazione espianto della cartilagine
- Utilizzando un bisturi (lama #10), tagliare e rimuovere grasso, muscoli, legamenti, tendini e tutto il tessuto connettivo per esporre la cartilagine dalla scanalatura femoropatellare delle articolazioni del ginocchio bovino.
- Utilizzando punzoni dermici da 3 mm e 6 mm, effettuare punzoni perpendicolari nella cartilagine per estrarre le spine cilindriche. Posizionare immediatamente i tappi in singoli pozzetti di una piastra di 48 pozzi contenente 500 L di 1x fosfato tamponato salina (PBS) integrato con 1% v/v antibiotico-antimicotico.
- Posizionare il lato superficiale di una spina cartilagine rivolto verso il basso in un pozzo nel dispositivo di sezionamento (Figura 2). Utilizzando una lama di rasoio, tagliare la spina lungo la superficie del dispositivo di affettatura per ottenere un licazione cartilaginea spessa 1 mm che include la zona superficiale. Ripetere l'operazione per ogni spina cartilagine.
- Conservare gli espianto di cartilagine singolarmente in tubi di polipropilene contenenti 500 L di 1x PBS integrati con inibitori della proteasi (PBS-PI, 1 mini-tablet PI per 50 mL 1x PBS) a -20 gradi centigradi.
- Prima di condurre ciascuno dei seguenti esperimenti di trasporto, scongelare le fiale contenenti espiazione per 30 minuti in un bagno d'acqua di 37 gradi centigradi.
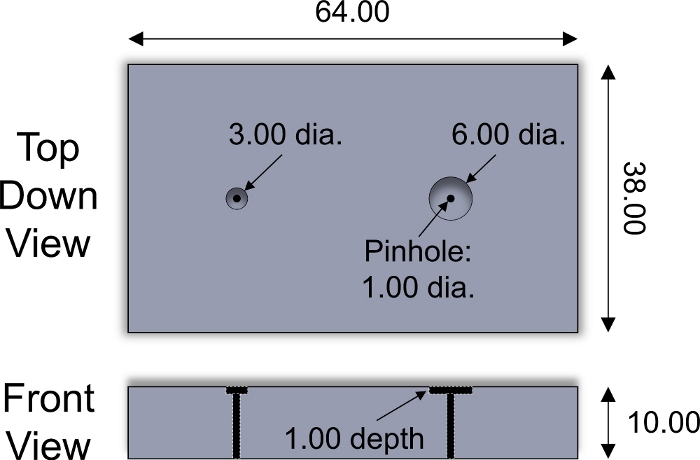
Figura 2: dispositivo di sezionamento personalizzato. Parametri di progettazione del dispositivo di sezionamento in acciaio inossidabile utilizzato per affettare espliche di 3 e 6 mm di diametro. Inserti in plastica di spessore variabile sono stati collocati all'interno di pozzetti per regolare lo spessore delle espianete a fette. Per spingere l'espianto fuori dal dispositivo è stato utilizzato un perno cilindrico in acciaio inossidabile di diametro <1 mm. Tutti i valori numerici sono presentati in mm. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Assorbimento dell'equilibrio dei CPC nella cartilagine
- Espiantare delicatamente le espianto della cartilagine (3 mm dia. X 1 mm di spessore.) con una delicata pulizia del compito di rimuovere l'eccesso di 1x PBS dalla superficie di espianto. Utilizzando un equilibrio, registrare rapidamente il peso bagnato di ogni espianto e quindi posizionare immediatamente in un bagno 1x PBS per prevenire la disidratazione.
- Preparare 30 soluzioni M (300 L per espianto) di CPC con etichetta fluorescente in 1x PBS-PI. Utilizzare tubi di polipropilene senza RNase per la ricostituzione.
- In una piastra da 96 pozzi, pipetta 300 L di ogni soluzione CPC da 30 M in pozzi separati. Evitare di utilizzare pozzi vicino al bordo della piastra per evitare l'evaporazione. Utilizzando una spatola, trasferire ogni explant alla soluzione contenente pozzi.
- Riempire i pozzi circostanti con 300 L di 1x PBS e coprire il piatto del pozzo con il coperchio. Sigillare i bordi della piastra con pellicola flessibile per ridurre al minimo l'evaporazione.
- All'interno di un'incubatrice di 37 gradi centigradi, posizionare la piastra su uno shaker piatto per limitare la sedimentazione delle particelle. Incubare per 24 h sotto rotazione delicata (50 rpm con un'orbita di 15 mm) per consentire l'assorbimento dell'equilibrio dei CPC nella cartilagine (Figura 3).
- Generare una curva standard per la correlazione tra fluorescenza e concentrazione di CPC
- Preparare diluizioni seriali di soluzioni CPC da 30 M – 0 M (10 diluizioni 2 pieghe) in 1x PBS-PI in tubi di polipropilene. Assicurarsi che siano presenti almeno 500 L di ogni diluizione.
- Aggiungere 200 L di ogni diluizione a pozzetti consecutivi in una piastra nera a 96 pozzetti. Duplicare in un'altra riga per aumentare le dimensioni del campione.
- Ottenere letture di fluorescenza di ogni campione utilizzando un lettore di lamie alle lunghezze d'onda di eccitazione ed emissione dell'etichetta fluorescente utilizzando un lettore di lamine.
- Traccia la lettura della fluorescenza rispetto alla concentrazione di CPC e deriva un'equazione per la parte lineare della curva.
NOTA: Per limitare la variabilità nelle letture di fluorescenza, incubare la soluzione di stock CPC alle stesse condizioni della piastra campione prima della generazione della curva standard.
- Dopo 24 h di incubazione, raccogliere il bagno di equilibrio da ogni pozzo in tubi di polipropilene separati.
- Trasferire 200 L di ogni soluzione in pozzetti separati di una piastra nera a 96 pozzetti. Ottenere letture di fluorescenza di ogni campione con le stesse impostazioni fluorescenti della curva standard. Se necessario, diluire il campione in 1x PBS-PI per garantire che le letture rietino all'interno della parte lineare della curva standard.
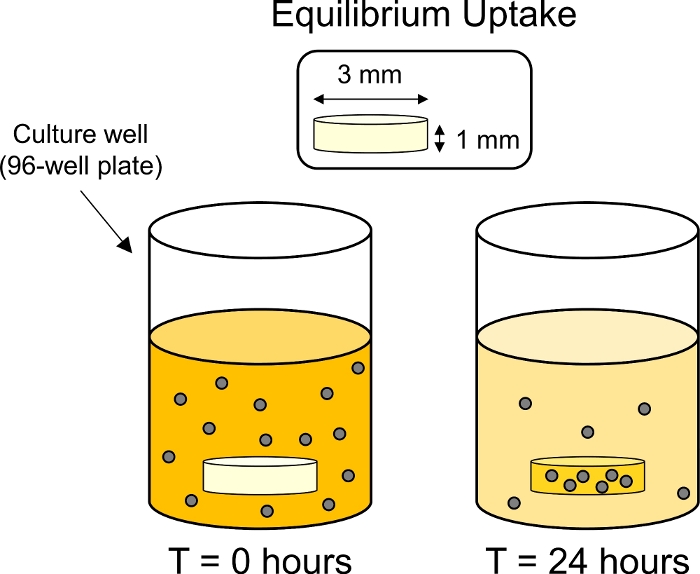
Figura 3: Schema degli esperimenti di assorbimento dell'equilibrio. Gli espianto di cartilagine (3 mm dia. x 1 mm di spessore) sono stati collocati in pozzi di individui in una piastra di 96 pozzi contenente soluzione CPC con etichetta fluorescente. Dopo 24 H CPC sono stati alzati dalla cartilagine, riducendo così la fluorescenza del bagno circostante. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
3. Profondità di penetrazione dei CPC nella cartilagine
- Preparare 30 soluzioni M (300 L per espianto) di CPC con etichetta fluorescente in 1x PBS-PI. Utilizzare tubi di polipropilene senza RNase per la ricostituzione.
- Utilizzando un bisturi, tagliare le espiante della cartilagine (6 mm di diametro x 1 mm di spessore) a metà per fare semi-dischi. Mantenere l'explant idratato con uno strato di 1x PBS-PI durante il taglio.
- Incollare un mezzo disco esplodibile al centro di un pozzo della camera di trasporto unidimensionale personalizzata utilizzando una epossiccia (Figura 4, Figura 5). Assicurarsi che l'epossia sia applicata al lato circonferente (curvo) dell'espianto. Rimuovere la colla in eccesso dal pozzo per evitare il contatto con la superficie di diffusione della cartilagine e prendere nota del lato superficiale dell'espianto.
- Aggiungere 80 L di 1x PBS-PI a entrambi i lati dell'espianto. Pipettare il liquido su e giù da un lato dell'espianto per verificare la presenza di perdite sull'altro lato. Se si verifica una perdita, riaggiustare l'espianto e applicare la posposia in base alle esigenze.
- Sostituire l'1x PBS-PI dal lato rivolto verso la superficie superficiale della cartilagine (a monte) con 80 L di soluzione CPC da 30 M. Mantenere 80 L di 1x PBS-PI sul lato rivolto verso la zona profonda della cartilagine (a valle).
- Posizionare con attenzione la camera di trasporto in un contenitore riparabile. Coprire la base del contenitore con uno strato 1x PBS per evitare l'evaporazione delle soluzioni. Assicurarsi che non vi sia alcun contatto diretto tra le soluzioni provenienti da camere a monte e a valle.
- Posizionare il contenitore coperto su uno shaker piatto per limitare la sedimentazione delle particelle. Incubare per 4 o 24 h a temperatura ambiente a rotazione delicata (50 rpm con un'orbita di 15 mm).
- Dopo l'incubazione, rimuovere l'espianto dalla camera e tagliare la fetta di 100 m dal centro dell'espianto.
NOTA: Questa sezione trasversale include le zone superficiali, medie e profonde della cartilagine. - Posizionare la fetta tra uno scivolo di vetro e un coperture. Idratare la fetta con uno strato di 1x PBS-PI.
- Con ingrandimento 10x, immagine attraverso l'intero spessore della fetta per ottenere z-stack di immagini fluorescenti utilizzando un microscopio confocale.
- Utilizzando ImageJ progetto l'intensità media delle immagini all'interno dello z-stack per determinare la profondità di penetrazione dei CPC nella cartilagine.
- Aprire la pila di immagini facendo clic su File Aprire.
- Fare clic su 'Immagine' sulla barra delle applicazioni e fare clic su Immagine . Proprietà Stacks . Progetto dal menu a discesa.
- Immettere i numeri di sezione da 1 alla sezione finale. Selezionare 'Intensità media' in Tipo di proiezione. Fare clic su'OK.'
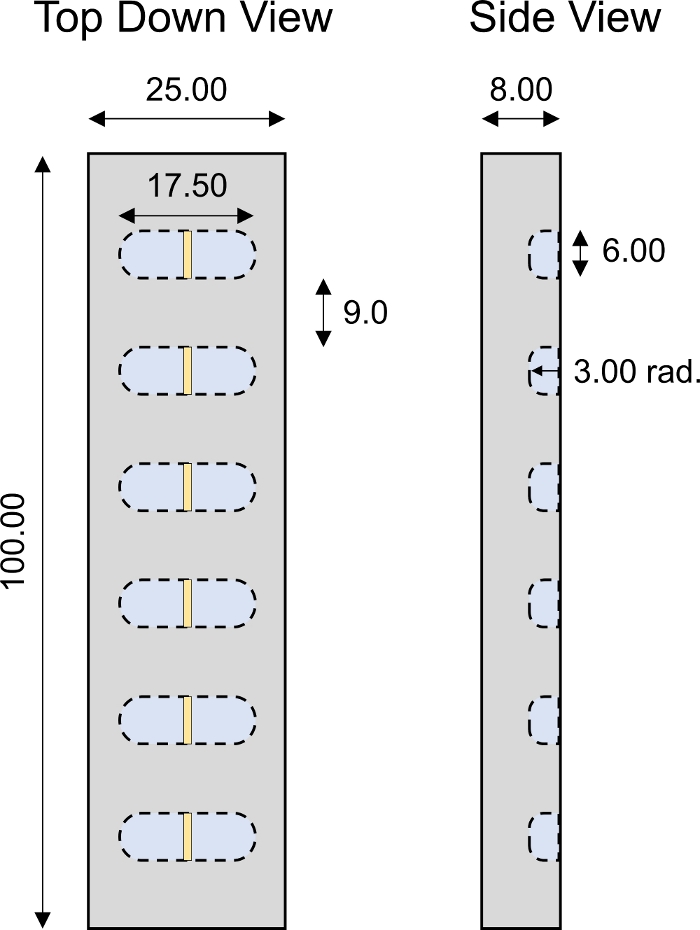
Figura 4: Camera di trasporto 1D progettata su base personalizzata. Parametri di progettazione della camera di trasporto PMMA 1D con 6 pozzi singoli. Tutti i valori numerici sono presentati in mm. Fare clic qui per visualizzare una versione più grande di questa figura.
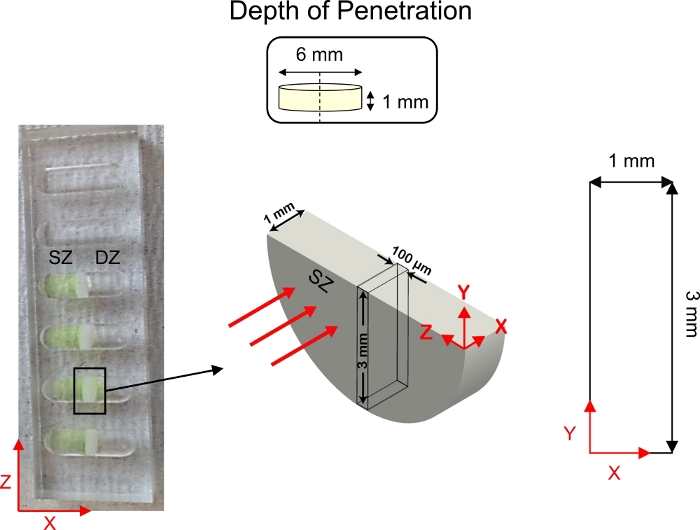
Figura 5: Schema degli studi di profondità di penetrazione. Gli espianto di cartilagine (diametro 6 mm x 1 mm di spessore) sono stati tagliati a metà e fissati al centro dei pozzi di trasporto di diffusione 1D. La soluzione CPC con tag fluorescente è stata aggiunta al lato del pozzo a contatto con la zona superficiale della cartilagine. 1x PBS-PI è stato aggiunto al lato del pozzo a contatto con la zona profonda (D) della cartilagine. Dopo la diffusione, una sezione trasversale della cartilagine (3 mm x 1 mm) è stata immagine utilizzando la microscopia confocale. Questa cifra è stata modificata da Vedadghavami et al.4 e Bajpayee et al.3Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
4. Tasso di diffusione non di equilibrio dei CPC nella cartilagine
- Riunire le due metà della camera di trasporto su base personalizzata (Figura 6) per assemblare e chiudere la camera. Utilizzare rondelle, dadi e bulloni per chiudere saldamente la camera con una chiave inglese.
NOTA: La camera di trasporto deve essere traslucida per non interferire con le letture fluorescenti. Le camere di trasporto utilizzate in questo protocollo sono costituite da polimetilmethacrylate (PMMA). - Rivestire lo spazio interno della camera con 0,5% w/v soluzione di latte bovino non grasso in 1x PBS (2 mL per ogni camera) per 15 min per evitare l'associazione non specifica di CPC alle pareti della camera. Quindi risciacquare la camera con 1x PBS (2 mL per ogni camera).
- Utilizzando il dispositivo di sezionamento personalizzato (Figura 2) e una lama di rasoio, affettare un'espianto cartilaginea di 6 mm (piano trasversale) ad uno spessore di 500-800 m, compresa la zona superficiale. Mantenere l'explant idratato con 1x PBS.
- Utilizzando punzoni a martello e dermici, create guarnizioni da fogli di gomma, come illustrato nella Figura 7.
- Assemblare ogni metà camera di trasporto per includere 1 grande guarnizione di gomma, 1 inserto PMMA e 1 piccola guarnizione di gomma ciascuna. Posizionare l'espianto nei pozzetti dell'inserto di plastica, con la zona superficiale rivolta verso la camera a monte. Sandwich le due metà insieme per completare l'assemblaggio e vite strettamente utilizzando una chiave inglese (Figura 7).
- Riempire la camera a monte con 2 mL di 1x PBS-PI e osservare la camera a valle per la fuoriuscita di liquido dalla camera a monte. Se è presente una perdita, rimontare la camera, regolando la posizione della guarnizione e la tenuta delle viti. Se non si verifica alcuna perdita, riempire la camera a valle con 2 mL 1x PBS-PI.
- Aggiungere una barra mini-stir sia a piedi che a valle e posizionare la camera su una piastra di mescolare. Allineare la camera in modo che il laser dallo spettrofotometro sia focalizzato verso il centro della camera a valle. Posizionare la parte del ricevitore del segnale dello spettrofotometro dietro la camera a valle (Figura 8).
NOTA: Il laser e il ricevitore dello spettrofotometro devono essere dotati dei filtri appropriati per eccitare, emettere e trasmettere segnali dalla proteina etichettata fluorescente. Proteggere la camera di trasporto dalla luce utilizzando una scatola nera durante la sperimentazione per evitare interferenze nel segnale di fluorescenza. È consigliabile sigillare le aperture sulla parte superiore della camera con pellicola flessibile per evitare l'evaporazione. - Raccogliere in tempo reale le letture delle emissioni di fluorescenza a valle e garantire un segnale stabile per almeno 5 minuti.
NOTA: gli aliquot della camera a valle possono essere ottenuti e valutati per la fluorescenza utilizzando un lettore di la placche se non è disponibile uno spettrofotometro o una camera di trasporto traslucida su misura. - Pipetta un volume pre-calcolato di soluzione di stock di CPC fluoreescently etichettati nella camera a monte per garantire una concentrazione finale di 3 M all'interno della camera a monte. Osservare il segnale di fluorescenza a valle e consentire al trasporto soluto di raggiungere un costante aumento della pendenza.
NOTA: un'espianto della cartilagine più spessa richiederà più tempo per raggiungere lo stato stabile. - Una volta raggiunto lo stato stabile, prendere 20 L dalla camera a monte e aggiungere alla camera a valle ("test di spike").
NOTA: Si osserverà un picco nella fluorescenza a valle. Ciò consentirà la correlazione tra le letture di fluorescenza e la concentrazione di CPC. - Raccogli letture di fluorescenza a valle in tempo reale.
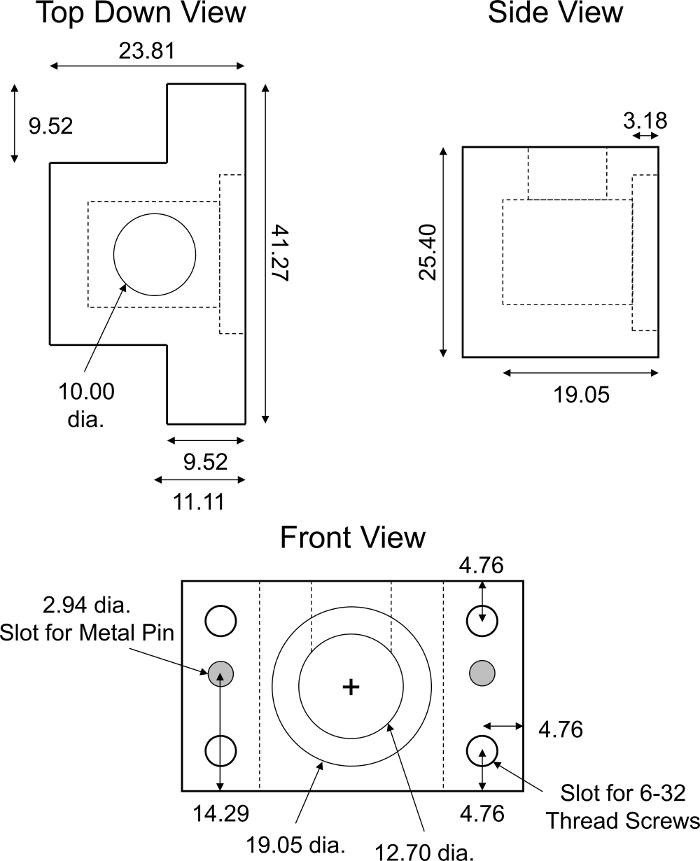
Figura 6: Camera di trasporto di diffusione non di equilibrio personalizzata. Parametri di progettazione della camera di trasporto di diffusione NON-equilibrium PMMA. La camera deve essere traslucida per non interferire con le letture di fluorescenza. La camera di trasporto completa consisteva di due metà identiche dell'apparecchio mostrato. Per garantire l'allineamento e la chiusura completa delle metà della camera sono stati necessari due perni cilindrici in acciaio inossidabile (diametro di 2,94 mm, lunghi 18 mm). Quattro slot identici per 6-32 viti di filo sono stati realizzati in ogni angolo della camera per l'assemblaggio a vite stretto. Tutti i valori numerici sono presentati in millimetri. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
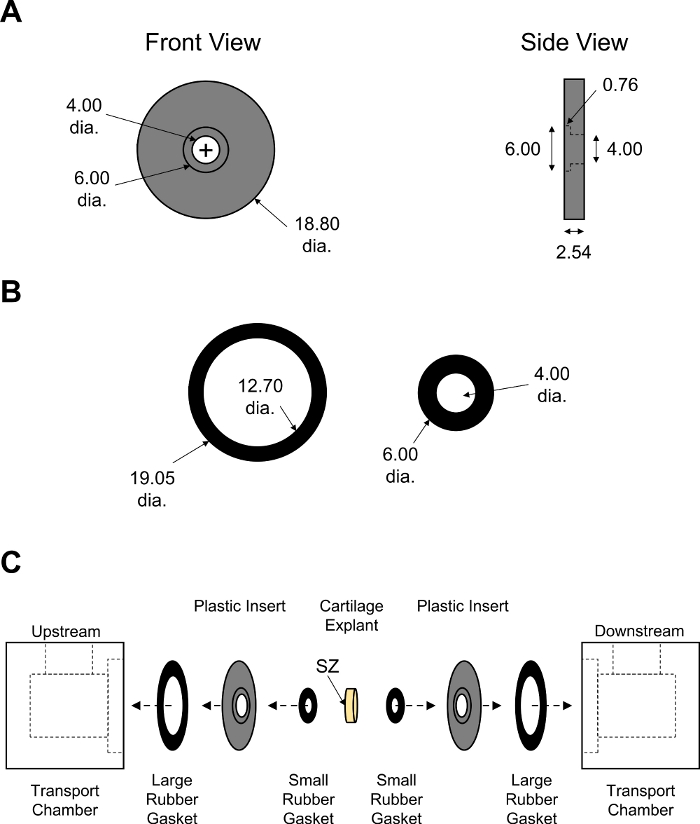
Figura 7: Assemblaggio della camera di trasporto di diffusione non di equilibrio. Parametri di progettazione di (A) inserti PMMA neri e (B) guarnizioni di gomma grandi e piccole. Lo spessore delle guarnizioni di gomma è stato regolato per garantire una stretta chiusura della camera. Tutti i valori numerici sono presentati in mm. (C) Schematico che mostra l'ordine di assemblaggio per due metà della camera di trasporto con explant cartilagine posto al centro. La S s indica una zona superficiale della cartilagine che si trovava di fronte alla camera a monte. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
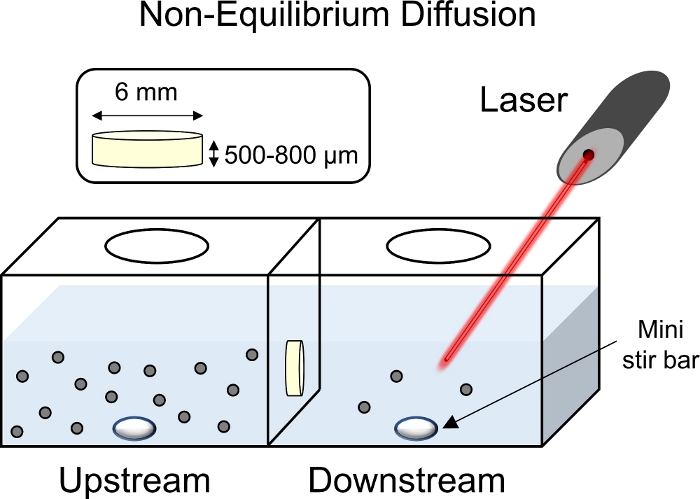
Figura 8: Schema degli esperimenti di diffusione non di equilibrio. Gli espianto di cartilagine (diametro 6 mm x 1 mm di spessore) sono stati posizionati al centro della camera di trasporto con la superficie superficiale rivolta verso la camera a monte. Entrambi i lati a monte e a valle della camera sono stati riempiti con 1x PBS-PI e mescolati con una mini barra di mescolare. Con un laser puntato verso la camera a valle per raccogliere letture fluorescenti, la soluzione CPC con tag fluorescente è stata aggiunta alla camera a monte. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Dopo l'assorbimento dell'equilibrio dei CPC per cartilagine, la fluorescenza del bagno diminuisce quando il soluto è stato risvegliato dal tessuto. Tuttavia, se il valore di fluorescenza del bagno finale rimane simile all'iniziale, indica che non vi è alcun/minimo soluto. Un'altra conferma dell'assorbimento soluto è se il tessuto ha visibilmente cambiato colore al colore del colorante fluorescente. L'assorbimento quantitativo dei soluti nella cartilagine è stato determinato utilizzando il rapporto di assorbimento (R<...
Discussione
I metodi e i protocolli qui descritti sono significativi per il campo della consegna mirata di farmaci ai tessuti caricati negativamente. A causa dell'alta densità di aggrecans caricati negativamente presenti in questi tessuti, viene creata una barriera, impedendo così ai farmaci di raggiungere i loro siti di destinazione cellulari che si trovano in profondità all'interno della matrice. Per affrontare questa sfida in sospeso, i farmaci possono essere modificati per incorporare vettori di droga caricati positivamente c...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal Dipartimento della Difesa degli Stati Uniti attraverso i programmi di ricerca medica diretti dal Congresso (CDMRP) sotto contratto W81XWH-17-1-0085, e il National Institute of Health R03 EB025903-1. AV è stato finanziato dal College of Engineering Dean's Fellowship presso la Northeastern University.
Materiali
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Riferimenti
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon