Method Article
Привлечение ученых сообщества для проведения неразрушающего генетического отбора редких популяций бабочек
В этой статье
Резюме
Здесь мы представляем простой протокол для неинвазивного генетического отбора популяций бабочек на основе полевого сбора остаточного остатка яйцеклеток. Он может быть использован для подтверждения видовой идентичности и количественной оценки генетической изменчивости. Этот протокол может быть легко адаптирован к более широким группам для участия науки сообщества.
Аннотация
Глобальное сокращение численности насекомых продолжает ускоряться. Эффективная генетическая выборка крайне необходима для углубления понимания многих таксонов и устранения существующих пробелов в знаниях. Этот протокол представляет собой продемонстрированный метод неразрушающего отбора проб редких бабочек для анализа популяционной генетической структуры или штрих-кодирования ДНК. Он использует хорион вылупившихся яйцеклеток бабочек, чтобы получить достаточно высокое количество и качество ДНК для успешного секвенирования генов для подтверждения идентичности вида и количественной оценки генетической изменчивости. Это может быть особенно полезно, когда другие методы отбора проб тканей непрактичны или недоступны. Хотя он разработан для чешуекрылых, он, тем не менее, может быть легко адаптирован для использования с другими видами насекомых. Он был специально разработан с простотой использования в качестве цели, чтобы помочь максимизировать широкое внедрение людьми с различным опытом и уровнем квалификации, такими как общинные ученые, специалисты по охране природы и студенты, а также для использования в больших географических районах для облегчения широкой выборки населения. Полученные данные могут помочь в принятии таксономических и листинговых решений, мерах по сохранению и управлению, а также в укреплении фундаментальных экологических исследований.
Введение
Эффективная популяционная генетическая выборка редких, сокращающихся и/или перечисленных таксонов насекомых часто имеет решающее значение для информирования о мерах по сохранению и управлению. Смертельные или травматические методы отбора проб тканей обычно используются для многих генетических анализов. Однако эти методы нежелательны или не разрешены, поскольку они могут нанести вред уязвимым существующим группам населения или негативно повлиять на поведение и приспособленность. Различные нелетальные или неинвазивные методы отбора проб с участием тканей, таких как цельные ноги, усики или обрезания крыльев, личиночные эксувии или гемолимфа из защитных выделений и других продуктов, таких как фрасс, были пригодны для генетических исследований насекомых 1,2,3,4,4,5,6,7,8,9 . Общая осуществимость и применимость этих различных методов отбора проб тканей значительно различаются в зависимости от биологии, экологии, поведения, размера и редкости очагового организма, ситуации и людей, собирающих материал. Например, обрезки целых ног или придатков требуют временного захвата и осторожного обращения с несколькими особями соответствующего жизненного этапа, как правило, опытным персоналом. Аналогичным образом, тканевые источники, такие как личиночные эксувии или фрассы, вероятно, будут практичными только в том случае, если организмы находятся в неволе или временно содержатся в течение достаточного периода.
Для исследовательских вопросов, задаваемых на уровне популяции, таких как вопросы, касающиеся потенциальной таксономической дифференциации или генетической структуры, часто требуется выборка в более широком временном или географическом масштабе (т.е. региональном или континентальном). В результате некоторые неинвазивные источники тканей могут быть совершенно непрактичными или, по крайней мере, неэффективными для сбора в количестве. Кроме того, сбор проб в таких масштабах может оказаться материально-техническим или финансовым нецелесообразным или непомерно опасным для отдельных исследователей или даже небольших полевых групп. В то время как прямое участие ученых сообщества все чаще принимается исследовательским сообществом для решения многих из этих проблем и ускорения сбора больших данных, принятие было ограничено для исследований, включающих неразрушающий, неинвазивный или eDNA выборку 10,11,12.
Чтобы помочь преодолеть некоторые из этих потенциальных ограничений, мы продемонстрировали, что хорион из вылупившихся яйцеклеток бабочки может дать достаточно большое количество и качество ДНК для успешного секвенирования генов для подтверждения идентичности вида и количественной оценки генетической изменчивости. Впоследствии мы протестировали различные протоколы сбора с использованием этого метода13. Эта экспериментальная работа послужила основой для дальнейшего методологического уточнения. В этом документе подробно описывается итоговый простой, но всеобъемлющий пересмотренный протокол сбора данных на местах, развернутый для ученых сообщества и другого неэкспертного персонала. Этот протокол является частью анализа структуры популяции матовой эльфийской бабочки (Callophrys irus), чтобы помочь информировать о будущих действиях по сохранению и федеральном определении возможного включения в список в соответствии с Законом США об исчезающих видах. Хотя потенциально более трудоемкий, чем некоторые неинвазивные методы, отсутствие необходимого контакта с организмом и простота использования делают его потенциально жизнеспособной моделью, которая может быть применена к другим программам генетических исследований популяции, нацеленным на выбор как обычных насекомых, так и насекомых, вызывающих озабоченность по сохранению, которые оставляют остаточные остатки яичных обломков от недавно вылупившихся нимф или личинок. Язык протокола, представленный здесь, был специально разработан для бабочек в семействе Lycaenidae и для использования неспециалистами, определяемыми здесь как ученые сообщества или другие лица (например, биологи агентства, интерны) с ограниченным энтомологическим опытом.
протокол
1. Распространение материалов среди ученых сообщества
- Внимательно изучите и соберите полный список необходимых материалов, связанных с коллекцией, ознакомившись с полной таблицей материалов.
- Если сбор образцов будет происходить в нескольких местах и/или несколькими отдельными лицами/группами, соберите и организуйте все необходимые материалы в отдельные развертываемые подразделения (рисунок 1 и рисунок 2).
- Транспортировка предметов снабжения (развертываемых подразделений) общинным ученым или другому персоналу, ответственному за сбор на местах.
- Если персонал не является местным, тщательно упакуйте расходные материалы (каждый развертываемый блок) в отдельную картонную транспортную коробку с полной транспортной этикеткой и кораблем.
ПРИМЕЧАНИЕ: Ускоренная доставка на данном этапе не требуется.
2. Подготовка коллекции ученых сообщества
- После получения принадлежностей для сбора, включая ящик для сбора, внимательно просмотрите список ламинированных поставок и проведите полную инвентаризацию. Сообщите руководителю проекта, если какие-либо поставки отсутствуют.
- Предварительно заполните микроцентрифужные трубки объемом 1,5 мл 180 мкл лизисного буфера, нанесите этикетки с предварительно напечатанной уникальной идентификационной этикеткой на каждую микроцентрифугу и поместите все трубки в ящик для хранения микроцентрифуг на 64 скважины. Надежно закрепите крышку после загрузки.
ПРИМЕЧАНИЕ: Если принтеры этикеток недоступны, нанесите уникальные идентификационные номера на боковую сторону и крышку каждого флакона с помощью маркера, защищенного от этанола. - Убедитесь, что все цифровое оборудование (например, смартфон или камера) полностью заряжено, а все запасные батареи упакованы.
- Частично наполните небольшой охладитель льдом для полевого хранения и местной транспортировки собранных образцов.
- Упакуйте все принадлежности для сбора в ящик для сбора или аналогичный прочный, защищенный от атмосферных воздействий контейнер для безопасной транспортировки и консолидированного хранения.
- Подробно ознакомьтесь с протоколом сбора неразрушающих генетических образцов, прежде чем отправиться в поле.
ПРИМЕЧАНИЕ: Используйте ламинированный и конденсированный, иллюстрированный протокол для получения дополнительных указаний в этой области (дополнительный рисунок S1 и дополнительный рисунок S2).
3. Сбор образцов в полевых условиях
- Прибыв на полевой участок, используйте карандаш или всепогодную ручку, чтобы записать в погодоустойчивую полевую тетрадь время суток, дату, общее название собственности (например, Национальный лес Апалачикола), конкретное название или описание местоположения полевого участка и показания GPS, если таковые имеются, а также полное имя и роли всех присутствующих лиц.
- Найдите подходящую среду обитания с присутствием личиночных видов растений-хозяев, характерных для целевой бабочки.
ПРИМЕЧАНИЕ: Используйте осторожность, чтобы избежать или свести к минимуму воздействие на чувствительные места обитания, популяции растений и дикую природу. Кроме того, обязательно обеспечьте все соответствующие разрешения землевладельца и / или разрешения до доступа к сайту и мероприятиям по сбору образцов. - С помощью смартфона или камеры сделайте подробные фотографии всех полевых участков, мест сбора образцов, растений-хозяев и любой другой информации, которая может иметь отношение к проекту. Используйте смартфоны или другие камеры, которые записывают GPS-координаты.
ПРИМЕЧАНИЕ: Геотегирование фотографий должно быть включено на всех смартфонах. - Всесторонне ищите все личиночные части растения-хозяина, такие как листья, цветочные почки, цветы или развивающиеся плоды, которые, как известно, отбираются яйцекладущими (яйцекладущими) взрослыми бабочками-самками для вылупившихся яиц. Для большинства Lycaenidae ищите белые, вылупившиеся яйца с отчетливым отверстием в центре, напоминающим пончик, из которого появилась новорожденная личинка (рисунок 3). Ищите невылупившиеся яйца, которые несколько темнее по цвету, часто зеленого или голубоватого цвета, и будут полностью неповрежденными без отверстия посередине (рисунок 4). Используйте ручную линзу или другое увеличительное устройство, чтобы внимательно осмотреть каждое яйцо.
- Как только вылупившееся яйцо будет найдено, наденьте нитриловые перчатки на обе руки.
- Используя чистые, стерильные, заостренные щипцы, возьмите и осторожно вытащите вылупившееся яйцо из растения-хозяина и поместите его непосредственно в меченую микроцентрифужную трубку, предварительно заполненную буфером лизиса, взятым из 64-луночного ящика для хранения.
ПРИМЕЧАНИЕ: Некоторые переносящие материалы растений-хозяев (диаметром менее 15 мм) приемлемы и нормальны во время сбора. - Соберите в общей сложности 5 образцов на участок / участок растения-хозяина (каждый из которых содержит 1-20 инкубационных яиц), стремясь к тому, чтобы общее количество яиц >50 в месте, если оно доступно.
ПРИМЕЧАНИЕ: Это поможет обеспечить, по крайней мере, некоторую ткань, собранную на каждом образце растения / участка, и увеличит шансы на обнаружение ДНК (личное наблюдение). - После каждого сбора яиц тщательно очищайте кончики щипцов, погружая их во флакон с 95% этанолом или обливая 95% этанолом из бутылки для выжимания или используя спиртовые салфетки.
ПРИМЕЧАНИЕ: Это поможет свести к минимуму перенос тканей между событиями отбора проб. - Если доступно, соберите несколько инкубационных яиц (1-20 яиц) с нескольких растений на одном участке хозяина в одну микроцентрифужную трубку и плотно закройте крышку. Для видов бабочек, использующих более крупные травянистые или древесные виды-хозяева, соберите несколько яиц из разных мест на одном и том же растении, если участки хозяина ограничены.
ПРИМЕЧАНИЕ: Растения находятся на одном участке хозяина, если их листья касаются друг друга. Если есть заметное физическое разделение между растениями или участками, это следует считать другим образцом. При сборе другого типа ткани, такого как личиночные эксувии или одна нога, поместите только одну ногу, фрагмент ноги или личиночную эксувию в трубку микроцентрифуги (один образец на человека). - Убедитесь, что весь собранный материал полностью погружен в буфер лизиса в каждой трубке микроцентрифуги объемом 1,5 мл. Коснитесь нижней части рассматриваемой трубки на твердой поверхности, чтобы при необходимости повторно погрузить любые образцы.
- Протрите щипцы до высыхания чистой одноразовой лабораторной салфеткой.
ПРИМЕЧАНИЕ: Тщательная очистка щипцов необходима для предотвращения перекрестного загрязнения между образцами. - При сборе нового образца выбросьте использованные нитриловые перчатки и замените их чистой парой.
- В защищенной от атмосферных воздействий полевой тетради используйте карандаш или всепогодную ручку для записи уникальной идентификационной метки, присвоенной из трубки микроцентрифуги, вместе с типом образца (например, яйца, личинки эксувии или ножка), приблизительным количеством инкубационных яиц и информацией о сборе, такой как имя (имена) коллекционера, дата, местоположение, виды растений-хозяев и любые дополнительные примечания (рисунок 2).
- Поместите закрытую микроцентрифужную трубку с образцом обломков яиц обратно в ящик для хранения микроцентрифуги с 64 скважинами.
- Поддерживайте 64-луночный ящик для хранения микроцентрифуги в охладителе со льдом, находясь в поле.
- Храните все другие материалы для сбора в ящике для сбора, находясь в поле, для безопасного и консолидированного хранения и транспортировки между объектами.
4. После завершения сбора полей
- Убедитесь, что все микроцентрифужные трубки, содержащие образцы, находятся в 64-луночном ящике для хранения микроцентрифуги в охладителе со льдом для транспортировки.
- Поместите все полевые принадлежности для сбора обратно в ящик для сбора.
- Транспортируйте все образцы обратно в офис или лабораторию и тщательно перепроверьте каждую микроцентрифужную трубку, чтобы убедиться, что весь образец материала полностью погружен в буфер лизиса.
- Поместите ящик для хранения микроцентрифуги на 64 скважины с образцами в морозильную камеру до отгрузки или обработки.
ПРИМЕЧАНИЕ: Средняя коммерческая морозильная камера при температуре 18 °C приемлема для краткосрочного хранения. - Тщательно оцените все расходные материалы в наборе инструментов для сбора и замените их по мере необходимости.
ПРИМЕЧАНИЕ: Это особенно важно, если запланировано несколько событий сбора полей. - Храните ящик для сбора данных в безопасном месте до следующего события сбора полей.
- Загрузите все цифровые изображения и обеспечьте безопасное резервное копирование всех на сервере или в облачной системе хранения.
- Отсканируйте или сфотографируйте исходные защищенные от атмосферных воздействий, страницы полевых записных книжек или полевые таблицы данных, содержащие данные коллекции, пока вся информация не будет введена в электронную таблицу проекта или базу данных.
5. Отправка образцов и данных
- Извлеките из морозильной камеры все 64-луночные ящики для хранения микроцентрифуг с образцами.
- Тщательно упакуйте коробки для хранения микроцентрифуг на 64 скважины с образцами и полевым блокнотом или полевыми техническими паспортами в стандартную транспортную коробку, приложите предоставленную транспортную этикетку с номером счета оригинального отправителя и отправьте через экспресс-доставку, гарантированную перевозчиком, ночью, на следующий день, директору проекта.
- Отправьте по электронной почте номер отслеживания пакета и копию отсканированных страниц записной книжки или полевых технических описаний директору проекта.
6. Извлечение ДНК
- После получения ящиков для хранения микроцентрифуг с 64 скважинами храните их при -20 °C для сохранения ДНК в образцах до готовности к извлечению ДНК.
- В лаборатории извлекают ДНК путем измельчения ткани насекомых, хранящейся в буфере лизиса после оттаивания от -20 °C. Добавьте 20 мкл протеиназы К и дайте образцу впитаться в течение ночи при 56 °C в нагретом инкубаторе не более 24 ч.
- Добавить соответствующие буферы для очистки и стирки в соответствии с рекомендацией13 конкретного производителя.
- Перенесите образец, взвешенный в буфере, в спиновую колонну, прикрепленную к флакону для сбора 2 мл.
- Открутите при 6 021 × g в течение 60 с с помощью центрифуги. Добавьте соответствующие буферы для стирки и открутите соответствующим образом.
- Высвобождайте связанную ДНК с помощью буфера элюзии (30 мкл) и вращайте образец в свежую микроцентрифужную трубку объемом 1,5 мл. Хранить при -20 °C.
ПРИМЕЧАНИЕ: Приступают к секвенированию, если концентрация ДНК превышает 0,010 нг/мл. См. рисунок 5 для концентрации ДНК по типу ткани.
7. Анализ данных последовательностей ДНК
- Обрезка или редактирование некачественных базовых вызовов в результирующих последовательностях.
- Запрос последовательностей к общедоступным базам данных для подтверждения идентификации видов.
- Выровняйте последовательности друг с другом для сравнения различий между людьми.
Результаты
Материалы для сбора до 563 образцов были отправлены восьми природоохранным и общинным ученым из девяти штатов по всему ареалу видов в восточной части Северной Америки. Материалы были отправлены в течение трех месяцев в течение 2021 года до местного пикового времени полета. На сегодняшний день мы получили в общей сложности 160 образцов ткани C. irus , которые были собраны (таблица 1). Геномная ДНК была извлечена в соответствии с протоколом для этого типа образцов, подробно описанным Storer et al.14. Из этих 160 образцов ДНК была успешно извлечена из 88 со средней концентрацией 1,67 нг/мкл (SE ± 2,98), а самый высокий выход ДНК составил 26,8 нг/мкл. Концентрации были количественно определены с использованием высокочувствительного набора для анализа в соответствии с инструкциями производителя с 2 мкл экстракта.
Хотя общее число полученных образцов существенно ниже, чем общее число материалов, развернутых для сбора, это в основном является артефактом обеспечения переизбытка коллекционных материалов для основного сборщика или руководителя группы, с тем чтобы они могли иметь максимальную гибкость для включения нескольких мест сбора и/или общинных ученых, участвующих при желании. Кроме того, C. iris является редким и сокращающимся таксоном, представленным ограниченными и часто относительно небольшими популяциями по всему его существующему ареалу. Несмотря на это ограничение, общее количество полученных образцов тканей является значительным, особенно по сравнению с тем, что можно было бы ожидать с более традиционной выборкой отдельных взрослых бабочек.

Рисунок 1: Отдельные развертываемые подразделения всех необходимых предметов снабжения, ожидающие отправки ученым сообщества или другому персоналу, ответственному за сбор данных на местах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 2: Отдельный развертываемый блок, включая все расходные материалы, прозрачный пластиковый ящик для сбора и заполненную экспресс-этикетку перевозчика, ожидающую отправки ученым сообщества или другому персоналу, ответственному за сбор в полевых условиях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Фотография вылупившегося яйца матовой эльфийской бабочки (Callophrys irus) на диком люпине (Lupinus perennis), показывающая отчетливое отверстие в центре, из которого вышла личинка новорожденного. Отметим, что общий цвет вылупившегося яйца – белый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Фото невылупившихся яиц матовой эльфийской бабочки (Callophrys irus) на диком люпине (Lupinus perennis). Обратите внимание, что невылупившиеся яйца не имеют заметного центрального отверстия и что их общий цвет голубовато-зеленый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
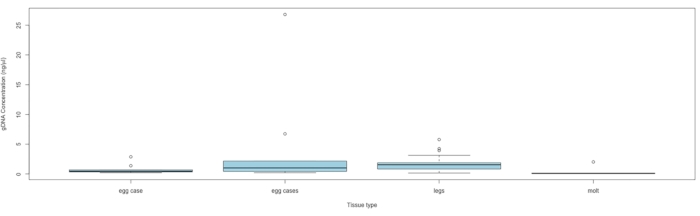
Рисунок 5: Концентрация ДНК по типу ткани. Средние линии коробки представляют медиану, каждая коробка расширяет IQR, а усы коробки составляют 1,5 × IQR, причем любые точки за пределами являются выбросами. Образцы, содержащие один случай яйца, имели только один случай яйца, а образцы, содержащие несколько случаев яиц, имели по крайней мере два случая, причем число случаев варьировалось от 2 до 20 (в среднем = 5,3) на образец. Аббревиатура: IQR = межквартильный диапазон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Государство | Футляр для яиц | Ящики для яиц | Фрасс | Нога | Линять | Общий итог |
| Арканзас | 2 | 2 | ||||
| Флорида | 3 | 10 | 7 | 22 | 42 | |
| Мичиган | ||||||
| Нью-Гэмпшир | 24 | 6 | 15 | 45 | ||
| Нью-Йорк | 30 | 30 | ||||
| Огайо | ||||||
| Висконсин | 9 | 5 | 5 | 19 | ||
| Оклахома | 16 | 6 | 22 | |||
| Общий итог | 36 | 21 | 16 | 65 | 22 | 160 |
Таблица 1: Количество и тип тканевого материала, собранного в разбивке по штатам.
Дополнительный рисунок S1: Титульная страница двустороннего, ламинированного, сжатого и иллюстрированного протокола для использования в полевых условиях. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2. Задняя страница двустороннего, ламинированного, сжатого, иллюстрированного протокола для использования в полевых условиях. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот протокол описывает полевой метод неразрушающего отбора проб редких бабочек для генетической структуры популяции или анализа штрихкодирования ДНК. Общие преимущества этого протокола специально разработаны, чтобы помочь максимизировать широкое внедрение людьми с различным опытом и уровнем квалификации, такими как ученые сообщества, практики сохранения и студенты. К ним относятся относительно низкая общая стоимость, простые в приобретении расходные материалы и оборудование, простой и доступный метод без многочисленных чрезмерно сложных шагов и простое развертывание в широкой географической области. Он также нацелен на остаточный органический материал, который устраняет необходимость временного захвата или манипулирования, и в процессе потенциально наносит вред живым организмам для приобретения генетических образцов. Кроме того, он расширяет потенциальный период, доступный для сбора образцов, за пределы традиционной фенологии или продолжительности жизни на определенном этапе жизни, повышая гибкость и общие возможности сбора, чтобы помочь максимизировать количество образцов.
В то время как основным таксоном для этого усилия была матовая эльфийская бабочка, широко распространенный, но сокращающийся специалист по среде обитания, этот протокол может быть применен более широко ко многим другим насекомым, включая тех, которые имеют проблему сохранения. Аналогичным образом, хотя протокол нацелен на сбор инкубационных яиц в качестве источника генетического материала, он может быть легко адаптирован к другим, потенциально более традиционным образцам (например, к ногам, фрагментам крыльев, антенным клипсам) или даже к целым организмам. Однако этот аспект также является потенциальным ограничением протокола. Хотя подавляющее большинство шагов предназначены для относительно простого и быстрого выполнения, всесторонний поиск участков личиночных растений-хозяев для выводящих яиц, которые по отдельности обычно <1,0 мм в диаметре, является трудоемким и трудоемким. Тем не менее, такая обширная выборочная деятельность особенно идеально подходит для более широкой сети участников, таких как общинные ученые.
Как и в случае с другими проектами на местах, необходима тщательная подготовка. Это включает в себя проведение полной инвентаризации предметов снабжения, необходимых для обеспечения отсутствия предметов снабжения, завершения любой необходимой подготовительной работы, их хорошо организованы, надежно упакованы и готовы к развертыванию на местах. Кроме того, весь персонал на местах, особенно те, кто проводит сбор тканей, должен подробно ознакомиться с протоколом сбора до любого мероприятия по сбору и адресовать любые вопросы лицам, осуществляющим надзор за проектом. Оказавшись в полевых условиях, часть протокола, посвященная сбору проб, требует тщательного внимания к деталям. Это включает в себя обнаружение и тщательный осмотр любых яйцеклеток, чтобы убедиться, что они вылуплены и, следовательно, пригодны для сбора, тщательная очистка щипцов, замена перчаток, чтобы помочь уменьшить перенос ткани между событиями отбора проб, и обеспечение того, чтобы образцы тканей были полностью погружены в буфер лизиса в каждой микроцентрифужной трубке объемом 1,5 мл. Наконец, важное значение имеет регистрация точных и подробных данных, которые включают в себя увязку уникальной идентификационной метки, присвоенной из микроцентрифужной трубки, с конкретным взятым образцом и всей другой соответствующей информацией о сборе. Хотя этот шаг является рутинным в научных исследованиях, он часто нуждается в тщательном уточнении и усилении для научной аудитории сообщества.
Здесь мы демонстрируем потенциальное использование ученых сообщества для сбора нелетальных образцов из небольших, редких и находящихся под угрозой исчезновения видов. Тем не менее, есть некоторые потенциальные ограничения, которые следует иметь в виду при анализе любых полученных генетических данных. Например, в то время как объединение образцов из одного пластыря увеличивает шансы на восстановление достаточного количества ДНК для обнаружения, это также потенциально вводит гетерозиготность. Кроме того, поскольку протокол включает в себя сбор хориона из вылупившихся яйцеклеток, только самки бабочек, представляющие родительскую ДНК, могут быть отобраны в популяции. Тем не менее, поскольку предыдущие генетические данные на уровне популяции не были доступны для C. irus, полученные в результате идеи могут только принести пользу сохранению и управлению видами. Например, в то время как тщательный, подробный дизайн исследования и тщательный отбор маркеров потребуются для адекватной оценки структуры популяции, протокол отбора проб, изложенный здесь, и использование штрих-кодирования ДНК цитохром-соксидазы 1 (CO1) могут быть использованы для обнаружения возникновения редких или находящихся под угрозой таксонов. Дополнительное обсуждение полезности и применения секвенирования ДНК из нелетального отбора проб, описанное здесь, подробно описано Storer et. ал.14.
Помимо основной цели сбора образцов для генетического анализа, в протоколе также подчеркивается, что участники делают подробные цифровые фотографии всех полевых участков, мест сбора, присутствующих личиночных растений-хозяев и любых других элементов окружающей среды обитания, которые могут иметь отношение к делу. Такая документация помогает обеспечить общую оценку среды обитания, которая полезна для иллюстрации существующих условий участка, таких как фенология растений, плотность ресурсов хозяина и история управления (например, недавний предписанный пожар). Такая информация особенно полезна для проектов, в которых полевые пробы берутся в течение более широкого временного периода для обеспечения более подробных экологических сопоставлений.
Наконец, по мере того, как глобальное сокращение численности насекомых продолжает ускоряться, крайне необходимы расширенные усилия по оценке и мониторингу видов15,16. Использование более широкого участия со стороны общинных ученых, студентов (например, стажеров и стипендиатов Службы охраны рыбных ресурсов и дикой природы США) и практиков в области охраны природы предлагает все более жизнеспособные варианты для обширного сбора данных многих типов, включая образцы ДНК. Соответственно, данные, генерируемые этим протоколом, имеют много возможных применений. К ним относятся помощь в информировании о природоохранных действиях (например, планирование, восстановление и управление), решения о включении в список или оценки статуса видов, а также экологические, популяционные и таксономические исследования.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторы хотели бы поблагодарить Дэвида Катрелла, Аманду Диллон, Стива Фуллера, Нила Гиффорда, Хайди Холман, Дина Джу, Салли Джу, Дэниела Кеннеди, Женевьеву Козак, Ребекку Лонгенекер, Морин МакКлунг, Мэтта Морана, Робина Нивера, Бренду Смит, Хантера Троубриджа и Джессапа Вайхельта за помощь в различных аспектах проекта, включая логистику, координацию, выдачу разрешений и/или сбор проб. Это исследование финансировалось за счет гранта Службы охраны рыбных ресурсов и дикой природы США (федеральный идентификационный номер F20AC00356), администрируемого Институтом управления дикой природой (грант SA 2021-01).
Материалы
| Name | Company | Catalog Number | Comments |
| 14 quart Igloo Playmate Cooler | Amazon | NA | portable cooler Amount per deployable unit: 1 cooler |
| 250 DNeasy Mini Spin Columns, Proteinase K, Buffers, Collection Tubes (2 mL) | Qiagen | 69506 | Qiagen DNeasy Blood & Tissue Kit Amount per deployable unit: NA |
| Andwin Scientific Supplier Diversity Partner LAB MARKERS BLACK | FisherSci | NC9280166 | ethanol proof lab marker Amount per deployable unit: 2 markers |
| Cardboard shipping box | shipping box Amount per deployable unit: as needed | ||
| Eisco Polyethylene Wash Bottles, LDPE | FisherSci | S14091 | lab grade spray or squirt bottle (for ethanol or alcohol) Amount per deployable unit: 1 bottle |
| FedEx U.S. express airbill | FedEx | NA | shipping return label Amount per deployable unit: 2 labels |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | FisherSci | NC9386261 | sterile 1.5 mL microcentrifuge tubes Amount per deployable unit: 128 tubes |
| Forceps, #4a, very fine yet extra strong tips (33 mm), 4-3/8" (111 mm) long | Bioquip | 4523 | straight tip forceps Amount per deployable unit: 2 straight forceps |
| Forceps, #7, curved tips (13 mm), very fine points, 4-1/2" (114 mm) long | Bioquip | 4527 | curved tip forceps Amount per deployable unit: 2 curved forceps |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | FisherSci | 06-666A | kimwipes (or other sterile wipe) Amount per deployable unit: 1 box |
| Laminated Illustrated field collection protocol | NA | NA | abbreviated protocol Amount per deployable unit: 1 protocol |
| Laminated list of materials | NA | NA | supply list Amount per deployable unit: 1 list |
| Lily Sugar 'N Cream The Original Solid Yarn, 2.5 oz, Medium 4 Gauge, 100% Cotton - Hot Pink - Machine Wash & Dry | Amazon | NA | pink yarn (to secure to forceps for visibility) Amount per deployable unit: 2 yards |
| Loupe by Bausch & Lomb, 10x Coddington Magnifier | Amazon | NA | hand lens Amount per deployable unit: 2 hand lenses |
| MyGift Clear Plastic 2-Tier Trays Craft Supply Storage Box/First Aid Carrying Case w/Top Handle & Latch Lock | Amazon | NA | supply storage box Amount per deployable unit: 1 box |
| Nitrile, Disposable Gloves, L, Powder-Free, 2.8 mil Palm Thickness | Grainger | 60NU14 | nitrile lab gloves (large) Amount per deployable unit: 1 box |
| Nitrile, Disposable Gloves, M, Powder-Free, 2.8 mil Palm Thickness | Grainger | 60NU13 | nitrile lab gloves (medium) Amount per deployable unit: 1 box |
| Qiagen, Inc. BUFFER ATL (200 ML) | Qiagen | 19076 | Qiagen ATL lysis buffer Amount per deployable unit: 180 µl/tube; 128 tubes |
| Rite In The Rain Weatherproof Side Spiral Notebook, Yellow Cover, Universal Page Pattern (No. 373-MX), 11 x 8.75 x 0.5 | Amazon | NA | weatherproof field notebook Amount per deployable unit: 1 notebook |
| Showgard Professional Stamp Tongs 6" 904 Round Tip Tweezers | Amazon | NA | 6" spade tip forceps Amount per deployable unit: 2 long spade forceps |
| Texwipe PolySat Pre-Wetted Wipers | FisherSci | 18-366-231 | alcohol wipes Amount per deployable unit: 100 wipes |
| Thermo Scientific CryoBoxes | FisherSci | 12-565-227 | 64 well microcentrifuge tubes collection/storage boxes Amount per deployable unit: 2 boxes |
| packing material Amount per deployable unit: as needed |
Ссылки
- Donald, H. M., Wood, C. W., Benowitz, K. M., Johnson, R. A., Drodie, E. D. Nondestructive sampling of insect DNA from defensive secretion. Molecular Ecology Resources. 12 (5), 856-860 (2012).
- Feinstein, J. DNA sequence from butterfly frass and exuviae. Conservation Genetics. 5 (1), 103-104 (2004).
- Hamm, C. A., Aggarwal, D., Landis, D. A. Evaluating the impact of non-lethal DNA sampling on two butterflies, Vanessa cardui and Satyrodes Eurydice. Journal of Insect Conservation. 14, 11-18 (2010).
- Holehouse, K. A., Hammond, R. L., Bourke, A. F. G. Non-lethal sampling of DNA from bumblebees for conservation genetics. Insectes Sociaux. 50 (3), 277-285 (2003).
- Lushai, G., et al. Application of molecular techniques to non-lethal tissue samples of endangered butterfly population (Parnassius apollo L.) in Norway for conservation management. Biological Conservation. 94 (1), 43-50 (2000).
- Monroe, E. M., Lynch, C., Soluk, D. A., Britten, H. B. Nonlethal tissue sampling techniques and microsatellite markers used for first report of genetic diversity in two populations of the endangered Somatochlora hineana (Odonata: Corduliidae). Annals of the Entomological Society of America. 103 (6), 1012-1017 (2010).
- Oi, C. A., López-Uribe, M. M., Cervini, M., Del Lama, M. A. Non-lethal method of DNA sampling in euglossine bees supported by mark-recapture experiments and microsatellite genotyping. Journal of Insect Conservation. 17 (5), 1071-1079 (2013).
- Scriven, J. J., Woodall, L. C., Goulson, D. Nondestructive DNA sampling from bumblebee feces. Molecular Ecology Resources. 13 (2), 225-229 (2013).
- Watts, P. C., Thompson, D. J., Daguet, C., Kemp, S. J. Exuviae as a reliable source of DNA for population-genetic analysis of odonates. Odonatologica. 34 (2), 183-187 (2005).
- Andrews, K., et al. All hands on deck: local ecological knowledge and expert volunteers contribute to the first delisting of a marine fish species under the Endangered Species Act. Citizen Science: Theory and Practice. 4 (1), 37 (2019).
- Buxton, A., Groombridge, J., Griffiths, G. Comparison of two citizen scientist methods for collecting pond water samples for environmental DNA studies. Citizen Science: Theory and Practice. 3 (2), 2 (2018).
- Granroth-Wilding, H., et al. Non-invasive genetic monitoring involving citizen science enables reconstruction of current pack dynamics in a re-establishing wolf population. BMC Ecology. 17 (1), 44 (2017).
- . DNeasy Blood & Tissue Kit Quick Start Protocol Available from: https://www.qiagen.com/us/resources/download.aspx?id=63e22fd7-6eed-4bcb-8097-7ec77bcd4de6&lang=en (2016)
- Storer, C., Daniels, J., Xiao, L., Rossetti, K. Using noninvasive genetic sampling to survey rare butterfly populations. Insects. 10 (10), 311 (2019).
- Wagner, D. L., et al. Insect decline in the Anthropocene: Death by a thousand cuts. Proceedings of the National Academy of Sciences of the United States of America. 118 (2), 20239891 (2021).
- Montgomery, G. A., et al. Is the insect apocalypse upon us? How to find out. Biological Conservation. 241, 108327 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены