Method Article
Агарозные жидкие гели, образованные сдвиговой обработкой во время гелеобразования для суспензионной 3D-биопечати
* Эти авторы внесли равный вклад
В этой статье
Резюме
Обработка сдвигом во время образования гидрогеля приводит к образованию микрогелевых суспензий, которые тонкие, но быстро реструктурируются после снятия сил сдвига. Такие материалы были использованы в качестве опорной матрицы для биопечатных сложных, нагруженных клетками структур. Здесь описаны методы, используемые для изготовления опорного слоя и совместимых биочернил.
Аннотация
Использование гранулированных матриц для поддержки деталей в процессе биопечати было впервые описано Bhattacharjee et al. в 2015 году, и с тех пор было разработано несколько подходов к подготовке и использованию поддерживающих гелевых слоев в 3D-биопечати. В этой статье описывается процесс производства микрогелевых суспензий с использованием агарозы (известных как жидкие гели), в котором образование частиц регулируется применением сдвига во время гелеобразования. Такая обработка создает тщательно определенные микроструктуры с последующими свойствами материала, которые дают явные преимущества в качестве встраивания печатных носителей, как химически, так и механически. К ним относятся поведение вязкоупругих твердых материалов при нулевом сдвиге, ограничение диффузии на большие расстояния и демонстрация характерного поведения флоккулированных систем при истончении сдвига.
Однако при снятии напряжения сдвига жидкие гели обладают способностью быстро восстанавливать свои эластичные свойства. Это отсутствие гистерезиса напрямую связано с определенными микроструктурами, о которых упоминалось ранее; Из-за обработки реакционноспособные, негелеобразные полимерные цепи на границе раздела частиц облегчают межчастичные взаимодействия, аналогичные эффекту Velcro. Это быстрое восстановление эластичных свойств позволяет биопечатать детали с высоким разрешением из биоматериалов с низкой вязкостью, поскольку быстрое преобразование опорного слоя улавливает биочернила на месте, сохраняя их форму. Кроме того, преимуществом агарозных жидких гелей является асимметричный переход гелеобразования/плавления (температура гелеобразования ~30 °C и температура плавления ~90 °C). Этот термический гистерезис агарозы позволяет печатать и культивировать биопечатную часть in situ без плавления поддерживающего жидкого геля. В этом протоколе показано, как производить гели с агарозной жидкостью, и демонстрируется их использование для поддержки производства ряда сложных деталей гидрогеля в рамках производства аддитив с подвесным слоем (SLAM).
Введение
Гидрогели являются идеальными материалами для использования в качестве поддержки роста клеток1. В зависимости от используемого материала они гелеобразно образуются с помощью мягких механизмов, которые не ставят под угрозу жизнеспособность клеток 2,3. Высокое содержание воды (обычно >90%) означает, что питательные вещества и кислород могут легко диффундировать в материал, а отходы клеточного метаболизма диффундируют4. Таким образом, было показано, что жизнеспособность клеток сохраняется в течение периодов, превышающих 1 год5, и в настоящее время есть примеры использования гидрогелей для хранения или «паузы» клеток для будущего терапевтического использования6. Они широко используются в тканевой инженерии для производства тканеподобных структур, но их использование, как правило, ограничено трудностями в контроле как структуры, так и состава материала. Исторически сложилось так, что прочность гидрогеля сравнительно низкая (по отношению ко многим твердым тканям) из-за высокого содержания воды и малых объемов, занимаемых полимерной матрицей, образующей структуру. Кроме того, многие пути гелеобразования (термический, ионотропный, фибриллогенез) предлагают достаточно медленную кинетику, что означает, что их механические свойства имеют тенденцию неуклонно развиваться со временем. За исключением взаимопроникающих сетей, низкая механическая жесткость и медленное время отверждения часто приводят к тому, что биочернила не могут свободно стоять при осаждении, имеют тенденцию к «просадке» и потере четкости при первоначальном экструдировании.
В попытке преодолеть эту ключевую проблему были разработаны встроенные методы печати, которые обеспечивают поддержку во время печати, в то время как механические свойства конструкции развиваются 7,8. Как только микроструктура геля полностью разовьется и механические свойства достигнут оптимального, опорная матрица может быть удалена, как правило, путем осторожной промывки или плавления поддерживающей фазы. В первоначальной работе по этому подходу использовалась вязкая плюроновая дисперсия, в которой вторичная фаза была распределена9. Совсем недавно Bhattacharjee et al. использовали гели в форме гранулированного карбопола, чтобы продемонстрировать, что массивы клеток могут быть суспендированы в поддерживающем геле10. Впоследствии Hinton et al. сообщили об экструзии гелевых материалов, содержащих клетки, в опорный слой, который состоял из микрогелевой суспензии, образованной из гранулированного желатина11. После экструзии ячеистого гидрогеля и его последующего отверждения желатин удаляли путем осторожного нагрева опорной ванны, что позволяло расплавить желатин. К сожалению, этот процесс все еще имеет ряд ограничений. Например, химическая структура желатина по сравнению с коллагеном (следовательно, он является гидролизованной формой коллагена) такова, что многие химические фрагменты в его основной цепи могут взаимодействовать с биологическими объектами; Таким образом, остаточная опорная матрица может мешать последующим биологическим процессам. Кроме того, продукты животного происхождения представляют собой ограничительное использование при рассмотрении вопроса о переводимости технологии. Это создает проблемы, если изготовленная деталь предназначена для клинического использования или даже если она предназначена для ответа на фундаментальные биологические вопросы, где это поверхностное загрязнение может вызвать серьезную проблему.
Впоследствии мы создали усовершенствованный процесс, который позволяет суспендировать производство гидрогелей в поддерживающей матрице, которая не имеет заряда в физиологических условиях и формируется из материалов, не относящихся к животному миру. Хотя этот процесс может быть использован с рядом биополимерных носителей, агароза обеспечивает материал, который инертен к биологическим взаимодействиям, поскольку он основан на сахаре и нейтрально заряжен при физиологическом рН12,13. Вместо того, чтобы фрагментировать уже существующий гель, материал основы формируется путем применения сдвига во время гелеобразования14,15,16. При этом образуется матрица частиц, которые проявляют дендроноподобные черты на своей поверхности и диспергируются во вторичной матрице негелеобразного полимера17,18. В результате получается материал с интересными свойствамиматериала 19,20,21,22, который может разжижаться при сдвиге аналогично ранее сообщенным гранулированным гелям, но имеет тенденцию быстрее восстанавливать вязкость при удалениисдвига 23. После того, как клеточный материал, экструдированный в опорную матрицу, полностью созреет, опорная матрица может быть удалена путем осторожного перемешивания перед помещением в культуру. Было показано, что этот процесс можно использовать для получения материалов со сложной структурой и рекапитуляции биологических структур как кожи, так и остеохондральной области23,24,25. В этом документе подробно описывается, как изготавливать вспомогательный материал, и выделяются соответствующие биочернила, используемые в различных сложных структурах.
протокол
ПРИМЕЧАНИЕ: Подробную информацию обо всех материалах, реагентах, оборудовании и программном обеспечении, используемых в этом протоколе, см. в таблице материалов .
1. Подготовка слоя суспензии жидкого геля
- Приготовьте 1000 мл дисперсной агарозы (0,5% мас./об.), добавив 5 г порошка агарозы в 1000 мл сверхчистой воды (тип 1, >18 мОм · см-1) в стеклянной бутылке объемом 2 000 мл.
- Добавьте в водную смесь магнитную мешалку диаметром 70 мм и закрепите крышку бутылки, сначала полностью затянув, а затем ослабив на четверть оборота.
- Растворите и стерилизуйте смесь, поместив стеклянную бутылку в корзину автоклава, закрыв крышку и запустив цикл в течение 15 минут при 121 ° C и 1 бар.
ПРИМЕЧАНИЕ: Этот протокол всегда используется для автоклавирования растворов на последующих этапах. - Выньте бутылку из автоклава, как только автоклав остынет до 80 °C, и поместите ее на магнитную мешалку (ненагретую), установив перемешивание на 800 об/мин.
ВНИМАНИЕ: Бутылка и жидкость остаются горячими. - Охладите золь в условиях окружающей среды, поддерживая постоянное перемешивание, до тех пор, пока температура не станет ниже его Т-геля (температура желирования), 32 ° C.
- Извлеките бутылку из мешалки и храните при температуре 4 °C.
ПРИМЕЧАНИЕ: Жидкий гель можно хранить до тех пор, пока он не понадобится.
2. Приготовление биочернил
- Приготовьте биочернила на основе гелланов, используя 1% (мас./мас.) золя низкоацилгеллановой камеди в сверхчистой воде (тип 1, >18 мОм·см-1).
- Взвесьте 0,5 г порошка геллана в лодку для взвешивания.
- Добавьте 49,5 г сверхчистой воды в стеклянную бутылку объемом 100 мл вместе с магнитной мешалкой.
- Сложите емкость для взвешивания, содержащую энергию геллана, пополам и медленно добавьте порошок в воду, постоянно помешивая.
- Растворите и стерилизуйте золь в автоклаве и дайте ему остыть до 20 °C.
- Храните биочернила при температуре 4 °C до дальнейшего использования.
- Приготовьте биочернила, смешанные с пектином и коллагеном, в сверхчистой воде (тип 1, >18 мОм·см-1).
- Приготовьте 5% (мас./об.) растворы пектина с низким содержанием метоксипектина, взвесив 2,5 г пектинового порошка в весовой лодке.
- Добавьте 50 мл сверхчистой воды в стеклянную бутылку объемом 100 мл вместе с магнитной мешалкой.
- Сложите емкость для взвешивания, содержащую пектиновую энергию, пополам и медленно добавьте порошок в воду, постоянно помешивая.
- Автоклавируйте водную смесь и охладите до 20 °С.
- Приготовьте смеси пектина и коллагена 1:1 и 2:1, добавив 3 мл раствора пектина к 3 мл раствора коллагена или добавив 4 мл раствора пектина к 2 мл раствора коллагена соответственно. Аккуратно перемешайте смеси с помощью пипетки, вынимая и дозируя смесь в 10 раз.
ПРИМЕЧАНИЕ: Эту процедуру лучше всего проводить с использованием холодных материалов на льду, чтобы предотвратить преждевременное гелеобразование коллагена. Предварительное охлаждение пектина и коллагена может быть достигнуто путем хранения при температуре 4 ° C перед смешиванием. - Хранить при температуре 4 °C до дальнейшего использования.
- Приготовьте биочернила, смешанные с альгинатом и коллагеном, в сверхчистой воде (тип 1, >18 мОм·см-1).
- Взвесьте 2 г альгинатного порошка в весовую лодку.
- Добавьте 50 мл сверхчистой воды в стеклянную бутылку объемом 100 мл вместе с магнитной мешалкой.
- Сложите емкость для взвешивания, содержащую альгинат, пополам и медленно добавьте порошок в воду, постоянно помешивая.
- Нагрейте дисперсию до 60 °C при постоянном помешивании до полного растворения альгината (прозрачная, слегка коричневая жидкость), а затем охладите до 20 °C.
- Разбавляют раствор альгината средой для культивирования клеток, такой как модифицированная среда орла Дульбекко (DMEM), добавляя 25 мл альгинатного раствора к 25 мл DMEM.
- Приготовьте альгинатно-коллагеновые смеси (1:1), добавив 3 мл раствора альгината/ДМЭМ к 3 мл раствора коллагена. Аккуратно перемешайте смеси с помощью пипетки, вынимая и дозируя смесь 10 раз, и храните при температуре 4 ° C.
ПРИМЕЧАНИЕ: Эту процедуру лучше всего проводить с использованием холодных материалов на льду, чтобы предотвратить преждевременное гелеобразование коллагена. Предварительное охлаждение пектина и коллагена может быть достигнуто путем хранения при температуре 4 ° C перед смешиванием.
3. Реологическая характеристика биочернил
- Включите реометр, вставьте 40 мм зубчатой геометрии и дайте постоять 30 минут.
- Обнулите высоту зазора реометра с помощью функции высоты нулевого зазора.
- Добавьте ~ 2 мл образца на нижнюю пластину и уменьшите верхнюю геометрию, чтобы создать высоту зазора 1 мм.
- Обрежьте образец, удалив лишний материал, выброшенный между пластинами. Для этого используйте плоский неабразивный край, чтобы оттянуть лишнюю жидкость от зазора и впитать папиросную бумагу.
ПРИМЕЧАНИЕ: Шаги 3.2-3.4 повторяются для изменения образца перед каждым из следующих шагов. - Проведите профили вискозиметрии для определения инъекционной способности биочернил.
- Выберите тест вискометрии в параметрах пользователя .
- Введите параметры для испытания на рампу с регулируемой скоростью сдвига: от 0,1 до 500 с-1 с с временем нарастания 1 минута.
- Повторите вискометрическое испытание на новых образцах, находящихся под контролем напряжения, используя верхнее и нижнее напряжения, определенные в результате испытания на рампу с регулируемой скоростью сдвига на шаге 3.5.2.
- Проведите небольшие испытания на деформацию , чтобы определить гелеобразующие характеристики биочернил.
- Выберите колебательное тестирование из пользовательских опций.
- Входные параметры в один частотный тест при постоянной деформации: частота 1 Гц, деформация 0,5% в течение 1 ч, при этом чернила гели.
- Проведение измерений амплитуды и частоты in situ на гелеобразных образцах.
- Выберите колебательный тест из пользовательских опций.
- Выберите амплитудную развертку и введите параметры для испытания на амплитудную развертку с контролем деформации: от 0,01 до 500% при постоянной частоте 1 Гц .
- Загрузите новый образец и выберите колебательный тест из пользовательских опций. Затем выберите частотный тест и входные параметры частоты от 0,01 до 10 Гц и деформацию, которая находится в пределах линейной вязкоупругой области (LVR) спектров, определенных по данным амплитудной развертки, полученным на шаге 3.7.2 (обычно значение от 50% до 80% от LVR).
4. Проектирование и печать 3D-структур с помощью 3D-биопринтера
- Запустите программное обеспечение САПР, чтобы начать создание модели САПР .
- Выберите Инструменты | Материалы в программном обеспечении САПР для определения параметров печати для выбранных биочернил.
- Входные параметры печати, относящиеся к используемому принтеру; Например, для 3D Discovery введите предполагаемый диаметр нити (~ 200-500 мкм для большинства биочернил) на вкладке толщины, чтобы определить толщину Z каждого слоя.
ПРИМЕЧАНИЕ: Расслоение конечной конструкции указывает на необходимость увеличения значения толщины, в то время как потеря разрешения подчеркивает необходимость уменьшения толщины. - Создайте желаемую структуру слой за слоем, используя вкладки «Слой » в программном обеспечении. Сгруппируйте слои с помощью вкладки «Группа» и назначьте каждому слою уровень на плоскости Z с помощью вкладки «Уровень ».
- Например, чтобы создать решетчатую структуру (используя биочернила, смешанные альгинат и коллаген, приготовленные на шаге 2.3), создайте один слой с нитями вдоль оси x и второй слой с нитями вдоль оси y. Назначьте оба на отдельный уровень.
- На вкладке « Группа » определите высоту сборки, выбрав количество повторяющихся единиц в структуре.
- Щелкните инструмент «Создать », чтобы создать G-код для проекта и просмотреть 3D-рендеринг конструкции.
- Закройте BioCAD и запустите программное обеспечение человеко-машинного интерфейса (HMI) 3D Discovery , чтобы начать процесс печати.
- Соберите печатающую головку в соответствии с инструкциями производителя. Установите микроклапан на печатающую головку и вкрутите выбранное экструзионное сопло.
- Нажмите функцию « Измерение длины иглы », чтобы откалибровать печатающую головку.
- Загрузите культуральный сосуд (например, 6-луночную пластину) на печатную платформу.
- Залейте биочернила в печатный картридж и ввинтите в печатающую головку над микроклапаном.
- Подключите собранную печатающую головку к пневматической системе давления и выберите печатающую головку на HMI для включения.
- Нажмите кнопку «Проверить давление», чтобы разрешить настройку давления экструзии.
- После того, как выбрано подходящее давление (~ 30-120 кПа в зависимости от желаемого разрешения), откройте сгенерированный ранее G-код и нажмите «Выполнить », чтобы начать процесс печати.
5. Приготовление кожных аналогов
- Культивирование дермальных фибробластов человека (HDF) и стволовых клеток, полученных из жировой ткани (ADSC), в DMEM с добавлением эмбриональной бычьей сыворотки (FBS) (10%), буфера HEPES (2,5%) и пенициллина/стрептомицина (1%) в колбах T75 до тех пор, пока не будет достигнуто 90% слияние. Культивируйте эпидермальные кератиноциты человека (HEK) в среде роста кератиноцитов (KGM) до тех пор, пока не будет достигнуто 70-80% слияния. Во время культивирования храните все клетки в условиях 37 °C, 5% CO2 и 95% воздуха в инкубаторе.
- Для приготовления HDF и ADSC для дермальных и жировых биочернил промойте клетки, осторожно пипетируя 3 мл фосфатно-буферного физиологического раствора (PBS) в колбы, наклоните колбу, чтобы закрутить PBS над клетками, и аспирируйте, стараясь не беспокоить прикрепленные клетки.
- Чтобы поднять клетки, наберите в колбу 3 мл 1x фермента диссоциации клеток, чтобы покрыть клетки, и поместите колбу в инкубатор на 3 мин, плотно постукивая колбой по ладони, чтобы сместить клетки. Нейтрализуют действие фермента, используя 6 мл полного DMEM.
ПРИМЕЧАНИЕ: Инкубируйте еще 2 минуты, если клетки остаются прикрепленными после постукивания. - Для приготовления дермальных и жировых биочернил поместите клеточные суспензии в отдельные пробирки по 15 мл и возьмите по 10 мкл от каждой для подсчета клеток с помощью гемоцитометра. Центрифугируют оставшиеся клеточные суспензии при 300 × г в течение 5 мин, чтобы гранулировать клетки.
- Аспирируйте надосадочную жидкость, стараясь не нарушить гранулу, добавьте соответствующий полимерный раствор (приготовленный на шаге 2.2) и перемешайте, используя мягкую стимуляцию пипеткой со следующими плотностями:
- Для жирового слоя пипеткой 5 ×10 5 ADSCs мл-1 на смесь коллагена и пектина 1:1.
- Для папиллярного слоя пипетка 3 ×10 6 HDF мл-1 на смесь коллагена и пектина 2:1.
- Для ретикулярного слоя пипетка 1,5 ×10 6 HDF мл-1 на смесь коллагена и пектина 2:1.
- Чтобы поднять клетки, наберите в колбу 3 мл 1x фермента диссоциации клеток, чтобы покрыть клетки, и поместите колбу в инкубатор на 3 мин, плотно постукивая колбой по ладони, чтобы сместить клетки. Нейтрализуют действие фермента, используя 6 мл полного DMEM.
- Для печати загрузите каждую биокраску в отдельный картридж и распечатайте конструкцию в поддерживающем жидком геле в стеклянной чашке Петри в соответствии с инструкциями в разделе 4.
- После завершения печати введите 2 мл 200 мМ CaCl 2∙2H2O вокруг конструкции и 3 мл адипогеннойсреды (полный DMEM с добавлением 500 мкМ изобутилметилксантина [IBMX], 50 мкМ индометацина и 1 мкМ дексаметазона) в жидкий гель с помощью шприца и иглы. Поместить в инкубатор на ночь.
- На следующий день снимите конструкцию с опорной ванны с помощью шпателя, аккуратно промойте в PBS и заживите в течение 14 дней в адипогенной среде в 6-луночной пластине.
- Через 14 дней удалите достаточное количество среды, чтобы создать границу раздела воздух-жидкость на поверхности конструкции, и засейте 2 × 10-6 кератиноцитов поверх конструкции, чтобы создать эпидермальный слой.
- Посев дополнительно за 1 неделю до анализа.
6. Подготовка модели сонной артерии
- Загрузите раствор биочернил на основе геллановой камеди (как описано на шаге 2.1) в картридж принтера.
- Распечатайте модель сонной артерии в чашке Петри, содержащей жидкий гелевый опорный материал, в соответствии с инструкциями по печати, приведенными в разделе 4.
- После завершения печати введите 2 мл 200 мМ CaCl 2∙2H2 O вокруг конструкции с помощью шприца и иглы.
- Минимум через 3 часа снимите конструкцию с опорной ванны с помощью шпателя и аккуратно промойте в PBS.
Результаты
Альгинатные и коллагеновые биочернила I типа
Было обнаружено, что разрешение печати (записанное в зависимости от диаметра нити) напрямую настраивается с помощью изменений давления экструзии (рис. 1A-C). Давление экструзии и разрешение печати были напрямую связаны с наименьшими диаметрами нити, полученными при печати при давлении экструзии 30 кПа. Интересно, что при давлении экструзии 30 кПа могут генерироваться нити, соответствующие внутреннему диаметру экструзионного сопла (средний диаметр нити: 323 мкм ± 50 мкм; диаметр сопла: 300 мкм), что позволяет предположить, что может быть достигнуто «максимальное разрешение». Кроме того, параметры печати для этого разрешения могут быть успешно применены для создания альгинатной/коллагеновой сосудистой трубки, которая может быть извлечена и перфузирована (рис. 1D).
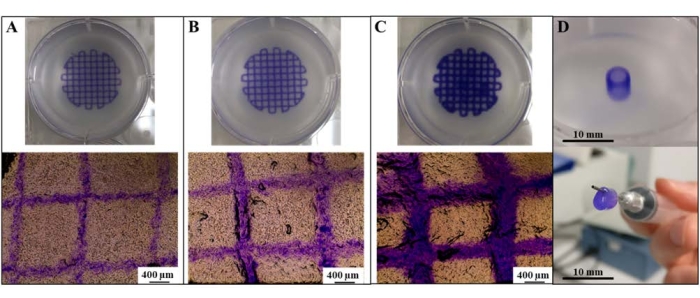
Рисунок 1: Генерация отпечатков с высоким разрешением с использованием SLAM. Адаптация разрешения печати альгинатных/коллагеновых решеток в зависимости от диаметра нити путем экструзии при (A) 30 кПа, (B) 60 кПа и (C) 120 кПа. (D) Образование альгинатной/коллагеновой сосудистой трубки. Масштабные линейки = 400 мкм (A-C), 10 мм (D). Аббревиатура: SLAM = аддитивное производство с подвесным слоем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Аналоги кожи
SLAM также использовался для создания структуры, похожей на кожу (рис. 2A), с использованием биочернил, образованных из смеси коллагена I и пектина. Для достижения градиента механических свойств, сходных с теми, которые обнаруживаются в коже, различные пропорции пектина и коллагена использовались в дермальном (5% пектина, смешанного в соотношении 2:1 с коллагеновым запасом 5 мг∙мл-1) и гиподермальном (5% вес/вес пектина, смешанного в соотношении 1:1 с запасом коллагена 5 мг∙мл-1) слоях. Полученная структура (рис. 2Bi-Bii) была хорошо интегрирована после погружения в DMEM без признаков расслоения. Важно отметить, что наблюдался высокий уровень жизнеспособности клеток по всей структуре (рис. 2Biii) после периода культивирования в течение 14 дней. Интересно, что за период культуры материалы застылив 24 раза, что указывает на переделку материала.
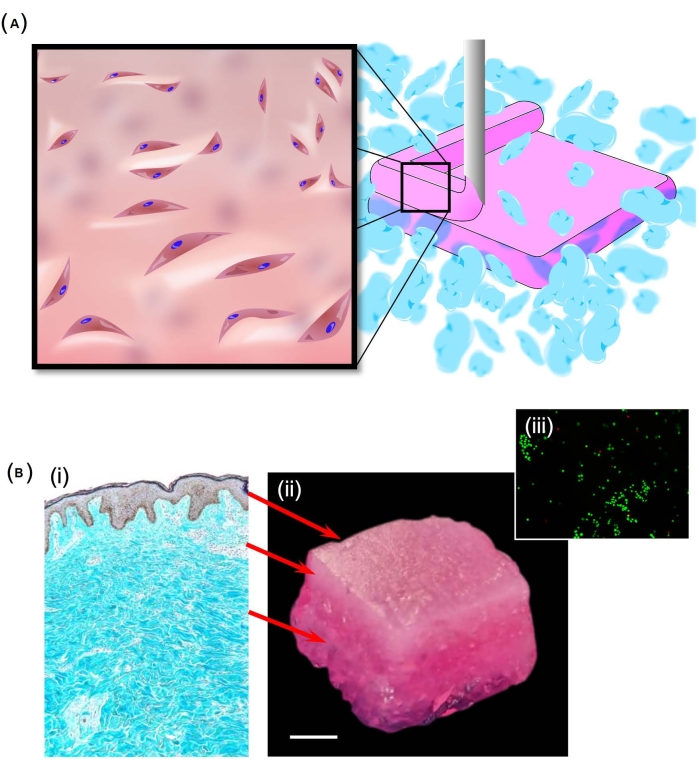
Рисунок 2: Создание кожистой структуры. (A) Схема, показывающая, как процесс SLAM был использован для создания слоистой структуры, встроенной в дермальные фибробласты человека. Подвесное ложе здесь было изготовлено из частиц, образованных из агарозы, в то время как подкожный и дермальный слои были сформированы из различных пропорций пектина и коллагена I. (B) Слоистая структура предназначалась для представления трехслойной структуры кожи (i). При успешном воспроизведении этой структуры (ii) высокие уровни жизнеспособности клеток были отмечены во всех образцах, как показано окрашиванием кальцеином-AM (iii). Масштабная линейка = 5 мм (Bii). Аббревиатура: SLAM = аддитивное производство с подвесным слоем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Сонная артерия
Чтобы раздвинуть границы метода, была произведена подборка более сложных отпечатков. В одном из таких примеров раздвоенная сонная артерия была напечатана с использованием 1% геллановых биочернил (рис. 3А), которые затем сшивали путем экструзии 200 мМ CaCl2 в слое псевдоожиженного геля (рис. 3В) и просто поднимали с носителя после гелеобразования (рис. 3В). Несмотря на то, что решения-прекурсоры для печати демонстрировали низкую вязкость, опорный слой успешно позволял производить сложную геометрию. Артерия сохранила свою структуру во время осаждения, сшивания и экстракции (рис. 3) без необходимости изменения кодов печати для включения дополнительных строительных лесов.
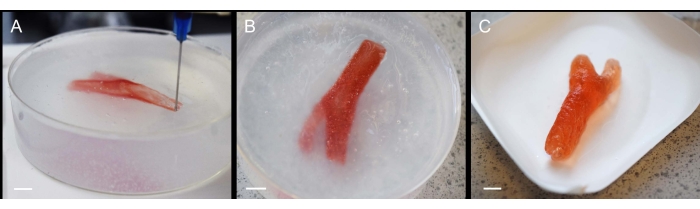
Рисунок 3: Процесс изготовления геллано-сонной артерии с использованием SLAM . (A) Экструзия гелана в слое жидкостного геля во время печати, (B) завершенный отпечаток сонной артерии в жидком геле во время сшивания и (C) окончательная модель сонной артерии после извлечения из жидкой гелевой подложки. Масштабные линейки = 10 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Рассмотрение выбора материалов, используемых для несущего слоя
На этапе разработки от опорного станины требовались различные характеристики. Эти характеристики включали: i) поддержание достаточной структуры для суспендирования экструдированного материала; ii) способность к истончению при сдвиге, позволяющая печатающей головке свободно перемещаться по вспомогательному материалу; iii) быстрая реструктуризация (самовосстанавливающиеся свойства), образующая опору вокруг нанесенных биочернил; iv) термически стабильны как при комнатной температуре, так и при физиологических температурах; v) нейтральный (т.е. незаряженный) материал, который является относительно биоинертным, в диапазоне pH и электролитов (ионных частиц и концентраций), предотвращая взаимодействие с клетками и заряженными биочернилами; vi) нетоксичный; и vii) предпочтительно из неживотного источника.
Несмотря на то, что существует множество биополимерных материалов, которые сохраняют некоторые из этих неотъемлемых характеристик, с возможностью выполнения взвешенного 3D-аддитивного производства без соответствия всем этим характеристикам 11,26,27, намерение здесь состояло в том, чтобы создать опорный слой, который преодолел бы некоторые практические проблемы, связанные с другими вспомогательными материалами. Благодаря химическим свойствам агарозы и, в частности, при составлении в виде жидкого геля для твердых частиц, все эти характеристики могут быть получены. Это позволило создать опорный слой, который можно было использовать для широкого спектра биочернил23,24,25,28. Действительно, биоинертная природа материала обеспечила потенциал для поддержания печатной структуры in situ на протяжении всей культуры, что позволило в течение достаточного времени для полного развития многих различных биочернил без изменений в биологии. Кроме того, частицы, истончение позволило легко удалить их из окончательной печатной конструкции, в то время как нетоксичное, неживотное происхождение позволяет быстро перенести их в клинику, преодолевая барьеры, связанные с этическими и нормативными требованиями.
Соображения при выборе материалов для биочернил
При прямой экструзионной биопечати биочернила наносятся на стол для 2D-печати. Полезно, чтобы мономерные растворы биочернил обладали способностью истончаться при сдвиге; Однако для получения высокоточных конструкций с физиологически значимыми размерами они должны иметь низкую тиксотропию и восстанавливаться до достаточно высокой вязкости, чтобы образовывать твердые нити при осаждении 29,30,31. При повышенной вязкости давление, необходимое для экструзии, значительно выше, что часто отрицательно влияет на жизнеспособность инкапсулированных клеток31,32. Суспензионная биопечать устраняет это ограничение, так как экструдированный материал поддерживается суспензионной ванной на протяжении всего сшивания. Эта разработка значительно расширяет диапазон составов биочернил, которые можно использовать. Например, недавняя работа показала использование растворов коллагена с низкой концентрацией, которые печатаются в очень сложных геометрических формах, аналогичных внутренней структуре сердца33,34,35. В приложениях, упомянутых в этом методе, встроенная печать позволяла выбирать чернила для биоматериала таким образом, чтобы наилучшим образом воспроизводить физиологическую среду, для которой они были предназначены, а не их способность печататься.
Ограничения по размеру структуры
В литературе по биофабрикации было продемонстрировано, что различные виды биопринтеров, основанные на альтернативных технологиях печатающих головок, могут быть включены во встроенные технологии производства. Технология, продемонстрированная здесь, ничем не отличается, с примерами, которые включают пневматический биопринтер на основе микроэкструзии (INKREDIBLE), как продемонстрировали Senior et al., и биопринтеры на основе экструзии с управляемыми микроклапанами (3D Discovery)23. Хотя это делает технологию доступной для широкого круга пользователей, которые, возможно, уже владеют биопринтером, ограничения на достижимый размер конструкции в конечном итоге зависят от спецификаций рассматриваемого биопринтера. Первоначально основное ограничение на генерацию больших структур определяется размером печатного стола, границами траекторий X, Y и Z, а также размером сосуда, в котором содержится поддерживающий жидкий гель.
Ограничения в разрешении
При изготовлении сложных конструкций микрометрового размера результирующее разрешение сильно зависит от точности принтера (контроль размера шага, степени экструзии), внутреннего диаметра печатного сопла и ряда регулируемых параметров программного обеспечения, включая скорость печати, давление печати и скорость потока36. Кроме того, контроль над размером капель, по-видимому, имеет решающее значение для облегчения создания структур с высоким разрешением, при этом наилучшие результаты наблюдаются в экструзионных принтерах с управляемым микроклапаном. В конечном счете, когда все параметры оптимизированы, разрешение печати может быть достигнуто, чтобы соответствовать или даже быть меньше внутреннего диаметра экструзионных сопел с нанесенной нитью порядка микрометровой шкалы37. Это, однако, зависит от оптимизации всех ранее упомянутых параметров печати, и разрешение может быть значительно ограничено механизмом печати и точностью. Например, пневматическая экструзия, по-видимому, не обеспечивает такое же разрешение печати, как экструзия с управляемым микроклапаном. Таким образом, достижение максимального разрешения печати может повлечь за собой финансовые последствия, поскольку такие системы влекут за собой значительно повышенные расходы для пользователя.
Перспективы и потенциал на будущее
В настоящее время существует большой интерес к использованию приостановленных производственных процессов для производства сложных мягких структур, содержащих встроенные ячейки, и, несомненно, в ближайшие годы будут достигнуты значительные успехи. Наблюдается постоянный прогресс в улучшении разрешения печати, хотя еще неизвестно, насколько это будет необходимо, учитывая, что большинство биологических систем способны перестраиваться на молекулярном уровне. В то время как в средствах массовой информации основное внимание уделяется использованию 3D-печатных тканей для непосредственной замены тканей человека после травмы или заболевания, любые надежные медицинские процедуры, обеспечиваемые этими процессами, появятся через несколько лет38,39. Более вероятно, что влияние этих сложных систем культивирования будет заключаться в скрининге лекарств или даже в использовании в качестве инструментов, чтобы улучшить наше понимание биологических процессов38. В частности, здесь может быть очень полезна биология развития, где точный контроль над особым осаждением молекул позволит исследователям исследовать роль многофакторных систем в процессах развития тканей.
Раскрытие информации
У авторов нет конфликтов интересов, о которых можно было бы заявить.
Благодарности
Авторы хотели бы поблагодарить EPSRC (EP / L016346 / 1), MRC и Альянс докторантуры Biosciences for Health за финансирование и поддержку этой работы.
Материалы
| Name | Company | Catalog Number | Comments |
| 3D Discovery Bioprinter | RegenHU | BIOFACTORY | Microvalve extrusion bioprinter |
| Agarose | Merck | 9012-36-6 | Material used to create fluid gel support baths |
| Benchtop autoclave | Prestige Medical | B8L75814 | Classic |
| Brilliant Blue G | Merck | 6104-58-1 | Dye used to stain structures |
| Calcium Chloride Dihydrate | Merck | 10035-04-8 | Used to reticulate printed structures |
| Dexamethasone | Merck | D4902-25MG | Used in adipogenic media |
| DMEM | Merck | D6429 | Cell culture media |
| Duran bottle | Merck | Z305219 | glass bottle |
| EVOS XL Core Imaging System | EVOS™ | AMEX1000 | Brightfield microscope with phase contrast |
| FBS | Fisher Scientific | 10500-064 | Cell culture media supplement |
| Gellan gum | Special Ingredients | 5060341112638 | Low Acyl Gellan gum used to make the bioink for the corotid artery model |
| HEPES buffer | Merck | H9897-10PAK | Buffer for cell culture media |
| Indomethacin | Merck | I7378 | Used in adipogenic media |
| Isobutyl-methylxanthine (IBMX) | Merck | I7018-100MG | Used in adipogenic media |
| Keratinocyte growth medium | Lonza | 00192060 | Used as media to culture keratinocytes |
| Low Methoxy Pectin | CP Kelco | LM-5CS | Pectin used to make pectin/collagen blends |
| Penicillin-streptomycin | Merck | P4333-100ML | Used to inhibit bacterial growth |
| PureCol EZ Gel solution | Merck | 5074 | Collagen solution used to make alginate/collagen blends |
| Sodium Alginate | Merck | 9005-38-3 | Alginate powder used to make alginate/collagen blends |
| TrypLE select | Fisher Scientific | 12563011 | cell dissociation enzyme |
| T75 Flasks | StarLab | CC7682-4175 | Used for culturing cells |
Ссылки
- Lee, K. Y., Mooney, D. J. Hydrogels for tissue engineering. Chemical Reviews. 101 (7), 1869-1880 (2001).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Drury, J. L., Mooney, D. J. Hydrogels for tissue engineering: scaffold design variables and applications. Biomaterials. 24 (24), 4337-4351 (2003).
- Iordachescu, A., et al. An in vitro model for the development of mature bone containing an osteocyte network. Advanced Biosystems. 2 (2), 1700156 (2018).
- Zhang, C., et al. Hydrogel cryopreservation system: an effective method for cell storage. International Journal of Molecular Sciences. 19 (11), 3330 (2018).
- McCormack, A., Highley, C. B., Leslie, N. R., Melchels, F. P. W. 3D printing in suspension baths: keeping the promises of bioprinting afloat. Trends in Biotechnology. 38 (6), 584-593 (2020).
- Cheng, W., Zhang, J., Liu, J., Yu, Z. Granular hydrogels for 3D bioprinting applications. View. 1 (3), 20200060 (2020).
- Lieben, L. The future of 3D printing of human tissues is taking shape. Nature Reviews Rheumatology. 12 (4), 191 (2016).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655 (2015).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Zarrintaj, P., et al. Agarose-based biomaterials for tissue engineering. Carbohydrate Polymers. 187, 66-84 (2018).
- te Nijenhuis, K. . Thermoreversible Networks: Viscoelastic Properties and Structure of Gels. , 194-202 (1997).
- Norton, I. T., Jarvis, D. A., Foster, T. J. A molecular model for the formation and properties of fluid gels. International Journal of Biological Macromolecules. 26 (4), 255-261 (1999).
- Fernández Farrés, I., Moakes, R. J. A., Norton, I. T. Designing biopolymer fluid gels: A microstructural approach. Food Hydrocolloids. 42, 362-372 (2014).
- Cooke, M. E., et al. Structuring of hydrogels across multiple length scales for biomedical applications. Advanced Materials. 30 (14), 1705013 (2018).
- Foster, N. C., Allen, P., El Haj, A. J., Grover, L. M., Moakes, R. J. A. Tailoring therapeutic responses via engineering microenvironments with a novel synthetic fluid gel. Advanced Healthcare Materials. 10 (16), 2100622 (2021).
- Ellis, A. L., Norton, A. B., Mills, T. B., Norton, I. T. Stabilisation of foams by agar gel particles. Food Hydrocolloids. 73, 222-228 (2017).
- Ghebremedhin, M., Seiffert, S., Vilgis, T. A. Physics of agarose fluid gels: Rheological properties and microstructure. Current Research in Food Science. 4, 436-448 (2021).
- Garrec, D. A., Norton, I. T. Understanding fluid gel formation and properties. Journal of Food Engineering. 112 (3), 175-182 (2012).
- Garrec, D. A., Guthrie, B., Norton, I. T. Kappa carrageenan fluid gel material properties. Part 1: Rheology. Food Hydrocolloids. 33 (1), 151-159 (2013).
- Adams, S., Frith, W. J., Stokes, J. R. Influence of particle modulus on the rheological properties of agar microgel suspensions. Journal of Rheology. 48 (6), 1195-1213 (2004).
- Senior, J. J., Cooke, M. E., Grover, L. M., Smith, A. M. Fabrication of complex hydrogel structures using suspended layer additive manufacturing (SLAM). Advanced Functional Materials. 29 (49), 1904845 (2019).
- Moakes, R. J. A., et al. A suspended layer additive manufacturing approach to the bioprinting of tri-layered skin equivalents. APL Bioengineering. 5 (4), 046103 (2021).
- Moxon, S. R., et al. Suspended manufacture of biological structures. Advanced Materials. 29 (13), 1605594 (2017).
- Noor, N., et al. 3D Printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Compaan, A. M., Song, K., Huang, Y. Gellan fluid gel as a versatile support bath material for fluid extrusion bioprinting. ACS Applied Materials & Interfaces. 11 (6), 5714-5726 (2019).
- Moxon, S. R., et al. Blended alginate/collagen hydrogels promote neurogenesis and neuronal maturation. Materials Science and Engineering: C. 104, 109904 (2019).
- Hölzl, K., et al. Bioink properties before, during and after 3D bioprinting. Biofabrication. 8 (3), 032002 (2016).
- Chimene, D., Lennox, K. K., Kaunas, R. R., Gaharwar, A. K. Advanced bioinks for 3D printing: a materials science perspective. Annals of Biomedical Engineering. 44 (6), 2090-2102 (2016).
- Schwab, A., et al. Printability and shape fidelity of bioinks in 3D bioprinting. Chemical Reviews. 120 (19), 11028-11055 (2020).
- Rutz, A. L., Lewis, P. L., Shah, R. N. Toward next-generation bioinks: Tuning material properties pre- and post-printing to optimize cell viability. MRS Bulletin. 42 (8), 563-570 (2017).
- Mosadegh, B., Xiong, G., Dunham, S., Min, J. K. Current progress in 3D printing for cardiovascular tissue engineering. Biomedical Materials. 10 (3), 034002 (2015).
- Zhou, K., Sun, Y., Yang, J., Mao, H., Gu, Z. Hydrogels for 3D embedded bioprinting: a focused review on bioinks and support baths. Journal of Materials Chemistry B. 10 (12), 1897-1907 (2022).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Kyle, S., Jessop, Z. M., Al-Sabah, A., Whitaker, I. S. Printability' of candidate biomaterials for extrusion based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), 1700264 (2017).
- Hinton, T. J., Lee, A., Feinberg, A. W. 3D bioprinting from the micrometer to millimeter length scales: Size does matter. Current Opinion in Biomedical Engineering. 1, 31-37 (2017).
- Seoane-Viaño, I., Trenfield, S. J., Basit, A. W., Goyanes, A. Translating 3D printed pharmaceuticals: From hype to real-world clinical applications. Advanced Drug Delivery Reviews. 174, 553-575 (2021).
- Jovic, T. H., Combellack, E. J., Jessop, Z. M., Whitaker, I. S. 3D bioprinting and the future of surgery. Frontiers in Surgery. 7, 609836 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены