Method Article
Мышиная модель хронического фиброза печени для изучения атрезии желчевыводящих путей
В этой статье
Резюме
Мы создали мышиную модель хронического фиброза печени, которая обеспечивает подходящую животную модель для механистического исследования фиброза печени, индуцированного вирусом, атрезии желчевыводящих путей (БА) и платформу для будущих методов лечения БА.
Аннотация
Атрезия желчевыводящих путей (БА) является смертельным заболеванием, сопровождающимся механической желтухой, и является наиболее распространенным показанием к трансплантации печени у детей. Из-за сложной этиологии и неизвестного патогенеза до сих пор не существует эффективных медикаментозных методов лечения. В настоящее время классическая модель мыши БА, индуцированная резус-ротавирусом (РРВ), является наиболее часто используемой моделью для изучения патогенеза БА. Эта модель характеризуется задержкой роста, желтухой кожи и слизистой оболочки, глинистым стулом и темно-желтой мочой. Гистопатология показывает тяжелое воспаление печени и обструкцию внутрипеченочных и внепеченочных желчных протоков, которые сходны с симптомами БА человека. Однако печень мышей с терминальной стадией в этой модели не имеет фиброза и не может полностью имитировать характеристики фиброза печени при клинической БА. В представленном исследовании была разработана новая модель хронического фиброза печени на мышах БА путем четырехкратного введения 5-10 мкг антитела против Ly6G с промежутками в 2 дня после каждой инъекции. Результаты показали, что у некоторых мышей успешно сформировался хронический БА с типичным фиброзом после промежутка времени, что означает, что эти мыши представляют собой подходящую животную модель для механистического исследования БА, вызванного вирусом-индуцированным фиброзом печени, и платформу для разработки будущих методов лечения БА.
Введение
Атрезия желчевыводящих путей (БА) является серьезным гепатобилиарным заболеванием, которое часто встречается у младенцев и детей младшего возраста; В частности, он проявляется как облитерирующая холангиопатия с желтухой новорожденных и бледным стулом1. Его клиническими характеристиками являются воспалительное разрушение внутрипеченочных и внепеченочных желчных протоков и прогрессирующий фиброз, который со временем перерастает в печеночную недостаточность2. По статистике, заболеваемость БА в странах Азии выше, чем в странах Европы и Америки, а заболеваемость БА в странах Азии составляет 1/8 000. Этиология БА включает вирусную инфекцию, аномальное развитие желчных протоков, иммунные нарушения и генетические вариации3. Операция Касаи является наиболее часто используемым методом улучшения холестаза у детей с БА, но, в конечном счете, это не может предотвратить прогрессирование фиброза4. Современное лечение БА в основном основано на трансплантации печени, которая ограничена отсутствием источников печени. Углубленное изучение патогенеза БА является самым непосредственным средством решения проблем этого заболевания. Тем не менее, исследования патогенеза БА в основном опираются на модели животных БА, и крайне важно выбрать подходящую модель на животных.
Большинство гистопатологических исследований БА показали, что гиперплазия желчных протоков (БДП), тромбоз желчи и фиброз воротной вены являются наиболее важными патологическими признаками БА, и в то же время существуют другие патологические признаки разных степеней, такие как инфильтрация портальных воспалительных клеток и отек гепатоцитов 5,6. В настоящее время существует множество моделей мышей, которые имитируют БА, такие как хроническая модель мыши, питаемая 3,5-тиоксикарбонил-1,4-дигидроколлидином (DDC), с обструкцией сегментарных желчных протоков и перихолангитом с участием внепеченочных желчных протоков7 и мышиная модель фиброза печени с внутрибрюшинной инъекцией четыреххлористого углерода8. Модель перевязки желчных протоков (BDL) характеризуется желтухой и быстрым фиброзом воротной вены9. Модель мышей, получавших альфа-нафтизотиоцианат (ANIT), представляет собой холангит, ограниченный внутрипеченочным желчным протоком, и повреждение гепатоцитов10. Мышиная модель с длительной желтухой индуцирована отсроченной инокуляцией резус-ротавируса (RRV)11. Несмотря на то, что существует множество моделей животных, особенно моделей мышей, каждая модель имеет свои ограничения. Они могут моделировать только часть характеристик заболевания БА, таких как острое воспаление или фиброз печени в процессе атрезии желчевыводящих путей, и не существует модели, которая в значительной степени соответствовала бы болезненному процессу и патологическим особенностям БА.
Классическая модель мыши BA индуцируется RRV, и эта модель наиболее похожа на модель BA у людей. Однако, в то время как мыши-модели БА, индуцированные RRV, демонстрируют сходные клинические симптомы и патологические характеристики с некоторыми из симптомов внепеченочной атрезии желчевыводящих путей, в этой модели отсутствует фиброз печени, что значительно ограничивает углубленное изучение механизмов БА и разработку новых методов лечения12. Таким образом, в этом исследовании была разработана новая модель хронического фиброза печени на мышах БА. Антитело против Ly6G вводили внутрибрюшинно перед инокуляцией RRV в день рождения. Затем 5-10 мкг антитела против Ly6G вводили четыре раза, с промежутками в 2 дня между каждой инъекцией. Симптомы БА у мышей улучшились, время выживания было увеличено, и мыши вошли в стадию хронического фиброза. Эта модель не только имитирует реакцию острой фазы БА, но и имитирует процессы печени и прогрессирующий фиброз. Таким образом, это более подходящая животная модель для механистического изучения БА, и она может обеспечить теоретическую основу для разработки будущих методов лечения БА.
Молекула Gr-1 представляет собой маркер клеточной поверхности миелоидного происхождения, который, как первоначально было обнаружено, экспрессируется в нейтрофилах13. Истощение антител против Ly6G снижает циркулирующие нейтрофилы более чем на 90% и изменяет ответ, активируемый другими иммунными клетками. Функции популяций клеток Gr-1+ были зарегистрированы в различных исследованиях с использованием специфических антител-поглотителей с различными эффектами, идентифицированными на цитокины и опосредованную иммунную защиту14. Мы изучили функцию клеток Gr-1+ в моделях мышей BA, инокулированных RRV. Однако, поскольку не было обнаружено, что молекула Gr-1 экспрессируется у людей, аналогичная молекула, CD177, была изучена у пациентов с БА15. Наши данные доказывают значимость популяций клеток Gr-1+ , особенно в хронической фиброзной фазе заболевания, и предоставляют подходящую модель на животных для исследования потенциальных методов лечения БА.
протокол
Это исследование было одобрено Институциональным комитетом по уходу за животными и их использованию Центра биомедицинских животных Гуанчжоу Юннуо (IACUC-AEWC-F2208020), где проводились все эксперименты на животных.
1. Создание модели хронической фиброзной БА у мышей
ПРИМЕЧАНИЕ: Все животные содержались в определенной среде, свободной от патогенов (SPF), в одной комнате, и эксперименты проводились в обычной среде. Мышей BALB/c на 12,5-е сутки беременности (возраст: 10-12 недель; вес 35-40 г) содержали в помещении без специфических патогенов при 25°С в 12-часовом цикле темноты/света и обеспечивали свободный доступ к автоклавной пище и воде. Неонатальные мыши в течение 24 ч после рождения (средняя масса тела: 1,5-1,6 г) были отобраны для мышиной модели BA.
- Подготовьте РРВ, как сообщалось ранее16.
ПРИМЕЧАНИЕ: Из-за плохого состояния выживаемости модельных мышей их необходимо разделить в возрасте 21 дня, чтобы избежать их укусов или даже убийства другими мышами в той же клетке. - Разделите неонатальных мышей на три группы: контрольную группу, группу RRV и группу RRV + анти-Ly6G. Внутрибрюшинно вводят новорожденным мышам 20 мкл RRV (титр: 1,5 x 106 БОЕ/мл) (группа RRV) или физиологический раствор (контрольная группа) в течение 24 ч после рождения. Чтобы истощить клетки Gr-1+ , предварительно обработайте каждую мышь внутрибрюшинной инъекцией 5 мкг антитела против Ly6G за 4 ч до инъекции RRV.
ПРИМЕЧАНИЕ: Раствор антител против Ly6G хранится при температуре 2-8 ° C и не должен быть заморожен. Выньте антитело перед использованием и поставьте при комнатной температуре на 30 минут, чтобы он согрелся. - Вводите 10 мкг антитела против Ly6G в брюшную полость мыши каждые 3 дня до 12-го дня после инъекции RRV (рис. 1A).
- Ежедневно проверяйте и записывайте внешний вид, вес и выживаемость всех мышей.
2. Внутрибрюшинная инъекция мышей
- Уберите новорожденных мышей из клетки. Используйте инсулиновый шприц объемом 1 мл для введения 20 мкл раствора RRV или 50 мкл раствора антител против Ly6G. Ущипните кожу шеи молодой мыши указательным и большим пальцами одной руки и осторожно придерживайте задние лапы мыши безымянным и хвостовым пальцами, чтобы обнажить брюшко.
- Поднимите иглу под наклоном вверх. Введите иглу в среднее бедро правой задней лапы мыши под углом 15° к коже. Двигаясь по подкожному пути до тех пор, пока игла не достигнет правого реберного края мыши, направьте иглу вниз в брюшную полость. Затем введите жидкость под печень мыши.
ПРИМЕЧАНИЕ: У новорожденных мышей желудок и селезенка находятся в левой части живота. Если игла введена с левой стороны, ее легко проткнуть желудок или вызвать кровоизлияние в селезенку. - Вытащите иглу сразу после инъекции и наблюдайте за кровотечением или подтеканием в месте инъекции. Если он есть, протрите его автоклавной ватой. Верните мышь в клетку матери.
ПРИМЕЧАНИЕ: Чтобы уменьшить влияние утечки жидкости во время инъекции на результаты эксперимента, убедитесь, что действие инъекции мягкое, медленно извлеките иглу и прижмите место инъекции ватным тампоном в течение 30 с.
3. Сбор образца ткани
- На 12-й день обезболивают мышей ингаляцией 4% изофлурана и препарируют их под микроскопом. Вставьте инсулиновый шприц объемом 1 мл в левый желудочек сердца для сбора крови. После забора крови усыпьте мышей путем вдыхания 4% изофлурана в течение 10 мин. Центрифугируют кровь при 400 × г в течение 5 мин при комнатной температуре и отделяют сыворотку для измерения функции печени.
ПРИМЕЧАНИЕ: Сбор крови должен быть выполнен, пока мыши живы. Если мыши погибнут, кровь задержится в кровеносных сосудах и не сможет быть собрана. - Сфотографируйте общий вид печени и желчных протоков. Впоследствии рассеките печень и селезенку мыши от окружающих тканей ножницами и пинцетом.
ПРИМЕЧАНИЕ: Печень и другие ткани собирают и резервируют при -80 ° C для экстракции РНК и белка или замачивают в 10% формалине для приготовления гистологических образцов.
4. Флуоресцентная ангиография внепеченочных желчных протоков
- После эвтаназии мышь полностью обнажите печень, желчный пузырь и внепеченочные желчные протоки ножницами и ватными палочками.
- Понаблюдайте под микроскопом, введите 5-10 мкл флуоресцентного красителя родамина 123 (20 мг / мл) в желчный пузырь с помощью инсулинового шприца объемом 1 мл и сделайте снимки. Этот процесс такой же, как и в предыдущем16.
ПРИМЕЧАНИЕ: Разные мыши в одной группе используются для сбора образцов тканей и флуоресцентной ангиографии.
5. Окрашивание H&E
- Погрузить свежую ткань печени мыши в 10% формалин на 24 ч.
- После погружения ткани в парафин используйте парафиновый микротом, чтобы разрезать парафиновый блок на участки толщиной 4 мкм и поместить два последовательных участка на одно и то же предметное стекло. Для стандартизации операции требуется опытный персонал, чтобы избежать порезов пальцев17.
- Поместите ломтики в решетку для нарезки, снимите парафин с ксилола, последовательно увлажните их в абсолютном этаноле, 95% этаноле, 80% этаноле, 70% этаноле и дистиллированной воде и замочите в каждом на 5 минут.
- Окрасьте срезы раствором гематоксилина на 5 мин, и замочите их в 1% соляной кислоте и 75% спирте на 5 с. Промойте срезы чистой водой, а пятните раствором эозина в течение 1 мин.
6. Иммуногистохимическое окрашивание CK19 и F4/80
- Первые три этапа аналогичны этапам встраивания тканей, секционирования и депарафинизации в секции окрашивания H&E.
- Выполните восстановление антигена с помощью буфера Tris-EDTA (10 ммоль / л основания Tris, 1 ммоль / л раствора ЭДТА, pH 9,0), нагрейте срезы в микроволновой печи при 95 ° C в течение 10 минут, а затем удалите и охладите их естественным путем до комнатной температуры.
- Поместите срезы тканей в 3% раствор перекиси водорода на 10 мин для удаления эндогенной пероксидазы.
- Обработайте срезы 5% козьей сывороткой, чтобы блокировать неспецифическое связывание.
- Добавьте в срезы первичный антимышиный цитокератин 19 или моноклональное антитело F4/80 против мыши и инкубируйте в течение ночи при 4 ° C.
- Инкубируйте срезы с соответствующими вторичными антителами в течение 30 мин при комнатной температуре.
- Используйте 3,3'-диаминобензидин (DAB) в качестве хромогенного агента для наблюдения за хромогенной реакцией под микроскопом.
- Наблюдайте за срезами под 40-кратным микроскопом, чтобы получить изображения, и анализируйте их по мере необходимости.
7. Красное окрашивание Сириуса
- Выполните первые три этапа встраивания тканей, секционирования и депарафинизации, как описано в разделе «Окрашивание H&E».
- После того, как срезы ткани будут окрашены гематоксилином, покройте каждую ткань 50 мкл раствора красителя Sirius Red при комнатной температуре в течение 1 часа.
- Высушите предметные стекла естественным путем при комнатной температуре в течение 4 часов, добавьте каплю нейтральной жевательной резинки на каждое предметное стекло и используйте покровное стекло, чтобы медленно покрыть ткань, чтобы избежать образования пузырьков. Оставьте предметные стекла при комнатной температуре на 24 часа, чтобы нейтральная резинка затвердела.
- Используйте поляризованную контрастную световую микроскопию для наблюдения за деталями отложения коллагена; Выберите четкое и подходящее поле зрения и отрегулируйте яркость и баланс белого поля зрения микроскопа. Получайте изображения и анализируйте их по мере необходимости под 40-кратным микроскопом.
Результаты
Мышам внутрибрюшинно вводили 5 мкг антитела против Ly6G в течение 24 ч после рождения, а затем внутрибрюшинно вводили 20 мкл RRV через 4 часа. Затем вводили 10 мкг антитела против Ly6G каждые 3 дня до 12-го дня (рис. 1А). Среднее время выживания в группе RRV составило 13 дней. Напротив, у большинства мышей, получавших антитела, развилась легкая желтуха, и потери веса не наблюдалось (рис. 1C). Около 20-30% мышей имели синдром БА с длительной желтухой и низкой массой тела, но прожили более 42 дней. После лечения антителами против Ly6G количество клеток Gr-1+ уменьшилосьна 15, и мыши вступили в стадию хронического фиброза, называемого хроническим БА. Образцы были собраны на 12-й и 42-й день, а срезы ткани, окрашенные Sirius Red, показали постепенное увеличение фиброза печени. Хронические мыши BA, выжившие в течение 42 дней, были использованы для подробного анализа. В дополнение к небольшому размеру, на ушах, ногах и коже хвоста была выражена желтуха (синие стрелки на рисунке 1E). На 6-й день после инъекции RRV цвет кала мышей стал светлее, а цвет мочи — темнее; это значительно отличалось от контрольной группы на 12-й день, когда мыши группы RRV показали белый кал и темно-желтую мочу. На 42-й день моча и кал мышей с хроническим БА также показали явные признаки желтухи (рис. 1D, E). Печень мышей БА была удалена и сравнена с печенью контрольной группы. Печень была меньше (рис. 2Б), некротические поражения были видны невооруженным глазом (рис. 2А, черный треугольник), а также наблюдался сегмент атрезии желчных протоков (рис. 2А, белые звездочки).
Анализ среза ткани печени показал, что терапия низкими дозами анти-Ly6G уменьшала воспаление воротной вены. Тем не менее, воспалительное накопление клеток все еще наблюдалось в срезах ткани печени на 42-й день (рис. 3А). Окрашивание Sirius Red показало небольшое увеличение отложения коллагена в портальной области на 12-й день после инъекции RRV. Более того, не наблюдалось существенных изменений в экспрессии коллагена после лечения антителом против Ly6g, но экспрессия коллагена в образцах тканей БА на 42-й день была значительно увеличена (рис. 3B). При исследовании под поляризованным световым микроскопом было замечено, что коллагеновые волокна накопились в соседней ткани печени. Значительное отложение коллагена, преимущественно зеленого, наблюдалось в образцах тканей БА на 42-й день (рис. 3C), а отложение коллагена еще больше увеличилось у мышей, которые прожили 42 дня без увеличения веса. При уменьшении портального воспаления на 12-й день наблюдались клетки желчных протоков CK19+ . Однако на 42-й день зрелые желчные протоки были практически не обнаружены, хотя наблюдалось увеличение CK19+ клеток желчных протоков (рис. 4A, красные стрелки указывают на эпителиальные клетки желчных протоков). В случае внепеченочных желчных протоков у мышей с хронической БА серийное рассечение портальной области мышей показало, что внепеченочные желчные протоки были заблокированы и имели воспалительные инфильтраты макрофагов (рис. 4B, черными стрелками обозначены макрофаги).
По сравнению с одним RRV, лечение низкой дозой антител против Ly6G уменьшало повреждение печени с точки зрения уровня ферментов печени на 12-й день после инокуляции RRV. Уровни аланинаминотрансферазы и щелочной фосфатазы в печени были выше в группе хронической БА, чем в нормальной контрольной группе. Наиболее выраженные изменения были обнаружены в уровнях билирубина, при этом мыши RRV + anti-Ly6G показали снижение уровней TBIL, DBIL и IBIL при острой БА по сравнению с одним RRV. У мышей с хронической БА уровни TBIL, DBIL и IBIL были повышены (рис. 5), что указывает на то, что функция печени была значительно снижена на стадии хронического фиброза BA.
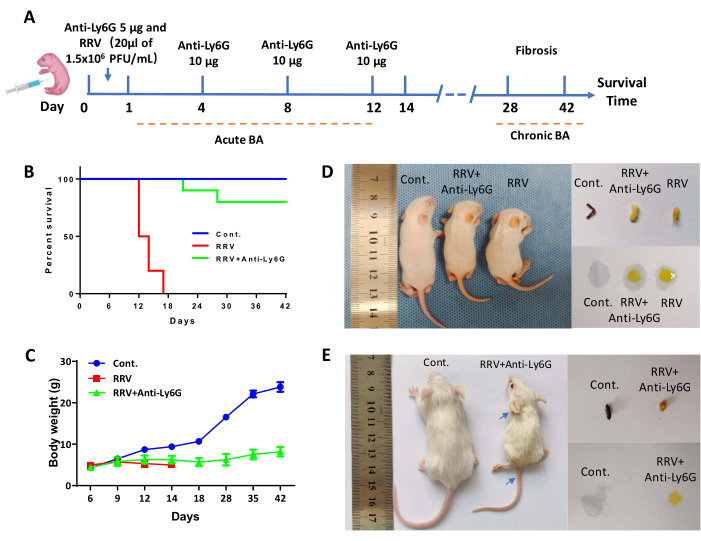
Рисунок 1: Эффекты лечения антителами против Ly6G на мышиной модели атрезии желчевыводящих путей, инфицированной RRV. (A) Схематическая иллюстрация низких доз антител для индуцирования острой и хронической фазы БА у мышей со стрелками, указывающими время инъекции антитела и RRV. (B) Кривые выживаемости мышей в группе нормального контроля (Cont.), группе резус-ротавируса (RRV) и группе антител RRV + анти-Ly6G. (C) Кривые массы тела мышей в каждой группе. (D) Репрезентативные изображения мышей, их фекалий и мочи в каждой группе на 12-й день. (E) Репрезентативные изображения мышей, их фекалий и мочи в каждой группе на 42-й день. Синими стрелками обозначены желтые уши и хвост. Этот рисунок был перепечатан с разрешения Zhang et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Влияние лечения антителами против Ly6G на печень в мышиной модели атрезии желчевыводящих путей, инфицированной RRV . (A) Сравнение анатомии печени и флуоресцентной ангиографии внепеченочных желчных протоков между хроническими мышами БА (справа) и нормальными мышами на 42-й день. (B) Сравнение размера печени у мышей с хроническим БА и нормальных мышей. Черный треугольник указывает на некроз печени у мышей с хронической БА. Белая звездочка указывает на внепеченочную билиарную атрезию. Этот рисунок был перепечатан с разрешения Zhang et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
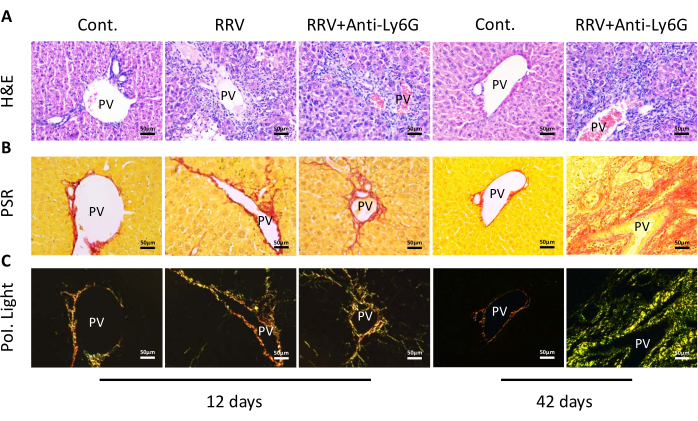
Рисунок 3: Срезы ткани печени мышей в группе нормального контроля (Cont.), группе резус-ротавируса (RRV) и группе антител RRV + против Ly6G на 12-й и 42-й день. (A) Изображения срезов ткани печени, окрашенных гематоксилином и эозином (H & E). (B) Окрашивание Sirius Red показало отложение коллагена (PSR). (C) Дальнейшее наблюдение за срезами с использованием микроскопии поляризованного света (Pol. Light). Аббревиатура: PV = воротная вена. Масштабная линейка = 50 мкм. Эта цифра была изменена по сравнению с Zhang et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
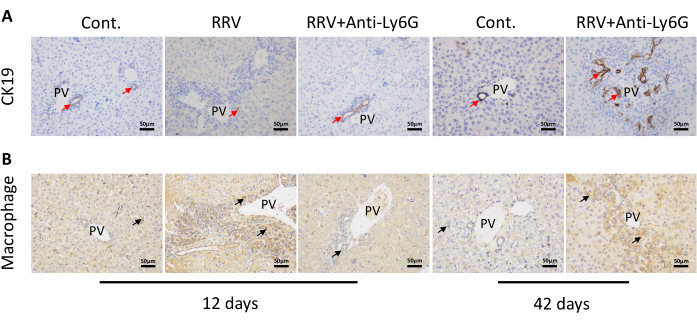
Рисунок 4: Иммуногистохимическое окрашивание срезов ткани печени из группы нормального контроля (Cont.), группы резус-ротавируса (RRV) и группы антител RRV + анти-Ly6G на 12-й и 42-й день . (A) Экспрессия маркера эпителиальных клеток желчных протоков (CK19) в разных группах лечения. (B) Воспалительная клеточная инфильтрация макрофагов была продемонстрирована в разных группах лечения. Аббревиатура: PV = воротная вена. Красная стрелка указывает на эпителиальные клетки желчных протоков. Черная стрелка указывает на макрофаги. Масштабная линейка = 50 мкм. Эта цифра была изменена по сравнению с Zhang et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
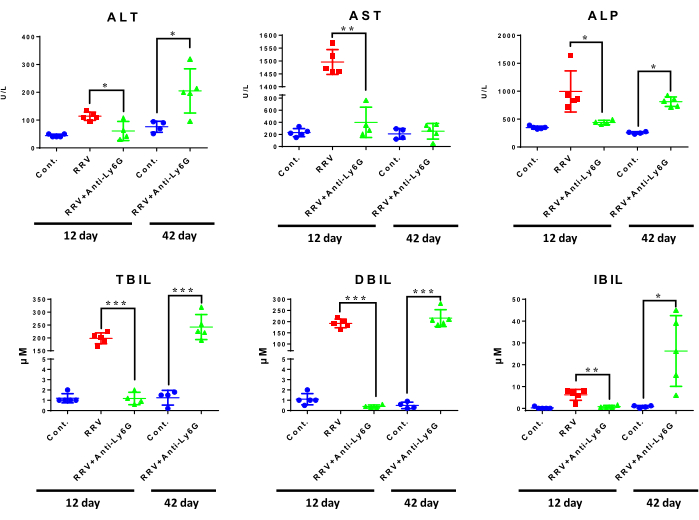
Рисунок 5: Сравнение функции печени у мышей в разных группах лечения. Кровь мышей была собрана после эксперимента и протестирована в лабораторном отделении больницы. Каждая группа содержала от трех до пяти мышей. *P < 0,05, **P < 0,01, ***P < 0,001. Сокращения: АЛТ = аланинаминотрансфераза; АСТ = аспартатаминотрансфераза; ALP = щелочная фосфатаза; TBIL = общий билирубин; DBIL = прямой билирубин; IBIL = непрямой билирубин. Эта цифра была изменена по сравнению с Zhang et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В нашем исследовании мы использовали антитела против Ly6G для устранения или уменьшения клеток Gr-1+ в мышиной модели атрезии желчевыводящих путей, инфицированной RRV, чтобы улучшить острый синдром БА, продлить выживаемость и позволить мышам БА войти в хроническую фазу. Снижение дозы антител может привести к хроническому БА с фиброзом печени, что свидетельствует о том, что количество клеток Gr-1+ изменяет результат БА в острой и хронической фазах. В нашем предыдущем исследовании количество клеток Gr-1+ было уменьшено после введения антитела против Ly6G, а общий статус выживаемости мышей BA был улучшен15. В то же время сообщалось, что макрофаги Gr-1+ 19, нейтрофилы Gr-1+ 20, миелоидные клетки Gr-1+ 21 и гранулоцитыGr-1+ могут усиливать фиброз на некоторых животных моделях22. Однако в этом исследовании клетки Gr-1+ у мышей были частично истощены низкими дозами антител против Ly6G, а отложения коллагена остались. В результате может потребоваться больше времени для более тщательного лечения заболевания.
Применение антитела против Ly6G уменьшало воспаление, частично сохраняло желчные протоки и предотвращало острую смерть, вызванную БА, у мышей. Однако только от 20% до 30% мышей вступили в хроническую фазу БА; это может быть связано с моментом времени и количеством инъекций антител против Ly6G. Нам необходимо продолжить изучение этого ключевого момента, чтобы повысить вероятность успеха. Кроме того, мы считаем, что важную роль могут играть не только клетки Gr-1+ , но и другие иммунные клетки, такие как NK-клетки, Т-клетки, В-клетки и макрофаги.
Что касается протокола, то здесь необходимо отметить некоторые детали. (i) Чтобы избежать утечки инъекционных наркотиков, мы используем инсулиновый шприц объемом 1 мл с иглой диаметром 0,33 мм, поскольку диаметр иглы небольшой, а отверстие иглы в шприце небольшое, что способствует снижению вероятности утечки лекарства. (ii) Перед инъекцией мышь должна быть зафиксирована, чтобы предотвратить ее движение, избежать утечки лекарственного средства и, таким образом, дополнительно обеспечить экспериментальный эффект. (iii) Во время инъекции препарата мы вводили лекарство на поверхность или нижний край печени мыши, насколько это возможно, чтобы лекарство попало в брюшную полость и полностью контактировало с печенью, чтобы вступить в силу. (iv) Инъекция обычно делается из верхней части правого бедра мыши, потому что желудок и селезенка новорожденной мыши находятся в левой части живота, а желудок полон молока. Если игла вводится с левой стороны, она может легко проколоть желудок, в результате чего молоко попадет в брюшную полость, или проколоть селезенку, вызвав кровотечение.
CD177 является гомологом Ly6G, и экспрессия CD177 у пациентов с БА была исследована. CD177 может быть использован в качестве маркера для ранней диагностики БА у детей, что указывает на то, что клетки CD177+ играют значительную роль в течении БА23. Проанализировав данные секвенирования РНК, наша команда обнаружила, что клетки CD177 были доминирующей популяцией клеток Gr-1+ ; между тем, мыши Cd177-/-BALB/ c, вакцинированные RRV, показали отсроченное начало БА и снижение заболеваемости и смертности18. Таким образом, наша модель хронической БА у мышей имеет очевидные преимущества для изучения патогенеза и прогрессирования заболевания БА; он также предоставляет подходящую модель животных для изучения потенциальных методов лечения БА.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Эта работа была поддержана грантами Национального фонда естественных наук Китая (81974056) для Р.З. и от Национального молодежного фонда природы Китая (82101808) и Проекта научно-технического планирования Гуанчжоу (No 202102020196) для З.Л.
Материалы
| Name | Company | Catalog Number | Comments |
| Balb/c mouse | Guangdong Skarjingda Biotechnology Co., LTD | 20221000112 | |
| rat anti-mouse Ly6G | Bio X Cell | clone 1A8 | West Lebanon, NH |
| rat anti-mouse cytokeratin 19 | Developmental Studies Hybridoma Bank | clone TROMA III | Iowa City, IA |
| rat anti-mouse F4/80 | R&D Systems | MAB5580 | Minneapolis, MN |
| RRV strain | ATCC | MMU 18006 | Manassas, VA |
| Fluorescent stereomicroscope | Olympus | SZX7 | |
| Leica light microscopy | Leica Microsystems | Leica DMI8+DFC7000T | Wetzlar, Germany |
| Hitachi Pre-Analytical Process Automation System | Hitachi | 7600 Clinical Analyzer | Tokyo, Japan |
| Isoflurane anesthetic | RWD | R510-22-10 | |
| Rhodamine 123 | Sigma-Aldrich | 83702 | |
| sirius red dye | Leagene | DC0041 | |
| paraffin microtome | Leica Microsystems | RM2235 | |
| neutral gum | Solarbio | G8590 |
Ссылки
- Lakshminarayanan, B., Davenport, M. Biliary atresia: A comprehensive review. Journal of Autoimmunity. 73, 1-9 (2016).
- Bassett, M. D., Murray, K. F. Biliary atresia: Recent progress. Journal of Clinical Gastroenterology. 42 (6), 720-729 (2008).
- Bezerra, J. A., et al. Biliary atresia: Clinical and research challenges for the twenty-first century. Hepatology. 68 (3), 1163-1173 (2018).
- Hartley, J. L., Davenport, M., Kelly, D. A. Biliary atresia. Lancet. 374 (9702), 1704-1713 (2009).
- Lee, W. S., Looi, L. M. Usefulness of a scoring system in the interpretation of histology in neonatal cholestasis. World Journal of Gastroenterology. 15 (42), 5326-5333 (2009).
- Russo, P., et al. Key histopathologic features of liver biopsies that distinguish biliary atresia from other causes of infantile cholestasis and their correlation with outcome: A multicenter study. The American Journal of Surgical Pathology. 40 (12), 1601-1615 (2016).
- Fickert, P., et al. Characterization of animal models for primary sclerosing cholangitis (PSC). Journal of Hepatology. 60 (6), 1290-1303 (2014).
- Sonoda, S., et al. Biliary atresia-specific deciduous pulp stem cells feature biliary deficiency. Stem Cell Research and Therapy. 12 (1), 582(2021).
- Xiao, Y., et al. Long noncoding RNA H19 contributes to cholangiocyte proliferation and cholestatic liver fibrosis in biliary atresia. Hepatology. 70 (5), 1658-1673 (2019).
- Desmet, V. J., Krstulović, B., Van Damme, B. Histochemical study of rat liver in alpha-naphthyl isothiocyanate (ANIT) induced cholestasis. The American Journal of Pathology. 52 (2), 401-421 (1968).
- Luo, Z., Shivakumar, P., Mourya, R., Gutta, S., Bezerra, J. A. Gene expression signatures associated with survival times of pediatric patients with biliary atresia identify potential therapeutic agents. Gastroenterology. 157 (4), 1138-1152 (2019).
- Mariotti, V., Strazzabosco, M., Fabris, L., Calvisi, D. F. Animal models of biliary injury and altered bile acid metabolism. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1864, 1254-1261 (2018).
- Egan, C. E., Sukhumavasi, W., Bierly, A. L., Denkers, E. Y. Understanding the multiple functions of Gr-1(+) cell subpopulations during microbial infection. Immunologic Research. 40 (1), 35-48 (2008).
- McDermott, A. J., et al. The role of Gr-1(+) cells and tumour necrosis factor-α signalling during Clostridium difficile colitis in mice. Immunology. 144 (4), 704-716 (2015).
- Zhang, R., et al. The role of neonatal Gr-1(+) myeloid cells in a murine model of rhesus-rotavirus-induced biliary atresia. The American Journal of Pathology. 188 (11), 2617-2628 (2018).
- Fu, M., et al. A silver nanoparticle method for ameliorating biliary atresia syndrome in mice. Journal of Visualized Experiments. (140), e58158(2018).
- Sy, J., Ang, L. C. Microtomy: Cutting formalin-fixed, paraffin-embedded sections. Methods in Molecular Biology. 1897, 269-278 (2019).
- Zhang, R., et al. CD177(+) cells produce neutrophil extracellular traps that promote biliary atresia. Journal of Hepatology. 77 (5), 1299-1310 (2022).
- Engel, D. R., et al. CX3CR1 reduces kidney fibrosis by inhibiting local proliferation of profibrotic macrophages. Journal of Immunology. 194 (4), 1628-1638 (2015).
- Liang, M., et al. A modified murine model of systemic sclerosis: Bleomycin given by pump infusion induced skin and pulmonary inflammation and fibrosis. Laboratory Investigation. 95 (3), 342-350 (2015).
- Chen, Y., et al. Differential effects of sorafenib on liver versus tumor fibrosis mediated by stromal-derived factor 1 alpha/C-X-C receptor type 4 axis and myeloid differentiation antigen-positive myeloid cell infiltration in mice. Hepatology. 59 (4), 1435-1447 (2014).
- Tomasson, M. H., et al. Fatal myeloproliferation, induced in mice by TEL/PDGFbetaR expression, depends on PDGFbetaR tyrosines 579/581. Journal of Clinical Investigation. 105 (4), 423-432 (2000).
- Zhang, R., Huang, J., Shan, J., Chen, Y., Xia, H. Peripheral blood CD177(+) cells as an early diagnostic marker for biliary atresia: A prospective multicentre study in pediatric patients with cholestasis. Journal of Hepatology. 77 (6), 1714-1716 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены