Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Полимеразная цепная реакция и дот-блот-гибридизация для обнаружения лептоспир в пробах воды
В этой статье
Резюме
В этом исследовании было разработано приложение точечного блоттинга для обнаружения лептоспир из трех основных клад в образцах воды. Этот метод позволяет идентифицировать минимальные количества ДНК, специфически нацеленные на зонд, меченный дигоксигенином, легко обнаруживаемые антителом к дигоксигенину. Этот подход является ценным и удовлетворительным инструментом для целей скрининга.
Аннотация
Дот-блот — это простой, быстрый, чувствительный и универсальный метод, который позволяет идентифицировать минимальное количество ДНК, специфически нацеленной на зондовую гибридизацию в присутствии ДНК-носителя. Он основан на переносе известного количества ДНК на инертную твердую основу, такую как нейлоновая мембрана, с использованием аппарата «точка-блот» и без электрофоретического разделения. Нейлоновые мембраны обладают высокой способностью связывания нуклеиновых кислот (400 мкг/см2), высокой прочностью и положительно или нейтрально заряжены. Используемый зонд представляет собой высокоспецифичный фрагмент одноцепочной ДНК длиной от 18 до 20 оснований, помеченный дигоксигенином (DIG). Зонд будет конъюгироваться с ДНК лептоспиры . После того, как зонд гибридизуется с целевой ДНК, он обнаруживается антителом против дигоксигенина, что позволяет легко обнаружить его по излучению, выявленному в рентгеновской пленке. Точки с излучением будут соответствовать интересующим фрагментам ДНК. В этом методе используется безизотопное мечение зонда, которое может иметь очень длительный период полураспада. Недостатком этой стандартной иммунометки является более низкая чувствительность, чем у изотопных зондов. Тем не менее, его смягчают с помощью полимеразной цепной реакции (ПЦР) и дотблот-анализов. Такой подход позволяет обогатить целевую последовательность и обнаружить ее. Кроме того, он может быть использован в качестве количественного применения при сравнении с серийным разбавлением хорошо известного стандарта. Здесь представлено приложение точечного блоттинга для обнаружения лептоспир из трех основных клад в пробах воды. Эта методология может быть применена к большому количеству воды после того, как они были концентрированы центрифугированием, чтобы предоставить доказательства наличия лептоспиральной ДНК. Это ценный и удовлетворительный инструмент для общих целей скрининга, который может быть использован для других бактерий, которые могут присутствовать в воде, улучшая понимание экосистемы.
Введение
Лептоспироз у человека в основном происходит из источников окружающей среды 1,2. Присутствие лептоспир в озерах, реках и ручьях является индикатором передачи лептоспироза среди диких животных, домашних и производственных животных, которые в конечном итоге могут вступать в контакт с этими водоемами 1,3,4. Кроме того, лептоспиры были обнаружены в неприродных источниках, включая сточные воды, стоячую и водопроводную воду 5,6.
Leptospira — это бактерия, распространенная во всем мире 7,8, и роль окружающей среды в ее сохранении и передаче хорошо известна. Лептоспиры могут выживать в питьевой воде при переменном рН и минералах9, а также в естественных водоемах1. Он также может выживать в течение длительного времени в дистиллированной воде10, а при постоянном pH (7,8) он может выживать до 152 дней11. Более того, лептоспиры могут взаимодействовать в бактериальных консорциумах, чтобы выжить в суровых условиях12,13. Он может быть частью биопленок в пресной воде с Azospirillum и Sphingomonas и даже способен расти и выдерживать температуры, превышающие 49 °C14,15. Он также может размножаться в переувлажненной почве и оставаться жизнеспособным до 379 дней16, сохраняя свою способность вызывать болезнь до17,18 года. Однако мало что известно об экологии в водоемах и о том, как она распределяется в них.
С момента открытия изучение рода Leptospira основывалось на серологических тестах. Только в нынешнем столетии молекулярные методы стали более распространенными в изучении этого спирохеты. Дот-блот практически не использовался для его идентификации с помощью (1) изотопного зонда, основанного на 16S рРНК и на межпростом повторе последовательности (ISSR)19,20, (2) в качестве иммуноферментного анализа на основе нанозолота для лептоспироза человека, применяемого к моче21, или (3) в качестве анализа на антитела для образцов мочи крупного рогатого скота22. Этот метод вышел из употребления, потому что изначально он был основан на изотопных зондах. Тем не менее, это хорошо известный метод, который в сочетании с ПЦР дает улучшенные результаты, и он считается безопасным из-за использования неизотопных зондов. ПЦР играет решающую роль в обогащении ДНК лептоспир путем амплификации определенного фрагмента ДНК, который может быть обнаружен в следовых количествах в образце. Во время каждого цикла ПЦР количество целевого фрагмента ДНК удваивается в реакции. В конце реакции ампликон умножается более чем в миллион раз23. Продукт, амплифицированный с помощью ПЦР, часто не видимый при агарозном электрофорезе, становится видимым при специфической гибридизации с DIG-меченым зондом в дот-блоте 24,25,26.
Метод дот-блоттинга прост, надежен и подходит для большого количества образцов, что делает его доступным для лабораторий с ограниченными ресурсами. Он использовался в различных исследованиях бактерий, включая (1) бактерииполости рта 27, (2) другие типы образцов, такие как пища и фекалии28, и (3) идентификацию некультивируемых бактерий29, часто в соответствии с другими молекулярными методами. Среди преимуществ, предлагаемых методом дот-блоттинга, можно выделить: (1) мембрана обладает высокой связывающей способностью, способной связывать более 200 мкг/см2 нуклеиновых кислот и до 400 мкг/см2; (2) результаты точечной блоттинга можно визуально интерпретировать без специального оборудования, и (3) их можно удобно хранить в течение многих лет при комнатной температуре (RT).
Род Leptospira был классифицирован на патогенные, промежуточные и сапрофитные клады30,31. Различие между этими кладами может быть достигнуто на основе конкретных генов, таких как lipL41, lipL32 и 16S рРНК. LipL32 присутствует в патогенных кладах и проявляет высокую чувствительность в различных серологических и молекулярных инструментах, в то время как у видов сапрофитов21 он отсутствует. Хозяйственный ген lipL41 известен своей стабильной экспрессией и используется в молекулярных методах32, в то время как ген 16S рРНК используется для их классификации.
Эта методика может применяться к большим объемам воды после их концентрирования центрифугированием. Он позволяет оценивать различные точки и глубины в водоеме для обнаружения присутствия лептоспиральной ДНК и клады, к которой она принадлежит. Этот инструмент ценен как для экологических, так и для общих целей скрининга, а также может быть использован для обнаружения других бактерий, которые могут присутствовать в воде.
Кроме того, ПЦР и дот-блоттинг технически и экономически доступны для широкого круга лабораторий, даже тех, в которых отсутствует сложное или дорогостоящее оборудование. Это исследование направлено на применение дот-блоттинга на основе дигоксигенина для идентификации трех клад лептоспир в пробах воды, собранных из природных водоемов.
Штаммы бактерий
В это исследование были включены двенадцать сероваров Leptospira (Autumnalis, Bataviae, Bratislava, Canicola, Celledoni, Grippothyphosa, Hardjoprajitno, Icterohaemorrhagiae, Pomona, Pyrogenes, Tarassovi и Wolffi). Эти серовары входят в коллекцию кафедры микробиологии и иммунологии факультета ветеринарной медицины и зоотехнии Национального автономного университета Мексики и в настоящее время используются в тесте на микроагглютинацию (MAT).
Все серовары Leptospira культивировали в EMJH, а их ДНК извлекали с помощью коммерческого набора для экстракции ДНК (см. Таблицу материалов). Геномная смесь ДНК двенадцати сероваров была использована в качестве положительного контроля патогенной клады Leptospira . В качестве положительного контроля промежуточной клады Leptospira была включена геномная ДНК из Leptospira fainei serovar Hurstbridge штамма BUT6, а в качестве положительного контроля для клады Leptospira saprophyte также была включена геномная ДНК Leptospira biflexa serovar Patoc штамма Patoc I.
Отрицательный контроль состоял из пустой плазмиды, ДНК неродственных бактерий (Ureaplasma urealyticum, Staphylococcus aureus, Brucella abortus, Salmonella typhimurium, Shigella boydii, Klebsiella pneumoniae, Acinetobacter baumannii и Escherichia coli) и воды ПЦР-класса, которая служила нешаблонным контролем.
Пробы воды
Двенадцать пробных лабораторных проб были собраны с использованием метода стратифицированно-случайного отбора проб из Научно-исследовательского центра биологии и аквакультуры Куэманко (CIBAC) (19° 16' 54" с.ш. 99° 6' 11" з.д.). Эти образцы были получены на трех глубинах: поверхностной, 10 и 30 см (рис. 1А, Б). Процедуры сбора воды не затронули ни один из исчезающих или охраняемых видов. Каждый образец собирали в стерильную микроцентрифужную пробирку объемом 15 мл. Для сбора образца каждую пробирку аккуратно погружали в воду, заполняли на выбранной глубине, а затем герметизировали. Образцы выдерживались при температуре 22 °C и оперативно транспортировались в лабораторию для обработки.
Каждый образец концентрировали центрифугированием в стерильных микроцентрифужных пробирках объемом 1,5 мл при плотности 8000 x g в течение 20 мин при комнатной температуре. Этот шаг повторялся до тех пор, пока все образцы не концентрировались в одной пробирке, которая затем использовалась для извлечения ДНК (рис. 1C).
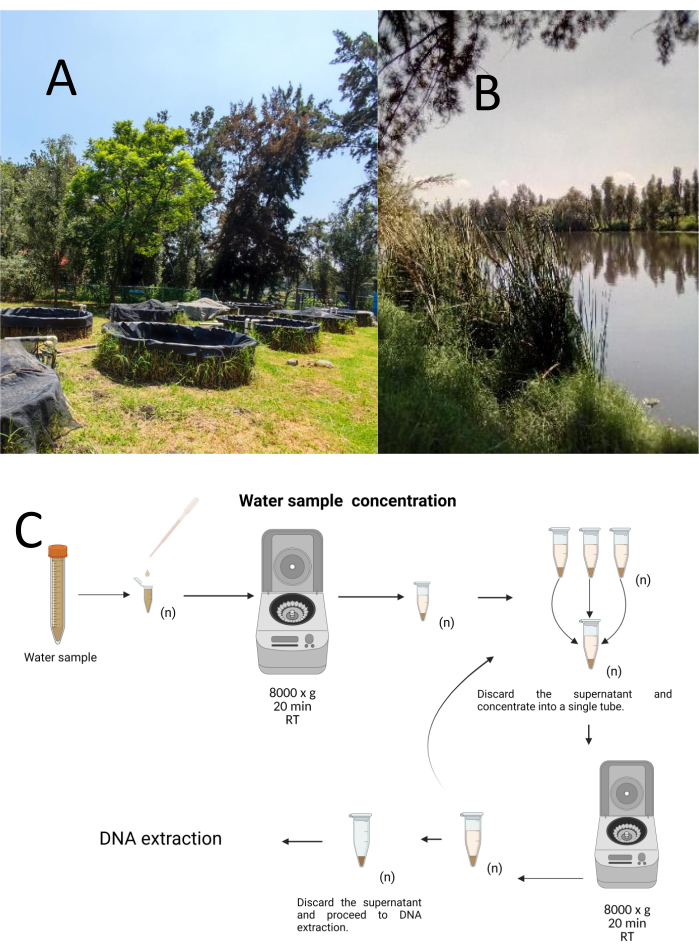
Рисунок 1: Концентрация проб воды центрифугированием. (A) Пруды для отбора проб воды и (B) Естественные ручьи. (C) Обработка проб воды на основе центрифугирования в повторяющихся стадиях столько раз, сколько необходимо (n). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Экстракция ДНК
Общую ДНК выделяли с помощью коммерческого набора геномной ДНК в соответствии с инструкциями производителя (см. Таблицу материалов). Экстракции ДНК элюировали в 20 мкл элюирующего буфера, а концентрацию ДНК определяли с помощью УФ-спектрофотометра при 260-280 нм и хранили при 4 °C до использования.
ПЦР-амплификация
Мишенями для ПЦР были 16генов S рРНК, lipL41 и lipL32, которые идентифицируют ДНК рода Leptospira и позволяют различать три клады: патогенную, сапрофитную и промежуточную. Как праймеры, так и конструкции зондов были основаны на предыдущих работах Ahmed et al., Azali et al., Bourhy et al., Weiss et al., и Branger et al.33,34,35,36,37. Последовательность каждого зонда, праймера и амплифицированного фрагмента описана в таблице 1, а их выравнивание с эталонными последовательностями приведено в дополнительном файле 1, дополнительном файле 2, дополнительном файле 3, дополнительном файле 4 и дополнительном файле 5. ПЦР-реагенты и условия термоциклирования описаны в разделе протокола.
Продукты амплификации визуализировали путем электрофоретического разделения на 1%-ном агарозном геле в ТАЭ (40 мМ трис-основание, 20 мМ уксусной кислоты и 1 мМ ЭДТА; рН 8,3) при 60 В в течение 45 мин с детектированием бромида этидия, как показано на дополнительном рисунке 1. В каждой ПЦР-реакции использовали геномную ДНК, полученную из каждого серовара, в концентрациях от 6 x 106 до 1 x 104 геномных эквивалентных копий (GEq), исходя из размера генома L. interrogans (4, 691, 184.н.)38 для патогенных лептоспир, размера генома L. biflexa (3, 956, 088.н.)39 для сапрофитных лептоспир, и размер генома L. fainei serovar Hurstbridge штамма BUT6 (4, 267, 324.н.) с номером присоединения AKWZ00000000.2.
Чувствительность зондов оценивали с помощью ДНК каждого патогенного серовара, L. biflexa serovar штамма Patoc I и L. fainei serovar Hurstbridge штамма BUT6 в каждом эксперименте. Для оценки специфичности ПЦР и дот-блот-гибридизации была включена ДНК неродственных бактерий.
Таблица 1: ПЦР-праймеры и зонды для амплификации продуктов для идентификации патогенных, сапрофитных и промежуточных клад Leptospira. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дот-блот-гибридизационный анализ
Этот метод называется точечным блоттингом, потому что отверстия, в которые помещается образец ДНК, имеют точечную форму, и когда их всасывают для фиксации на месте с помощью вакуумного отсасывания, они приобретают такую форму. Эта методика была разработана Kafatos et al.40. Этот метод позволяет проводить полуколичественное определение лептоспир в каждом ПЦР-положительном образце. Протокол состоит из денатурации NaOH 0,4 М при комнатной температуре, образцов с ДНК лептоспир от 30 нг до 0,05 нг, что соответствует 6 x 106 до 1 x 104 лептоспир, промокают на нейлоновую мембрану 96-луночным аппаратом dot-blot. После иммобилизации ДНК связывается с мембраной под воздействием ультрафиолетового излучения 120 мДж. Каждый зонд ДНК конъюгируют с дигоксигенином-11 dUTP на стадии катализа терминальной трансферазы на 3'-конце (дигоксигенин - растительный стероид, полученный из Digitalis purpurea, используемый в качестве репортера41). После строгой гибридизации меченого ДНК-зонда (50 пмоль) при определенной температуре на ДНК-мишень гибриды ДНК визуализируют с помощью хемилюминесцентной реакции с антителом против дигоксигенин-щелочной фосфатазы, ковалентно конъюгированным с его субстратом CSPD. Люминесценция фиксируется экспозицией рентгеновской пленки (рис. 2).
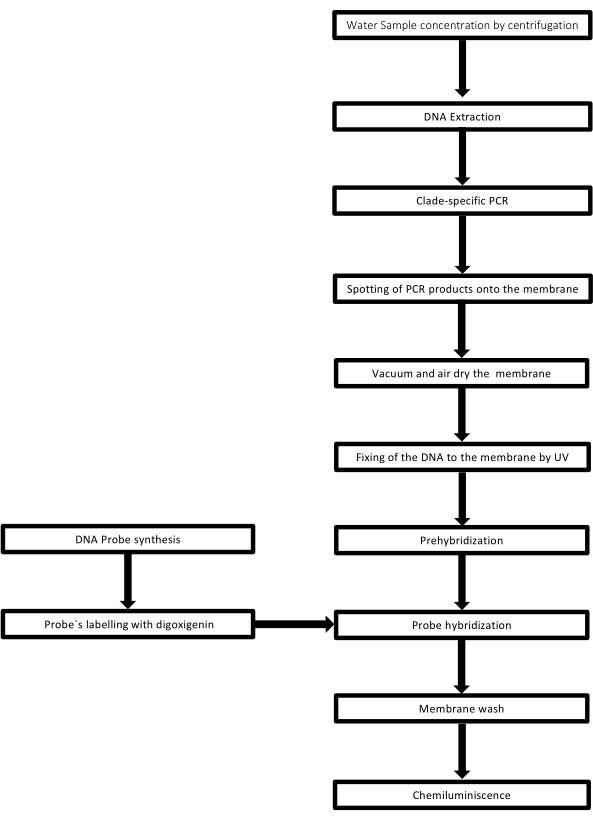
Рисунок 2: Этапы процедуры ПЦР-блоттинга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Подготовка образцов
- Сконцентрируйте каждую пробу воды в микроцентрифужных пробирках объемом 1,5 мл центрифугированием при 8 000 x g в течение 10 мин при 4 °C. Повторите этот шаг столько раз, сколько потребуется, чтобы сконцентрировать образец в объеме 250 мкл.
- Используйте набор для извлечения ДНК в соответствии с инструкциями производителя (см. Таблицу материалов).
- Выполните специфическую ПЦР в соответствии с используемым зондом dot-blot (таблица 1).
- Амплификацию проводят в ПЦР-пробирках с конечным объемом 25 мкл, содержащим 1 X буфер, 2,5 единицы Taq-полимеразы, 1 μM каждого праймера, 0,2 мМ каждого dNTP, 1,5 мМ MgCl2 и 100 нг целевой ДНК из каждого образца воды или референсной геномной ДНК.
- Запрограммируйте реакцию ПЦР в амплификаторе в соответствии с условиями термоциклирования (табл. 2).
- Храните реакции при температуре 4 °C до использования.
- Поместите 10 μл каждого продукта ПЦР для промакивания в отдельную лунку 96-луночного планшета.
- Добавьте 40 μл TE в каждую лунку и перемешайте пипетированием.
ПРИМЕЧАНИЕ: 96-луночный планшет можно запечатать и хранить при температуре 4 °C в течение ночи. Следуйте инструкциям, приведенным в дополнительном файле 6 , чтобы подготовить буферы и растворы для протокола. На рисунке 3 изображены этапы пробоподготовки.
Таблица 2: Условия термоциклирования ПЦР для генов 16S, lipL41 и lipL32. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
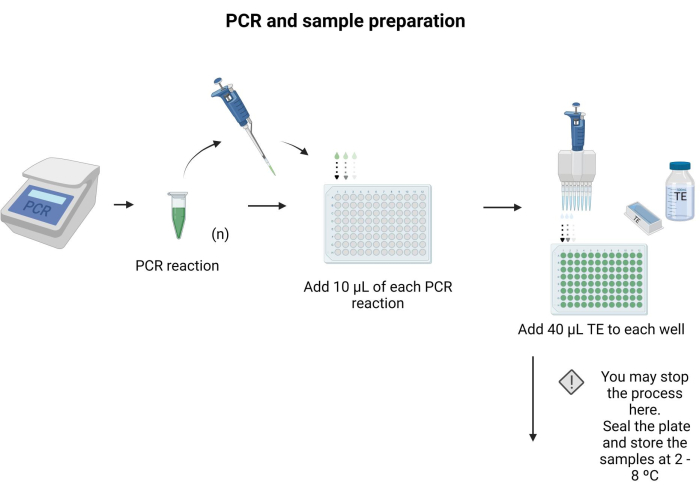
Рисунок 3: ПЦР и пробоподготовка. Применяя специфический протокол ПЦР, продукт ПЦР переносили в планшет для микротитрования, и в каждую лунку добавляли 40 мкл ТЭ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Сборка аппарата «точка-блот»
ПРИМЕЧАНИЕ: Сборка аппарата «точка-блот» показана на рисунке 4. Во время процедуры надевайте перчатки для работы со щелочными растворами и защищайте нейлоновую мембрану от загрязнения.
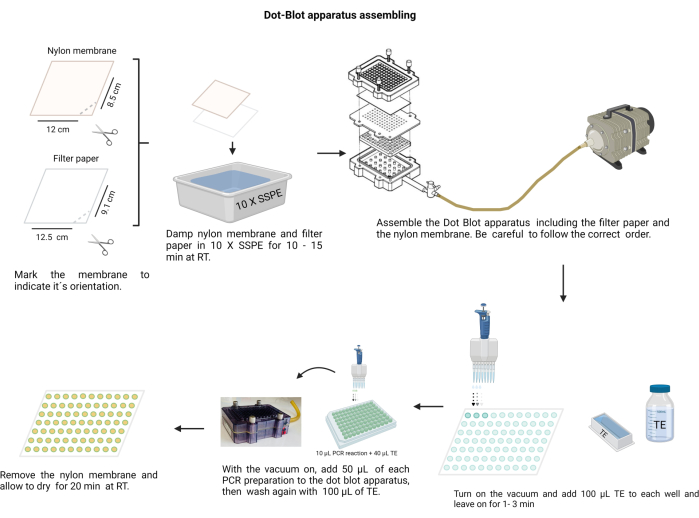
Иллюстрация 4: Сборка аппарата «Точка-блот». Фильтровальная бумага и нейлоновая мембрана (предварительно смоченная в 10 X SSPE) должны быть расположены в правильном порядке. Сборка должна быть плотно закреплена винтами перед включением вакуума. Каждую лунку необходимо промыть TE, и продукты ПЦР загружаются в соответствующие лунки. После пропускания продукта ПЦР через мембрану каждую лунку снова промывают TE и дают высохнуть. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Разрежьте нейлоновую мембрану (см. Таблицу материалов) и отфильтруйте бумагу на листы размером 12 х 8,5 см.
- Отметьте мембрану перманентным маркером.
- Сделайте ножницами выемку на одном краю, чтобы обозначить правильную ориентацию. Используйте метку, чтобы запомнить порядок образцов.
- Смочите мембрану и фильтровальную бумагу 10 X соляно-натрий-фосфатно-ЭДТА-буфером (SSPE; 3 M NaCl, 0,2 M2PO4 и 0,02 M EDTA, pH 7,4) (Дополнительный файл 6). Обработайте мембрану чистым пинцетом с тупым концом.
- Соберите камеру-блот; сначала фильтровальная бумага, затем мембрана поверх пластикового уплотнения. Закрепите крышку винтами крест-накрест.
- Подключите камеру к вакууму, поместите по 100 μл TE в каждую лунку, подержите вакуум в течение 1 минуты, а затем остановите его.
- Включите вакуум на низкой скорости и загрузите 50 мкл каждого образца в соответствующую лунку на мембране аппарата дот-блот (в соответствии с заданным распределением мембраны).
ПРИМЕЧАНИЕ: Гомогенизируйте каждый образец в 96-луночном планшете гемагглютинации перед помещением его в камеру с дот-блоттингом. - Дайте вакууму высохнуть мембрану. При необходимости осторожно ударьте по камере, чтобы выпустить пузырьки в образце.
- Промойте каждую лунку, поместив в нее 100 μл TE с непрерывным пылесосом и дав ему высохнуть.
ПРИМЕЧАНИЕ: После завершения перекачки крайне важно сначала выключить насос и отсоединить его. Невыполнение этого требования может привести к попаданию рефлюкса в аппарат. ДНК не нуждается в стадии денатурации, если используется положительно заряженная нейлоновая мембрана, но если используется другая инертная подложка, может потребоваться стадия предварительной денатурации и денатурация на основе щелочи41.
3. Денатурация и фиксация ДНК
ПРИМЕЧАНИЕ: На рисунке 5 показана процедура фиксации мембраны ДНК.
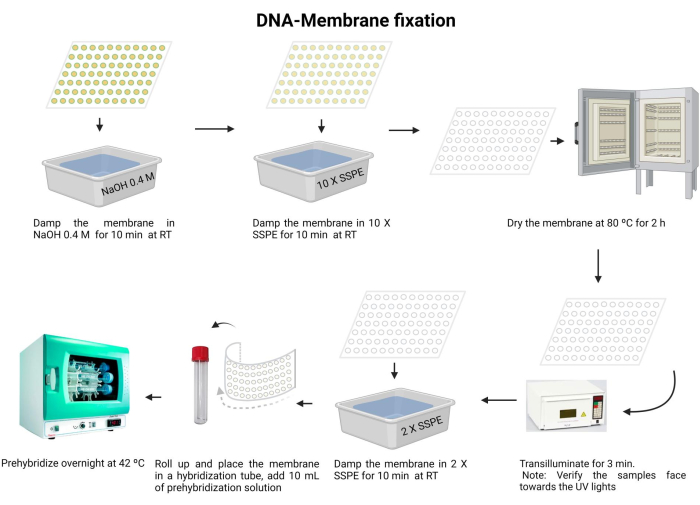
Рисунок 5: Процедура фиксации ДНК-мембраны. ДНК денатурируется в щелочном растворе. Затем его нейтрализуют 10 X SSPE, и мембрану сушат. Далее мембрана просвечивается. Мембрана регидратируется 2 X SSPE и предварительно гибридизуется в течение ночи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Инкубировать мембрану с 0,4 М NaOH в течение 10 мин при комнатной температуре.
- Уравновесьте мембрану 10 X SSPE в течение 10 минут при комнатной температуре.
- Высушите мембрану при 80 °C в течение 2 часов.
- Трансиллюминировать ультрафиолетовым светом 120 мДж в течение 3 мин. Убедитесь, что образцы ориентированы лицевой стороной вниз к источнику УФ-излучения. При использовании УФ-сшивающего агента убедитесь, что образцы обращены вверх, и повторите этот шаг дважды.
ПРИМЕЧАНИЕ: Мембрана должна быть полностью сухой перед УФ-сшивкой. ДНК будет иммобилизована ковалентной связью с нейлоновой мембраной. Каждое сшивание занимает от 18'' до 1', при этом оптимальная доза УФ-облучения для большинства экспериментов по гибридизации составляет примерно 0,6-0,8 кДж/м2.
Воздействие УФ-излучения вредно для глаз и кожи. Носите соответствующие средства защиты и избегайте контакта с голой кожей. - Промойте мембрану 2 X SSPE в течение 10 минут.
- Аккуратно сложите мембрану и вставьте ее в гибридизационную пробирку (используйте микроцентрифужную пробирку объемом 15 мл).
- Добавьте в пробирку 10 мл раствора для предварительной гибридизации (дополнительный файл 6) и инкубируйте при 42 °C в течение ночи. Убедитесь, что трубка хорошо герметизирована, чтобы предотвратить утечку.
4. Гибридизация
- Извлеките 5 мл раствора для предварительной гибридизации из пробирки для гибридизации. Чтобы использовать 5 мл во второй раз, держите его в другой пробирке и храните при температуре -4 °C.
- Добавьте 15 μл меченого зонда (табл. 1) в гибридизационную пробирку. Промойте наконечник в растворе, чтобы убедиться, что промаркированный зонд был тщательно введен в разведение.
ПРИМЕЧАНИЕ: Связывание ДНК-зонда не так сильно, как связывание антиген-антитело. Таким образом, изменения концентрации зонда или ДНК в образце могут влиять на интенсивность излучаемой флуоресценции. ДНК-зонды являются стехиометрическими, что означает, что количество молекул зонда, связанных с ДНК, эквивалентно количеству молекул ДНК, присутствующих в растворе. На рисунке 6 показана гибридизация зонда. - Инкубировать при 42 °C в течение ночи.
- Выполните ДНК-зондирование DIG-мечения. Следуйте инструкциям, указанным в таблице 3 , чтобы смешать реагенты, затем инкубируйте смесь при 37 °C в течение 1 ч. Затем добавьте 80 μL дистиллированной воды и храните хвостатый зонд при температуре 4 °C.
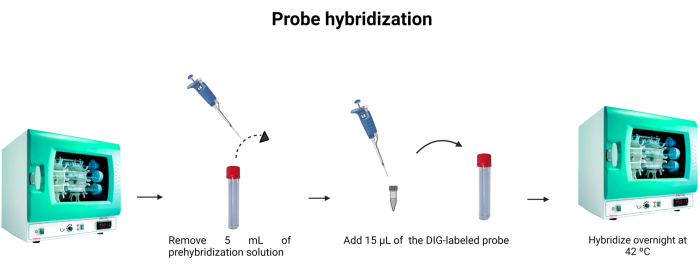
Рисунок 6: Гибридизация зондов. Объем буфера для гибридизации регулируется, и зонд, меченный дигоксигенином, включается, чтобы обеспечить гибридизацию зонда в течение ночи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 3: Реагенты для мечения зондов дигоксигенином (DIG). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
5. Хемилюминесценция (анти-DIG-мечение)
- Дважды промойте мембрану 2 X SSPE/0,1% SDS при комнатной температуре в течение 10 минут.
- Инкубировать мембрану с 5 X SSPE/0,1% SDS при температуре отжига зонда в течение 15 минут.
ПРИМЕЧАНИЕ: На этом этапе используйте контейнер с крышкой, чтобы поддерживать температуру как можно дольше. Обеспечьте равномерную и постоянную температуру по всей мембране. Приблизительный объем в каждой стирке составляет 100 мл указанного раствора. - Один раз промойте мембрану буфером 1 (дополнительный файл 6) при комнатной температуре в течение 5 минут.
- Один раз промыть мембрану буфером 2 (дополнительный файл 6) при комнатной температуре в течение 30 минут.
- Промойте мембрану буфером 2 и добавьте антитело против дигоксигенина (15 мкл) (см. Таблицу материалов), затем инкубируйте в течение 45 мин (время инкубации может варьироваться от 30 до 60 мин). Это вторичное антитело помечает зонд для обнаружения.
ПРИМЕЧАНИЕ: Мембрану можно хранить в буфере 2 с антителом против дигоксигенина в течение ночи при 4-8 °C. Анти-DIG-мечение процесса хемилюминесценции показано на рисунке 7.
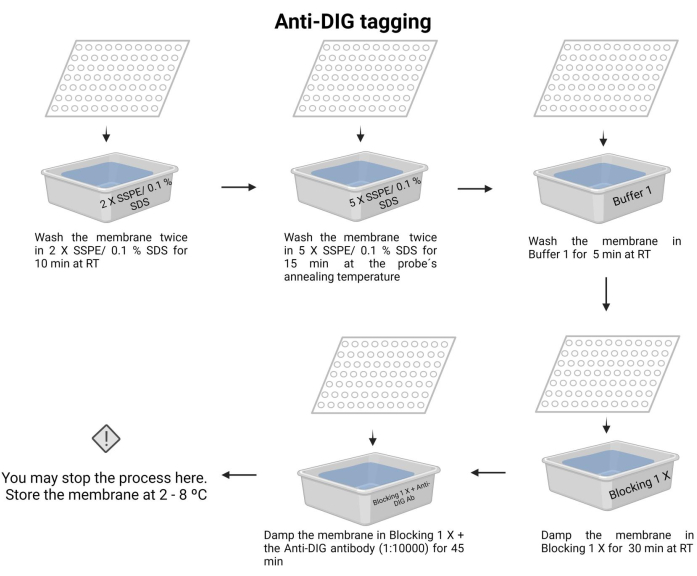
Рисунок 7: Анти-DIG-мечение процесса хемилюминесценции. Несвязанные нуклеиновые кислоты удаляют буферными растворами. Зонд выравнивается с целевой ДНК, и избыток удаляется. Мембрану блокируют блокирующим буфером 1 X и добавляют антитело против DIG (1:10000). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Хемилюминесценция (нанесение субстрата)
- Дважды промойте мембрану в буфере 1 при комнатной температуре в течение 15 минут.
- Простирайте один раз в буфере 3 (см. дополнительный файл 6) при комнатной температуре в течение 5 минут, позволяя мембране стечь большую часть буфера, оставляя его почти сухим.
- Добавьте готовый к применению CSPD (динатрий 3-(4-метоксиспиро {1,2-диоксетан-3,2'-(5'-хлор) трицикло [3.3.1.13,7] декан}-4-ил) фенилфосфат, см. Таблицу материалов) и оставьте на 5 минут (увлажненными пальцами гомогенизируйте CSPD с одной стороны на другую).
- Поместите мембрану в прозрачный пластиковый пакет (12,5 x 9 см), который соответствует размеру мембраны. Осторожно удалите пузырьки воздуха, равномерно распределите CSPD и запечатайте пакет.
- Инкубируйте мембрану на водяной бане при температуре 37 °C в течение 15 мин (это может быть до 30 мин) и убедитесь, что мембрана с образцами расположена вниз, чтобы она хорошо погрузилась. Следите за тем, чтобы температура оставалась постоянной и хорошо распределялась по мембране.
- Просушите полиэтиленовый пакет и закрепите его скотчем на уже использованной рентгенографической пленке. Это позволит легко работать во время процедуры экспонирования.
ПРИМЕЧАНИЕ: На рисунке 8 показано применение субстрата в процессе хемилюминесценции.

Иллюстрация 8: Применение субстрата в процессе хемилюминесценции. Свободное антитело удаляют, а субстрат CSPD (1:250) добавляют к мембране. Реакция активируется путем инкубации при 37 °C, а мембрана устроена так, чтобы записывать хемилюминесценцию в рентгеновскую пленку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Хемилюминесценция (обнаружение)
- Выполните процедуру экспонирования. В фотолаборатории приготовьте растворы проявителя и фиксатора (см. Таблицу материалов) в соответствующих лотках.
- В темноте осторожно поместите неподвижную мембрану лицом к новой рентгенографической пленке и вставьте ее в рентгенографическую кассету (см. Таблицу материалов).
- Зарегистрируйте время воздействия. Время воздействия может варьироваться от 1 мин до 30 мин и более. Начните с 5 минут и соответствующим образом отрегулируйте время.
- Замочите рентгеновскую пленку в растворе проявителя на 1-3 минуты и аккуратно промойте водопроводной водой (15-45 с).
- Замочите рентгеновскую пленку в растворе фиксатора на 1-3 минуты и аккуратно промойте водопроводной водой (45 с).
- Дайте рентгеновской пленке высохнуть на воздухе и задокументируйте анализ в видимом белом лайтбоксе.
ПРИМЕЧАНИЕ: Избегайте встряхивания мембраны во время рентгеновского воздействия. Процесс обнаружения показан на рисунке 9. - Переходим к интерпретации результата. В экспонированной рентгеновской пленке точки с излучением могут быть визуально расположены и соответствовать фрагментам ДНК с гибридизацией зонда. Интенсивность излучаемого сигнала зависит от люминесценции и длительности воздействия.
ПРИМЕЧАНИЕ: Мембраны можно хранить в сухом виде в фильтровальной бумаге в течение нескольких месяцев при комнатной температуре.
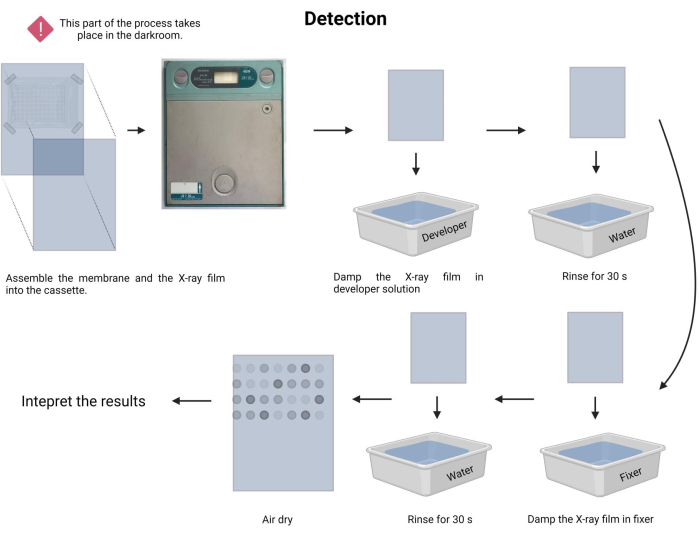
Рисунок 9: Обнаружение процесса хемилюминесценции. В темное время суток мембрана подвергается воздействию рентгеновской пленки внутри рентгеновской кассеты. Далее ей разрешили постоять во время экспозиции, а затем проявили и закрепили рентгеновскую пленку. Наконец, он был высушен на воздухе и интерпретирован. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
8. Процедура мембранной дегибридизации
- Дважды промыть мембрану в течение 10 мин дистиллированной водой.
- Промывайте мембрану в течение 20 минут 0,4 М NaOH при температуре 53 °C (дважды).
- Дважды промойте мембрану в течение 10 минут 2 X SSPE.
- Дайте мембране высохнуть при комнатной температуре.
- Сохраните мембрану и вернитесь к шагу 3.5 протокола.
ПРИМЕЧАНИЕ: Мембрану можно хранить в буфере для предварительной гибридизации в течение ночи при температуре 4-8 °C. На следующий день возобновите инкубацию при 42 °C в течение 1 часа, чтобы буфер предварительной гибридизации достиг температуры. Затем перейдите к шагу 3.5 протокола.
Результаты
Для оценки эффективности метода использовали геномную ДНК из чистых культур каждого серовара Leptospira , а также кладоспецифичный зонд. Мембраны получали с 100 нг геномной ДНК на ПЦР-реакцию для каждого серовара, за которым следовали восемь геномных ДНК неродственных бактерий и различ?...
Обсуждение
Критические этапы метода дотблоттинга включают (1) иммобилизацию ДНК, (2) блокирование свободных сайтов связывания на мембране негомологичной ДНК, (3) комплементарность между зондом и фрагментом-мишенью в условиях отжига, (4) удаление негибридизованного зонда и (5) обнаружение репортерной...
Раскрытие информации
Авторы заявляют, что конфликта интересов нет.
Благодарности
Мы в долгу перед коллекцией лептоспир кафедры микробиологии и иммунологии факультета ветеринарной медицины и зоотехнии Национального автономного университета Мексики. Мы благодарны за щедрое пожертвование эталонных штаммов Leptospira ; Leptospira fainei serovar Hurstbridge штамм BUT6 и Leptospira biflexa serovar Patoc штамм Patoc I доктору Алехандро де ла Пенья Моктесума. Мы благодарим д-ра Хосе Антонио Окампо Сервантеса, координатора CIBAC, и персонал за их материально-техническую поддержку. EDT проводился в рамках программы «Терминальный проект» для студентов бакалавриата Столичного автономного университета-кампуса Куаджимальпа. Мы признательны за Biorender.com программное обеспечение для создания рисунков 1 и 3-9.
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Purelink DNA extraction kit | Invitrogen | K182002 | |
| Gotaq Flexi DNA Polimerase (End-Point PCR Taq polymerase kit) | Promega | M3001 | |
| Whatman filter paper, grade 1, | Merk | WHA1001325 | |
| Nylon Membranes, positively charged Roll 30cm x 3 m | Roche | 11417240001 | |
| Anti-Digoxigenin-AP, Fab fragments Sheep Polyclonal Primary-antibody | Roche | 11093274910 | |
| Medium Base EMJH | Difco | S1368JAA | |
| Leptospira Enrichment EMJH | Difco | BD 279510 | |
| Blocking Reagent | Roche | 11096176001 | |
| CSPD ready to use Disodium 3-(4-methoxyspiro {1,2-dioxetane-3,2′-(5′-chloro) tricyclo [3.3.1.13,7] decan}8-4-yl) phenyl phosphate | Merk | 11755633001 | |
| Deoxyribonucleic acid from herring sperm | Sigma Aldrich | D3159 | |
| Developer Carestream | Carestream Health Inc | GBX5158621 | |
| Digoxigenin-11-ddUTP | Roche | 11363905910 | |
| EDTA, Disodium Salt (Dihydrate) | Promega | H5032 | |
| Ficoll 400 | Sigma Aldrich | F8016 | |
| Fixer Carestream | Carestream Health Inc | GBX 5158605 | |
| Lauryl sulfate Sodium Salt (Sodium dodecyl sulfate; SDS) C12H2504SNa | Sigma Aldrich | L5750 | |
| N- Lauroylsarcosine sodium salt CH3(CH2)10CON(CH3) CH2COONa | Sigma Aldrich | L-9150 | It is an anionic surfactant |
| Polivinylpyrrolidone (PVP-40) | Sigma Aldrich | PVP40 | |
| Polyethylene glycol Sorbitan monolaurate (Tween 20) | Sigma Aldrich | 9005-64-5 | |
| Sodium Chloride (NaCl) | Sigma Aldrich | 7647-14-5 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | 151-21-3 | |
| Sodium hydroxide (NaOH) | Sigma Aldrich | 1310-73-2 | |
| Sodium phosphate dibasic (NaH2PO4) | Sigma-Aldrich | 7558-79-4 | |
| Terminal transferase, recombinant | Roche | 3289869103 | |
| Tris hydrochloride (Tris HCl) | Sigma-Aldrich | 1185-53-1 | |
| SSPE 20X | Sigma-Aldrich | S2015-1L | It can be Home-made following Supplementary File 6 |
| Primers | Sigma-Aldrich | On demand | Follow table 1 |
| Probes | Sigma-Aldrich | On demand | Follow table 1 |
| Equipment | |||
| Nanodrop™ One Spectrophotometer | Thermo-Scientific | ND-ONE-W | |
| Refrigerated microcentrifuge Sigma 1-14K, suitable for centrifugation of 1.5 ml microcentrifuge tubes at 14,000 rpm | Sigma-Aldrich | 1-14K | |
| Disinfected adjustable pipettes, range 2-20 µl, 20-200 µl | Gilson | SKU:F167360 | |
| Disposable 1.5 ml microcentrifuge tubes (autoclaved) | Axygen | MCT-150-SP | |
| Disposable 600 µl microcentrifuge tubes (autoclaved) | Axygen | 3208 | |
| Disposable Pipette tips 1-10 µl | Axygen | T-300 | |
| Disposable Pipette tips 1-200 µl | Axygen | TR-222-Y | |
| Dot-Blot apparatus Bio-Dot | BIORAD | 1706545 | |
| Portable Hergom Suction | Hergom | 7E-A | |
| Scientific Light Box (Visible-light PH90-115V) | Hoefer | PH90-115V | |
| UV Crosslinker | Hoefer | UVC-500 | |
| Thermo Hybaid PCR Express Thermocycler | Hybaid | HBPX110 | |
| Radiographic cassette with IP Plate14 X 17 | Fuji |
Ссылки
- Bierque, E., Thibeaux, R., Girault, D., Soupé-Gilbert, M. E., Goarant, C. A systematic review of Leptospira in water and soil environments. PLOS One. 15 (1), e0227055 (2020).
- Haake, D. A., Levett, P. N. Leptospirosis in humans. Current Topics in Microbiology and Immunology. 387, 65-97 (2015).
- Tripathy, D. N., Hanson, L. E. Leptospires from water sources at Dixon Springs Agricultural Center. Journal of Wildlife Diseases. 9 (3), 209-212 (1973).
- Smith, D. J., Self, H. R. Observations on the survival of Leptospira australis A in soil and water. The Journal of Hygiene. 53 (4), 436-444 (1955).
- Karpagam, K. B., Ganesh, B. Leptospirosis: a neglected tropical zoonotic infection of public health importance-an updated review. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 39 (5), 835-846 (2020).
- Casanovas-Massana, A., et al. Spatial and temporal dynamics of pathogenic Leptospira in surface waters from the urban slum environment. Water Research. 130, 176-184 (2018).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003898 (2015).
- Mwachui, M. A., Crump, L., Hartskeerl, R., Zinsstag, J., Hattendorf, J. Environmental and behavioural determinants of Leptospirosis transmission: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003843 (2015).
- Andre-Fontaine, G., Aviat, F., Thorin, C. Waterborne Leptospirosis: Survival and preservation of the virulence of pathogenic Leptospira spp. in fresh water. Current Microbiology. 71 (1), 136-142 (2015).
- Trueba, G., Zapata, S., Madrid, K., Cullen, P., Haake, D. Cell aggregation: A mechanism of pathogenic Leptospira to survive in freshwater. International Microbiology: the Official Journal of the Spanish Society for Microbiology. 7 (1), 35-40 (2004).
- Smith, C. E., Turner, L. H. The effect of pH on the survival of leptospires in water. Bulletin of the World Health Organization. 24 (1), 35-43 (1961).
- Barragan, V. A., et al. Interactions of Leptospira with environmental bacteria from surface water. Current Microbiology. 62 (6), 1802-1806 (2011).
- Abdoelrachman, R. Comparative investigations into the influence of the presence of bacteria on the life of pathogenic and apathogenic leptospirae. Antonie van Leeuwenhoek. 13 (1), 21-32 (1947).
- Singh, R., et al. Microbial diversity of biofilms in dental unit water systems. Applied and Environmental Microbiology. 69 (6), 3412-3420 (2003).
- Kumar, K. V., Lall, C., Raj, R. V., Vedhagiri, K., Vijayachari, P. Coexistence and survival of pathogenic leptospires by formation of biofilm with Azospirillum. FEMS Microbiology Ecology. 91 (6), 051 (2015).
- Yanagihara, Y., et al. Leptospira Is an environmental bacterium that grows in waterlogged soil. Microbiology Spectrum. 10 (2), 0215721 (2022).
- Gillespie, R. W., Ryno, J. Epidemiology of leptospirosis. American Journal of Public Health and Nation’s Health. 53 (6), 950-955 (1963).
- Bierque, E., et al. Leptospira interrogans retains direct virulence after long starvation in water. Current Microbiology. 77 (10), 3035-3043 (2020).
- Zhang, Y., Dai, B. Marking and detection of DNA of leptospires in the dot-blot and situ hybridization with digoxigenin-labeled probes. Journal of West China University of Medical Sciences. 23 (4), 353-435 (1992).
- Mérien, F., Amouriaux, P., Perolat, P., Baranton, G., Saint Girons, I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. Journal of Clinical Microbiology. 30 (9), 2219-2224 (1992).
- Veerapandian, R., et al. Silver enhanced nano-gold dot-blot immunoassay for leptospirosis. Journal of Microbiological Methods. 156, 20-22 (2019).
- Junpen, S., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Ishmael, F. T., Stellato, C. Principles and applications of polymerase chain reaction: basic science for the practicing physician. Annals of Allergy, Asthma & Immunology: Official Publication of the American College of Allergy, Asthma, & Immunology. 101 (4), 437-443 (2008).
- Boerner, B., Weigelt, W., Buhk, H. J., Castrucci, G., Ludwig, H. A sensitive and specific PCR/Southern blot assay for detection of bovine herpesvirus 4 in calves infected experimentally. Journal of Virological Methods. 83 (1-2), 169-180 (1999).
- Curry, E., Pratt, S. L., Kelley, D. E., Lapin, D. R., Gibbons, J. R. Use of a Combined duplex PCR/Dot-blot assay for more sensitive genetic characterization. Biochemistry Insights. 1, 35-39 (2008).
- Pilatti, M. M., Ferreira, S. d. e. A., de Melo, M. N., de Andrade, A. S. Comparison of PCR methods for diagnosis of canine visceral leishmaniasis in conjunctival swab samples. Research in Veterinary Science. 87 (2), 255-257 (2009).
- Conrads, G., et al. PCR reaction and dot-blot hybridization to monitor the distribution of oral pathogens within plaque samples of periodontally healthy individuals. Journal of Periodontology. 67 (10), 994-1003 (1996).
- Langa, S., et al. Differentiation of Enterococcus faecium from Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus strains by PCR and dot-blot hybridisation. International Journal of Food Microbiology. 88 (2-3), 197-200 (2003).
- Francesca, C., Lucilla, I., Marco, F., Giuseppe, C., Marisa, M. Identification of the unculturable bacteria Candidatus arthromitus in the intestinal content of trouts using dot-blot and Southern blot techniques. Veterinary Microbiology. 156 (3-4), 389-394 (2012).
- Arent, Z., Pardyak, L., Dubniewicz, K., Plachno, B. J., Kotula-Balak, M. Leptospira taxonomy: then and now. Medycyna Weterynaryjna. 78 (10), 489-496 (2022).
- Thibeaux, R., et al. Biodiversity of environmental Leptospira: Improving identification and revisiting the diagnosis. Frontiers in Microbiology. 9, 816 (2018).
- Carrillo-Casas, E. M., Hernández-Castro, R., Suárez-Güemes, F., de la Peña-Moctezuma, A. Selection of the internal control gene for real-time quantitative RT-PCR assays in temperature treated Leptospira. Current Microbiology. 56 (6), 539-546 (2008).
- Azali, M. A., Yean Yean, C., Harun, A., Aminuddin Baki A, N. N., Ismail, N. Molecular characterization of Leptospira spp. in environmental samples from North-Eastern Malaysia revealed a pathogenic strain, Leptospira alstonii. Journal of Tropical Medicine. 2016, 2060241 (2016).
- Ahmed, N., et al. Multilocus sequence typing method for identification and genotypic classification of pathogenic Leptospira species. Annals of Clinical Microbiology and Antimicrobials. 5, 28 (2006).
- Bourhy, P., Collet, L., Brisse, S., Picardeau, M. Leptospira mayottensis sp. nov., a pathogenic species of the genus Leptospira isolated from humans. International Journal of Systematic and Evolutionary Microbiology. 64, 4061-4067 (2014).
- Weiss, S., et al. An extended Multilocus Sequence Typing (MLST) scheme for rapid direct typing of Leptospira from clinical samples. PLOS Neglected Tropical Diseases. 10 (9), e0004996 (2016).
- Branger, C., et al. Polymerase chain reaction assay specific for pathogenic Leptospira based on the gene hap1 encoding the hemolysis-associated protein-1. FEMS Microbiology Letters. 243 (2), 437-445 (2005).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLOS One. 3 (2), e1607 (2008).
- Kafatos, F. C., Jones, C. W., Efstratiadis, A. Determination of nucleic acid sequence homologies and relative concentrations by a dot hybridization procedure. Nucleic Acids Research. 7 (6), 1541-1552 (1979).
- Bhat, A. I., Rao, G. P. Dot-blot hybridization technique. Characterization of Plant Viruses. , 303-321 (2020).
- Yadav, J. P., Batra, K., Singh, Y., Singh, M. Comparative evaluation of indirect-ELISA and Dot-blot assay for serodetection of Mycoplasma gallisepticum and Mycoplasma synoviae antibodies in poultry. Journal of Microbiological Methods. 189, 106317 (2021).
- Malinen, E., Kassinen, A., Rinttilä, T., Palva, A. Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology. 149, 269-277 (2003).
- Wyss, C., et al. Treponema lecithinolyticum sp. nov., a small saccharolytic spirochaete with phospholipase A and C activities associated with periodontal diseases. International Journal of Systematic Bacteriology. 49, 1329-1339 (1999).
- Shah, J. S., I, D. C., Ward, S., Harris, N. S., Ramasamy, R. Development of a sensitive PCR-dot-blot assay to supplement serological tests for diagnosing Lyme disease. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 37 (4), 701-709 (2018).
- Niu, C., Wang, S., Lu, C. Development and evaluation of a dot-blot assay for rapid determination of invasion-associated gene ibeA directly in fresh bacteria cultures of E. coli. Folia microbiologica. 57 (6), 557-561 (2012).
- Wetherall, B. L., McDonald, P. J., Johnson, A. M. Detection of Campylobacter pylori DNA by hybridization with non-radioactive probes in comparison with a 32P-labeled probe. Journal of Medical Microbiology. 26 (4), 257-263 (1988).
- Kolk, A. H., et al. Detection of Mycobacterium tuberculosis in clinical samples by using polymerase chain reaction and a nonradioactive detection system. Journal of Clinical Microbiology. 30 (10), 2567-2575 (1992).
- Scherer, L. C., et al. PCR colorimetric dot-blot assay and clinical pretest probability for diagnosis of Pulmonary Tuberculosis in smear-negative patients. BMC Public Health. 7, 356 (2007).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist Reviews. 29, S49-S52 (2008).
- Zhang, Y., Dai, B. Detection of Leptospira by dot-blot hybridization with photobiotin- and 32P-labeled DNA. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 130-132 (1992).
- Terpstra, W. J., Schoone, G. J., ter Schegget, J. Detection of leptospiral DNA by nucleic acid hybridization with 32P- and biotin-labeled probes. Journal of Medical Microbiology. 22 (1), 23-28 (1986).
- Shukla, J., Tuteja, U., Batra, H. V. DNA probes for identification of leptospires and disease diagnosis. The Southeast Asian Journal of Tropical Medicine and Public Health. 35 (2), 346-352 (2004).
- Jiang, N., Jin, B., Dai, B., Zhang, Y. Identification of pathogenic and nonpathogenic leptospires by recombinant probes. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 26 (1), 1-5 (1995).
- Fach, P., Trap, D., Guillou, J. P. Biotinylated probes to detect Leptospira interrogans on dot-blot hybridization or by in situ hybridization. Letters in Applied Microbiology. 12 (5), 171-176 (1991).
- Huang, N., Dai, B. Assay of genomic DNA homology among strains of different virulent leptospira by DNA hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 122-125 (1992).
- Dong, X., Dai, B., Chai, J. Homology study of leptospires by molecular hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (1), 1-4 (1992).
- Komminoth, P. Digoxigenin as an alternative probe labeling for in situ hybridization. Diagnostic Molecular Pathology: The American Journal of Surgical Pathology, part B. 1 (2), 142-150 (1992).
- Saengjaruk, P., et al. Diagnosis of human leptospirosis by monoclonal antibody-based antigen detection in urine. Journal of Clinical Microbiology. 40 (2), 480-489 (2002).
- Okuda, M., et al. Enzyme-linked immunosorbent assay for the detection of canine Leptospira antibodies using recombinant OmpL1 protein. The Journal of Veterinary Medical Science. 67 (3), 249-254 (2005).
- Suwimonteerabutr, J., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Kanagavel, M., et al. Peptide-specific monoclonal antibodies of Leptospiral LigA for acute diagnosis of leptospirosis. Scientific reports. 7 (1), 3250 (2017).
- Levett, P. N. Leptospirosis. Clinical Microbiology Reviews. 14 (2), 296-326 (2001).
- Monahan, A. M., Callanan, J. J., Nally, J. E. Proteomic analysis of Leptospira interrogans shed in urine of chronically infected hosts. Infection and Immunity. 76 (11), 4952-4958 (2008).
- Rojas, P., et al. Detection and quantification of leptospires in urine of dogs: a maintenance host for the zoonotic disease leptospirosis. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 29 (10), 1305-1309 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены