Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка выработки глюкозы в печени, уреагенеза и липолиза с использованием модели перфузионной печени мышей
В этой статье
Резюме
В данной работе мы представляем надежный метод перфузии печени мышей in situ для изучения острой и прямой регуляции метаболизма печени без нарушения печеночной архитектуры, но при отсутствии внепеченочных факторов.
Аннотация
Печень выполняет множество функций, включая метаболизм питательных веществ. В отличие от других моделей исследования печени in vitro и in vivo , изолированная перфузионная печень позволяет изучать биологию и метаболизм печени в целом печени с интактной печеночной архитектурой, отделенной от влияния внепеченочных факторов. Перфузии печени были первоначально разработаны для крыс, но метод был адаптирован и к мышам. Здесь мы опишем протокол перфузии печени мыши in situ . Печень перфузируется антеградно через воротную вену оксигенированным бикарбонатным буфером Кребса-Хензелейта, а выход собирается из надпеченочной нижней полой вены с пережатием подпеченочной нижней полой вены для замыкания контура. С помощью этого метода можно оценить прямое воздействие исследуемого соединения на печень с подробным временным разрешением. Функция и жизнеспособность печени стабильны в течение, по крайней мере, 3 ч, что позволяет включить внутренний контроль в тот же эксперимент. Экспериментальные возможности с использованием этой модели многочисленны и могут помочь понять физиологию печени и ее заболевания.
Введение
Печень является важным органом в обмене веществ. Он играет ключевую роль в контроле энергетического баланса всего организма, регулируя метаболизм глюкозы, липидов и аминокислот. Рост числа заболеваний печени во всем мире становится серьезным глобальным бременем для здравоохранения, и необходимо больше знаний о патофизиологии и ее последствиях для функций печени.
Для исследований печени были разработаны различные модели in vitro, дополняющие исследования in vivo. Широко используются выделенные и культивируемые первичные гепатоциты грызунов и человека. Непаренхиматозные клетки могут быть отделены от гепатоцитов с помощью дифференциального и градиентного центрифугирования, а совместное культивирование различных типов клеток полезно для изучения межклеточных перекрестных помех1. Несмотря на то, что первичные гепатоциты человека считаются золотым стандартом для тестирования токсичности лекарств, несколько исследований показали, что гепатоциты быстро дедифференцируются в культуре тканей, что приводит к потере функций печени 2,3,4. Культивирование гепатоцитов в 3D-сфероидной системе улучшает дифференцировку, более стабильно и, по-видимому, имитирует печень in vivo в большей степени, чем традиционные 2D-системы культивирования. Точно вырезанные срезы печени являются еще одной хорошо зарекомендовавшей себя моделью in vitro, которая сохраняет тканевую архитектуру нетронутой и содержит непаренхиматозные клетки, присутствующие в печени6. К более продвинутым моделям in vitro относятся печень на чипе7 и органоиды печени8. Однако при всех этих подходах происходит потеря структурной целостности и динамики потока, в том числе векторного потока в портально-печеночных венах, что, вероятно, влияет на обобщаемость.
Изолированная перфузионная печень крысы была впервые описана Клодом Бернаром в 1855 году и до сих пор используется в различных научных областях для изучения биологии, токсикологии и патофизиологии печени. Преимущества перфузии печени по сравнению с вышеупомянутыми моделями in vitro включают сохранение печеночной архитектуры, сосудистого потока, полярности и зональности гепатоцитов, а также взаимодействия между гепатоцитами и непаренхиматозными клетками. По сравнению с исследованиями in vivo, перфузионная печень позволяет изучать метаболизм печени изолированно, избегая внепеченочных факторов, переносимых кровью, и с полным контролем над условиями эксперимента. В течение10,11,12,13 лет было сделано несколько модификаций для улучшения модели перфузии печени крыс. Несмотря на то, что для изолированных исследований перфузионной печени использовались мыши, литературы по ним меньше. В данной работе мы представляем метод перфузии печени мышей in situ путем канюляции воротной вены и надпеченочной полой вены для изучения острых и прямых метаболических реакций на метаболические субстраты и гормоны, измеренных в печеночном венозном стоке из печени мыши в режиме реального времени.
протокол
Все эксперименты на животных проводились с разрешения Датской инспекции по экспериментам на животных, Министерства окружающей среды и продовольствия Дании (разрешение 2018-15-0201-01397) и местного комитета по этике в соответствии с директивой ЕС 2010/63/EU, Национальными институтами здравоохранения (публикация No 85-3) и в соответствии с руководящими принципами датского законодательства, регулирующего эксперименты на животных (1987 г.). Это терминальная процедура, а причиной смерти является обескровливание и перфорация диафрагмы под глубоким наркозом.
1. Подопытные животные
- Получить мышей нужной линии, возраста и пола. В этом исследовании использовались мыши-самцы C57BL/6JRj в возрасте 11-16 недель. Содержате до 5 самцов или 8 самок мышей в клетке с неограниченным доступом к корму и воде и поддерживайте цикл 12 часов / 12 часов света и темноты с включенным освещением с 6 утра до 6 вечера.
2. Предоперационная подготовка
- Сделать буфер для перфузии печени.
- Буфер Кребса-Хенселейта. Смешайте и растворите 118 ммоль/л NaCl, 4,7 ммоль/л KCl, 1,2 ммоль/лMgSO4 и 1,2 ммоль/л KH 2 PO4 в dH 2 O. Растворите 1,25 ммоль/л CaCl2в отдельном стакане и добавьте буфер.
- Растворите 25 ммоль/л NaHCO3 и медленно добавляйте в буфер, помешивая. Храните буфер при температуре 4 градуса. Буфер стабилен не менее 1 месяца.
ПРИМЕЧАНИЕ: Осаждение может произойти, если CaCl2 и NaHCO3 не растворяются по отдельности перед добавлением.
- Отфильтруйте перфузионный буфер через фильтр 2 мкм и отрегулируйте pH до 7,5 с помощью HCl.
ПРИМЕЧАНИЕ: Этот шаг следует выполнять в день эксперимента, так как рН со временем увеличивается, даже при хранении в закрытых колбах. - Приготовьте испытуемые соединения в концентрации, превышающей желаемую конечную концентрацию (например, 20-кратную концентрацию при инфузии со скоростью 0,175 мл/мин с помощью насоса-манипулятора) в отфильтрованном перфузионном буфере Кребса-Хензелейта с регулируемым pH. При необходимости разбавляют испытуемые соединения в перфузионном буфере Кребса-Хензелейта с добавлением 1% БСА в качестве носителя (чтобы избежать адгезии к трубкам и стеклянной посуде, необходимой для всех пептидов), фильтруют через фильтр соответствующего размера.
3. Операция и перфузия
ПРИМЕЧАНИЕ: Иллюстрация перфузионной установки, используемой в этом исследовании, представлена на рисунке 1.
- Газируйте перфузионный буфер (95% O 2, 5% CO2) в течение не менее 30 минут, чтобы обеспечить печень достаточным количеством кислорода и поддерживать правильный pH с начала операции (бикарбонатная буферная система достигнет pH 7,4 при непрерывном газообразовании, см. дополнительный рисунок 1).
- Обезболить мышь путем введения кетамина (90 мг/кг) и ксилазина (10 мг/кг) путем внутрибрюшинной инъекции.
- Положите мышь лежа на нагретом операционном столе и подтвердите отсутствие рефлексов в ответ на защемление пальца ноги. Спрейте с 70% этанолом, чтобы волосы не прилипали к ножницам. Фиксация мыши на теплой поверхности помогает повысить устойчивость для следующих процедур.
- Сделайте надрез ножницами у основания живота и разрежьте вверх до грудной клетки с обеих сторон, чтобы обнажить брюшную полость. Сдвиньте кишечник вправо с помощью ватного тампона, обнажив воротную вену.
- Поместите две лигатуры под воротную вену с помощью изогнутых щипцов и подготовьте свободный узел для каждой лигатуры.
- Введите катетер 0,7 мм в воротную вену. При перфорации извлеките иглу из катетера и проведите катетер через вену до тех пор, пока кончик катетера не окажется близко к печени, как показано на рисунке 2. Кровь поступает в катетер.
- Затяните лигатуры. Если катетер не заполнен кровью, заполните его перфузионным буфером, чтобы избежать попадания пузырьков воздуха.
- Присоедините перфузионную трубку и начните перфузию печени с помощью бикарбонатного буфера Krebs-Henseleit при 37 °C, запустив роликовый насос со скоростью потока перфузии 0,8 мл/мин. Печень бледнеет в течение нескольких секунд.
- Разрежьте грудную клетку и диафрагму с помощью ножниц. В этот момент животное усыпляют. Поместите лигатуру под надпеченочную нижнюю полую вену с помощью тонких точечных щипцов. Положите ручку, свернутую марлю или другой одноразовый предмет под заднюю часть мыши, чтобы сделать вену более доступной.
- Ввести катетер в надпеченочную нижнюю полую вену через правое предсердие сердца. При перфорации извлеките иглу из катетера и проведите катетер через вену до тех пор, пока кончик катетера не приблизится к печени. Кровь и перфузионный буфер заканчиваются сразу.
- Затяните лигатуру и присоедините трубку для сбора перфузионных стоков. Закрепите все трубки водонепроницаемой лентой (гладкой лентой или аналогичной).
- Используйте адаптер сосудистого зажима, чтобы разместить сосудистый зажим поперек подпечочной полой вены непосредственно над правой почечной веной, чтобы предотвратить смешивание (Рисунок 2).
- Увеличьте скорость потока перфузии до 3,5 мл/мин и запустите таймер. Запустите запись давления. Успешная перфузия обычно приводит к давлению ~10 мм/рт.
- Накройте печень стерильной простыней, смоченной физиологическим раствором, и добавляйте физраствор во время эксперимента, чтобы она не пересыхала.
- Соберите перфузионные стоки в течение 1 минуты и измерьте объем. Объем должен составлять примерно 3,5 мл/мин. Примесь крови на этом этапе не ожидается, и сердце больше не качает.
- Подождите 30 минут перед началом эксперимента.
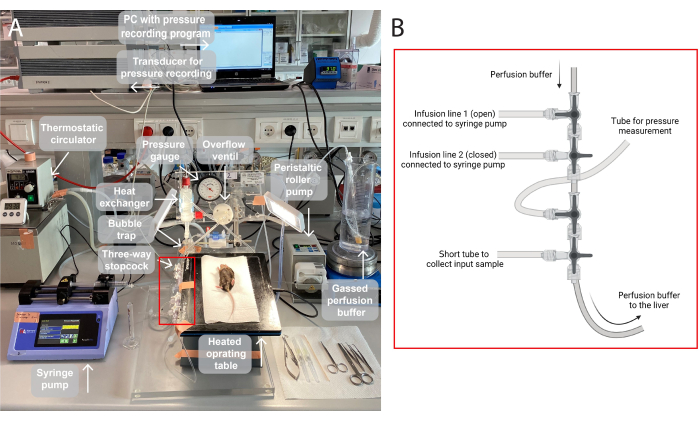
Рисунок 1: Иллюстрация перфузионной установки. (A) Операционный стол поднимается на штативную подставку и нагревается до 37 °C. Перфузионный буфер газируется (95% O 2, 5% CO2), перекачивается перистальтическим роликовым насосом и нагревается в теплообменнике с помощью встроенной пузырьковой ловушки. Кроме того, система состоит из манометра и шпиндельного насоса для регулировки давления перфузии. Перфузионное давление непрерывно регистрируется и визуализируется с помощью датчика на ПК, программы регистрации давления. (B) Красная рамка фиксирует соединения трехходовых запорных кранов. Первый трехходовой запорный кран открыт для инфузии испытуемого соединения через шприцевой насос, а второй закрыт. Третий открыт для непрерывных измерений давления. Четвертый запорный кран может быть использован для сбора входных проб, например, для анализа газов в перфузионной печени. Коннекторы могут быть модифицированы по мере необходимости для конкретных экспериментов, требующих большего или меньшего количества инфузионных линий. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
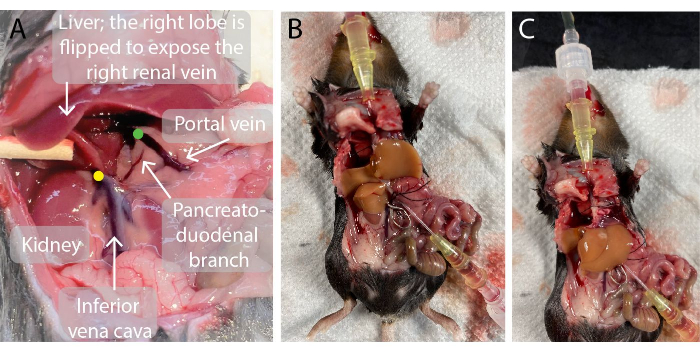
Рисунок 2: Фотографии брюшной полости мыши до и во время перфузии печени. (A)Зеленая точка указывает на расположение кончика катетера воротной вены. Важно, чтобы кончик катетера располагался чуть ниже точки разветвления воротной вены в левую и правую воротные вены печени, но выше панкреато-дуоденальной ветви, чтобы избежать утечки. Желтая точка указывает на правильное расположение сосудистого зажима на подпечочной нижней полой вене между правой почечной веной и печенью, чтобы избежать обратного тока крови в перфузированную печень. (В, В) Перфузионная печень мыши с двумя катеттерами, введенными в воротную вену (В) и надпеченочную нижнюю полую вену (С) и сосудистым зажимом на подпечочной нижней полой вене (В). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Экспериментируйте
- Начните эксперимент со сбора первых исходных образцов с помощью сборщика дробей в конце периода равновесия. Соберите пробы через нужный интервал времени и сразу же положите их на лед.
- Регулярно проверяйте пузырьковую ловушку и заполняйте ее перфузионным буфером, когда она близка к опорожнению.
- Отбирают образец буфера через трехходовой запорный кран непосредственно перед его попаданием в орган и из собирательного катетера, введенного в нижнюю полую вену (после его перфузии через печень).
- Измерьте образцы с помощью анализатора газов крови, чтобы подтвердить, что орган метаболически активен (на это указывает повышение парциального давленияСО2 и снижение рН).
- Повторите шаги 4.3-4.4 в конце эксперимента, чтобы оценить жизнеспособность на протяжении всего эксперимента (дополнительный рисунок 2).
ПРИМЕЧАНИЕ: Снижение парциального давления кислорода не обеспечивает надежного измерения дыхания из-за потерь кислорода из трубки, органа и т.д. - Через 15 минут исходной перфузии начните первую стимуляцию, введя исследуемое вещество через трехходовой запорный кран с желаемой скоростью потока с помощью шприцевого насоса (например, 20-кратная концентрация исследуемого вещества при инфузии со скоростью 0,175 мл/мин с помощью насоса-пистолета). В качестве альтернативы можно заменить исходный буфер на новый (насыщенный кислородом и нагретый) буфер, содержащий исследуемое соединение в конечной концентрации.
- Прекратите стимуляцию и соберите исходные образцы в течение 20-30 минут перед началом второй стимуляции.
- По окончании эксперимента настаивают соответствующую положительную жидкость в течение 5-10 мин.
- После эксперимента иссекают перфузированную печень и взвешивают ее, чтобы нормализовать выход к весу печени. Мгновенно заморозьте печень в жидком азоте для потенциального измерения содержания белка, чтобы нормализовать выход на содержание белка.
5. Биохимические измерения
- Количественно определите концентрацию интересующей молекулы с помощью анализов, подходящих для измерений в перфузионном буфере (собственные или коммерчески доступные колориметрические анализы или ИФА). Буфер совместим с большинством методов, основанных на омиксах, таких как метаболомика и протеомика.
ПРИМЕЧАНИЕ: В этом исследовании мочевина измерялась на основе колориметрического анализа, описанного ранее14. Глюкозу и неэтерифицированные жирные кислоты количественно определяли с помощью коммерчески доступных наборов.
6. Анализ данных
- Представьте данные в виде графиков XY, показывающих секреторный выход с течением времени.
ПРИМЕЧАНИЕ: Одним из достоинств системы перфузии in vitro является то, что данные можно выразить в виде фактического результата (концентрация × скорость потока, например, мкмоль/мин), а не измеренной концентрации на выходе (ммоль/л), как в исследованиях in vivo . Рассмотрите возможность нормализации выхода к весу печени при сравнении различных моделей мышей или к общему содержанию белка (измеренного BCA) при сравнении контрольных мышей с мышиными моделями с ожирением или заболеваниями печени, где увеличение массы печени может быть связано с повышенным содержанием жира. - Представьте сводные данные в виде отдельных точек для каждого животного, представляющих среднюю или общую производительность в течение исходного уровня и за период стимуляции (обычно 15-30 минут) или приращенную производительность с использованием предыдущего исходного уровня для каждого периода стимуляции в зависимости от дизайна исследования.
- Проанализируйте данные с помощью парного t-критерия (две группы) или одностороннего ANOVA с повторными стимуляциями (более двух групп) с соответствующим post-hoc тестом для многократного тестирования.
Результаты
Устойчивый базовый уровень необходим для того, чтобы определить, приводит ли стимул или субстрат к высвобождению интересующей молекулы. На рисунке 3А показан пример успешного эксперимента. Продукцию мочевины в перфузионной печени измеряют с интервал?...
Обсуждение
Изолированная перфузионная печень мыши является мощным исследовательским инструментом для изучения динамики и молекулярных механизмов печеночного метаболизма. Возможность поминутного отбора проб обеспечивает детальную оценку непосредственного воздействия исследуемого соединен?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, имеющего отношение к данной статье.
Благодарности
Исследования и Nicolai J. Wewer Albrechtsen были поддержаны грантом Novo Nordisk Foundation Excellence Emerging Investigator Grant - Endocrinology and Metabolism (Application No. NNF19OC0055001), премия Европейского фонда по изучению диабета (NNF21SA0072746) и Независимого исследовательского фонда Дании, Sapere Aude (1052-00003B). Центр исследований белка Фонда Ново Нордиск получает финансовую поддержку Фонда Ново Нордиск (Грантовое соглашение NNF14CC0001). Рисунок 1B был создан с помощью biorender.com. Мы благодарим д-ра Руне Е. Куре (Novo Nordisk A/S) за плодотворные дискуссии о перфузионной печени мышей.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
Ссылки
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330 (2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187 (2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137 (2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. . Isolated Liver Perfusion and its Applications. , (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -. G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены