JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
간 포도당 생산, 요소 형성 및 지방 분해는 관류 마우스 간 모델을 사용하여 정량화되었습니다.
요약
여기에서, 우리는 간 구조를 방해하지 않으면서 간 외 요인이 없는 상태에서 간 대사의 급성 및 직접적인 조절을 연구하기 위해 쥐 간의 현장 관류를 위한 강력한 방법을 제시합니다.
초록
간은 영양소 대사를 포함한 다양한 기능을 가지고 있습니다. 간 연구의 다른 시험관 및 생체 내 모델과 달리 분리된 관류된 간은 간외 요인의 영향에서 분리된 온전한 간 구조로 전체 간의 간 생물학 및 대사를 연구할 수 있습니다. 간 관류는 원래 쥐를 위해 개발되었지만 이 방법은 쥐에도 적용되었습니다. 여기서는 마우스 간의 in situ 관류에 대한 프로토콜을 설명합니다. 간은 산소가 공급된 Krebs-Henseleit 중탄산염 완충액으로 문맥을 통해 전위적으로 관류되고, 출력은 회로를 닫기 위해 하대정맥을 클램핑하여 상하정맥에서 수집됩니다. 이 방법을 사용하면 테스트 화합물의 직접적인 간 효과를 자세한 시간 분해능으로 평가할 수 있습니다. 간 기능 및 생존력은 최소 3시간 동안 안정적이므로 동일한 실험에서 내부 대조군을 포함할 수 있습니다. 이 모델을 사용한 실험 가능성은 무궁무진하며 간 생리학 및 간 질환에 대한 통찰력을 추론할 수 있습니다.
서문
간은 신진대사에 필수적인 기관입니다. 포도당, 지질, 아미노산 대사를 조절하여 전신 에너지 균형을 조절하는 데 중요한 역할을 합니다. 전 세계적으로 간 질환의 증가는 주요 글로벌 건강 부담으로 부상하고 있으며 병태 생리학과 간 기능에 미치는 영향에 대한 더 많은 지식이 필요합니다.
in vivo 연구를 보완하기 위해 간 연구를 위해 다양한 in vitro 모델이 개발되었습니다. 설치류와 인간으로부터 분리되고 배양된 1차 간세포가 널리 사용됩니다. 비실질 세포는 차등 및 기울기 원심분리를 사용하여 간세포에서 분리할 수 있으며, 서로 다른 세포 유형의 공동 배양은 세포 간 누화1을 연구하는 데 유용합니다. 1차 인간 간세포는 약물 독성 테스트의 황금 표준으로 간주되지만, 여러 연구에 따르면 간세포는 조직 배양에서 빠르게 역분화되어 간 기능을 상실하는 것으로 나타났습니다 2,3,4. 3D 스페로이드 시스템에서의 간세포 배양은 역분화를 개선하고, 더 안정적이며, 기존의 2D 배양 시스템보다 생체 내에서 간을 더 높은 수준으로 모방하는 것으로 보인다5. 정밀하게 절단된 간 절편은 조직 구조를 그대로 유지하고 간에 존재하는 비실질 세포를 포함하는 또 다른 잘 정립된 체외 모델이다6. 보다 발전된 in vitro 모델에는 liver-on-a-chip7 및 간 오가노이드8가 포함됩니다. 그러나 이러한 모든 접근 방식에서는 벡터 문맥-간 정맥 흐름을 포함한 구조적 무결성 및 흐름 역학이 손실되어 일반화 가능성에 영향을 미칠 수 있습니다.
분리된 관류된 쥐의 간은 1855년 클로드 베르나르(Claude Bernard)에 의해 처음 기술되었으며, 9 간생물학, 독성학 및 병태생리학 연구를 위해 다양한 과학 분야에서 여전히 사용되고 있다. 위에서 언급한 시험관 내 모델과 비교하여 관류된 간의 장점에는 간 구조, 혈관 흐름, 간세포 극성 및 구역화, 간세포와 비실질 세포 간의 상호 작용이 유지됩니다. in vivo 연구와 비교했을 때, 관류된 간은 혈액에 의해 운반되는 간외 인자를 피하고 실험 조건을 완벽하게 제어하면서 격리된 방식으로 간 대사를 연구할 수 있습니다. 수년에 걸쳐 쥐의 간 관류 모델을 개선하기 위해 몇 가지 수정이 이루어졌습니다10,11,12,13. 쥐가 분리된 관류 간 연구에 사용되었지만, 문헌은 적습니다. 여기에서는 실시간으로 생쥐 간에서 배출되는 간에서 측정된 대사 기질 및 호르몬에 대한 급성 및 직접적인 대사 반응을 연구하기 위해 문맥 및 하대정맥의 캐뉼레이션에 의한 생쥐 간의 제자리 관류를 위한 방법을 제시합니다.
프로토콜
모든 동물실험은 덴마크 동물실험검사관, 덴마크 환경식품부(허가 2018-15-0201-01397) 및 현지 윤리위원회의 허가를 받아 EU 지침 2010/63/EU, 국립보건원(간행물 번호 85-3) 및 동물실험에 관한 덴마크 법률(1987)의 지침에 따라 수행되었습니다. 이것은 말기 절차이며 사인은 심부 마취 하에 횡격막의 출출 및 천공입니다.
1. 실험동물
- 원하는 균주, 연령 및 성별의 마우스를 얻습니다. 이 연구는 11-16주 된 수컷 C57BL/6JRj 마우스를 사용했습니다. 케이지 당 최대 5 마리의 수컷 또는 8 마리의 암컷 마우스를 수용하고 차우와 물에 대한 임시 접근을 허용하고 오전 6 시부 터 오후 6 시까 지 조명을 켜고 12 시간 / 12 시간 명암 사이클을 유지합니다.
2. 수술 전 준비
- 간 관류 완충액을 만드십시오.
- Krebs-Henseleit 버퍼. 118 mmol/L NaCl, 4.7 mmol/L KCl, 1.2 mmol/L MgSO 4 및 1.2 mmol/L KH 2 PO4를 dH 2 O에 혼합 및 용해시킵니다. 별도의 비커에 1.25 mmol/L CaCl2를 용해시키고 완충액을 추가합니다.
- 25mmol/L NaHCO3를 용해시키고 교반하면서 완충액에 천천히 첨가합니다. 버퍼를 4도에서 보관합니다. 버퍼는 최소 1개월 동안 안정적입니다.
참고: CaCl2 및 NaHCO3 를 첨가하기 전에 개별적으로 용해하지 않으면 침전이 발생할 수 있습니다.
- 2μm 필터를 통해 관류 완충액을 여과하고 HCl을 사용하여 pH를 7.5로 조정합니다.
알림: 이 단계는 밀폐된 플라스크에 보관하더라도 시간이 지남에 따라 pH가 증가하므로 실험 당일에 수행해야 합니다. - 여과 및 pH 조정 Krebs-Henseleit 관류 완충액에서 원하는 최종 농도(예: 사이드암 펌프를 통해 0.175mL/분의 속도로 주입 시 20배 농도)보다 높은 농도로 테스트 화합물을 준비합니다. 해당되는 경우, 1% BSA를 담체로 첨가한 Krebs-Henseleit 관류 완충액에 희석한 테스트 화합물(모든 펩타이드에 필수적인 튜브 및 유리 제품에 대한 접착을 방지하기 위해)을 적절한 크기의 필터를 통해 여과합니다.
3. 작동 및 관류
참고: 이 연구에 사용된 관류 설정의 그림은 그림 1에 나와 있습니다.
- 관류 완충액(95% O2, 5%CO2)을 최소 30분 동안 가스로 공급하여 간에 충분한 산소를 공급하고 작동 시작부터 올바른 pH를 유지합니다(중탄산염 완충 시스템은 연속 가스 발생 시 pH 7.4에 도달합니다. 보충 그림 1 참조).
- 복강 내 주사로 케타민(90mg/kg)과 자일라진(10mg/kg)을 투여하여 마우스를 마취합니다.
- 가열된 수술대에 마우스를 누운 상태로 놓고 발가락 꼬집음에 대한 반응으로 반사 신경이 부족한지 확인합니다. 머리카락이 가위에 달라붙지 않도록 70% 에탄올을 뿌립니다. 마우스를 따뜻한 표면에 고정하면 다음 절차의 안정성을 높이는 데 도움이 됩니다.
- 복부 기저부를 가위로 절개하고 양쪽 흉곽까지 위쪽으로 절개하여 복강을 노출시킵니다. 면봉을 사용하여 장을 오른쪽으로 움직여 문맥을 노출시킵니다.
- 구부러진 집게를 사용하여 문맥 아래에 두 개의 합자를 놓고 각 합자에 대해 느슨한 매듭을 준비합니다.
- 문맥에 0.7mm 카테터를 삽입합니다. 구멍이 뚫리면 그림 2와 같이 카테터에서 바늘을 제거하고 카테터 끝이 간에 가까워질 때까지 카테터를 정맥을 통해 안내합니다. 혈액이 카테터로 흐릅니다.
- 합자를 조입니다. 카테터에 혈액이 채워져 있지 않으면 기포가 유입되지 않도록 관류 완충액으로 채우십시오.
- 관류 튜브를 부착하고 0.8mL/min의 관류 유속으로 롤러 펌프를 시작하여 37°C에서 Krebs-Henseleit 중탄산염 완충액으로 간 관류를 시작합니다. 간은 몇 초 안에 창백해집니다.
- 가위를 사용하여 흉곽과 횡격막을 자릅니다. 이 시점에서 동물은 안락사됩니다. 미세한 점포를 사용하여 suprahepatic inferior vena cava 아래에 합자를 놓습니다. 마우스 뒤쪽에 펜, 말린 거즈 또는 기타 일회용품을 놓아 정맥에 더 쉽게 접근할 수 있도록 합니다.
- 심장의 우심방을 통해 하대정맥상에 카테터를 삽입합니다. 구멍이 뚫리면 카테터에서 바늘을 제거하고 카테터 끝이 간에 가까워질 때까지 카테터를 정맥을 통해 안내합니다. 혈액과 관류 완충액은 즉시 소진됩니다.
- 합자를 조이고 관류 유출물 수집을 위한 튜브를 부착합니다. 모든 튜브를 방수 테이프(매끄러운 테이프 또는 이와 유사한 테이프)로 고정합니다.
- vessel clamp 어댑터를 사용하여 혼합을 방지하기 위해 오른쪽 신장 정맥 바로 위의 infrahepatic vena cava를 가로질러 vessel clamp를 배치합니다(그림 2).
- 관류 유속을 3.5mL/분으로 높이고 타이머를 시작합니다. 압력 기록을 시작합니다. 성공적인 관류는 일반적으로 ~10mm/Hg의 압력을 초래합니다.
- 간을 식염수로 적신 멸균 드레이프로 덮고 실험 중에 식염수를 첨가하여 건조를 방지합니다.
- 1분 동안 관류 유출물을 수집하고 부피를 측정합니다. 부피는 약 3.5mL/분이어야 합니다. 이 단계에서는 혈액이 섞이지 않을 것으로 예상되며, 심장은 더 이상 펌프질을 하지 않습니다.
- 실험을 시작하기 전에 30분의 평형 기간 동안 기다리십시오.
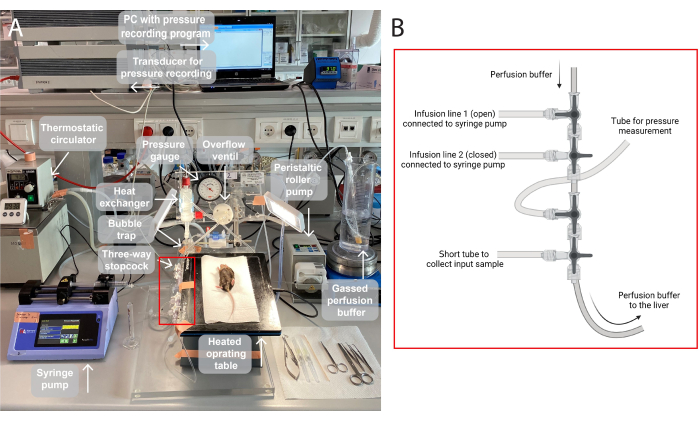
그림 1: 관류 설정 그림. (A) 수술대를 삼각대 스탠드에 올려 놓고 37°C로 가열합니다. 관류 완충액은 가스화되고(95% O2, 5%CO2) 연동 롤러 펌프를 통해 펌핑되고, 버블 트랩이 내장된 열교환기에서 가열됩니다. 또한 이 시스템은 관류 압력 조정을 위한 압력 게이지와 스핀들 펌프로 구성됩니다. 관류 압력은 압력 기록 프로그램인 PC의 변환기를 통해 지속적으로 기록되고 시각화됩니다. (B) 빨간색 상자는 3방향 스톱콕의 연결을 캡처합니다. 첫 번째 3방향 마개는 주사기 펌프를 통해 테스트 화합물을 주입하기 위해 열려 있고 두 번째 마개는 닫혀 있습니다. 세 번째는 연속 압력 측정을 위해 열려 있습니다. 제4 마개는 예를 들어, 관류된 간을 가로지르는 가스 분석을 위해 입력 샘플을 수집하는데 사용될 수 있다. 커넥터는 더 많거나 적은 주입 라인이 필요한 특정 실험을 위해 필요에 따라 수정할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
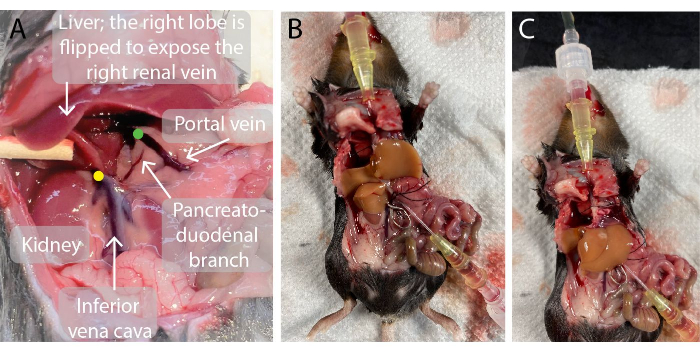
그림 2: 간 관류 전과 관류 중 쥐 복강 사진 . (A)녹색 점은 문맥 카테터 끝의 위치를 나타냅니다. 카테터의 끝은 문맥의 분지 지점 바로 아래에 좌우 간문맥으로 위치하지만 누출을 방지하기 위해 췌장-십이지장 가지 위에 위치하는 것이 중요합니다. 노란색 점은 관류된 간으로 혈액이 역류하는 것을 방지하기 위해 오른쪽 신장 정맥과 간 사이의 하대정맥에 혈관 클램프의 정확한 위치를 나타냅니다. (나, 씨) 문맥(B)과 상하정맥(C)에 삽입된 두 개의 카테터와 혈관이 하대정맥(B)에 고정되어 있는 관류된 쥐 간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 실험
- 평형 기간이 끝날 때 분획 수집기를 사용하여 첫 번째 기준선 샘플을 수집하여 실험을 시작합니다. 원하는 시간 간격으로 샘플을 수집하여 즉시 얼음 위에 놓습니다.
- 버블 트랩을 정기적으로 점검하고 비어있을 때 관류 버퍼로 다시 채우십시오.
- 완충액이 장기에 들어가기 직전에 3방향 마개를 통해 그리고 하대정맥에 삽입된 수집 카테터(간을 통해 관류된 후)에서 완충액 샘플을 채취합니다.
- 혈액 가스 분석기로 샘플을 측정하여 장기가 대사 적으로 활성화되어 있는지 확인합니다 (CO2 분압 증가 및 pH 감소로 나타남).
- 실험이 끝날 때 4.3-4.4단계를 반복하여 실험 전반에 걸쳐 생존 가능성을 평가합니다(보충 그림 2).
알림: 산소 분압의 감소는 튜브, 장기 등의 산소 손실로 인해 신뢰할 수 있는 호흡 측정을 제공하지 않습니다. - 기준선 관류 15분 후 주사기 펌프를 사용하여 원하는 유속으로 3방향 스톱콕을 통해 테스트 물질을 주입하여 첫 번째 자극을 시작합니다(예: 사이드암 펌프를 통해 20mL/분의 속도로 주입할 때 테스트 물질의 0.175배 농도). 또는 기준선 완충액을 최종 농도에 시험 화합물을 포함하는 새로운(산소화 및 가열) 완충액으로 전환합니다.
- 자극을 멈추고 두 번째 자극을 시작하기 전에 20-30분 동안 기준선 샘플을 수집합니다.
- 실험이 끝나면 5-10분 동안 적절한 양성 대조군을 주입합니다.
- 실험 후 관류된 간을 절제하고 무게를 측정하여 간 무게에 대한 출력을 정규화합니다. 단백질 함량을 측정하기 위해 간을 액체 질소에 스냅 냉동하여 단백질 함량에 대한 출력을 정상화합니다.
5. 생화학적 측정
- 관류 완충액(사내 또는 상업적으로 이용 가능한 비색 또는 ELISA 분석)에서 측정에 적합한 분석을 사용하여 관심 분자의 농도를 정량화합니다. 이 완충액은 대사체학(metabolomics) 및 단백질체학(proteomics)과 같은 대부분의 오믹스 기반 기술과 호환됩니다.
참고: 이 연구에서 요소는 이전에 설명한 비색 분석을 기반으로측정되었습니다 14. 글루코스 및 비에스테르화 지방산은 시판되는 키트를 사용하여 정량하였다.
6. 데이터 분석
- 시간 경과에 따른 분비 출력을 보여주는 XY 그래프로 데이터를 표시합니다.
참고: in vivo 연구에서와 같이 측정된 출력(mmol/L) 대신 실제 출력(농도 × 유속, 예: μmol/min)으로 데이터를 표현할 수 있다는 것이 in vitro 관류 시스템의 장점 중 하나입니다. 다른 마우스 모델을 비교할 때 간 무게에 대한 출력을 정규화하거나, 지방 함량 증가로 인해 간 무게가 증가할 수 있는 비만 또는 간 질환이 있는 마우스 모델과 대조군 마우스를 비교할 때 총 단백질 함량(BCA로 측정)으로 정규화하는 것을 고려하십시오. - 요약 데이터를 기준선 및 자극 기간(일반적으로 15-30분) 동안 평균 또는 총 출력을 나타내는 동물당 개별 점으로 표시하거나 연구 설계에 따라 각 자극 기간에 대해 이전 기준선을 사용하여 증분 출력을 나타냅니다.
- 쌍체 t-검정(두 그룹) 또는 반복 자극이 있는 일원 분산 분석(두 개 이상의 그룹)을 사용하여 여러 검정을 위한 적절한 사후 검정을 사용하여 데이터를 분석합니다.
결과
자극 또는 기질이 관심 분자의 방출로 이어지는지 여부를 결정하기 위해서는 꾸준한 기준선이 필요합니다. 그림 3A 는 성공적인 실험의 예를 보여줍니다. 관류된 간에서 요소의 생성은 2분 간격으로 측정되며 평균 ± SEM으로 표시됩니다. 두 자극 기간 각각에 앞서는 기준선 기간은 일정합니다. 두 자극 기간 동안의 평균 요소 생산량과 각각의 이전 기?...
토론
분리된 관류된 쥐의 간은 간 대사의 역학 및 분자 메커니즘 연구를 위한 강력한 연구 도구입니다. 분 단위 샘플 수집의 가능성은 간에 대한 테스트 화합물의 직접적인 효과에 대한 자세한 평가를 제공합니다. in vivo 연구와 비교했을 때, 관류된 간을 사용하면 혈액에 의해 운반되는 간외 인자를 피하고 실험 조건을 완벽하게 제어하면서 격리된 방식으로 간 대사를 연구할 수 있습니다. 분리?...
공개
저자는 이 기사와 관련된 이해 상충이 없음을 선언합니다.
감사의 말
이 연구와 Nicolai J. Wewer Albrechtsen은 Novo Nordisk Foundation Excellence Emerging Investigator Grant - Endocrinology and Metabolism(Application No. NNF19OC0055001), 유럽 당뇨병 연구 재단 미래 지도자상(NNF21SA0072746) 및 덴마크 독립 연구 기금, Sapere Aude(1052-00003B). 노보 노디스크 재단 단백질 연구 센터(Center for Protein Research)는 노보 노디스크 재단(Novo Nordisk Foundation)의 재정 지원을 받고 있습니다(보조금 계약 NNF14CC0001). 그림 1B는 biorender.com 로 작성되었습니다. 관류된 쥐의 간에 대한 유익한 토론을 해주신 Dr. Rune E. Kuhre(Novo Nordisk A/S)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
참고문헌
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330 (2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187 (2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137 (2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. . Isolated Liver Perfusion and its Applications. , (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -. G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유