È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di glucosio epatico, ureagenesia e lipolisi quantificate utilizzando il modello di fegato di topo perfuso
In questo articolo
Riepilogo
Qui, presentiamo un metodo robusto per la perfusione in situ del fegato di topo per studiare la regolazione acuta e diretta del metabolismo epatico senza disturbare l'architettura epatica ma in assenza di fattori extra-epatici.
Abstract
Il fegato ha numerose funzioni, tra cui il metabolismo dei nutrienti. A differenza di altri modelli di ricerca epatica in vitro e in vivo, il fegato perfuso isolato consente lo studio della biologia e del metabolismo epatico in tutto il fegato con un'architettura epatica intatta, separata dall'influenza di fattori extra-epatici. Le perfusioni epatiche sono state originariamente sviluppate per i ratti, ma il metodo è stato adattato anche ai topi. Qui descriviamo un protocollo per la perfusione in situ del fegato di topo. Il fegato viene perfuso anterogradamente attraverso la vena porta con tampone bicarbonato di Krebs-Henseleit ossigenato e l'output viene raccolto dalla vena cava inferiore sopraepatica con clampaggio della vena cava inferiore infraepatica per chiudere il circuito. Utilizzando questo metodo, gli effetti epatici diretti di un composto in esame possono essere valutati con una risoluzione temporale dettagliata. La funzionalità epatica e la vitalità sono stabili per almeno 3 ore, consentendo l'inclusione di controlli interni nello stesso esperimento. Le possibilità sperimentali che utilizzano questo modello sono numerose e possono dedurre informazioni sulla fisiologia epatica e sulle malattie del fegato.
Introduzione
Il fegato è un organo essenziale nel metabolismo. Svolge un ruolo chiave nel controllo dell'equilibrio energetico di tutto il corpo regolando il metabolismo di glucosio, lipidi e aminoacidi. L'aumento delle malattie del fegato in tutto il mondo sta emergendo come un importante onere per la salute globale e sono necessarie maggiori conoscenze sulla fisiopatologia e sulle sue conseguenze per le funzioni epatiche.
Sono stati sviluppati vari modelli in vitro per la ricerca sul fegato a complemento degli studi in vivo. Gli epatociti primari isolati e coltivati da roditori ed esseri umani sono ampiamente utilizzati. Le cellule non parenchimali possono essere separate dagli epatociti utilizzando la centrifugazione differenziale e a gradiente, e la co-coltura di diversi tipi cellulari è utile per studiare il crosstalk intercellulare1. Sebbene gli epatociti umani primari siano considerati il gold standard per testare la tossicità dei farmaci, diversi studi hanno dimostrato che gli epatociti si dedifferenziano rapidamente in coltura tissutalecon conseguente perdita delle funzioni epatiche 2,3,4. La coltura di epatociti in un sistema sferoidale 3D migliora la dedifferenziazione, è più stabile e sembra imitare il fegato in vivo in misura maggiore rispetto ai tradizionali sistemi di coltura 2D5. Le fette di fegato tagliate con precisione sono un altro modello in vitro ben consolidato che mantiene intatta l'architettura tissutale e contiene le cellule non parenchimali presenti nel fegato6. I modelli in vitro più avanzati includono il fegato su chip7 e gli organoidi epatici8. Tuttavia, con tutti questi approcci, c'è una perdita di integrità strutturale e dinamica del flusso, incluso il flusso vettoriale della vena portale-epatica, che probabilmente influisce sulla generalizzabilità.
Il fegato di ratto perfuso isolato è stato descritto per la prima volta da Claude Bernard nel 1855 ed è ancora utilizzato in vari campi scientifici per studi di biologia epatica, tossicologia e fisiopatologia. I vantaggi del fegato perfuso rispetto ai modelli in vitro sopra menzionati includono il mantenimento dell'architettura epatica, del flusso vascolare, della polarità e della zonazione degli epatociti e delle interazioni tra epatociti e cellule non parenchimali. Rispetto agli studi in vivo, il fegato perfuso permette lo studio del metabolismo epatico in maniera isolata evitando fattori extra-epatici veicolati dal sangue e con un controllo completo sulle condizioni sperimentali. Nel corso degli anni sono state apportate diverse modifiche per migliorare il modello di perfusione epatica di ratto 10,11,12,13. Sebbene i topi siano stati utilizzati per studi isolati sul fegato perfuso, è disponibile meno letteratura. Qui, presentiamo un metodo per la perfusione in situ del fegato di topo mediante incannulamento della vena porta e della vena cava sopraepatica inferiore per studiare le risposte metaboliche acute e dirette ai substrati metabolici e agli ormoni misurate nell'effluente venoso epatico dal fegato di topo in tempo reale.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti con il permesso dell'Ispettorato danese per gli esperimenti sugli animali, del Ministero dell'Ambiente e dell'Alimentazione della Danimarca (permesso 2018-15-0201-01397) e del comitato etico locale in conformità con la direttiva UE 2010/63/UE, del National Institutes of Health (pubblicazione n. 85-3) e seguendo le linee guida della legislazione danese che disciplina la sperimentazione animale (1987). Questa è una procedura terminale e la causa della morte è il dissanguamento e la perforazione del diaframma in anestesia profonda.
1. Animali da esperimento
- Ottenere topi del ceppo, dell'età e del sesso desiderati. Questo studio ha utilizzato topi maschi C57BL/6JRj di età compresa tra 11 e 16 settimane. Ospita fino a 5 topi maschi o 8 femmine per gabbia con accesso ad libitum a cibo e acqua e mantieni un ciclo luce-buio di 12 ore/12 ore con luci accese dalle 6 alle 18.
2. Preparativi preoperatori
- Prepara un tampone per perfusione epatica.
- Buffer di Krebs-Henseleit. Mescolare e sciogliere 118 mmol/L NaCl, 4,7 mmol/L KCl, 1,2 mmol/L MgSO 4 e 1,2 mmol/L KH 2 PO4 in dH 2 O. Sciogliere 1,25 mmol/L CaCl2in un becher separato e aggiungere il tampone.
- Sciogliere 25 mmol/L di NaHCO3 e aggiungere lentamente al tampone mescolando. Conservare il tampone a 4 gradi. Il tampone è stabile per almeno 1 mese.
NOTA: La precipitazione può verificarsi se CaCl2 e NaHCO3 non vengono disciolti singolarmente prima di essere aggiunti.
- Filtrare il tampone di perfusione attraverso un filtro da 2 μm e regolare il pH a 7,5 utilizzando HCl.
NOTA: Questo passaggio deve essere eseguito il giorno dell'esperimento, poiché il pH aumenta nel tempo, anche se conservato in matracci chiusi. - Preparare i composti in esame a una concentrazione superiore alla concentrazione finale desiderata (ad esempio, concentrazione 20x se infusi a una velocità di 0,175 mL/min tramite una pompa a braccio laterale) in tampone di perfusione Krebs-Henseleit filtrato e a pH regolato. Se del caso, diluire i composti in esame nel tampone di perfusione Krebs-Henseleit con l'aggiunta dell'1% di BSA come vettore (per evitare l'adesione a tubi e vetreria, essenziale per tutti i peptidi), filtrati attraverso un filtro di dimensioni adeguate.
3. Funzionamento e perfusione
NOTA: Nella Figura 1 viene fornita un'illustrazione della configurazione di perfusione utilizzata in questo studio.
- Gassare il tampone di perfusione (95% O 2, 5% CO2 ) per almeno 30 minuti per fornire ossigeno sufficiente al fegato e mantenere il pH corretto fin dall'inizio dell'operazione (il sistema tampone bicarbonato raggiungerà un pH di 7,4 in caso di gassificazione continua, vedere la Figura 1 supplementare).
- Anestetizzare un topo somministrando ketamina (90 mg/kg) e xilazina (10 mg/kg) mediante iniezione intraperitoneale.
- Posizionare il mouse supino su un tavolo operatorio riscaldato e confermare la mancanza di riflessi in risposta al pizzicamento della punta. Spruzzare con etanolo al 70% per evitare che i capelli si attacchino alle forbici. Il fissaggio del mouse alla superficie calda aiuta ad aumentare la stabilità per le seguenti procedure.
- Fai un'incisione con le forbici alla base dell'addome e taglia verso l'alto fino alla gabbia toracica su entrambi i lati per esporre la cavità addominale. Sposta l'intestino verso destra usando un batuffolo di cotone, esponendo la vena porta.
- Posiziona due legature sotto la vena porta usando una pinza curva e prepara un nodo sciolto per ciascuna legatura.
- Inserire un catetere da 0,7 mm nella vena porta. Una volta perforato, rimuovere l'ago dal catetere e guidare il catetere attraverso la vena fino a quando la punta del catetere non è vicina al fegato, come illustrato nella Figura 2. Il sangue scorre nel catetere.
- Stringere le legature. Se il catetere non è pieno di sangue, riempirlo con tampone di perfusione per evitare l'introduzione di bolle d'aria.
- Collegare il tubo di perfusione e avviare la perfusione del fegato con il tampone di bicarbonato Krebs-Henseleit a 37 °C avviando la pompa a rulli a una portata di perfusione di 0,8 mL/min. Il fegato impallidisce in pochi secondi.
- Taglia la gabbia toracica e il diaframma usando le forbici. A questo punto, l'animale viene soppresso. Posizionare una legatura sotto la vena cava inferiore sopraepatica utilizzando una pinza a punta fine. Posiziona una penna, una garza arrotolata o un altro oggetto usa e getta sotto il retro del mouse per rendere la vena più accessibile.
- Inserire un catetere nella vena cava sopraepatica inferiore attraverso l'atrio destro del cuore. Una volta perforato, rimuovere l'ago dal catetere e guidare il catetere attraverso la vena fino a quando la punta del catetere non è vicina al fegato. Il sangue e il tampone di perfusione si esauriscono immediatamente.
- Stringere la legatura e collegare un tubo per la raccolta dell'effluente di perfusione. Fissare tutti i tubi con nastro impermeabile (nastro lucido o simile).
- Utilizzare un adattatore per pinza vascolare per posizionare una pinza vascolare attraverso la vena cava infraepatica immediatamente sopra la vena renale destra per evitare la commistione (Figura 2).
- Aumentare la portata di perfusione a 3,5 mL/min e avviare un timer. Avviare la registrazione della pressione. Una perfusione riuscita di solito si traduce in una pressione di ~10 mm/Hg.
- Coprire il fegato con un telo sterile inumidito con soluzione fisiologica e aggiungere soluzione fisiologica durante l'esperimento per evitare che si secchi.
- Raccogliere l'effluente di perfusione per 1 minuto e misurarne il volume. Il volume dovrebbe essere di circa 3,5 ml/min. In questa fase non è prevista la mescolanza di sangue e il cuore non pompa più.
- Attendere un periodo di equilibrio di 30 minuti prima di iniziare l'esperimento.
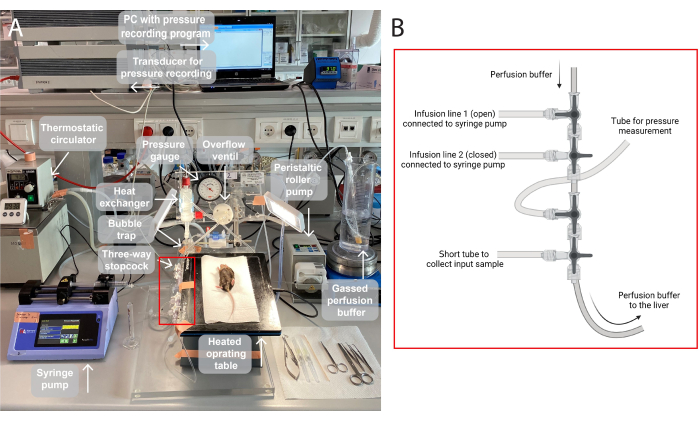
Figura 1: Un'illustrazione della configurazione della perfusione. (A)Il tavolo operatorio è sollevato su un treppiede e riscaldato a 37 °C. Il tampone di perfusione viene gassizzato (95% O 2, 5% CO2 ), pompato tramite una pompa peristaltica a rulli e riscaldato nello scambiatore di calore con una trappola di bolle incorporata. Il sistema è inoltre composto da un manometro e da una pompa a mandrino per la regolazione della pressione di perfusione. La pressione di perfusione viene continuamente registrata e visualizzata tramite un trasduttore su un PC, un programma di registrazione della pressione. (B) La scatola rossa cattura i collegamenti dei rubinetti a tre vie. Il primo rubinetto a tre vie è aperto per l'infusione di un composto di prova tramite una pompa a siringa e il secondo è chiuso. Il terzo è aperto per misurazioni continue della pressione. Il quarto rubinetto può essere utilizzato per raccogliere campioni in ingresso, ad esempio per l'analisi dei gas attraverso il fegato perfuso. I connettori possono essere modificati in base alle esigenze per esperimenti specifici che richiedono più o meno linee di infusione. Fare clic qui per visualizzare una versione più grande di questa figura.
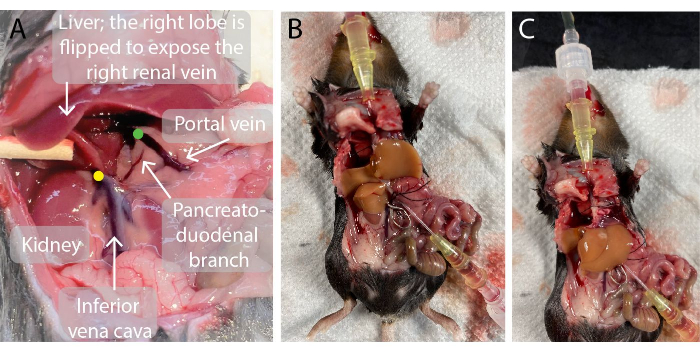
Figura 2: Foto della cavità addominale del topo prima e durante la perfusione epatica. (A)Il punto verde indica la posizione della punta del catetere della vena porta. È importante che la punta del catetere sia posizionata appena sotto il punto di ramificazione della vena porta nelle vene porta epatiche sinistra e destra, ma al di sopra del ramo pancreato-duodenale per evitare perdite. Il punto giallo indica la corretta posizione del morsetto vascolare sulla vena cava infraepatica inferiore tra la vena renale destra e il fegato per evitare il riflusso del sangue nel fegato perfuso. (B, C) Un fegato di topo perfuso con i due cateteri inseriti nella vena porta (B) e nella vena cava inferiore sopraepatica (C) e il morsetto vascolare sulla vena cava inferiore infraepatica (B). Fare clic qui per visualizzare una versione più grande di questa figura.
4. Sperimenta
- Iniziare l'esperimento raccogliendo i primi campioni di base utilizzando un raccoglitore di frazioni alla fine del periodo di equilibrio. Raccogliere i campioni all'intervallo di tempo desiderato e metterli immediatamente sul ghiaccio.
- Controllare regolarmente la trappola per bolle e riempirla con il tampone di perfusione quando è quasi vuota.
- Prelevare un campione del tampone attraverso un rubinetto a tre vie immediatamente prima che entri nell'organo e dal catetere di raccolta inserito nella vena cava inferiore (dopo che è stato perfuso attraverso il fegato).
- Misurare i campioni con un analizzatore di gas ematici per confermare che l'organo è metabolicamente attivo (indicato da un aumento della pressione parziale di CO2 e da una diminuzione del pH).
- Ripetere i passaggi 4.3-4.4 alla fine dell'esperimento per valutare la fattibilità durante l'esperimento (Figura 2 supplementare).
NOTA: La diminuzione della pressione parziale dell'ossigeno non fornisce una misura affidabile della respirazione a causa delle perdite di ossigeno dai tubi, dall'organo, ecc. - Dopo 15 minuti di perfusione basale, avviare la prima stimolazione infondendo una sostanza in esame attraverso un rubinetto a tre vie alla portata desiderata utilizzando una pompa a siringa (ad esempio, concentrazione 20 volte superiore della sostanza in esame quando infusa a una velocità di 0,175 ml/min tramite una pompa a braccio laterale). In alternativa, sostituire il tampone basale con un nuovo tampone (ossigenato e riscaldato) contenente il composto in esame nella concentrazione finale.
- Interrompere la stimolazione e raccogliere campioni basali per 20-30 minuti prima di iniziare la seconda stimolazione.
- Al termine dell'esperimento, infondere un controllo positivo appropriato per 5-10 min.
- Dopo l'esperimento, asportare il fegato perfuso e pesarlo per normalizzare l'output al peso del fegato. Congelare istantaneamente il fegato in azoto liquido per la potenziale misurazione del contenuto proteico per normalizzare l'output al contenuto proteico.
5. Misure biochimiche
- Quantificare la concentrazione della molecola di interesse utilizzando saggi appropriati per le misurazioni in tampone di perfusione (saggi colorimetrici o ELISA in-house o disponibili in commercio). Il tampone è compatibile con la maggior parte delle tecniche basate sull'omica, come la metabolomica e la proteomica.
NOTA: In questo studio, l'urea è stata misurata sulla base di un test colorimetrico precedentemente descritto14. Il glucosio e gli acidi grassi non esterificati sono stati quantificati utilizzando kit disponibili in commercio.
6. Analisi dei dati
- Presentare i dati in grafici XY che mostrano l'output secretorio nel tempo.
NOTA: Una delle virtù del sistema di perfusione in vitro è che è possibile esprimere i dati come l'output effettivo (concentrazione × portata, ad es. μmol/min) invece della concentrazione misurata nell'output (mmol/L) come negli studi in vivo . Prendere in considerazione la normalizzazione dell'output al peso del fegato quando si confrontano diversi modelli murini o al contenuto proteico totale (misurato da BCA) quando si confrontano topi di controllo con modelli murini con obesità o malattie del fegato in cui un aumento del peso del fegato può essere dovuto all'aumento del contenuto di grassi. - Presentare i dati di riepilogo come singoli punti per animale che rappresentano l'output medio o totale durante il basale e in un periodo di stimolazione (in genere 15-30 minuti) o l'output incrementale utilizzando il basale precedente per ciascun periodo di stimolazione a seconda del disegno dello studio.
- Analizzare i dati utilizzando il test t accoppiato (due gruppi) o l'ANOVA unidirezionale con stimolazioni ripetute (più di due gruppi) con un test post-hoc appropriato per test multipli.
Risultati
È necessaria una linea di base costante per determinare se uno stimolo o un substrato porta al rilascio della molecola di interesse. La Figura 3A mostra un esempio di esperimento riuscito. La produzione di urea nel fegato perfuso viene misurata a intervalli di 2 minuti e indicata come media ± SEM. I periodi basali che precedono ciascuno dei due periodi di stimolazione sono costanti. La produzione media di urea durante i due periodi di stimolazione e le risp...
Discussione
Il fegato di topo perfuso isolato è un forte strumento di ricerca per lo studio delle dinamiche e dei meccanismi molecolari del metabolismo epatico. La possibilità di prelevare campioni minuto per minuto fornisce una valutazione dettagliata dell'effetto diretto di un composto in esame sul fegato. Rispetto agli studi in vivo, il fegato perfuso permette di studiare il metabolismo epatico in maniera isolata evitando fattori extra-epatici veicolati dal sangue e con un controllo completo sulle condizioni sperimenta...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse relativi a questo articolo.
Riconoscimenti
Gli studi e Nicolai J. Wewer Albrechtsen sono stati supportati dalla Novo Nordisk Foundation Excellence Emerging Investigator Grant - Endocrinology and Metabolism (Application No. NNF19OC0055001), European Foundation for the Study of Diabetes Future Leader Award (NNF21SA0072746) e Independent Research Fund Denmark, Sapere Aude (1052-00003B). Il Centro per la ricerca sulle proteine della Fondazione Novo Nordisk è sostenuto finanziariamente dalla Fondazione Novo Nordisk (accordo di sovvenzione NNF14CC0001). La Figura 1B è stata creata con biorender.com. Ringraziamo il Dr. Rune E. Kuhre (Novo Nordisk A/S) per le fruttuose discussioni sul fegato di topo perfuso.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
Riferimenti
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330 (2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187 (2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137 (2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. . Isolated Liver Perfusion and its Applications. , (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -. G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon