Method Article
Procedimiento para la Ingeniería de pulmón
En este artículo
Resumen
Hemos desarrollado una matriz extracelular y de pulmón descelularizada biorreactor novela biomiméticos que se puede utilizar para generar tejido pulmonar funcional. Por la siembra de las células en la matriz y el cultivo en el biorreactor, que generan tejido que demuestra el intercambio de gases eficaz cuando se trasplantan en vivo por periodos cortos de tiempo.
Resumen
Los tejidos pulmonares, incluyendo cáncer de pulmón y enfermedades pulmonares crónicas, como enfermedad pulmonar obstructiva crónica, de forma acumulativa representan alrededor de 280.000 muertes al año, la enfermedad pulmonar obstructiva crónica es actualmente la cuarta causa de muerte en los Estados Unidos 1. Que contribuyen a esta mortalidad es el hecho de que los pulmones por lo general no más allá de reparar o regenerar el nivel microscópico, celular. Por lo tanto, el tejido pulmonar que está dañado por la degeneración o una infección, o el tejido pulmonar resecado quirúrgicamente que no es funcionalmente reemplazado en vivo. Para explorar si el tejido pulmonar se pueden generar in vitro, se trataron los pulmones de ratas adultas utilizando un procedimiento que elimina los componentes celulares para producir un andamio extracelular pulmonar acelular matriz. Esta estructura mantiene las estructuras jerárquicas de ramificación de las vías respiratorias y los vasos sanguíneos, así como una membrana basal en gran parte intacto, que comprende colágeno IV, laminina y fibronectina. El andamio se monta en un biorreactor diseñado para imitar los aspectos críticos de la fisiología pulmonar, tales como ventilación con presión negativa y la perfusión vascular pulsátil. Por el epitelio pulmonar y el cultivo de endotelio vascular en el andamio montado en biorreactores, que son capaces de generar tejido pulmonar que es fenotípicamente similar al tejido pulmonar de origen y que es capaz de participar en el intercambio de gases para los intervalos de tiempo (45-120 minutos). Estos resultados son alentadores y sugieren que la repoblación de la matriz pulmonar es una estrategia viable para la regeneración del pulmón. Esta posibilidad se presenta una oportunidad no sólo de trabajar para aumentar la oferta de tejidos de los pulmones para un trasplante, sino también para el estudio de células respiratorias y la biología molecular in vitro durante más tiempo y en un microambiente más preciso que previamente ha sido posible.
Protocolo
1. Biorreactor de la Asamblea
Figura detallado (s) del diseño de biorreactores y montaje tanto para descelularización y la cultura se proporcionan en las Figuras 1 y 2, respectivamente. Todos los componentes deben ser esterilizados antes de la asamblea del biorreactor. Los puntos específicos a continuación se indican:
CONEXIONES:
- La cánula arterial consiste en un ajuste de cierre luer conectado a un Y-splitter por un segmento corto de tubo. El conector de cierre luer se conecta a la tubería de perfusión, y el segmento de la Y que no se sutura a la arteria pulmonar se conecta a una válvula de una vía. La válvula de una vía está orientado de tal manera que el líquido puede ser elaborado en el tubo (en la dirección opuesta a la perfusión), pero durante la perfusión de los órganos todos los medio de flujos en el pulmón.
- De la cánula traqueal también se compone de un conector de cierre luer vinculado a un Y-splitter con un tubo. El cierre luer se conecta a un circuito de respiración entre el embalse de la tráquea y la cámara principal. El segmento de la Y-conector que no se sutura a la tráquea también está conectada a una válvula de una vía. La válvula de una vía se orienta en la misma forma que la cánula arterial.
FUNCIONES:
- Las válvulas unidireccionales en la cánula arterial y la tráquea se utilizan para eliminar las burbujas de aire en la tubería, permitiendo la inversión del flujo en la tubería y por lo tanto, las burbujas de aire que permite al ser eliminado.
- El "circuito de respiración" incluye dos válvulas unidireccionales, colocada de tal modo que el medio sigue un camino diferente dentro y fuera de los pulmones. Una descripción más detallada de esta característica se presenta en una publicación previa de nuestro laboratorio 2.
- Perfusión vascular se realiza utilizando una bomba de rodillo. Medio es perfundido a la arteria pulmonar a través de la cánula adjunta, fluye a través de la vasculatura pulmonar y la vena pulmonar directamente en el biorreactor principal, donde medio se ha elaborado para la perfusión.
2. Cosecha de Órganos
- La eutanasia para adultos (3-6 meses de edad) Fischer 344 ratas por sobredosis de pentobarbital sódico, de acuerdo con las directrices establecidas por la American Veterinary Medical Association (60 mg / kg IP). Nota: la solución de pentobarbital incluyen heparina a 100 unidades / ml para la anticoagulación.
- Rocíe o limpie el pecho y el abdomen con un 70% de etanol.
- Abrir la cavidad torácica, dejando al descubierto el corazón y los pulmones, teniendo cuidado de no dañar los pulmones. Con cuidado, hacer una pequeña ventana a través del diafragma hacia la cavidad torácica, los pulmones, causando que se retractara, y luego ampliar la incisión horizontal para exponer las bases de los pulmones. Hacer dos incisiones verticales a través de las costillas, y retirar la caja torácica para exponer el corazón y los pulmones.
- Preparar un sistema de perfusión por gravedad, es decir, utilizando una jeringa con el émbolo retirado, una llave de 3 vías, y ~ 20 cm del tubo con una 1.5inch, 21 de calibre de la aguja. Mantener la jeringa en el ~ 20 cm por encima del animal con un soporte de anillo. Asegúrese de que todo el aire del tubo de perfusión.
- Cortar la aurícula derecha para drenar la sangre, evitando que vuelvan a los pulmones. Corte de la aurícula izquierda para permitir un fácil drenaje de la sangre y la perfusión de los pulmones también puede ser útil, pero no es necesario.
- Insertar la aguja en la base del ventrículo derecho y abra la llave de paso para la perfusión de los pulmones con una solución de nitroprusiato de sodio y heparina (50U/ml y 1ug/ml, respectivamente) en PBS. Confirme que la arteria pulmonar se llena de líquido de perfusión, y que la sangre es claro de los pulmones. Si es necesario, vuelva a llenar la jeringa con la perfusión de líquidos. Por lo general sólo se requiere 10 ml ~.
- Continuar la perfusión hasta que los pulmones estén limpios de sangre, y luego se detiene la perfusión.
- Diseccionar la libre circulación de la tráquea, hasta el cuello en la medida de lo posible. Asegúrese de que la tráquea se separa del esófago. Diseccionar todas las conexiones restantes en el corazón, los pulmones y la tráquea, y eliminar en bloque.
- El uso de un bisturí o unas tijeras afiladas, corte la punta del corazón, la exposición de los ventrículos derecho e izquierdo.
- Canular el tronco pulmonar a través del ventrículo derecho, y la sutura en su lugar. Elimine cualquier exceso de tejido del ventrículo izquierdo.
- Canular la tráquea y de sutura en su lugar. Asegúrese de que tanto las cánulas traqueales y arterial pulmonar se colocan de tal manera que no hay ningún esfuerzo de torsión en la tráquea, los pulmones o los grandes vasos (Figura 1).
- Asegúrese de que no hay burbujas de aire en la cánula arterial, ya que las burbujas de aire atrapado en el sistema puede impedir el flujo constante de a través del órgano. En algunos casos, una burbuja de aire puede detener por completo el líquido flow.To lograr esto, coloque el bloque de corazón / pulmón en un frasco que contiene PBS. Use una jeringa con aguja para inyectar una pequeña cantidad de PBS en la cánula del corazón para expulsar las burbujas.
- Lavado de las vías respiratorias con PBS 4.5 veces, para eliminar el aire tanto como sea posible de los pulmones.
- Después del paso de lavados están completos, inflar el pulmón con PBS que contiene sodio nitroprusiato (SNP) en 1ug/ml. Poner un tapón en la cánula traqueal, por lo que la solución permanece en el pulmón. Permitir que el pulmón se incuban durante 30 minutos, ya que la misma solución que fluye a través de los vasos a través de la arteria pulmonar, para permitir la vasodilatación.
- Conecte el corazón / pulmones a un tope de biorreactor utilizando las conexiones luer-lock relacionado con la cánula en forma de Y, que se describe en la "Asamblea biorreactor" por encima. (Figura 1).
3. Órgano descelularización
- Conecte la tapa (con los pulmones adjunto) a los aparatos descelularización (Figura 1). La cánula de la arteria pulmonar se debe conectar a la línea de perfusión y de la cánula traqueal debe flotar libremente. Asegúrese de que todas las líneas estén libres de aire. Como se describió anteriormente, el aire en las líneas pueden ser una fuente de descelularización pobres al impedir el flujo de líquido decllularization. El aire atrapado en el sistema también puede persistir en el tiempo de cultivo, cuando se puede tener un impacto negativo en la supervivencia de las células 3.
- Inflar el pulmón con PBS / SNP hasta que los pulmones están llenos, pero no demasiado inflados. Inmediatamente tapa de la cánula traqueal por lo que el pulmón sigue siendo inflado.
- Perfusión pulmonar con PBS / SNP por lo menos durante 15 minutos a aproximadamente 15 mmHg (20 cm H 2 O de presión). Después de 15 minutos o más, retire el tapón de la cánula traqueal a permitir que el pulmón se desinfle.
- Continuar la perfusión con PBS / SNP durante 30 minutos. Si es necesario, vuelva a llenar PBS / SNP para garantizar la presión de perfusión se mantiene a 10-15 mmHg.
- Comenzar la perfusión con una solución de descelularización (CHAPS 8 mm, 1M NaCl, 25 mM EDTA en PBS 1X). Tenga cuidado para asegurar que todas las líneas estén libres de aire. Un sistema de vacío puede ser útil para proporcionar succión.
Perfusión con solución descelularización hasta 500 ml de solución a través de la perfusión pulmonar. Óptima de la presión es <15 mmHg (~ 20 cm H 2 O). Para ello será necesario 2,5 horas. Los caudales son normalmente muy lento (0.2-0.5ml/minute) inicialmente, y aumentar rápidamente durante la segunda hora a aproximadamente 1ml/minute o mayor. Periódicamente, extraer el líquido utilizado descelularización de biorreactor, asegurando suficiente líquido sigue siendo apoyar el pulmón y la cánula traqueal.
4. Órgano de lavado y esterilización
- Transferencia de pulmón y biorreactor de una campana de cultivo de tejidos. Empiece a enjuagar con PBS estéril, eliminando el frasco de 500 ml que contenía el líquido descelularización y reemplazar con un frasco estéril que contiene hasta 1 litro de PBS estéril. Use succión al vacío para asegurar que las líneas estén libres de aire.
- Perfundir PBS a través de la vasculatura de 10-15 mmHg, de la misma manera que para descelularización. Periódicamente, eliminar los desechos de biorreactor de PBS y reemplazar y / o rellenar el frasco con PBS fresco, PBS estéril. Es recomendable utilizar una técnica estéril.
- Proseguir con el lavado hasta por lo menos 2,5 L de PBS estéril han perfundido los pulmones.
- Transferencia de pulmón a un nuevo sistema, biorreactor estéril que contiene PBS. Asegúrese de que tanto el circuito de perfusión todo y las líneas de las vías respiratorias todo se llena de líquido. Todos los pasos posteriores se utiliza una bomba pulsátil para la perfusión de los pulmones en 5ml/min.
- Esterilizar el andamio, ya sea a través de la perfusión durante la noche con PBS + 10% de SFB + 10% pluma de estreptococos solución o durante 3 horas con 0,1% de ácido peracético en PBS. Esto último requiere enjuague el pulmón con 3 cambios de PBS 250ml durante varias horas para eliminar el ácido residual. Por cada lavado, el pulmón debe estar ventilado, así como perfusión para asegurar que todas las partes del tejido están bien enjuagados.
- La transferencia de los pulmones a una incubadora a 37 ° C y perfundir con PBS que tiene 10% de SFB y 10% de penicilina / estreptomicina ~ 1 hora o hasta que la temperatura se equilibra, en preparación para el tratamiento benzonasa.
- Tratar de pulmón con benzonasa para extraer el ADN remanente:
- Caliente el buffer benzonasa (véase la tabla de los reactivos) a 37 ° C.
- Para cada pulmón, llenar una jeringa de 10 ml con tampón benzonasa única y una jeringa de 10 ml con benzonasa 90U/ml en el buffer.
- Detener la perfusión del pulmón.
- Inflar la vía aérea con buffer benzonasa.
- Permitir que el pulmón se desinfla (de ~ 1 minuto). A continuación, inflar el pulmón con la solución benzonasa. Durante la inflación con tampón benzonasa y benzonasa, trate de evitar inyectar el aire en el pulmón.
- Permitir que el pulmón se siente sin perfusión o ventilación a 37 ° C durante 1 hora después de inflar con benzonasa.
- Reanudar la perfusión con la PBS + 10% de SFB, 10% de penicilina / estreptomicina que ya está en el biorreactor, y continúan durante la noche. Al día siguiente, el pulmón se puede conservar a 4 ° C (para un máximo de 3 meses) o preparadas para la siembra de células.
- Para preparar el andamiaje para la repoblación celular, reemplace el PBS / FBS / solución benzonasa con ~ 250 ml de medio de cultivo. Perfusión de al menos una hora antes que las células se introducen, unaª reemplazar con medio de cultivo fresco justo antes de la siembra de las células.
5. Recelularización
La elección de la fuente de células para la resiembra de órganos se deja a los investigadores individuales. Muchas fuentes de células pueden ser utilizadas, incluidas las poblaciones disponibles en el mercado, recién aisladas células pulmonar neonatal o fetal, las células madre embrionarias, o fuentes de células disponibles comercialmente. Protocolos específicos de aislamiento de estas poblaciones de células se pueden encontrar en otras partes 4,5,6. En este caso, se proporcionan instrucciones sobre la forma de semilla de las dos poblaciones de células epiteliales y endoteliales.
Siembra endotelial:
- Preparar una suspensión de la población deseada de las células endoteliales, en medio de cultivo apropiado. Suspensión de células de filtro a través de un colador para eliminar células 40um grupos de células. A la siembra endotelial típica en nuestro laboratorio se utilizan aproximadamente 30 millones de pulmón de rata células endoteliales microvasculares en 60 ml de medio de cultivo.
- Prescindir de la suspensión celular en un pequeño depósito temporal incorporado en el circuito de perfusión del biorreactor (Figura 2). Asegúrese de que la tubería de este depósito y el circuito de perfusión todo esté libre de burbujas de aire.
- Infunden las células en la arteria pulmonar en 3ml/min utilizando una bomba de rodillo.
- Después de la infusión de células, continuar la perfusión con un medio de recirculación de la bio-reactor principal a la tasa deseada.
- Sobre una base diaria, asegúrese de que el tubo de perfusión está libre de burbujas de aire.
- Medio debe ser reemplazado con un nuevo medio con regularidad, lo que a menudo se hace cada 3-4 días.
Siembra epiteliales:
- Preparar una suspensión celular de la población de células epiteliales que desee. En nuestro laboratorio, por lo general consiste de aproximadamente 50-100 millones de células de ratas pulmonar neonatal. Filtro de la población a través de células colador 40um y suspender en 15 ml de medio de cultivo en una jeringa. Llenar el depósito de las vías respiratorias con 80 ml de medio de cultivo.
- Coloque el biorreactor en un 37 ° C tejidos incubadora de la cultura, y conectar la bomba de jeringa para la ventilación. Asegúrese de que todas las líneas de ventilación estén libres de aire.
- Sembrar las células en los pulmones mediante la inyección de 15 ml de suspensión celular en una sola inyección en la cánula traqueal.
- Iniciaremos una sola respiración, lenta utilizando la bomba de jeringa. Esta respiración es administrado por la retirada de 60 ml de aire del biorreactor principal 3ml/minute, por lo tanto una duración aproximada de 20 minutos. Asegúrese de que los filtros de aire en el biorreactor principal se coronó inmediatamente después de la inyección de la suspensión celular y antes de comenzar la respiración lenta.
- Permitir que los pulmones se sientan estática de aproximadamente 18hrs, y luego comenzar la perfusión vascular lenta (aproximadamente 0,5 ml / min).
6. Órgano de la Cultura
Aunque los detalles de la perfusión y la ventilación puede variar en función del diseño experimental, los puntos a continuación se indican:
- Durante el cultivo endotelial, la perfusión se realiza típicamente en 1-3 ml / min usando una bomba de rodillo. Durante el cultivo epiteliales, la ventilación se proporciona normalmente a una velocidad constante de 1 respiración por minuto, utilizando una bomba de jeringa. La retirada de la 5-10ml de aire del biorreactor principal que normalmente se requiere para llevar a cabo la ventilación pulmonar en un volumen corriente normal. Debido a la necesidad de mantener la estanqueidad biorreactor durante la ventilación, la ventilación debe ser detenido al día y el aire en la cámara principal debe ser reemplazado. Todo el aire en el sistema de aire ambiente, que es aproximadamente el 21% de oxígeno por la presión parcial. El retiro de 5 10 ml de aire del biorreactor (que induce una inspiración 5-10ml de líquido en el pulmón) se basa en el tamaño de los lóbulos del pulmón y de cómo están siendo cultivados (lóbulos puede ser atado para el análisis, mientras que el lóbulos restantes continúan en la cultura). La cantidad de aire evacuado por la bomba de jeringa que se elija para aproximar el "volumen corriente" del pulmón cultivadas.
- Medio debe ser cambiado aproximadamente cada 3-4 días durante el cultivo.
- Durante el co-cultivo de ambas epitelio y el endotelio, los experimentos en el laboratorio de nuestra semilla por lo general primero el epitelio de 4-8 días, tiempo durante el cual se ventila la ingeniería tisular. El endotelio es entonces cabeza de serie a través de la perfusión, después de que el tejido es a la vez perfundidos y ventilados.
7. Los resultados representativos:
Descelularización
Cuando el protocolo se realiza correctamente, los pulmones recién extraído debe contener el aire sin filtrar. Inflando con aire mientras está sumergido en un líquido puede comprobar esto - no debe haber burbujas que indican las fugas de aire. La descelularización posterior debe permitir ~ 500 ml de líquido descelularización fluya a través de los pulmones a lo largo de 2,5 a 3 horas a 37 ° C, y en última instancia, PBS debe ser capaz de fluir a través de los pulmones a unos 10 ml / min (en ~ 15 mm Hg de la presión hidrostática) al final de enjuague. Después del tratamiento con 0,1% de ácido peracético y benzonasa, los pulmones se pueden almacenar a 4 ° C durante un máximo de 3 meses, y aún así seguir siendo adecuada para recelularización.
La final de la matriz extracelular descelularizada debe estar completamente desprovisto de materiales celulares, y conserven las características bruto, microscópicas y ultraestructurales de pulmón nativo. Descelularización insuficiente o enjuague puede dar lugar a restos de ADN se "pega" a la horca, que pueden ser visualizados con un estándar de hematoxilina y eosina (véase la Figura 3 para la comparación).
Repoblación de la matriz acelular y la cultura del tejido pulmonar
Si las células son aisladas de 7 días de edad las crías de rata neonatal, como se describe en el suplemento en línea que acompaña el trabajo de Petersen y sus colegas 4, se puede esperar un rendimiento celular de 120-150 millones de células por litro de 10 crías (poco más de 10 millones células por recién nacido).
Las condiciones óptimas para la siembra y cultivo de los posteriores del pulmón en el biorreactor debe rendir bien distribuidos dentro de las células de los 5 lóbulos del pulmón, y debe proporcionar una cobertura de aproximadamente el 70% de la matriz extracelular andamios (Figura 3). La población de células cultivadas será positivo para los principales marcadores de células respiratorias, tales como pro-secreción de proteína-C (CPE), de células Clara proteína secretora (CCSP), y acuaporina 5 (AQP), con el fin de la abundancia relativa (Figura 4).
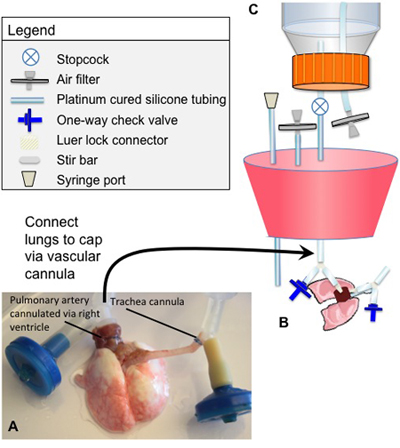
Figura 1. Cánulas puestos y biorreactor descelularización
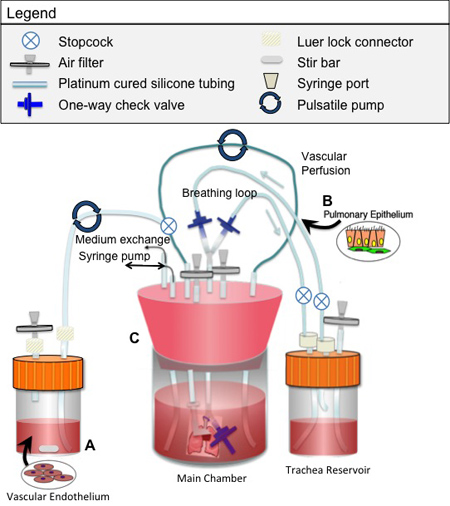
Figura 2. Biorreactor utilizados para la siembra y cultivo de tejido pulmonar de ingeniería
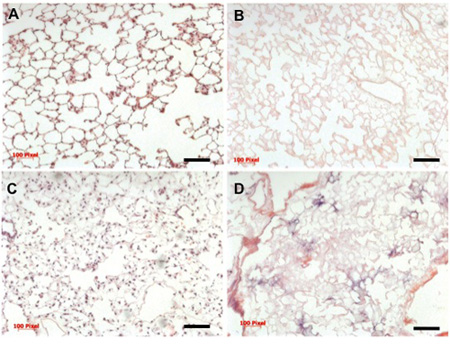
Figura 3. Histología de descelularizada nativos, y el pulmón repoblada
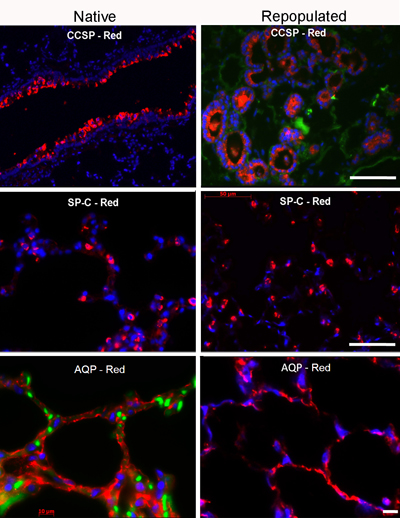
Figura 4. La tinción de inmunofluorescencia para los marcadores de pulmón clave
Discusión
Los aspectos más críticos del sistema que aquí se presenta incluye el mantenimiento de la esterilidad, y la estrecha vigilancia de las presiones ejercidas sobre el lecho vascular en todo el proceso de preparación y siembra el andamio y el cultivo de la repoblación de pulmón. La esterilidad se mantiene mejor en autoclave todos los materiales antes de su uso, y mediante el montaje de los pulmones en un sistema cerrado poco después de explante y evitar el posterior incumplimiento de esta barrera. Después de la matriz descelularizada ha sido totalmente aclarado y se transfiere a un biorreactor estéril para la cultura, el tapón de silicona y otros sellos y las conexiones no debe ser alterado o eliminado. Para mantener la presión bajo control, el flujo por gravedad, es preferible siempre que sea posible. Cuando una bomba es necesaria para la recirculación del fluido, que comienzan después del lavado con PBS y continua durante el cultivo, se recomienda medir directamente la presión justo antes de que el líquido entra en la arteria pulmonar con un transductor de presión. La magnitud de la presión aplicada no debe exceder los 15 mm Hg.
Recellularized pulmones pueden ser cultivados durante períodos variables de tiempo, por lo general van de 4 días a un máximo de 3 semanas. Perfusión vascular se realiza generalmente en 1-3 ml / min durante el cultivo del endotelio, mientras que la ventilación se aplica típicamente a una velocidad de 1 respiración / min durante el cultivo epiteliales. Durante los periodos de la cultura combinados, la ventilación y la perfusión simultánea es la adecuada. La ventilación se puede realizar con cualquier medio líquido o aire.
En el transcurso de las últimas décadas, varios grupos han realizado una importante labor de ingeniería de tejidos que muestran la viabilidad de la diferenciación del epitelio pulmonar in vitro y de reproducir varios aspectos de pulmón microanatomía 7,8,9, 10. Sin embargo, hasta hace poco, ninguno de estos intentos de 4,5 para diseñar el tejido pulmonar se había traducido en un órgano implantable que fue capaz de mantener la separación entre la sangre y los compartimentos de las vías respiratorias y que pueden participar en el intercambio de gases. Por lo tanto, aunque los métodos descritos son sólo un primer paso hacia el objetivo a largo plazo de la generación de tejido pulmonar funcional, este trabajo es un paso alentador hacia la posibilidad de aumentar la cantidad de tejido pulmonar disponible para el trasplante. Por otra parte, este trabajo elabora el trabajo realizado por Ott et al. Uygun y sus colegas y 11,12, lo que demuestra la eficacia de una matriz extracelular descelularizada como un andamio para la ingeniería de tejidos tridimensionales complejas estructuras y apoyar el crecimiento y la supervivencia de varios tipos de células . Este trabajo también es importante por su contribución al arsenal terapéutico de las células respiratorias y biólogos moleculares. Al ofrecer un único entorno tridimensional que también puede proporcionar adecuados estímulos mecánicos, y que no comparte el riesgo concomitante de una rápida des-diferenciación que se puede encontrar al epitelio de cultivo de los roedores en el laboratorio con los métodos más tradicionales 13, los científicos podrían usar nuestro sistema para obtener nuevos conocimientos sobre las interacciones célula-célula y célula-matriz que juegan un papel en la diferenciación y función celular. Este conocimiento puede ser muy poderosa si se usa como palanca para guiar el destino de varias poblaciones de células madre, como grupo Cortiella ha demostrado en los estudios iniciales 14.
Divulgaciones
Agradecimientos
Damos las gracias a Maegan B. Colehour para ayudar con el desarrollo bio-reactor. Estos estudios fueron financiados por la Universidad de Yale Departamento de Anestesia y por el NIH subvención HL 098 220 (a LEN). THP fue apoyado por el NIH T32 GM007171.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Eutanasia | |||
| Heparina | Sigma-Aldrich | H4784 | |
| Nitroprusiato de sodio | Fluka | 71778 | |
| Euthasol solución de la eutanasia | Virbac AH | 710101 | 390 mg / ml de solución de pentobarbital de sodio de valores debe ser diluido apropiadamente para la administración de IP |
| Decell Solución | |||
| CHAPS | Sigma-Aldrich | C3023 | |
| NaCl | Estadounidense Bioanalytical | AB01915 | |
| EDTA | Sigma | E5134 | |
| NaOH | JT Baker | 3722-01 | |
| 1X PBS | Gibco | 14190 | |
| Componentes biorreactor | |||
| 480 ml frasco | Cole Parmer | EW-3460560 | |
| Tapón de silicona, talla 14 | Cole Parmer | EW-06.298-26 | |
| Y-conectores | Cole Parmer | ED-30.614-08 | Se utiliza para cánulas arteriales y traqueal |
| Tubo de silicona | Masterflex | 96420-14, 16 | L / S 14, 16 |
| Transductores de presión | Edwards Lifesciences | PX-212 | |
| La válvula de retención | Cole Parmer | EW-98.553-20 | Válvula de una vía |
| Llaves de paso de 4 vías | Edwards Lifesciences | 594WSC | |
| Filtro de jeringa | Cole Parmer | 2915-08 | PTFE, 0.2μm |
| Decell y apparati enjuague (adiciones al biorreactor) | |||
| 500 y 1000 ml botellas de vidrio | Corning | 1395-500;-1L | Se utiliza para decell y aclarado por la gravedad |
| Benzonase tratamiento | |||
| Penicilina / estreptomicina | Gibco | 15140122 | |
| FBS | Hyclone | SH30071.03 | |
| Tris-HCl | Estadounidense Bioanalytical | AB14043 | 1 M, pH 8,0 |
| MgCl2 | JT Baker | 2444-01 | |
| BSA | Sigma | A9647 | |
| Benzonase nucleasa | Sigma | E1014 | Endonucleasa utiliza para eliminar restos de ADN de la matriz |
Referencias
- American Lung Association. . Lung Disease Data. , (2008).
- Petersen, T. H., Calle, E. A., Colehour, M. B., Niklason, L. E. Bioreactor for the Long Term Culture of Lung Tissue. Cell Transplant. , (2010).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface tension induced epithelial cell damage in a model of pulmonary airway reopening. J Appl Physiol. 94, 770-783 (2003).
- Petersen, T. H. Tissue-Engineerined Lungs for in Vivo Implantation. Science. 329, 538-5341 (2010).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-9233 (2010).
- Cortiella, J. Influence of acellular natural lung matrix on murine embryonic stem cell differentiation and tissue formation. Tissue Eng. Part A. 16, 2565-2580 (2010).
- Sugihara, H., Toda, S., Miyabara, S., Fujiuyama, C., Yonemitsu, N. Reconstruction of alveolus-like structure from alveolar type II epithelial cells in three-dimensional collagen gel matrix culture. Am J Pathol. 142, 783-7892 (1993).
- Choe, M. M., Sporn, P. H., Swartz, M. A. Extracellular matrix remodeling by dynamic strain in a three-dimensional tissue-engineered human airway wall model. American Journal Respiratory Cell Molecular Biology. 35, 306-306 (2006).
- Cortiella, J. Tissue-enginered lung: an in vivo and in vitro comparison of polyglycolic acid and pluronic F-127 hydrogel/somatic lung progenitor cell constructs to support tissue growth. Tissue Engineering. 12, 1213-1213 (2006).
- Price, A. P. Development of a Decellularized Lung Bioreactor System for Bioengineering the Lung: The Matrix Reloaded. Tissue Eng Part A. , (2010).
- Ott, H. C. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat. Med. 14, 213-221 (2008).
- Uygun, B. E. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat. Med. 16, 814-820 (2010).
- Shannon, J. M., Mason, R. J., Jennings, S. D. Functional differentiation of alveolar type II epithelial cells in vitro: effects of cell shape, cell-matrix interactions and cell-cell interactions. Biochim. Biophys. Acta. 931, 143-156 (1987).
- Cortiella, J. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng Part A. , (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados