需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从废弃的人类胎儿大脑皮质组织神经干细胞的生成
摘要
描述一个简单和可靠的方法是从丢弃的人类胚胎皮层组织的神经干细胞的分离和培养。从已知的人类神经系统疾病的病理细胞和分子过程的特性,可用于文化,以及提供一个平台,以评估药理药效。
摘要
神经干细胞(NSCs)居住在沿脑室区神经上皮的皮质板的发展。这些早期的祖细胞,最终上升到中间的祖先,后来,大脑皮层的各种神经元和神经胶质细胞亚型。发电量和扩大人类神经干细胞从废弃的正常胎儿组织(所谓的神经球)提供了一种手段,用以直接研究人体正常的国科会发展 1-5的功能方面。这种方法也可以直接向从已知的神经系统疾病的神经干细胞的生成,从而给予的机会,以确定疾病的进程,改变祖细胞的增殖,迁移和分化6-9。我们一直专注于识别人类唐氏综合征的神经干细胞可能有助于加速老年痴呆症的疾病表型10,11的病理机制。无论在体内还是在体外培养的小鼠模型,可以复制的基因位于人类21号染色体上的相同的剧目。
这里我们使用一个简单而可靠的的方法隔离综合征从流产的人类胚胎皮层神经干细胞,并在文化中成长。该方法提供有限的解剖标志,细胞分选,电镀和人类神经干细胞传代收获组织,解剖的具体方面。我们还提供一些基本的协议更有选择性的细胞亚型的人类神经干细胞诱导分化。
研究方案
1。神经干细胞培养的清扫和维护的解决方案和材料的制备
- 提前准备100毫升夹层中(KNOCKOUT的DMEM/F12,Invitogen)和冷藏。
- Prepare100毫升培养液(干临NSC可持续森林管理,Invitrogen公司),并保持在37 ° C在水浴。
- 准备长期长期冷冻保存的细胞的细胞冷冻培养基(KNOCKOUT的DMEM/F12 +10%胎牛血清+ 5%DMSO)。
- 如果需要,准备为4%多聚甲醛(PFA)组织固定。
- 消毒,灭菌镊子和手术刀片,带手柄用于清扫。
- 抛开移液枪,10毫升转移移液器,和40微米的细胞过滤器解离(屋宇署猎鹰352340)。
- 预留10厘米的几个文化菜解剖光盘(BD),50 mL离心管解离(BD),组织储存和冷冻小瓶冷冻细胞(BD)的1.5 mL离心管。
2。隔离人类神经干细胞从人类胎儿大脑
- 收获后,立即终止对胎儿的可行的组织是手术成功的关键。选修的程序,定时获取样品可以提前安排,以尽量减少胎儿死亡后的时间。概念产品收获后2小时内的程序,但最好可以在几分钟之内的选任程序实现。胎儿组织中,往往是支离破碎。然而,在一般情况下,大脑的很大一部分仍然完整的视觉识别。胎龄(GA)的限制是由成文法,但已使用此协议,GA 18-22周之间。
- 胎儿的大脑被放置在一个10毫升的Petri菜含有冰冷的基因敲除的DMEM/F12解决方案。识别解剖标志的皮质的不同部位。正面和parieto枕部皮层的边界推断中央沟和裂裂交集为导向。从中央沟前额叶皮层和沿边境的手术刀裂裂的解剖组织,一定要保持完好的心室和完好。
- 从额叶皮层的分离块删除任何残留的血液和脑膜。如果样品是足够的质量,它是理想的解剖成几个较小的样本,作各种用途的块:部分(固定在4%多聚甲醛,煤灰)和蛋白质/基因检测(快于-80℃冷冻)。
- 选定的脑块转移到50 mL离心管中,并加入组织的货量约3倍,冰冷的基因敲除的DMEM/F12解决方案。轻轻机械吹打分离10毫升移液管组织,直到所有的组织变得支离破碎(一般为20-30倍),然后通过一个40微米的细胞滤网(屋宇署猎鹰352340)过滤的细胞获得单或接近的单细胞停牌。
- 在2000转和室温离心5分钟,细胞悬液,在10毫升的新鲜温暖的培养液(干临NSC SFM),重悬细胞沉淀,血球计数细胞数。
- 添加到5毫升的温暖的培养液, 每 25平方厘米培养瓶和 2X10 6细胞转移到每个烧瓶中。文化是保持在37 ° C / 5%的CO 2培养箱中培养1周前分析。更改为进一步培养或实验一周一次中期的一半。
3。神经干细胞的进一步鉴定或experimentations Manipulaton
- 神经球通常建议文化与NSC直径200至400微米不等的条件下形成1至2周。在此阶段神经球,可解离为15分钟获得单细胞为0.2 g / L的EDTA钙和镁的自由汉克斯介质(汉克斯)在37 ° C。细胞悬液纺在2000转,新鲜汉克斯冲洗,在温暖的亚文化的培养基replated。
- 要开始分化,游离细胞均镀上涂层的盖玻片poly-D-lysine/laminin 1 1X10 5%盖玻片细胞(24mmX24mm)的密度。少突胶质细胞分化是通过维持细胞KNOCKOUT的DMEM/F12(Invitrogen公司,主,MD)2%B27(50X,Invitrogen公司,主,医师),10 ng / ml的碱性成纤维细胞生长因子100毫微克/毫升SHH +在10ng/ml,PDGF - AA 2天没有生长因子,然后切换到同一介质中,另外5天。神经元的分化是通过维持细胞击倒7天的DMEM/F12 +2%B27(50X)。星形胶质细胞的分化是通过击倒了一个星期的DMEM/F12 1%胎牛血清培养细胞。
- 从预制神经球分离细胞,神经干细胞基因转染可以做。在这里,我们表现出神经干细胞与EGFP - C1转染,电。电EGFP - C1的构造是利用小鼠神经干细胞AMAXA Nucleofector套件(VPG1004)AMAXA Nucleofector设备(龙沙AAD - 1001)后,该公司的指令。总之,1 × 10 6细胞的5微克的DNA与100μL转染介质,混合和脉冲电后,细胞悬浮在神经干细胞维持进一步的文化媒介。转染细胞的分化与神经球后,电的3-4天的分解进行了处理,下面的步骤3.2中所描述的相同程序。
4。冻结的神经干细胞和亚文化
- 游离细胞悬液,离心和冻结介质悬浮1X10 7细胞/瓶/毫升的浓度。慢慢冻结的细胞在-20℃,-80 ° C,然后转移存放时间过长,以液态氮。
- 这些细胞快速解冻37 ° C水浴和悬浮在温暖的DMEM/F12 10%血清一洗,离心除去冷冻介质,并在温暖的培养基中悬浮。
5。代表性的成果:
下面描述的方法和神经球,可以看到一个圆形,光滑的边框和相当同质的大小(图2a)一周后,从18孕周的正常胎儿的神经干细胞培养。这些神经球,可转与EGFP - C1或其他结构和荧光显微镜下(图2b)。成立神经球,然后用EDTA和镀涂盖玻片分散的细胞分离。 4%parafamaldehyde,并根据各自的协议分化的细胞固定与不同的细胞类型特异性标志物染色。 Multipotentiality观察与表达的标记指示(Fig2C D,若丹明)星形胶质细胞神经元(Fig2E,女,罗丹明)和少突胶质细胞(Fig2G H,若丹明)。没有经历电EGFP的细胞也分化成不同细胞类型和不同的细胞特异性标志物染色。 Multipotentiality观察与表达的标记指示(Fig3A,B fluoroscein)星形胶质细胞神经元(Fig3C,若丹明和Fig3D,fluoroscein)和少突胶质细胞(Fig3E,女,若丹明)。
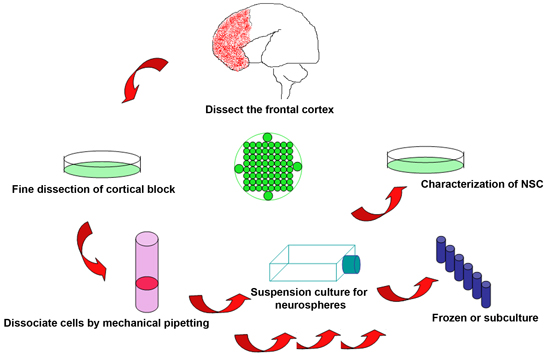
隔离丢弃人类胎儿大脑的神经干细胞的实验过程示意图图1 。

图2,未分化和分化的人类神经细胞,在体外propogated。 (一)神经球相差显微镜下表现出光滑,圆形的边界和文化的快速增长后1个星期以上。 (二)各种质粒和构造的介绍,可以通过转。三天EGFP - C1转染,多个单元格显示fluoroscein免疫荧光显微镜下看到的绿色荧光蛋白的表达。 EGFP - C1转染神经球是分离和分化成神经元(C,D),星形胶质细胞(E,F)和少突胶质细胞(G,H)的不同条件下,罗丹明荧光下所见。同时,转染EGFP的阳性细胞fluoroscein荧光下显示。转染细胞(白色箭头头),未转染细胞(白色箭头)无异。 Hoechst33342细胞核染色。比例尺为200μm为A,B的100微米和25微米的CH。
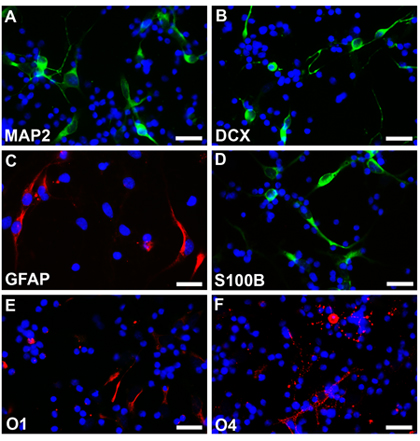
图3。神经球未转分离和分化成神经元(A,B fluoroscein),星形胶质细胞和少突胶质细胞(C,D,若丹明,fluoroscein)(E,F,若丹明)不同条件下。 Hoechst33342细胞核染色。比例尺是25微米的AF。
讨论
是对文化的新鲜组织和人类细胞系生产的各种方法。从历史上看,已经收获和新鲜组织培养,立即在中枢神经系统中产生的各种细胞类型。然而,这种做法显然是有限的,可这在人类样本的情况下,通常是相当小的样本数量。鉴于操纵的最小程度,新鲜培养的神经细胞提供最可靠的实验系统,通过限制延长培养潜在的工件。供应有限导致的第二种方法产生人体细胞线,已通过插入各种癌基因12...
披露声明
致谢
这项工作是支持部分由美国国立卫生研究院:HD054347和NS063997 - 01到VLS的。通过国务院卫生合同#C024324到VLS的纽约帝国州干细胞基金中的一部分,这项工作也得到了支持。这里所表达的意见仅为作者个人的,不一定反映帝国干细胞,纽约州卫生署,纽约州的。 VLS的是一个多丽丝公爵临床科学家发展奖得主。我们也感谢他的反O1,反物理学抗体的礼物教授蒂莫西Vartanian。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| KNOCKOUT的DMEM/F12 | Invitrogen公司 | 12660-012 | 解离中等 |
| 干临国科会可持续森林管理 | Invitrogen公司 | A10509 - 01 | 培养基 |
| 胎牛血清 | Invitrogen公司 | 10091-148 | 冷冻介质 |
| Hanks液( 钙,镁2) | Invitrogen公司 | 14175-095 | 解离中等 |
| 二甲基亚砜 | Sigma - Aldrich公司 | D2650 | 冷冻介质 |
| EDTA | Sigma - Aldrich公司 | 431788 | 解离中等 |
| 多聚甲醛 | Sigma - Aldrich公司 | 158127 | 固定的解决方案 |
| 碱性成纤维细胞生长因子 | 研发 | 234 - FSE | 分化培养基 |
| SHH | 研发 | 1845 - SH | 分化培养基 |
| PDGF - AA | 研发 | 221 - AA | 分化培养基 |
| B27 | Invitrogen公司 | 17504-044 | 分化培养基 |
| 鼠抗- MAP2 | Sigma - Aldrich公司 | M2320 | 1:200 |
| 兔抗- DCX | 细胞信号转导 | 4604s | 1:200 |
| 兔抗GFAP | DAKO公司 | Z0334 | 1:200 |
| 兔抗- S100B | DAKO公司 | Z0311 | 1:200 |
| 兔抗O1群 | 教授Timothy Vartanian礼物* | 1:50 | |
| 兔抗- O4 | 教授Timothy Vartanian礼品* | 1:50 | |
| 40微米细胞过滤器 | 屋宇署猎鹰 | 352340 |
*提摩太Vartanian,医学博士,哲学博士,美国威尔康乃尔医学院神经病学和神经科学,纽约,系
参考文献
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r., Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。