Method Article
In-vivo-Laser Axotomie in C. elegans
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ein Protokoll, um Neuronen im Schnitt C. elegans Mit einem MicroPoint gepulster Laser vorgestellt. Wir beschreiben die Einrichtung des Systems, Immobilisierung Würmer und Durchtrennen markierten Neuronen. Vorteile sind ein relativ kostengünstiges System und die Fähigkeit, neuronale Prozesse oder abzutragen Zellen trennen In vivo.
Zusammenfassung
Neuronen mit anderen Zellen über Axone und Dendriten, schlank Membran-Erweiterungen, die prä-oder post-synaptischen Spezialisierungen enthalten kommunizieren. Wenn ein Neuron durch Verletzung oder Krankheit beschädigt wird, kann es zu regenerieren. Cell-inneren und äußeren Faktoren beeinflussen die Fähigkeit eines Neurons zu regenerieren und Restore-Funktion. Vor kurzem hat die Nematoden C. elegans wurde als ein hervorragendes Modell Organismus entstanden, um Gene zu identifizieren und Signalwege, die die Regeneration von Neuronen 1-6 beeinflussen. Die wichtigste Methode, um neuronale Regeneration in C. initiieren elegans ist die Laser-vermittelte Schneiden oder Axotomie. Während Axotomie, ist ein fluoreszenzmarkierten neuronalen Prozess abgetrennt mit Hochenergie-Impulsen. Zunächst neuronalen Regeneration in C. elegans wurde unter Verwendung eines verstärkten Femtosekunden-Laser 5. Allerdings haben anschließenden Regeneration Studien gezeigt, dass eine konventionelle gepulste Laser verwendet werden, um genau zu trennen Neuronen in vivo und rufen eine ähnliche regenerative Antwort 1,3,7 werden.
Wir präsentieren ein Protokoll für die Durchführung von In-vivo-Laser Axotomie in der Wurm mit Hilfe eines MicroPoint gepulsten Lasers, ein schlüsselfertiges System, das leicht zugänglich ist und dass wurde in großem Umfang für gezielte Zellablation verwendet. Wir beschreiben die Ausrichtung der Laser-, Montage der Würmer, Schneiden bestimmten Neuronen und Beurteilung anschließende Regeneration. Das System bietet die Möglichkeit, eine große Zahl von Neuronen in mehreren Würmern während eines Experiments abgeschnitten. So ist die Laser-Axotomie wie hier beschrieben, ein effizientes System für die Initiierung und Analyse des Prozesses der Regeneration.
Protokoll
1. Zusammenbau des Systems
Die spezifischen Komponenten unseres Systems sind unten aufgeführt. Wenn sie richtig montiert, sollte der Benutzer in der Lage sein, das Mikroskop mit einer Hand zu konzentrieren, bewegen sich die Bühne mit den anderen (entweder mit der Maus oder dem Joystick), aktivieren Sie den Laser mit dem Fußpedal, und haben eine klare Sicht auf die on- Bild ein.
- MicroPoint Laser montiert, um die Epi-Fluoreszenz-Port eines zusammengesetzten Mikroskop. Wir verwenden eine Nikon 80i, aber keine Forschung-grade aufrecht oder invertiert Umfang funktionieren sollte. Die MicroPoint System wird eine eigene dichroitische, die den Fluorophor, dass die Zellen, die Sie möchten Etiketten passen sollten. Cutting-Zellen mit alternativen Fluorophoren markiert erfordert zusätzliche dichroics. Zusätzlich ist ein Impulsgeber und Fußpedal mit dem MicroPoint System kommen.
- 100x, 1,4 NA Öl-Objektiv für die Durchführung von Operationen und die Beurteilung Regeneration, plus zusätzliche Ziele wie nötig für die Lokalisierung der Probe auf dem Objektträger. Wir verwenden eine Nikon Plan Apo VC für Chirurgie, und feststellen, dass ein 4-fach nützlich ist für die grobe Fokussierung und der Suche nach der Probe.
- Motorisierte Bühne mit Joystick. Eine Bühne mit extrem hoher Genauigkeit und Reproduzierbarkeit ist überflüssig, da die Bühne ist nur für die Ausrichtung verwendet. Wir verwenden eine Vor OptiScan II (siehe Diskussion).
- Camera. Die Kamera muss eine Frame-Rate aus, um Fokus und Ziel der markierten Neuriten mit den 100x-Objektiv, bei der Visualisierung des Bildes auf dem Computer zu überwachen. Wir bevorzugen Abschwächung des Beleuchtungslicht während der Axotomie Verfahren, um mögliche Verwechslung Effekte aus Foto-Entfärben oder Schäden (siehe 1.7 unten) zu vermeiden. So muss die Kamera empfindlich genug sein, um diese reduzierte Lichtmenge aufnehmen. Wir verwenden eine Hamamatsu Orca 05G, und finden, dass die Bildgebung bei 16,3 Hz ist ausreichend. Equivalent-Kameras ersetzt werden könnten.
- Computer, Monitor und Imaging-Software, dass die Kamera fahren kann. Darüber hinaus verwenden wir die Imaging-Software, um den motorisierten Bühne mit einer Maus zu manipulieren (siehe Diskussion).
- Air Tisch. Diese Anforderung kann je nach Standort variieren, aber seit der Operation mit einem 100x Objektiv durchgeführt wird, finden wir Schwingungsisolierung wesentlich zu sein.
- Leichte Versorgung mit Lichtleiter und Verschluss-Mechanismus für die Beleuchtung des Fluorophors. Der Lichtleiter wird dem MicroPoint befestigen. Der Verschlussmechanismus ist nützlich, um die Beleuchtungsstärke unabhängig von der Laser reduzieren. Wir verwenden eine Vor Lumen 200 oder einer Leica EL6000 und dämpfen bis zu 80% der gesamten Lichtintensität für Axotomie.
2. Laser-Setup
Ein detailliertes Protokoll zunächst koordiniert und gebündelt wird der Laser mit dem MicroPoint Lasersystem zur Verfügung gestellt. Wir gehen davon aus, dass dieses Verfahren eingehalten wurde erfolgreich beim ersten Setup gefolgt. Dazu gehören die Ausrichtung der Laser mit dem Fadenkreuz im Okular. Hier bieten wir ein Protokoll für die regelmäßige Wartung der Laserfokus und Intensität.
Wie in der MicroPoint manuelle erwähnt, ist die gepulste Stickstoff-Laser in der Lage schweren Schaden für das menschliche Auge. Es sollte darauf geachtet, niemals direkt in den Laserstrahl werden. Einmal installiert, sollte das Sperrfilter sicher Block-Strahlung durch die Okulare.
Cutting Neuronen in einem Organismus von der Größe eines Sandkorn kann schwierig sein. Da der Bereich der Schäden, die durch den Laser getan ist sehr klein, ist es unerlässlich, die dreidimensionale Position des Laserfokus zu kennen, um die Probe exakt Ziel. Der Laserfokus wird mithilfe der gespiegelten gleiten. Zunächst testen wir, dass die z Position des Laserfokus im Fokus der Bildgebung Weg entspricht. Als nächstes wird der xy Ort des Schadens Fokus mit Fadenkreuz in der Imaging-Software markiert.
Focusing in der z-Ebene
- Drücken Sie den Graufilter ND16 (Abbildung 1a). Wir verwenden Neutralfilter in der Epi-Illumination Pfad zu dem Laser zu dämpfen und gleichzeitig einen Schwerpunkt. Für noch feinere Fokussierung, drücken sowohl in der ND16 und ND4 fluoreszierenden Filter.
- Stellen Sie die MicroPoint Laser 1 Impuls mit dem Schalter drehte sich zu 'Select' (Abbildung 1b), und bewegen Sie dann den Filter Rad, um die entsprechenden langen Bypass-Sperrfilter (Abbildung 1c).
- Legen Sie die gespiegelte Bild auf der Bühne und konzentrieren sich auf Nadelstiche in ihm mit dem 4X Ziel Durchlicht.
- Fügen Sie einen Tropfen Immersionsöl auf das gespiegelte Bild und eine Neuausrichtung auf Nadelstiche mit dem 100X Objektiv. Öffnen Sie den Verschluss der Kamera mit dem Strahlengang Schalthebel (Abbildung 1d) und der Laser Shutter (Abbildung 1e). Wenn nötig, transmittierten Lichtintensität, so dass die Kanten der Löcher gestochen werden: dies wird in der Fokussierung genau zu helfen.
- Drücken Sie das Fußpedal. Dabei sollte sich ein kleines Loch in den Spiegel, wenn der Laser richtig fokussiert ist.
- Fokus des Mikroskops etwas oberhalb der Ebene der gespiegelten Bild und schießen den Laser wieder. Dies sollte eine noch kleinereLoch als der erste Schuss, oder lassen Sie keine Marke überhaupt. Wiederholen Sie die durch die Konzentration unterhalb der verspiegelten Folie.
- Wenn ein Loch ist nicht in 2.5 produziert, oder wenn ein größeres Loch entsteht, wenn die sich oberhalb oder unterhalb der Oberfläche des Spiegels, Neuausrichtung der Laser mit der Fokus-Ring auf der Ablation Kopf. Stellen Sie sicher, dass das Loch noch richtig mit dem Fadenkreuz im Okular ausgerichtet. Bei konsequenter Nutzung der z-Ebene konzentrieren selten angepasst werden muss.
Focusing in der xy-Ebene
- Folgen Sie den Schritten bis 2.3 über 2,1, und drücken Sie das Fußpedal, um ein kleines Loch in den Spiegel gleiten zu machen.
- Initiate 'Live' Capture-Modus aus den Elementen 'Acquire' Menü. In der "Measure"-Symbolleiste wählen Sie "ROI-Editor", und wählen Sie dann den 'double cross "-Werkzeug und ziehen Sie das Fadenkreuz, um sie mit dem Zentrum der neuen Loch ausrichten. Klicken Sie auf "Save ROI" und dann "Exit-Editor 'und wieder Live-Capture-Modus.
- Aktivieren Sie die "Maus XY"-Einstellung in Elemente auf der Bühne mit der Maus zu manipulieren.
- Ziehen Sie den Graufilter (s) wieder in die ursprüngliche Position (en), stellen Sie den Laserpulsen bis 10, und entfernen Sie das gespiegelte Bild.
Einstellen der Leistung des Lasers
- Die Leistung des Lasers sollte auf ein Minimum Kraft notwendig, um das Neuron Ihrer Wahl geschnitten eingestellt werden. Stellen Sie die Macht, indem Sie die Dämpfungsplatte (Abbildung 1f) während des Schneidens lebenden Würmer (wie unten beschrieben). Wenn die Laserleistung zu hoch ist, kommt es zu peripheren Schäden oder Explosion ein Loch in den Wurm. Wenn die Laserleistung zu gering ist, wird es nicht sever des Neurons. Sobald das System eingerichtet wurde, die Stellung der Eichleitung nur selten geändert werden muss. Wenn der Laser wird schwach, und die Dämpfungsplatte muss bewegt werden, um weiter schneiden, könnte dies ein Zeichen, dass der Farbstoff in der Farbstoff-Zelle zu ersetzen (siehe Diskussion) werden muss.
3. Immobilisierung der Würmer
- Bereiten Sie eine Lösung von 3% geschmolzene Agarose in M9 (22mm KH2PO4, 42mm Na2HPO4, 85mm NaCl, 1 mM MgSO4). Dispense 5 ml geschmolzene Agarose in ein 15 ml Falcon Röhrchen. Füllen Sie ein anderes Rohr mit Wasser. Die Röhrchen in ein modulares Heizelement bis 55 ° C eingestellt Füllen Sie das Heizelement mit Wasser zu mini Wasserbäder für jedes Röhrchen zu schaffen. Hinweis: Agarose in großen Mengen auf Vorrat hergestellt werden und für die nachfolgenden Experimente wieder eingeschmolzen.
- Legen Sie zwei Schichten der Etikettierung Band auf jedem der beiden Rutschen und einen sauberen Objektträger zwischen diesen Folien. Dispense einem Rückgang von Agarose mit einem Kunststoff-Glühbirne Pipette auf die Mitte des sauberen Objektträger und legen Sie eine andere Folie senkrecht zur ersten, so dass die resultierende Agarose-Pad die Dicke von zwei Stücken des Bandes (Abbildung 2). Entfernen Sie eine der beiden Folien aus dem Pad nach 30 Sekunden. Spülen und speichern Sie die Kunststoff-Pipette in die mit Wasser gefüllten Falcon-Röhrchen für die Verwendung mit nachfolgenden Folien.
- Als nächstes legen Sie 3-5 ul von 0,10 um oder 0,05 um Polystyrol-Kügelchen in der Mitte des Pads. Add 5-10 Würmer Ausdruck fluoreszierendes Protein in den Nervenzellen des Interesses. Wenn die Neuronen von Interesse asymmetrisch auf der rechten oder linken Seite des Wurms verbreitet sind, verwenden Sie eine Platin holen, um Würmer, so dass die richtige Seite nach oben drehen. Worms muss auf Folien innerhalb von 10 Minuten Vorbereitung der Agarose-Pads gelegt werden.
- Vorsichtig ein Deckglas auf die Würmer. Nach dem Aufsetzen des Deckglases, bewegen Sie es nicht in Bezug auf die Agarose-Pad, da dies die Nagelhaut zu stören und zerstören die Würmer. Legen Sie die vorbereiteten Objektträger unter dem Mikroskop Bühne.
4. Cut Neuronen
- Direktes Licht in die Okulare mit dem Strahlengang Schalthebel. Konzentrieren Sie sich auf den Wurm mit dem 4X Ziel geschnitten werden, einen Tropfen Öl auf das Deckglas, und wechseln Sie in den 100X Objektiv. Bringen Sie den Strahlengang der Kamera.
- Benutzen Sie die Maus auf das Neuron Ihrer Wahl unter der Mitte des Fadenkreuzes zu bewegen. Drücken Sie das Fußpedal an den Laser Feuer und durchtrennen die neuronalen Prozess. Bei Bedarf können zwei Gruppen von Impulsen verwendet werden, um das Neuron zu trennen sein. Zunächst ist es hilfreich, genau zu verfolgen, die Neuronen in den einzelnen Würmer wurden durchtrennt, um spätere Regeneration zu beurteilen. Wenn richtig ausgeführt, produziert Laser Axotomie eine kleine Pause in das Neuron, ohne nennenswerte Schäden an den umliegenden Hautgewebe oder anderen Neuronen (siehe Abbildung 3). In bestimmten Fällen kann eine kleine Narbe um den Ort der Verletzung zu bilden.
- Recover die Würmer durch das Entfernen der Deckgläschen in einer direkten Aufwärtsbewegung, wobei darauf geachtet, dass die Würmer auf dem Agarose-Pad bleiben. Nicht rutschen dem Deckglas ab. Dann schneiden Sie das Pad um die Würmer mit Nadel-Nase-Zangen und platzieren Sie den Abschnitt Agarose auf einem frisch ausgesäten NGM-Platte mit OP50 8. Platz 10 &mgr; l sterilem M9 auf dem Pad, um die Würmer aus den Kügelchen frei und entfernen Agarose.
5. Ergebnis Neuronen für die Regeneration
- Bereiten Agarose-Pad wie in Schritt 2.2 beschrieben.
- Legen Sie Würmer in 3-5 μ L von Polystyrol-Kügelchen. Deckglas auflegen. Slides können nacheinander hergestellt werden, oder alternativ alle Würmer können im Voraus und die Folien in 10 cm Kulturschalen mit jeweils einem feuchten Kimwipe die Agarose feucht zu halten gehalten vorbereitet werden.
- Verwenden Sie den 100X Ziel, den abgetrennten Neuronen zu visualisieren. In vielen Neuronen, wird ein neuronales Stumpf distal der Schnitt vor Ort bleiben. Wir nutzen die Anwesenheit von diesem Rest als Indiz dafür, dass das Neuron in der Tat war durchtrennt (Abb. 4). Das Vorhandensein dieser Stumpf macht es möglich, ein Neuron, das abgeschnitten wurde und von einem, der nicht geschnitten wurde regeneriert unterscheiden. Hinweis: Sowohl die distalen und proximalen Stümpfe zunächst nach dem Schneiden zurückzuziehen.
- Beurteilen Regeneration. Eine Vielzahl von Parametern bestimmt werden kann. Eine einfache Test, ob die verletzten Neuron hat ein Wachstum Kegel (Abb. 4a) gebildet und regeneriert, oder nicht (Abbildung 4b). Alternativ können Neuritenlänge verfolgt und verglichen werden.
6. Repräsentative Ergebnisse
Als Beispiel beschreiben wir Charakterisierung der Regeneration der γ-Aminobuttersäure (GABA) Motoneuronen. Diese Neuronen, die im Bauchmark wohnen und zu erweitern Prozesse umfänglich an der dorsalen Nervenstrang, sind für die ordnungsgemäße Fortbewegung 9 essentiellen. GABA Neuronen sichtbar gemacht werden durch die Expression einer genetisch kodierten Fluorophor, wie grün fluoreszierende Protein (GFP), die unter der Kontrolle des unc -47 oder -25 unc Promotoren (Stämme EG1285 und CZ1200 jeweils zur Verfügung aus dem C. elegans Genetic-Center ).
Berg L4-Stadium Würmer wie beschrieben, drehen Sie den Würmern so die GABA Neuronen auf ihr Recht zugewandten Seiten sind oben, und legen Sie das Deckglas. Cut 1-3 von der hinteren Kommissuren in jeder Wurm, der Mitte zwischen den dorsalen und ventralen Seile. Vermeiden Sie Schnitte Kommissuren, dass Quer-oder fasciculate mit anderen Kommissuren, da diese schwer zu später Partitur. Recover Würmer wie beschrieben.
18 bis 24 Stunden nach einer erfolgreichen Axotomie werden die Würmer von der Operation erholt haben und weisen eine normale Bewegungsapparates und Eiablage Verhaltensweisen. Discard Würmer, die tot oder krank sind. Montieren Sie den Rest, wie beschrieben, und zu bewerten Regeneration. Wir in der Regel sollen mindestens 30 geschnitten Neuronen pro experimentellen Bedingungen zu beurteilen. In oxIs12 Tiere, wird in der Regel 60-70% der abgetrennten L4 GABA Neuronen ein Wachstum Kegel-Struktur, durch eine Verbreiterung der Membran an der Spitze und die Verlängerung von mehreren Neuriten Filialen, und wanderten aus dem Schnitt Website (Abbildung 4a) bewiesen initiiert haben. In vielen Fällen wird das Wachstum Kegel migriert mit dem dorsalen Nervenstrang, eine benachbarte neuronale Kommissur oder den distalen Stumpf wieder haben. Die restlichen 30% der Neuronen entweder initiiert haben kein Wachstum, bilden einen Baumstumpf proximal an den Ort der Axotomie oder verlängert nur kleine Filopodien (Abbildung 4b) haben.

Abbildung 1. Die UV gepulsten Laser Axotomie System. Spezifische Komponenten sind: (a) ND-Filter (b) Puls-Selektor (c) Filterrad Hebel (d) Strahlengang Schalthebel (e) Laser Shutter und (f) Dämpfungsplatte.
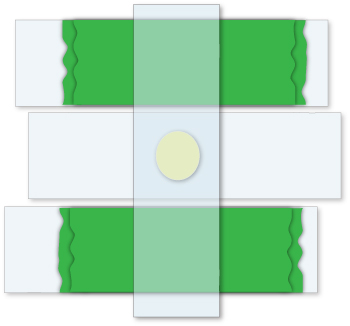
Abbildung 2. Vorbereiten einer Agarose-Pad. Zur Herstellung eines Agarose-Pad in der gewünschten Dicke, zwei Lagen Klebeband (grün) sind auf zwei Folien gelegt. Eine Folie wird zwischen den ersten beiden gelegt, und ein Tropfen Agarose wird dann an die saubere Folie hinzugefügt. Schließlich wird eine vierte Folie senkrecht zu den ersten drei platziert, was zu einem Pad, das die Dicke von zwei Stücken des Bandes.
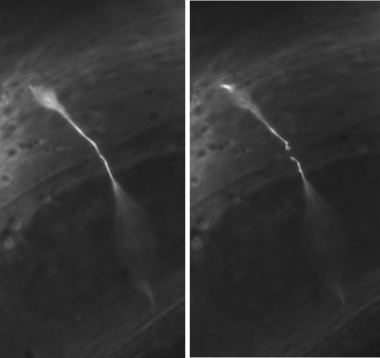
Abbildung 3. Vertreter GABA Neuron axotomies. In einem typischen Experiment werden GABA Neuron Kommissuren in der Mitte der lateralen Seite des Wurms durchtrennt. Eine abgetrennte Kommissur wird unmittelbar vor (links) und nach (rechts) Axotomie gezeigt. Alle Bilder wurden mit einer 100X Öl-Objektiv aufgenommen.
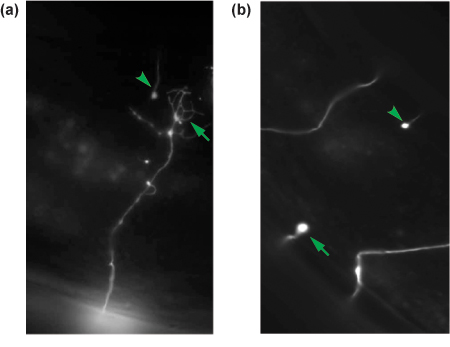
Abbildung 4. Repräsentative Ergebnisse der GABA Neuron axotomies. 24 Stunden post-Axotomie abgetrennten Axone sind für die Regeneration erzielt. Ein regenerierenden Axone mit einem Wachstum Kegel (Pfeil) ist in (a), während ein nicht-regenerierenden Axone als proximalen Stumpf (Pfeil) in (b) zu sehen sind. Der distale Stumpf jedem Schnitt Axon ist in jedem Panel (Pfeilspitze) gezeigt und ist ein Indiz dafür, dass das Axon wurde durchtrennt.
Diskussion
Eine Vielzahl von Lasersystemen wurden verwendet, um Neuriten in C schneiden elegans, und mehrere Studien haben ihre Leistung im Detail 3,7,10,11 untersucht. Die MicroPoint Laser in unserem Protokoll ist ein schlüsselfertiges System, das einfach zu installieren und zu warten ist, und wird zu einem niedrigen Preis den Forschern im Vergleich zu einem Ti-Saphir-Laser-System zur Verfügung. Im Vergleich zu einem Ti-Saphir-System, jedoch ist die MicroPoint Laser erwartet, dass Schäden an einer größeren Fläche, die nachteilig für einige Anwendungen führen kann. Wenn ein Ti-Saphir-System gewünscht wird, ist ein hervorragendes Protokoll auf den Aufbau eines solchen Systems zur Verfügung 12.
Das aktuelle Protokoll kann auf einer Vielzahl von Neuronen in C durchgeführt werden elegans, aber stellen wir fest, dass die Unterschiede in der regenerativen Fähigkeiten zwischen verschiedenen Typen von Neuronen 13 sind zu erwarten. Darüber hinaus können verschiedene transgene Hintergründe beeinflussen regenerative Erfolg. Obwohl der Prozentsatz der Regeneration GABA Neuronen ist ziemlich konstant zwischen verschiedenen transgenen Marker Stämme haben wir festgestellt, insgesamt einen leichten Anstieg der Regeneration in juIs76 14 vs oxIs12 15 Würmer. Die Unterschiede zwischen den Markierungen des Touch-Neuronen wurden auch 2 beschrieben.
Wir bevorzugen es, die Würmer mit Mikroperlen als Anästhetika immobilisieren wie die Perlen in schneller und konsequenter Ruhigstellung 16 Resultat. Dies ist auch vorteilhaft, da wir in der Lage, um die Regeneration frei von möglichen Verwechslung Effekte durch Anästhesie 17 zu beobachten sind. Eine Alternative Anästhesie-freie Methode zur Immobilisierung ist die Verwendung von mikrofluidischen Bauteilen. Der Einsatz der Mikrofluidik für Axotomie wurde ausgiebig 17-22 beschrieben.
Wir finden, dass mit konsequenten Einsatz der Laser funktioniert am besten, wenn das Cumarin in den Farbstoff-Zelle 440 geändert wird einmal pro Woche nach dem Eingriff in die MicroPoint Handbuch beschrieben ist. Falls erforderlich, kann die Dämpfung Schieberegler verwendet, um Macht zu erhöhen, aber dies kann ein Hinweis auf alte Farbstoff-oder Laser-Versatz werden. Außerdem hat der Farbstoff-Zelle eine begrenzte Lebensdauer und muss in absehbarer Zeit umgebaut oder ersetzt werden (siehe Fehlersuche).
Es kann schwierig sein, das Ziel Neuriten unter dem Fadenkreuz, dass der Laserfokus markieren Manöver, vor allem wenn das Tier nicht vollständig gelähmt ist. Wir finden, dass eine manuelle Bühne nicht optimal ist für diesen Zweck, obwohl es sicherlich brauchbar ist. Ein Joystick-gesteuerte motorische Phase ist präziser, und wir finden, dass mit einer Software, Bild Ziehen mit der Maus, um den motorisierten Bühne bewegen unterstützt am besten ist. Nikon Elements bietet diese Funktion und wird in diesem Protokoll beschrieben, aber die freie Mikromanager Paket, sowie andere Imaging-Software, kann eine ähnliche Funktionalität haben. Eine andere Art von feinen Ausrichtung ist es, den Laserfokus zu verschieben, anstatt das Tier. Ein Galvanometer beam-Lenkung ist als Add-on auf die MicroPoint Laser, wenn dieser Ansatz wird bevorzugt.
Neben ihrer Anwendung auf die Untersuchung der neuronalen Regeneration, kann der Laser benutzt, um andere Zelltypen, wie Haut-, Muskel-oder spezialisierte Zellen abzutragen oder zu stören spezifischen neuronalen Synapsen 23-27 sein. Darüber hinaus könnte Signalwege, die zur Degeneration von Nervenzellen, die Verletzung oder Krankheit begleitet regeln mit diesem System untersucht werden. Als solche wird die Verwendung von gepulsten Lasern weiter leuchten sowohl die genetischen Faktoren und die zellbiologische Veränderungen, die neuronale Regeneration und anderen relevanten Prozesse zu erleichtern vergossen.
Fehlerbehebung:
Hier beschrieben werden einige häufig auftretende Probleme und ihre Lösungen beschrieben.
- Der Laser schneidet nicht richtig. Dies ist wahrscheinlich, weil entweder der Laser außerhalb des Fokus (siehe Abschnitt 2) oder der Farbstoff in der Farbstoff-Zelle muss ersetzt (siehe MicroPoint Handbuch). Alternativ kann der Farbstoff-Zelle muss ersetzt oder neu aufgebaut werden.
- Die Würmer sind auf Agarose-Pad bewegen. Dieser ist in der Regel ein Zeichen, dass die Agarose-Pad zu feucht ist. Wir finden, dass Pads für ca. 30 Sekunden verlassen werden, bevor Würmer auf sie gesetzt werden, um dieses Problem zu umgehen müssen. Sie können auch versuchen, den kleineren (0,05 um) Mikrokügelchen.
- Die Rückgewinnung von Würmern ist schwierig und ineffizient. Dies kann durch falsche Deckglas Entfernung oder durch eine trockene Agarose Pad verursacht werden. Wenn das Pad zu trocken ist, können Sie feststellen, dass die Axone ein beaded Erscheinungsbild zu entwickeln. In einigen Fällen ist dies, weil die Würmer waren nicht auf dem Pad platziert bald, nachdem es gemacht wurde. Alternativ kann ein Altbestand von Agarose-Lösung haben eine mehr als 3% Konzentration nach wiederholtem Schmelzen.
Offenlegungen
Danksagungen
Die Arbeit in den Hammarlund Labor wird gefördert durch: NIH gewährt R01 NS066082-01 und T32GM007223, die Beckman-Stiftung, und der Ellison Medical Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| 0,05 um Polystyrol-Kügelchen | Polysciences, Inc. | 08691 | |
| 0,10 um Polystyrol-Kügelchen | Polysciences, Inc. | 00876 | |
| Agarose GPG / LE | Amerikanischen Bioanalytische | 00972 | Reinstwasser |
| Falcon 14 ml Polystyrol-Round-Röhrchen | BD Biosciences | 352057 | 17 x 100 mm Stil, nicht pyrogen |
| Thermo Scientific Plain vorgereinigte Objektträger | Erie Scientific Company | 420-004T | 3 "x 1" x 1 mm |
| Deckgläser | VWR | 48366 205 | 18 mm x 18 mm Nr. 1 1 / 2 |
| KIMTECH Science Kimwipes | Kimberly-Clark | 34155 | |
| BD Falcon 100 x 15mm Stil Petrischale | BD Biosciences | 351029 | |
| Band blank 3/4W x 500L | TimeMed | T-512 | |
| Immersionsöl | Nikon | Typ A, nd = 1,515 | |
| EG1285 oder CZ1200 | C. elegans Genetic-Center | http://www.cbs.umn.edu/CGC/strains/ | |
| OptiScan II | VOR Scientific | ||
| NIS-Elements Ar oder Br | Nikon | ||
| MicroPoint Ablation Laser System | Photonic Scientific | ||
| Zusammengesetztes Mikroskop | Nikon | Eclipse-80i | |
| Hamamatsu Kamera | Hamamatsu Photonics | Modell C8484-05G01 | |
| Dell Precision T3400 PC mit Intel Core 2 Duo | Dell | ||
| Windows XP Professional | Microsoft | Version 2002, Series Pack 3 | |
| Dual-Trockenbad Incubator | Fisher Scientific | Analog steuert | |
| 4X Plan Fluor Ziel | Nikon | ||
| 100X Plan Apo VC Öl-Objektiv | Nikon | ||
| Dumont # 5 / 45 Pinzetten | Dumont | 11251-35 | Dumoxel Standard Tipps, können auch # 7 |
| Präpariermikroskop | Nikon | SMZ800 | Mit NI-150 High Intensity Illuminator |
Referenzen
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Ghosh-Roy, A., Wu, Z., Goncharov, A., Jin, Y., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branchi ng. Proceedings of the National Academy of Sciences. 104, 15132-15137 (2007).
- Yan, D., Wu, Z., Chisholm, A. D., Jin, Y. The DLK-1 Kinase Promotes mRNA Stability and Local Translation in C. elegans Synapses and Axon Regeneration. Cell. 138, 1005-1018 (2009).
- Yanik, M. F. Neurosurgery: Functional regeneration after laser axotomy. Nature. 432, 822-822 (2004).
- Gabel, C. V., Antoine, F., Chuang, C., Samuel, A. D. T., Chang, C. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , (1988).
- McLntire, S. L., Jorgensen, E., Kaplan, J., Horvitz, H. R. The GABAergic nervous system of Caenorhabditis elegans. Nature. 364, 337-341 (1993).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in. C. elegans. Optics Express. 15, 8521-8531 (2007).
- Chung, S., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Applied Physics A: Materials Science & Processing. 96, 335-341 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature Protocols. 5, 395-407 (2010).
- Wang, Z., Jin, Y. Genetic dissection of axon regeneration. Current Opinion in Neurobiology. , (2010).
- Huang, X., Cheng, H. -. J., Tessier-Lavigne, M., Jin, Y. MAX-1, a Novel PH/MyTH4/FERM Domain Cytoplasmic Protein Implicated in Netrin-Mediated Axon Repulsion. Neuron. 34, 563-576 (2002).
- McIntire, S. L., Reimer, R. J., Schuske, K., Edwards, R. H., Jorgensen, E. M. Identification and characterization of the vesicular GABA transporter. Nature. 389, 870-876 (1997).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. . Laser microsurgery in C. elegans in Methods in Cell Biology: Caenorhabditis elegans: Modern Biological Analysis of an Organism. , .
- Guo, S. X. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5, 531-533 (2008).
- Zeng, F., Rohde, C. B., Yanik, M. F. Sub-cellular precision on-chip small-animal immobilization, multi-photon imaging and femtosecond-laser manipulation. Lab on a Chip. 8, 653-656 (2008).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F., F, M. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab on a Chip. 7, 1515-1523 (2007).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Current Opinion in Neurobiology. 19, 561-567 (2009).
- Samara, C. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proceedings of the National Academy of Sciences. , (2010).
- Nelson, F. K., Riddle, D. L. Functional study of the Caenorhabditis elegans secretory-excretory system using laser microsurgery. Journal of Experimental Zoology. 231, 45-56 (1984).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental Biology. 78, 577-597 (1980).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Developmental Biology. 87, 286-300 (1981).
- Allen, P. B. Single-synapse ablation and long-term imaging in live C. elegans. Journal of Neuroscience Methods. 173, 20-26 (2008).
- Pujol, N. Distinct Innate Immune Responses to Infection and Wounding in the C. elegans Epidermis. Current biology. CB 18, 481-489 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten