Method Article
Imaging von Estrogen Receptor-α in Rat Pial Arteriolen mit einem Digital-Immunfluoreszenz-Mikroskop
In diesem Artikel
Zusammenfassung
Das Ziel dieses Artikels ist es, ein Verfahren zu demonstrieren Immunfluoreszenz Detektion von Östrogen-Rezeptor-α (ERa) in Ratten Pia arteriellen Scheiben mit einem digitalen Immunfluoreszenz-Mikroskop zu optimieren.
Zusammenfassung
Viele von Östrogen-Effekten auf vaskuläre Reaktivität sind durch die Interaktion mit Östrogen-Rezeptoren 1, 2, 3 vermittelt. Obwohl zwei Untertypen (Östrogen-Rezeptor-α und β) bestehen, hat Östrogen-Rezeptor-α sowohl in den glatten Muskelzellen und Endothelzellen in der Pia-arterielle Segmente unter Verwendung von fluoreszierenden Färbung mit konfokalen Laser-Scanning-Mikroskopie 4 kombiniert identifiziert worden. Darüber hinaus ist ER-α in den Kernen und im Zytoplasma der Ratte basilaris Arterien 5 befindet. Die Rezeptoren sind reichlich vorhanden und fluoreszieren hell, aber klare Darstellung der diskreten Gruppen von Rezeptoren ist schwierig wahrscheinlich auf die Zahlen in vielen Zellschichten Pia Gefäßsegmente entfernt. Darüber hinaus haben viele Berichte mit immunhistochemischen Techniken mit der konfokalen Mikroskopie schlecht detailliert die Anforderungen von entscheidender Bedeutung für Reproduktion Versuche 6 gekoppelt. Unser Ziel für diesen Artikel ist eine einfache Technik zu beschreiben, t zu optimierenHE-Färbung und Visualisierung von ER-α mit Querschnitts-Scheiben pialen Arteriolen erhalten von weiblichen Gehirn von Ratten. Zunächst perfuse Ratten mit Evans blauen Farbstoff leicht identifizieren Oberfläche pialen Arterien, die wir isolieren unter einem Binokular. Die Verwendung eines Kryostaten bis 8 um Querschnitte der Arterien Scheibe ermöglicht es uns, dünne Gefäßabschnitte zu erhalten, so dass unterschiedliche Behälter Flugzeuge mehr übersichtlich visualisiert werden. Quer durch das Schiff, anstatt mit Hilfe eines kleinen Schiffes Segment hat den Vorteil einer einfacheren Betrachtung der Endothel-und glatten Muskelschichten. Darüber hinaus eines digitalen Immunfluoreszenz-Mikroskop mit erweiterter Tiefenschärfe Software erzeugt scharfe Bilder von zehn Minuten vor zwölf verschiedene Schiffstypen Flugzeuge und ist kostengünstiger als die Verwendung eines konfokalen Laser-Scanning-Mikroskop nutzen.
Protokoll
1. Isolierung und Vorbereitung der Pial Arterien
- Während die Ratte narkotisiert einfügen und sichern einen Katheter in eine Arterie und perfuse mit 1% Evans-Blau in 1X PBS. Pial Schiffe gut Fleck mit dem Evans-Blau-Farbstoff so dass sie leichter zu isolieren.
- Auszug des Gehirns und bei -70 ° C bis zum Gebrauch. Optimalerweise sollten Gehirn nicht länger als 2 Monate gelagert werden.
- Mit einem Binokular entfernen Pia Arteriolen (Durchmesser 35-50 um) von der Oberfläche des Gehirns. Ziehen Sie alle blau gefärbten Arteriolen von dorsal und lateral der Oberfläche der Hirnrinde mit spitzen Pinzette. Entfernen Sie überschüssiges Anhänger kortikalen Gewebe, bevor sie in das Fixativ.
- Fix die geernteten Arteriolen in 2% Paraformaldehyd in kaltem 0,1 M PBS für 30 min.
- Zur Vorbereitung der Arteriolen zum Schneiden pour Einbettmedium über das Einfrieren Disc / Bohrfutter (Set bei -20 ° C).
- Legen Sie Arteriole Abschnitt flach auf dem Chuck einend warten, bis es gefrieren. Fest statt das Schiff oben rechts auf den Kryostaten Eiserzeugerplatte zum Einbetten von Medien mit der Spitze der Arterie zu Ihnen zeigt. Halten Sie es mit einer Pinzette, bis er fest zugefroren ist.
- Legen Sie die Eiserzeugerplatte mit dem Schiff in den Kryostaten Kopf und schnitt 8 um Pia Arteriole Ringen mit dem Kryostaten.
- Montieren Sie die Arteriole Abschnitte auf Chrom-Kalium-Gelatine subbed Dias.
- Bewahren Sie die vorbereiteten Folien in einer Bildschirmpräsentation Box im Kühlschrank bei 4 ° C über Nacht.
2. ER-α Immunfluoreszenzfärbung
Tag 1
- Entfernen Sie die Dias aus dem Kühlschrank, bringt jeweils auf Raumtemperatur.
- Zum Waschen der Objektträger pour 1-1.5 ml 0,1 M PBS (genug, um alle Abschnitte behandeln) lassen Sie sich für 10 Minuten, abtropfen lassen und wiederholen Sie den Vorgang noch zweimal. Jede Kante der Folie hat eine hydrophobe Marker. Folglich bleibt die Flüssigkeit auf der Oberfläche der Folie. Mit jedem Waschen die Flüssigkeit gegossenheraus und mit frischen 0,1 M PBS ersetzt.
- Inkubieren in 1 ml 50 mM Ammoniumchlorid 30 min bei Raumtemperatur auf endogene Fluoreszenz zu reduzieren.
- Waschen Sie die Slides in 0,1 M PBS 3x10 min. wie in 2.2 beschrieben
- Block Dias in 0,1% Triton-X 100 plus 1% normalem Ziegenserum (NGS) in PBS für 30 min. um unspezifische Bindung zu reduzieren.
- Inkubieren Proben mit dem primären Antikörper (Kaninchen polyklonaler anti-ER-α; 1:500) in PBS + 0,1% Triton-X + 1% NGS über Nacht bei 4 ° C.
Tag 2
- Entfernen Sie die Dias aus dem Kühlschrank, bringt jeweils auf Raumtemperatur.
- Waschen Sie die Slides in 0,1 M PBS 3x10 min. wie in 2.2 beschrieben
- Inkubieren mit Oregon Green 488 sekundäre Anti-Kaninchen in 1% NGS +0,1% Triton-X100 + PBS für 2 Stunden im Dunkeln bei Raumtemperatur. Von diesem Schritt müssen die nächsten Schritte im Dunkeln durchgeführt werden.
- Waschen Sie die Slides in 0,1 M PBS 3x10 min. wie in 2.2 beschrieben
- Unter einem ventilated Kapuze, Platz 1 Tropfen 4 ', 6-Diamino-2-phenylindole (DAPI) plus Montage Medien auf die Gefäße und setzen Sie dann ein Deckglas über die Probe.
- Übernehmen klaren Nagellack an den Rändern des Deckglases zu versiegeln. Bewegen Sie den Schieber, bis sie vollständig trocken, was dauert etwa 24 Stunden.
3. Digitales Fluoreszenz-Imaging
- Für die Bildgebung ER-α in die Pia-Behälter Scheibe verwenden wir eine Nikon Eclipse 80i digitalen Fluoreszenz-Mikroskop mit Filtern für 3 Farben (blau, grün und rot) mit einer digitalen Kamera ausgestattet.
- Legen Sie die vorbereiteten Objektträger mit den gefärbten Pia Gefäßsegmente unter dem Mikroskop und stellen Sie die fluoreszenzmarkierten Bereiche von Interesse zu visualisieren. Start am x100 Vergrößerung dann x600 Vergrößerung zu erhöhen.
- Verwenden Sie die Kamera Bilder in DAPI (blau) und FITC (grün) Kanäle für Zellkerne (DAPI) und ER-α (Oregon Green) mit Nikon Erweiterte Tiefe Focus Software Capture mehrfache View konvertierens der Gefäßabschnitte in 2-D-Bilder.
4. Repräsentative Ergebnisse:
Wir lokalisierten Östrogen-Rezeptor-α in Pia arteriellen Gefäße unter Verwendung von fluoreszierenden Sonden und optimiert unsere Visualisierung des Rezeptors mit digitalen Fluoreszenzmikroskopie. Um die Anwesenheit des Rezeptors, einem polyklonalen Kaninchen-Primärantikörper und einem Oregon Green 488 markierten sekundären Antikörper wurde zur Abbildung der Rezeptoren in pialen Arterien von der Oberfläche des Gehirns isoliert. Auch eine Kernfärbung (DAPI) wurde verwendet, um die Zellkerne zu identifizieren und festzustellen, ob wir Rezeptoren im Zellkern befinden könnten erkennen, da ER-α berichtet worden ist, anwesend zu sein in der Zelle cyotosol und den Zellkern. Darüber hinaus führten wir bestätigende Versuche, um die Spezifität des primären Antikörpers zu validieren und zu verifizieren, die Bindung des sekundären an den primären Antikörper.

Abbildung 1. Immunfluoreszenzfärbung für ER-α (grün) und Gegenfärbung mit DAPI (blau) in einem pialen Arterie Ring von weiblichen Rattenhirn isoliert. Abb. 1A zeigt das fusionierte Bilder auf das Vorhandensein von einigen intranukleären Östrogen-Rezeptor-a (Pfeil). Abb. 1B und 1C sind die fokussiertes Bild von ER-α, die eine Kombination von Z-Stapel-Bildern ist. Die Bilder wurden am x600 Vergrößerung aufgenommen und sind vom Schnitt Ring des gleichen Schiffes in verschiedenen Ebenen. Die Pfeile zeigen die Östrogen-Rezeptor-α.
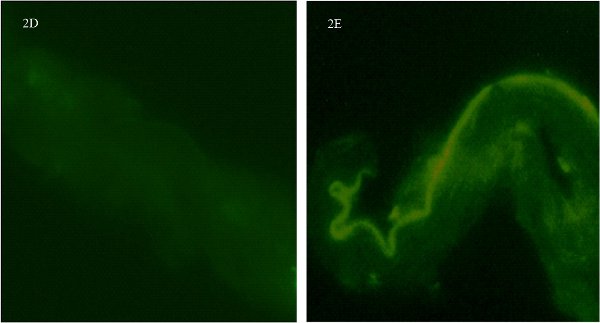
Abbildung 2. Immunfluoreszenzfärbung für Kontrollgruppen in einer pialen Arterie Ring von weiblichen Rattenhirn isoliert. Abb. 2D zeigt das Schiff ohne Primärantikörper. Abb. 2E zeigt das Schiff ohne die Sekundär-Antikörper (Anm. deutliche Autofluoreszenz entlang Endothelzellen auf dieser Seite). Die Bilder wurden am x600 Vergrößerung aufgenommen und sind vom Schnitt Ring des gleichen Schiffes in different Ebenen.
Diskussion
Bisher haben wir gezeigt, dass nach transienter globaler Ischämie-Hirn-Trauma der pialen Arterie Fähigkeit, Durchmesser als Reaktion auf beide Vasodilatatoren 7, 8 und 9 zu ändern Vasokonstriktoren deutlich ist in jungen ovariektomierten Ratten deprimiert. Chronische Östrogen Fülle wieder vasomotorische Reaktionen 7-9. Darüber hinaus kehrt verzögert Östrogen-Ersatztherapie die wohltuende Wirkung von Östrogen auf die Pia Arterie vasodilatatorische Kapazität 10 führt uns zur Frage, ob langfristige Östrogen Erschöpfung ER-α Dichte wirkt in der cerebrovasculature. Wir planten, Immunofluoreszenz Markierung mit Western-Blot auf Veränderungen in ER-α Expression als Reaktion auf chronische Erschöpfung Östrogen bewerten kombinierten Einsatz. Da wir einige Schwierigkeiten bei der Visualisierung von diskreten Gruppen von Rezeptoren hatten wir modifiziert die Methode, die wir zeigen hier. Deshalb war unser primäres Ziel in dieser Studie zum ersten Entwicklung eine relativ einfache Methode, um die visuelle Optimierungsierung der Rezeptoren in pialen Arteriolen. In Absprache mit mehreren Berichten 6,11,12 fanden wir es notwendig, Anpassungen für die Art des Gewebes waren wir Sondieren, die Dicke der Probe, die Verteilung von ER-α in das Schiff, als auch der Grad der unspezifischen Bindung zu .
Unsere Methode ist sehr effektiv, um das Vorhandensein von ER-α in Pia Schiff Scheiben sichtbar zu machen. Aber wie andere zuvor den erfolgreichen Einsatz dieser Methoden hingewiesen ist stark abhängig von der Spezifität und Konzentration der Antikörper, die subzelluläre Lokalisation der Proteine von Interesse, die Fixierung und blockiert Protokolle und Gewebe Handling 12. Vor Visualisierung unseres Schiffes Vorbereitungen verbrachten wir Zeit zu arbeiten, alle diese Variablen. Wir haben deutlich gemacht, wie wir einige unserer Herangehensweise in diesem Papier einstellen benötigt.
Wir wollten optimal visualisieren ER-α in pialen Arteriolen und diese vor einigen Herausforderungen.Erstens ist die durchschnittliche Größe einer Ratte pialen Arterie zwischen 35-50 um was Trennung und Entfernung aus der Hirnoberfläche etwas tricky. Wir fanden, dass Perfusion mit Evans blauen Farbstoff vor der Tötung macht Dissektion der Arterien erleichtern. Evans-Blau kann sich auf Fluoreszenz, aber wir spüren, dass der Vorteil der Verwendung dieser Farbstoff seiner geringen Nachteile überwiegen. In unserem Protokoll die Gefäße werden mehrmals gewaschen. Dies minimiert die verbleibende Farbstoff in die Gefäße und reduziert die möglichen Auswirkungen des Farbstoffes auf Fluoreszenz. Eine weitere Schwierigkeit, die wir hatten, war, dass die Dicke der Pia Gefäßsegmente klare Darstellung der Rezeptoren erschwert. Darüber hinaus konnten wir nicht erhalten, besonders klare Bilder wahrscheinlich aufgrund der Tatsache, dass ER-α durch mehrere Zellschichten wurde verstreut. Wir haben versucht, die Arbeit mit Längs-Schiff Scheiben (wie andere), aber aufgrund der kleinen Pia Größe war es schwierig, die Gefäße behandeln und zu verhindern Verdrehen der Schiffe während der Montageauf Folien auch unter dem Mikroskop. Schließlich haben wir erfolgreich unsere Technik mit Hilfe eines Kryostaten und Schneiden des Schiffes quer in bis 8 um dicke Ringe geändert. Die Ringe sind leichter zu handhaben und einige können auf einem Schlitten montiert werden.
Einmal haben wir das Schiffe hielten wir es für notwendig, um die Wirksamkeit der erste Blitz Einfrieren des Gewebes dann Fixierung der Gefäße durch Danseshatalb und Mitarbeiter 11 vorgeschlagen zu prüfen. Obwohl wir etwas weniger Hintergrund Immunfluoreszenz finden wir auch festgestellt, dass die Rezeptoren weniger stark machen Visualisierung der Rezeptoren schwieriger gefärbt. Daher bevorzugen wir die ersten, die gesamte Gehirn einfrieren und lagern, bis sie benötigt (in der Regel zwischen 1-2 Monaten). Wir ziehen aus den Gefäßen, wie beschrieben und fixieren die Gefäße vor dem Schneiden mit dem Kryostaten. wie wir demonstrieren hier.
Ein notwendiger Schritt ist, die Kontrollen sowohl mit dem primären und dem sekundären Antikörper separat ausgeführtzur Spezifität und Hintergrund Immunfluoreszenz zu bestimmen. Estrogen-Rezeptor-α-Antikörpern kann schwierig sein, mit zu arbeiten. In der Tat haben wir versucht, 3 verschiedene Primärantikörper (1 monoklonalen und 2 polyklonal), bevor wir mit dem Erfolg unserer Rezeptor Färbung zufrieden waren. Als Teil unserer Kontrolle übernehmen wir zunächst die Spezifität des primären Antikörpers durch Unterlassung der Addition des primären Antikörpers nachgewiesen. 2D zeigt das Schiff ohne Primärantikörper. Es gibt keine Flecken und nur ein wenig Hintergrund-Signal. Da der primäre Antikörper polyklonal, gibt es einige diffuse unspezifische Hintergrundfärbung. Zweitens, haben wir den primären Antikörper, nicht aber der sekundäre Antikörper (Abb. 2E). Man sieht eine schöne Marge, die die Autofluoreszenz entlang der endothelialen Grenzen der Gefäße. Dies steht im Einklang mit der Arbeit von Dan und Kollegen 5. Doch weder die kleinen Punkte Immunfluoreszenz, dass ER-α stellen, noch die körniges Aussehen reflecting die Anwesenheit von zahlreichen Rezeptoren kann ohne die Kombination der beiden primären und sekundären Antikörper nachgewiesen werden. Wir haben festgestellt, ein deutliches Muster der Autofluoreszenz entlang der endothelialen Rande der Gefäße. Diese unabhängigen Tests für Antikörper-Spezifität sind wichtig, da sie die Spezifität der Antikörper für die ER-α zu bestätigen und der sekundäre Antikörper bindet an den primären.
Zum Schluss, wie andere 4 gezeigt, enthalten 5 Gehirn Blutgefäße zahlreichen ER-α-Subtyp-Rezeptoren. In unseren Händen, die Vorbereitung 8μm Querschnitt Scheiben von isolierten pialen Arterien verbessert Färbung und Visualisierung der Rezeptoren. Traditionelle Methoden der konfokalen Mikroskopie, um die Proben zu untersuchen. Die Fähigkeit, serielle optische Schnitte von dicken Proben Sicht ist ein wichtiger Vorteil der konfokalen Mikroskopie. Allerdings können Kauf einer Ware konfokalen Mikroskop sehr teuer sein. Durch die Verwendung erweiterter Tiefenschärfe (EDF)-Software, fanden wir, dasskonnten unsere Geräte zu senken. Mit Hilfe eines Fluoreszenz-Mikroskops mit EDF erhielten wir klare Bilder und sind in der Lage, Pia arteriellen ER-α auf mehreren Ebenen mit Z-Stapel zu visualisieren. Ein wesentlicher Vorteil der EDF-Software ist, dass es Bilderfassung ermöglicht in einer Art und Weise um effektiv eine 3-D Bild von den Bildern. Für Laboratorien, die keinen Zugang zu einem konfokalen Mikroskop oder die Mittel zum Kauf einer digitalen Fluoreszenzmikroskop mit angeeignet Software kann eine praktische und weniger kostspielige Option, je nach den Zielen der Ermittler werden.
Offenlegungen
Die geäußerten Ansichten sind die der Autoren und spiegeln nicht die offizielle Politik oder Position des Uniformed Services University of the Health Sciences, das Department of Defense, oder die Regierung der Vereinigten Staaten.
Danksagungen
Die Arbeit für dieses Projekt wurde durch Mittel der National Institutes of Health R01-NR5339 und den uniformierten Diensten University of the Health Sciences-R061LD unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Evans Blue | Sigma | E-2129 | |
| PBS 10X | Sigma | P-5493 | |
| Paraformaldehyd | Fisher Scientific | T353 | |
| Tissue-Tek OCT Compound | VWR | 25608-930 | |
| Ammoniumchlorid | Sigma | A9434 | |
| Triton X-100 | Sigma | T9284 | |
| Normalem Ziegenserum | Invitrogen | 16210-064 | |
| ER-α polyklonalen Kaninchen-Antikörper | Santa Cruz | H-184 | |
| Oregon Green 488 Ziege anti-Kaninchen IgG | Invitrogen | O-11038 | |
| Vectashield MontageMedium für Fluoreszenz mit DAPI | Vector Lab | H-1200 |
Referenzen
- Smiley, D. A., Khalil, R. A. Estrogen compounds, estrogen receptors and vascular cell signaling in the aging blood vessels. Curr. Med. Chem. 16, 1863-1887 (2009).
- Miller, V. M., Duckles, S. P. Vascular actions of estrogens: functional implications. Pharmacol. Rev. 60, 210-241 (2008).
- Duckles, S. P., Krause, D. N. Cerebrovascular effects of oestrogen: multiplicity of action. Clin. Exp. Parmacol. Physiol. 34, 801-808 (2007).
- Stirone, C., Duckles, S. P., Krause, D. N. Multiple forms of estrogen receptor-a incerebral blood vessels: regulation by estrogen. Am. J. Physiol. Endocrinol. Metab. 284, E184-E192 (2003).
- Dan, P., Cheung, J. C., Scriven, D. R., Moore, E. D. Epitope-dependent localization of estrogen receptor-alpha, but not -beta, in en face arterial endothelium. Am. J. Physiol. Heart Circ. Physiol. 284, 1295-1306 (2003).
- Fritschy, J. M. Is my antibody staining specific? How to deal with pitfalls of immunohistochemistry. Eur. J. Neurosci. 28, 2365-2370 (2008).
- Watanabe, Y., Littleton-Kearney, M. T., Traystman, R. J., Hurn, P. D. Estrogen restores post-ischemic pial and microvascular dilation. Am. J. Physiol. Heart and Circ. 281, H155-H160 (2001).
- Li, M., Zeynalov, E., Li, X., Miyazaki, C., Koehler, R. C., Littleton-Kearney, M. T. Effects of estrogen on postischemic pial artery reactivity to ADP. Microcirculation. 16, 403-413 (2009).
- Qin, X. Y., Hurn, P. D., Littleton-Kearney, M. T. Estrogen restores postischemic sensitivity to thromboxane mimetic U46619 in rat pial artery. Cereb. Blood. Flow. Metab. 25, 1041-1046 (2005).
- Miyazaki, C., Koelher, R. C., Littleton-Kearney, M. T. Effects of HET0016 and estrogen on pial artery vasodilatory capacity. FASEBJ Abstracts. , (2007).
- Daneshtalab, N., Dore, J. J. E., Smeda, J. S. Troubleshooting tissue specificity and antibody selection: procedures in immunohistochemical studies. J. Pharmacol. Toxical. Methods. 61, 127-135 (2010).
- Lorincz, A., Nusser, Z. Specificity of immunoreactants. J. Neurosci. 28, 9083-9086 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten