Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Seguimiento de las actividades de quinasa y fosfatasa través del ciclo celular por Proporcional FRET
En este artículo
Resumen
FRET basada en los periodistas están cada vez más utilizado para monitorear las actividades de quinasa y fosfatasa en las células vivas. Aquí se describe un método sobre el uso de FRET basada en la prensa para evaluar el ciclo celular dependiente de los cambios en la fosforilación de destino.
Resumen
Förster transferencia de energía por resonancia (FRET) basado en una prensa permite la evaluación de la quinasa endógena y las actividades de la fosfatasa en las células vivas. Estas sondas consisten normalmente en las variantes de la PPC y YFP, intervenido por una secuencia phosphorylatable y un dominio de unión a fosfato. Tras la fosforilación, la conformación de la sonda cambios, que se traduce en un cambio de la distancia y orientación entre la PPC y YFP, dando lugar a un cambio en la eficiencia de FRET (Figura 1). Varias sondas han sido publicados en la última década, el seguimiento del balance de la actividad de múltiples quinasas y fosfatasas, incluyendo reporteros de la PKA 2, PKB 3, 4 PKC, PKD 5, 6 ERK, JNK 7, Cdk 18, Aurora B 9 y Plk1 9 . Dada la estructura modular, sondas adicionales es probable que surjan en el futuro cerca de 10.
Progresión del ciclo celular se ve afectada por el estrés signaling vías 11. Cabe destacar que el ciclo celular está regulado de manera diferente durante imperturbable crecimiento en comparación con cuando las células se están recuperando del estrés 12. Time-lapse de imágenes de células a través del ciclo celular por lo que requiere especial precaución. Esto se convierte en un problema particularmente cuando se emplean imágenes radiométrica, ya que dos imágenes con una elevada relación señal ruido están obligados a interpretar correctamente los resultados. Radiométrica de imágenes de FRET los cambios dependiente del ciclo celular en las actividades de quinasa y fosfatasa ha sido predominantemente restringida a sub-secciones del ciclo celular 8,9,13,14.
En este caso, hablamos de un método para supervisar FRET basado en sondas utilizando imágenes radiométrica todo el ciclo de la célula humana. El método se basa en un equipo que está disponible para muchos investigadores en ciencias de la vida y no requiere conocimientos técnicos de la microscopía y procesamiento de imágenes.
Protocolo
1. La introducción de la sonda a las células
- Co-transfectar células con una sonda FRET y basado en un plásmido de resistencia que confieren. Elegir un método de transfección que sea eficiente en su celda de tipo de interés. Para las células U2OS, estándar de calcio métodos de transfección de fosfato dan resultados adecuados 15.
- Seleccione las celdas en el antibiótico apropiado para al menos siete días. Esto enriquece la cantidad de células que expresan la sonda y limita la cantidad de células con niveles de expresión de tóxicos, o los niveles de expresión que afectan gravemente el ciclo celular.
- (Opcional) Seleccione de clones estables.
- El uso de células fijas o en vivo, compruebe que la PPC y YFP están presentes en todas las células en aproximadamente la misma proporción.
- En el caso de algunas células contienen sólo la PPC o YFP, la recombinación es probable que haya ocurrido. La recombinación puede ocurrir ya sea durante el crecimiento bacteriano o después de la transfección de la sonda y puede en este último caso dependerá de la calidad del plásmido. Repita el plásmido preparación y linealizar el plásmido antes de la transfección si el problema persiste.
2. Radiométrica de vigilancia FRET
- Las células de las semillas en placas con fondo de cristal, o para el montaje de la cubierta se desliza en una cámara. Asegúrese que los platos / cubreobjetos hay 1,5 (170 m de espesor).
- Monte las células en medio de cultivo sin rojo fenol en un microscopio de epifluorescencia motorizado con control de temperatura a 37 ° C. Garantizar la regulación del pH de los medios de comunicación, ya sea por el CO 2 o mediante el uso de CO 2-medios de comunicación independientes como Liebowitz-15.
- Centrarse en las células con luz transmitida. No busques en las células con luz fluorescente.
- Para empezar, la adquisición de una imagen de 12 bits o 16 con la excitación YFP (YFPex) y YFP filtros de emisión (YFPem) y un espejo dicroico adecuado. El uso de intervalos máximos disponibles que todavía permite la resolución subcelular necesario. El uso de un binning de alta para reducir el tiempo de exposición o la intensidad es crucial para evitar la fototoxicidad.
- Measure o estimar la intensidad de fondo y el ruido aproximado de medir o estimar el promedio aproximado, valores mínimo y máximo de píxeles en un área desprovista de células. Tiempo de cambio de la exposición y los filtros de densidad neutra para que la media de la señal en la célula es aproximadamente la intensidad de fondo además de cinco a diez veces la diferencia entre la máxima y la intensidad de fondo min.
- Compruebe que las imágenes no están cerca de estar saturado. La intensidad máxima de la imagen debe ser menos de la mitad del rango dinámico (por ejemplo, max 2000, en una imagen de 12 bits) para permitir que las diferencias de intensidad cuando las células entrar en mitosis.
- Repita el paso desde 2,4 hasta 2,6 con excitación PPC y YFP filtros de emisiones y un espejo dicroico adecuado.
- Seleccionar varias regiones, con las células transfectadas, con exclusión de las regiones utilizadas para el punto 2.4 a 2,7, y asegurarse de que la intensidad máxima es de menos de la mitad del rango dinámico en todas las células.
- Iniciar un experimento de lapso de tiempo la adquisición de dos imágenes de cada 45 min con YFPex - YFPem y CFPex - YFPem conjuntos de filtros.
3. Verificación y optimización de las condiciones
- Abrir las imágenes adquiridas y controlar el tiempo de ciclo celular de la mitosis de la mitosis de las células que expresan la sonda transfectadas.
- Comparar el tiempo del ciclo celular medido con los datos publicados por el tipo de células empleadas. Por otra parte, la película no transfectadas las células mediante la adquisición de una imagen de la luz transmitida solamente (DIC por ejemplo, o de contraste de fase) cada hora para obtener referencia los tiempos de ciclo celular.
- En caso de que el tiempo de la mitosis de la mitosis corresponde a la referencia los tiempos del ciclo celular, vaya al paso 4. Por otra parte, volver a adquirir las imágenes con más exposición, más tiempo o múltiples puntos z-niveles y repita el paso 3.
- En caso de que el tiempo de la mitosis de la mitosis no corresponde hacer referencia a los tiempos del ciclo celular, la película de células transfectadas con la adquisición de una imagen de la luz transmitida sólo (por ejemplo, DIC o de contraste de fase) cada hora, seguido por una imagen al finalde la experiencia para identificar las células transfectadas.
- Si las células transfectadas aún muestran los tiempos de ciclo más largo de células, repita el paso 1, pero menos transfectar sonda o seleccionar clones estables que contienen cantidades muy bajas de la sonda.
- Si las células transfectadas muestran tiempos normales del ciclo celular en ausencia de luz fluorescente, repita el paso 2, pero reducir la exposición mediante la modificación de filtros de hurgar en la basura, de densidad neutra, el tiempo de exposición, y el tiempo entre las imágenes.
4. El análisis de FRET
- El análisis puede ser realizado por la mayoría de los software dedicados a la microscopía. A continuación se describe cómo realizar el análisis utilizando el software gratuito ImageJ ( http://rsb.info.nih.gov/ij ) utilizando la relación de plug-in Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- Abrir las imágenes en ImageJ. En caso de que las imágenes están en el formato de un STAC multicolork (por ejemplo, DeltaVision), separar los canales individuales, en primer lugar a la conversión a un HyperStack: Imagen-HyperStack pila de HyperStack y, posteriormente, dividir a las pilas de un solo canal con: Imagen-HyperStack-reducir la dimensionalidad
- Multiplique el YFPex - pila YFPem con 3 usando: Proceso-Matemáticas-Multiplicar Este paso es opcional, ya que sólo se diseñó para aumentar la claridad visual de las imágenes asegurando que las razones no están en el rango entre 0 y 1.
- En el YFPex - pila YFPem, dibuja una región de interés (ROI) en un área que carece de células, pero que está cerca de una célula de medición. Células diferentes en la misma imagen puede requerir diferentes regiones, ya que tanto el fondo y la intensidad de la señal por lo general es más fuerte en el centro de la imagen.
- Agregue el retorno de la inversión ROI de manager: Analizar las herramientas de ROI-manager.
- Medir la intensidad promedio de la rentabilidad, tanto en el YFPex - YFPem y la CFPex - pila YFPem: Analizar, Medir .
- Repetir a los puntos de tiempo múltiples y verificar que las intensidades de fondo cerca de la célula de interés son similares en toda la película.
- Establecer medidas para incluir un mínimo de intensidad: Analizar las mediciones-Set-Min y el valor máximo de gris.
- Dibuja una región de interés que cubren la mayor parte de una célula y medir la intensidad mínima, tanto en el YFPex - YFPem y CFPex el - pila YFPem. Tomar la diferencia entre la intensidad medida mínima y la intensidad de fondo de 4,6 y se divide por dos. Esto proporciona una estimación de partida para un valor de corte.
- Además Relación abierta. Seleccione la YFPex - YFPem y CFPex el - pila YFPem. Para FRET relación, seleccione CFPex - YFPem como una pila, para visualizar relación invertida FRET sondas FRET, donde disminuye la eficiencia de la fosforilación, seleccione YFPex - YFPem como una pila.
- Inserte las intensidades de fondo medido y los valores de recorte.
- Establecer la escala de la pila ratio resultante y aplicar una u look adecuadop tabla (LUT) para visualizar los cambios de relación.
5. Resultados representante
Plk1 actividad es visible por primera vez en el núcleo en la fase G2 y picos durante la mitosis. La Figura 3 muestra un experimento con la configuración mínima fototoxicidad como se describe en la sección 2. Tenga en cuenta que este es un resultado inicial de representación y que las condiciones de exposición o el tiempo entre las imágenes puede ser modificado para aumentar la relación señal a ruido o la resolución temporal. Figura 3D muestra que la mayoría de las células que expresan la sonda proliferan con un tiempo de ciclo celular de entre 20 y 25 horas, lo que indica que las condiciones de imagen y los niveles de expresión de la sonda no afectan a los tiempos del ciclo celular. Aunque hay mucho ruido, la tendencia de aumento de la actividad Plk1 en G2 y en horas pico en la mitosis 14 es claramente visible (Figura 3a). Procesamiento de los datos en bruto, aquí por medio de filtrado presenta como una quimógrafo (Fig. 3B), o la cuantificación de la media ra invertido tio (Fig. 3C) puede mejorar la claridad.
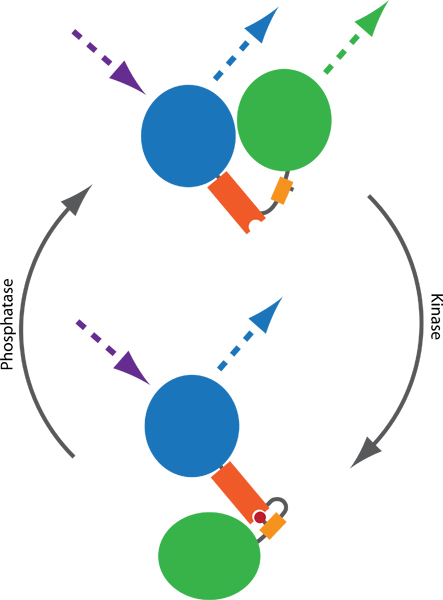
Figura 1. Esquema de una sonda FRET para monitorear las actividades de quinasa y fosfatasa. Dos fluoróforos, por lo general PPC (azul) y YFP (verde), están conectados por un dominio de unión a fosfato (naranja) y una secuencia phosphorylatable (amarillo). Fosforilación (rojo) media de unión al dominio de unión a fosfato, lo que induce un cambio conformacional en la sonda. Los resultados de cambio en la conformación de una diferencia en la distancia y orientación entre los dos fluoróforos, que afecta a la eficiencia de FRET entre PPC y YFP. FRET puede ser visualizado por PPC emocionante y control de las emisiones YFP (líneas punteadas).
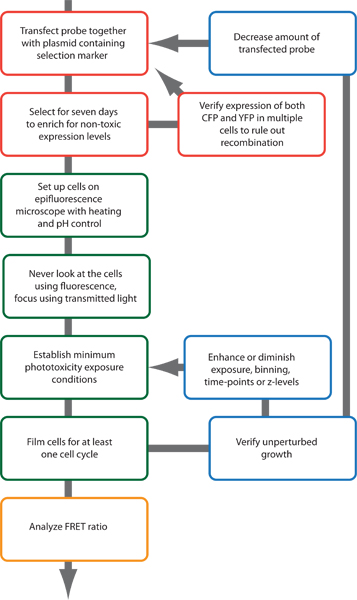
Figura 2. Esquema de los del procedimiento experimental.
p_upload/3410/3410fig3.jpg "/>
Figura 3. Plk1 actividad es visible por primera vez en el núcleo en la fase G2 y picos durante la mitosis. Las células que expresan una U2OS FRET seguimiento basado en la actividad de la sonda Plk1 9,14 fueron filmados durante 60 horas utilizando un DeltaVision Spectris sistema de imágenes equipado con un objetivo de 20x NA aire 0,7 y una lámpara de mercurio. Condiciones imágenes fueron seleccionadas para causar fototoxicidad mínimo, como se indica en la sección 2, con binning 4x y filtros de densidad neutra que bloquea el 99% de la luz entrante. Una representación, en falso color de la invertida FRET-relación, a raíz de un celular a través de cuatro divisiones. B, quimógrafo de la celda se muestra en la A después de aplicar un filtro de media. C, la cuantificación de la proporción invertida FRET de la celda se muestra en A. D, entrada mitótico acumulado de 50 FRET-sonda de las células que expresan, incluyendo las divisiones de las células hijas.
Discusión
Monitoreo FRET todo el ciclo celular requiere de consideraciones que son menos importantes cuando se evalúa a corto plazo respuestas a los estímulos externos. En primer lugar, progresión del ciclo celular es fácilmente perturbada por las señales de estrés, lo que requiere que la fototoxicidad se mantiene al mínimo. En segundo lugar, todos los periodistas pueden afectar los procesos celulares en la titulación de quinasas, fosfatasas o dominios de la interacción. La forma en que probablemente más sencilla de eva...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Los autores se apoyan en la investigación sueca del Consejo, la fundación sueca para la investigación estratégica, la Sociedad Sueca del Cáncer, la sociedad del cáncer infantil sueco, Ake Wibergs y la Fundación Jeanssons.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Número de catálogo | Empresa | |
| Leibovitz L-15, sin rojo fenol | 21083-027 | GIBCO, por Tecnologías de la Vida | |
| DMEM + Glutamax-I | 31966 | GIBCO, por Tecnologías de la Vida | |
| De suero fetal bovino (FBS) | SV30160.03 | HyClone | |
| 0,05% de tripsina EDTA | SH30236.01 | HyClone | |
| Penicilina-estreptomicina | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO, por Tecnologías de la Vida | |
| Puromicina | P8833 | Sigma-Aldrich |
Referencias
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados