Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Überwachung Kinase und Phosphatase-Aktivitäten durch den Zellzyklus durch Ratiometric FRET
In diesem Artikel
Zusammenfassung
FRET-basierten Reporter werden immer häufiger eingesetzt, um Kinase-und Phosphatase-Aktivitäten in lebenden Zellen zu überwachen. Hier beschreiben wir eine Methode auf, wie FRET-basierten Reporter nutzen, um den Zellzyklus-abhängige Veränderungen in Ziel-Phosphorylierung zu beurteilen.
Zusammenfassung
Förster Resonance Energy Transfer (FRET)-basierten Reportern 1 erlauben die Beurteilung der endogenen Kinase-und Phosphatase-Aktivitäten in lebenden Zellen. Solche Sonden bestehen typischerweise aus Varianten von GFP und YFP, durch eine phosphorylierbaren Sequenz und einer phospho-bindende Domäne eingegriffen. Nach der Phosphorylierung FRET der Sonde ändert Konformation, die zu einer Veränderung des Abstandes oder der Orientierung zwischen CFP und YFP Ergebnisse, die zu einer Veränderung der Effizienz (Abb. 1). Mehrere Sonden haben in den letzten zehn Jahren veröffentlicht worden, die Überwachung der Aktivität Balance mehrerer Kinasen und Phosphatasen, darunter Reporter von PKA 2, PKB 3, PKC 4, PKD 5, ERK 6, JNK 7, Cdk 18, Aurora B 9 und Plk1 9 . Angesichts des modularen Aufbaus sind zusätzliche Sonden wahrscheinlich in naher Zukunft 10 austreten.
Progression durch den Zellzyklus wird durch Stress signali betroffenng Wege 11. Bemerkenswert ist, dass der Zellzyklus unterschiedlich während ungestörte Wachstum im Vergleich zu, wenn die Zellen vor Stress erholt 12 geregelt. Zeitraffer-Bildgebung von Zellen durch den Zellzyklus erfordert daher besondere Vorsicht. Dies wird zu einem Problem vor allem beim Einsatz ratiometrische Bildgebung, da zwei Bilder mit einem hohen Signal-Rausch-Verhältnis erforderlich sind, um richtig zu interpretieren die Ergebnisse. Ratiometric FRET Bildgebung von Zell-Zyklus abhängig Veränderungen im Bereich der Kinase-und Phosphatase-Aktivitäten vorwiegend muss Teilbereiche des Zellzyklus 8,9,13,14 beschränkt.
Hier diskutieren wir eine Methode zur FRET-Sonden mit ratiometrische Bildgebung in der gesamten menschlichen Zellzyklus kontrollieren. Die Methode stützt sich auf die Einrichtungen, zur Verfügung zu viele Forscher in den Biowissenschaften ist und erfordert keine Fachkenntnisse der Mikroskopie oder Bildverarbeitung.
Protokoll
1. Die Einführung der Sonde in Zellen
- Co-Transfektion von Zellen mit einer FRET-basierten Sonde und ein Plasmid Resistenz. Wählen Sie eine Transfektion Methode, die effizient in Ihr Handy-Typ von Interesse. Für U2OS Zellen, geben Standard-Calciumphosphat-Transfektion Methoden angemessene Ergebnisse 15.
- Markieren Sie die Zellen in dem entsprechenden Antibiotikum für mindestens 7 Tage. Dies bereichert die Menge an Zellen, die die Sonde und begrenzt die Menge an Zellen mit toxischen Expressionsniveaus oder Expressionsniveaus, die stark beeinflusst den Zellzyklus.
- (Optional) für eine stabile Klone zu selektieren.
- Mit festen oder lebende Zellen sicher, dass sowohl CFP und YFP in allen Zellen vorhanden auf etwa dem gleichen Verhältnis werden.
- Bei einigen Zellen nur CFP oder YFP enthalten, hat Rekombination wahrscheinlich aufgetreten. Die Rekombination kann entweder während das Wachstum von Bakterien oder nach der Transfektion der Sonde und kann in diesem Fall auf dem Plasmid Qualität abhängen. Wiederholen Sie die Plasmid pWiedergutmachung und Linearisierung des Plasmids vor der Transfektion, wenn das Problem weiterhin besteht.
2. Überwachung ratiometrische FRET
- Seed-Zellen auf Glas unteren Gerichte oder Deckgläser für den Einbau in eine Kammer. Stellen Sie sicher, dass Geschirr / Deckgläser kein 1.5 (170 um dick).
- Berg-Zellen in Wachstumsmedium ohne Phenolrot auf einem motorisierten Epifluoreszenzmikroskop mit Temperatur-Regler auf 37 ° C. Stellen Sie sicher, pH-Regulierung der Medien, entweder durch CO 2 oder mit CO 2-unabhängigen Medien wie Liebowitz-15.
- Konzentrieren Sie sich auf Zellen mit Hilfe von Durchlicht. Schauen Sie nicht auf Zellen mit fluoreszierenden Licht.
- Starten Sie durch den Erwerb einer 12 oder 16 Bit-Bild mit YFP-Anregung (YFPex) und YFP-Emission (YFPem) Filter und eine geeignete dichroitische Spiegel. Verwenden Sie maximal Binning zur Verfügung, die noch erlaubt die erforderliche subzelluläre Auflösung. Mit einem hohen Binning auf Belichtungszeit oder die Intensität zu verringern ist entscheidend für Phototoxizität zu vermeiden.
- Mirasure oder Schätzung der Hintergrund-Intensität und die ungefähre Lärm durch Messung oder Abschätzung der groben Durchschnitt, Minimum und Maximum Pixelwerte in einem Gebiet ohne Zellen. Ändern Sie Belichtungszeit und Neutralfilter so dass die durchschnittliche Signal in der Zelle ist ungefähr Hintergrund Intensität plus fünf vor zehn mal den Unterschied zwischen max und min Hintergrund Intensitäten.
- Stellen Sie sicher, dass die Bilder nicht in der Nähe nicht gesättigt. Die maximale Intensität im Bild sollte weniger als die Hälfte der Dynamikumfang (zB max 2000 in einem 12-Bit-Bild), um Intensitätsunterschiede erlauben, wenn die Zellen Mitose geben.
- Wiederholen Sie Schritt von 2,4 bis 2,6 mit CFP Anregungs-und YFP-Emission-Filter und eine geeignete dichroitische Spiegel.
- Wählen Sie mehrere Regionen mit transfizierten Zellen, mit Ausnahme der Regionen für Punkt von 2,4 bis 2,7 verwendet werden, und sicherzustellen, dass die maximale Intensität ist weniger als die Hälfte der Dynamikumfang in allen Zellen.
- Starten Sie eine Zeitraffer-Experiment erwirbt zwei Bilder alle 45 min mit YFPex - YFPem und CFPex - YFPem Filter-Sets.
3. Überprüfung und Optimierung der Bedingungen
- Öffnen Sie die aufgenommenen Bilder und Überwachung der Dauer des Zellzyklus von Mitose zu Mitose für Zellen, die transfiziert Sonde zum Ausdruck bringen.
- Vergleichen Sie die gemessene Dauer des Zellzyklus zu veröffentlichenden Daten für den jeweiligen Zelltyp. Alternativ untransfizierte Dünnschichtzellen durch den Erwerb eines Bildes von Durchlicht nur (z. B. DIC oder Phasen-Kontrast) jede Stunde um Referenzzelle Zykluszeiten zu bekommen.
- Bei der Zeit von Mitose zu Mitose entspricht Zellzyklus Timings Referenz, fahren Sie mit Schritt 4 fort. Alternativ wieder erwerben Bilder mit schwerer Belastung, mehr Zeit-Punkten oder mehreren z-Ebenen und Schritt 3 wiederholen.
- Bei der Zeit von Mitose zu Mitose entspricht nicht Zellzyklus-Timings Referenz, transfiziert Dünnschichtzellen durch den Erwerb eines Bildes von Durchlicht nur (z. B. DIC oder Phasen-Kontrast-) stündlich durch ein Bild, gefolgt am Endedes Experiments zu transfizierten Zellen zu identifizieren.
- Wenn die transfizierten Zellen noch mehr Zellzyklus mal zeigen, wiederholen Sie Schritt 1, aber transfizieren weniger Sonde oder wählen Sie für eine stabile Klone, die sehr geringe Mengen der Sonde enthalten.
- Wenn die transfizierten Zellen des normalen Zellzyklus mal zeigen, in der Abwesenheit von Fluoreszenzlicht, wiederholen Sie Schritt 2, aber niedriger Belichtung, indem Sie Binning, Neutralfilter, Belichtungszeit, und die Zeit zwischen den Bildern.
4. Analyse FRET
- Die Analyse kann von den meisten Software gewidmet Mikroskopie durchgeführt werden. Hier beschreiben wir, wie die Analyse mit Hilfe der Freeware ImageJ (durchführen http://rsb.info.nih.gov/ij ) unter Verwendung des Plugins Verhältnis Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- Öffnen Sie die Bilder in ImageJ. Falls Ihr Bilder sind im Format eines mehrfarbigen stack (z. B. Deltavision), trennen Sie die einzelnen Kanäle durch erste Umwandlung einer HyperStack: zu HyperStack Image-HyperStack-Stack und anschließend teilen Sie sie auf einzelne Kanal-Stacks mit: Image-HyperStack-Dimensionalität zu reduzieren
- Multiplizieren Sie die YFPex - YFPem Stapel mit 3 Verwendung: Process-Math-Multiply Dieser Schritt ist optional, da sie nur dazu bestimmt ist, die visuelle Klarheit der Bilder, indem sichergestellt wird, dass Verhältnisse nicht in den Bereich zwischen 0 und 1 zu erhöhen.
- In der YFPex - YFPem Stack, zeichnen Sie eine Region of Interest (ROI) in einem Gebiet, das frei von Zellen ist, aber das liegt in der Nähe einer Zelle zu messen. Verschiedene Zellen in das gleiche Bild können unterschiedliche Regionen, da beide Hintergrund und Signalintensität in der Regel am stärksten ist in der Mitte des Bildes.
- Fügen Sie den ROI zu ROI-Manager: Analysieren-tools-ROI-Manager.
- Messen Sie die mittlere Intensität der ROI sowohl in der YFPex - YFPem und die CFPex - YFPem stack: Analyze-Measure .
- Wiederholen Sie bei mehreren Zeitpunkten und sicherstellen, dass Hintergrund-Intensitäten in der Nähe der Zelle von Interesse sind, ähnlich den ganzen Film.
- Set Messungen minimal Intensität gehören: Analyse-Set Messungen-Min-und Max-Grauwert.
- Zeichnen Sie eine Region von Interesse für die meisten von einer Zelle und messen Sie die minimale Intensität sowohl in der YFPex - YFPem und die CFPex - YFPem Stapel. Nehmen Sie die Differenz zwischen der gemessenen minimalen Intensität und die Hintergrund-Intensität von 4,6 und dividieren sie durch zwei. Dies stellt einen Ausgangspunkt Schätzung für eine Clipping-Wert.
- Öffnen Verhältnis Plus. Wählen Sie die YFPex - YFPem und die CFPex - YFPem Stapel. Für FRET-Verhältnis, wählen CFPex - YFPem als Stapel 1, für den invertierten FRET Verhältnis Visualisierung Sonden, wo die Effizienz sinkt FRET auf Phosphorylierung, wählen YFPex - YFPem als Stapel 1.
- Legen Sie die gemessenen Intensitäten Hintergrund-und Clipping-Werte.
- Stellen Sie die Skalierung der resultierende Verhältnis Stack und wenden Sie einen passenden Look up-Tabelle (LUT)-Verhältnis Veränderungen sichtbar zu machen.
5. Repräsentative Ergebnisse
Plk1 Aktivität wird zuerst sichtbar in den Kern in der G2-Phase und Gipfel während der Mitose. Abbildung 3 zeigt ein Experiment mit minimal Phototoxizität Einstellungen wie in Abschnitt 2 beschrieben. Bitte beachten Sie, dass dies eine repräsentative erste Ergebnis ist, und dass die Exposition Bedingungen oder zwischen den Bildern kann geändert werden, um Signal-Rausch-Verhältnis oder zeitliche Auflösung zu erhöhen. Abbildung 3D zeigt, dass ein Großteil der Zellen, die die Sonde wuchern mit einem Zellzyklus-Zeit zwischen 20 und 25 Stunden, was darauf hinweist, dass die Aufnahmebedingungen und Expression der Sonde nicht beeinflussen Zellzyklus Timings. Zwar gibt es erheblichen Lärm, wodurch der Trend der Plk1 Aktivität in G2 und gipfelt in der Mitose 14 ist deutlich zu erkennen (Abb. 3A). Die Verarbeitung der Rohdaten, die hier durch meine Filterung präsentiert als Kymographion (Abb. 3B), oder die Quantifizierung der durchschnittlichen invertiert ra tio (Abb. 3C) kann der Klarheit.
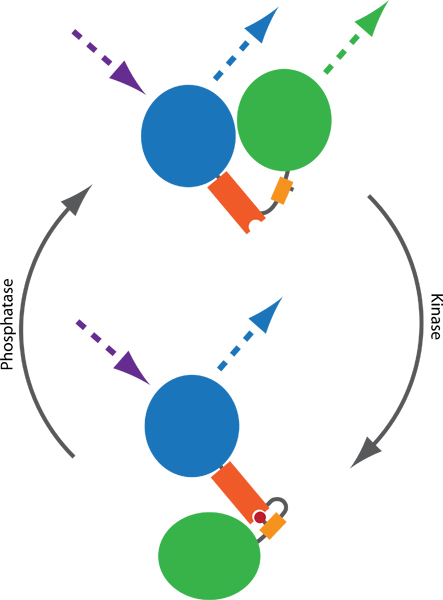
Abbildung 1. Prinzip einer FRET-basierten Sonde an Kinase-und Phosphatase-Aktivitäten überwachen. Zwei Fluorophore, in der Regel CFP (blau) und YFP (grün), werden durch einen phospho-bindende Domäne (orange) und ein phosphorylierbaren Sequenz (gelb) verbunden. Phosphorylierung (rot) vermittelt die Bindung an die phospho-bindende Domäne, dabei wird eine Konformationsänderung in der Sonde. Die Konformationsänderung führt zu einem Unterschied in der Ferne oder die Orientierung zwischen den beiden Fluorophoren, die FRET-Effizienz zwischen CFP und YFP beeinflusst. FRET kann visualisiert werden durch spannende CFP und YFP-Emission Monitoring (gestrichelte Linien).
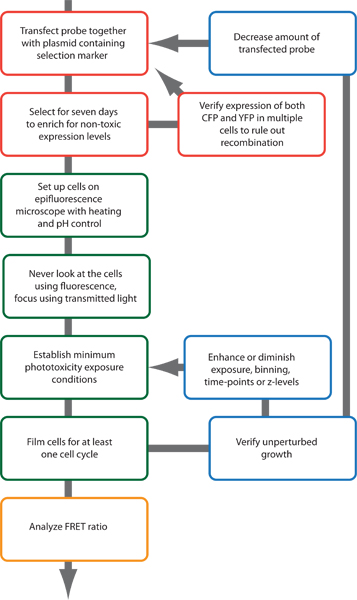
Abbildung 2. Schematische Darstellung des experimentellen Verfahren.
p_upload/3410/3410fig3.jpg "/>
Abbildung 3. Plk1 Aktivität wird zuerst sichtbar in den Kern in der G2-Phase und Gipfel während der Mitose. U2OS Zellen, die einen FRET-basierten Sonde Überwachung Plk1 Aktivität 9,14 wurden für 60 h mit einem Deltavision Spectris Imaging-System mit einem 20x NA 0,7 Luft objektive und eine Quecksilberlampe ausgestattet gefilmt. Imaging Bedingungen wurden gewählt, um minimal Phototoxizität verursachen, wie in Abschnitt 2 umrissenen, mit 4x Binning und Neutralfilter, dass Block 99% des einfallenden Lichts. A, falsche Farbdarstellung invertiert FRET-Ratio nach einer Zelle bis 4 Divisionen. B, Kymographion der Zelle in A nach dem Auftragen eine mittlere Filter angezeigt. C, Quantifizierung des invertierten FRET Verhältnis der Zelle in A. D dargestellt, kumulative mitotischen Eintrag von 50 FRET-Sonde exprimierenden Zellen, einschließlich Abteilungen der Tochterzellen.
Diskussion
Überwachung FRET während des Zellzyklus erfordert Überlegungen, die weniger wichtig sind bei der Beurteilung der kurzfristigen Reaktionen auf äußere Reize. Zuerst wird das Fortschreiten des Zellzyklus leicht gestört durch Stress-Signalisierung, verlangen, dass Phototoxizität auf ein Minimum gehalten wird. Zweitens können alle Reporter möglicherweise beeinflussen zelluläre Prozesse durch Titration aus Kinasen, Phosphatasen oder Interaktion Domains. Der wohl einfachste Weg, um zu beurteilen, wenn die experimente...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren sind vom schwedischen Forschungsrat, die Schwedische Stiftung für strategische Forschung, dem schwedischen Cancer Society, der schwedischen Kinder-Krebs-Gesellschaft, Åke Wibergs Stiftung und Jeanssons Stiftung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Katalog-Nummer | Firma | |
| Leibovitz L-15, kein Phenolrot | 21083-027 | GIBCO von Life Technologies | |
| DMEM + Glutamax-I | 31966 | GIBCO von Life Technologies | |
| Fetal Bovine Serum (FBS) | SV30160.03 | HyClone | |
| 0,05% Trypsin EDTA | SH30236.01 | HyClone | |
| Penicillin-Streptomycin | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO von Life Technologies | |
| Puromycin | P8833 | Sigma-Aldrich |
Referenzen
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten