È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monitoraggio Attività chinasi e fosfatasi attraverso il ciclo cellulare da raziometrica FRET
In questo articolo
Riepilogo
FRET basato giornalisti sono sempre più utilizzati per monitorare le attività di chinasi e fosfatasi in cellule vive. Qui si descrive un metodo su come utilizzare FRET-based reporter per valutare ciclo-dipendente delle cellule cambiamenti nella fosforilazione di destinazione.
Abstract
Förster risonanza trasferimento di energia (FRET) a base di reporter 1 consentono la valutazione della chinasi endogene e delle attività della fosfatasi nelle cellule viventi. Tali sonde consistono tipicamente di varianti del CFP e YFP, è intervenuto da una sequenza phosphorylatable e una fosfo-dominio di legame. Su fosforilazione, la conformazione della sonda cambiamenti, che si traduce in una variazione della distanza o l'orientamento tra CFP e YFP, portando ad un cambiamento di FRET efficienza (Fig. 1). Più sonde sono state pubblicate nell'ultimo decennio, monitorando l'equilibrio tra l'attività di chinasi e fosfatasi molteplici, tra cui i giornalisti di PKA 2, PKB 3, PKC 4, PKD 5, 6 ERK, JNK 7, Cdk 18, Aurora B 9 e 9 Plk1 . Dato il design modulare, le sonde aggiuntive possono emergere nel futuro vicino a 10.
Progressione attraverso il ciclo cellulare è affetto da stress signaling percorsi 11. In particolare, il ciclo cellulare è regolato in modo diverso durante l'imperturbabile crescita rispetto a quando le cellule si stanno riprendendo dallo stress 12. Time-lapse imaging di cellule attraverso il ciclo cellulare richiede quindi particolare cautela. Questo diventa un problema soprattutto quando si impiegano immagini raziometrici, visto che due immagini con un elevato rapporto segnale-rumore sono tenuti ad interpretare correttamente i risultati. Raziometrico FRET imaging di cambiamenti del ciclo cellulare dipendente in attività di chinasi e fosfatasi sono prevalentemente stata limitata a sotto-sezioni del ciclo cellulare 8,9,13,14.
Qui si discute un metodo per monitorare FRET-based utilizzando sonde di imaging raziometriche tutto il ciclo delle cellule umane. Il metodo si basa sul materiale che è disponibile per molti ricercatori nelle scienze della vita e non richiede conoscenze specialistiche di microscopia o di elaborazione delle immagini.
Protocollo
1. Introducendo la sonda per le cellule
- Co-trasfezione delle cellule con una sonda FRET-based e una resistenza plasmide conferimento. Scegliere un metodo di trasfezione che sia efficiente in cella tipo di interesse. Per le celle U2OS, standard di fosfato di calcio metodi di trasfezione dare risultati adeguati 15.
- Selezionare le celle nel antibiotico appropriato per almeno sette giorni. Ciò arricchisce la quantità di cellule che esprimono la sonda e limita la quantità di cellule con livelli di espressione tossici, o livelli di espressione che influenzano pesantemente il ciclo cellulare.
- (Facoltativo) Seleziona per cloni stabili.
- Usando cellule fisse o dal vivo, verificare che sia CFP e YFP sono presenti in tutte le cellule a circa lo stesso rapporto.
- Nel caso in cui alcune cellule contengono solo CFP o YFP, ricombinazione è probabilmente avvenuto. Ricombinazione può avvenire sia durante la crescita batterica o dopo la transfezione della sonda e può in quest'ultimo caso, dipendono dalla qualità plasmide. Ripetere p plasmideriparazione e linearizzare il plasmide prima trasfezione se il problema persiste.
2. Raziometrico monitoraggio FRET
- Cellule seme su piatti fondo di vetro, o scivola copertura per il montaggio in una camera. Assicurarsi che i piatti / coprioggetto sono 1,5 (170 micron di spessore).
- Montare le cellule nel terreno di coltura senza rosso fenolo su un microscopio a epifluorescenza motorizzato con controllo della temperatura impostata a 37 ° C. Garantire una regolamentazione del pH dei media, sia per CO 2 oppure utilizzando CO 2-media indipendenti come Liebowitz-15.
- Focus su cellule a luce trasmessa. Non guardare sulle cellule usando la luce fluorescente.
- Inizio con l'acquisizione di un 12 o 16 bit immagine con eccitazione YFP (YFPex) e YFP emissione (YFPem) filtri e uno specchio dicroico adatto. Usa binning massima disponibile che permette ancora la risoluzione richiesta subcellulare. Utilizzando un binning alto per diminuire il tempo di esposizione o l'intensità è fondamentale per evitare di fototossicità.
- MeAsure o stimare l'intensità del rumore di fondo e approssimativo, misurando o stimando la media massima, minima e massima dei valori dei pixel in una zona priva di cellule. Tempo di esposizione e cambiare i filtri a densità neutra in modo che il segnale di media nella cella è di circa l'intensità di fondo più cinque a dieci volte la differenza tra max e min intensità di fondo.
- Verificare che le immagini non sono vicino alla saturazione. L'intensità massima l'immagine deve essere inferiore alla metà della gamma dinamica (per esempio max 2000 in un'immagine a 12 bit) per tener conto delle differenze di intensità quando le cellule entrano mitosi.
- Ripetere il passo 2,4-2,6 con eccitazione CFP e YFP filtri emissione e uno specchio dicroico adatto.
- Selezionare più regioni con le cellule transfettate, escludendo le regioni utilizzate per punto 2.4 del 2.7, e garantire che l'intensità massima è meno della metà della gamma dinamica in tutte le cellule.
- Avviare un time-lapse esperimento acquisizione di due immagini ogni 45 min con YFPex - YFPem e CFPex - YFPem set di filtri.
3. Verifica e ottimizzazione delle condizioni
- Aprire le immagini acquisite e monitorare il tempo di ciclo cellulare da mitosi a mitosi per le cellule che esprimono la sonda transfettate.
- Confrontare il tempo misurato ciclo cellulare ai dati pubblicati per il tipo di cellulare utilizzato. In alternativa, film untransfected cellule con l'acquisizione di una immagine di luce trasmessa solo (ad esempio DIC o contrasto di fase) ogni ora per ottenere riferimento i tempi di ciclo cellulare.
- Nel caso in cui il tempo da mitosi a mitosi corrisponde al riferimento tempi ciclo cellulare, passare al punto 4. In alternativa, ri-acquisire le immagini con più esposizione, più tempo o più punti di z-livelli e ripetere il punto 3.
- Nel caso in cui il tempo da mitosi a mitosi non corrisponde a tempi di riferimento del ciclo cellulare, le cellule trasfettate pellicola con l'acquisizione di una immagine di luce trasmessa solo (ad esempio DIC o contrasto di fase) ogni ora seguita da una sola immagine alla finedell'esperimento per identificare le cellule transfettate.
- Se le cellule trasfettate mostrano ancora i tempi di ciclo più lungo cellulare, ripetere il passo 1, ma trasfezione meno sonda o per selezionare i cloni stabili che contengono quantità molto basse di sonda.
- Se le cellule trasfettate mostrano normali tempi di ciclo cellulare, in assenza di luce fluorescente, ripetere il punto 2, ma una minore esposizione modificando binning, i filtri a densità neutra, tempo di esposizione, e il tempo tra le immagini.
4. Analizzando FRET
- L'analisi può essere eseguita dalla maggior parte dei software dedicati alla microscopia. Qui si descrivono come eseguire l'analisi utilizzando il freeware ImageJ ( http://rsb.info.nih.gov/ij ) utilizzando il plugin Rapporto Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- Aprire le immagini in ImageJ. Nel caso in cui le immagini sono nel formato di un Stac multicolorek (ad esempio Deltavision), separare i singoli canali di prima li converte in un HyperStack: Image-HyperStack-stack HyperStack e successivamente dividerli a pile singolo canale usando: Immagine-HyperStack-ridurre la dimensionalità
- Moltiplicare il YFPex - pila YFPem con 3 usando: Process-Math-Moltiplicare Questo passaggio è facoltativo, in quanto è solo destinato ad aumentare la chiarezza visiva delle immagini, assicurando che i rapporti non sono nel range compreso tra 0 e 1.
- Nel YFPex - pila YFPem, disegnare una regione di interesse (ROI) in una zona che è privo di cellule, ma che si trova vicino a una cella da misurare. Cellule diverse nella stessa immagine può richiedere diverse regioni, sia come sfondo e l'intensità del segnale è di solito più forte al centro di un'immagine.
- Aggiungere il ROI al ROI manager: Analisi-tools-ROI manager.
- Misurare l'intensità media del ROI in entrambe le YFPex - YFPem e CFPex - pila YFPem: Analisi-Misura .
- Ripetere in vari intervalli di tempo e verificare che intensità sfondo vicino alla cella di interesse sono simili in tutto il film.
- Impostare le misure per includere l'intensità minima: Analisi-Set misurazioni-Min e Max valore di grigio.
- Disegnare una regione di interesse che coprono la maggior parte di una cella e misurare l'intensità minima in entrambe le YFPex - YFPem e CFPex - pila YFPem. Prendere la differenza tra l'intensità misurata minimale e l'intensità di fondo da 4,6 e dividerlo per due. Questo fornisce una stima di partenza per un valore di ritaglio.
- Rapporto + aperto. Selezionare la YFPex - YFPem e CFPex - pila YFPem. Per FRET rapporto, selezionare CFPex - YFPem come stack 1, per il rapporto invertito FRET visualizzazione sonde FRET in cui riduce l'efficienza sul fosforilazione, selezionare YFPex - YFPem come stack 1.
- Inserire l'intensità di fondo misurata ed i valori di ritaglio.
- Impostare la scala dello stack rapporto risultante e applicare un u adatto sguardop table (LUT) di visualizzare le modifiche rapporto.
5. Rappresentante Risultati
Plk1 attività è il primo visibile nel nucleo in fase G2 e picchi durante la mitosi. La figura 3 mostra un esperimento utilizzando le impostazioni di fototossicità minime come descritto nella sezione 2. Si prega di notare che questo è un risultato rappresentativo iniziale e che le condizioni di esposizione o di tempo tra le immagini possono essere modificati per aumentare rapporto segnale rumore o di risoluzione temporale. La figura mostra in 3D che la maggioranza delle cellule che esprimono la sonda proliferare con un tempo di ciclo cellulare tra 20 e 25 ore, indicando che le condizioni di imaging e livelli di espressione della sonda non influiscono tempi del ciclo cellulare. Anche se c'è rumore considerevole, il trend di Plk1 crescente attività in G2 e un picco nel mitosi 14 è chiaramente visibile (fig. 3A). L'elaborazione dei dati grezzi, qui da dire filtraggio presentato come un chimografo (fig. 3B), o la quantificazione della media ra invertita tio (fig. 3C) può migliorare la chiarezza.
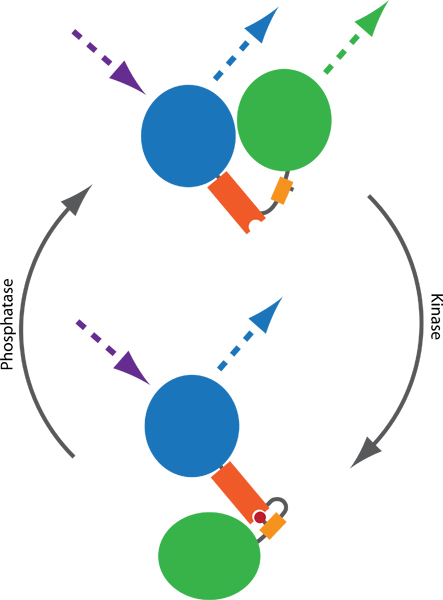
Figura 1. Principio di una sonda FRET a base di monitorare le attività chinasi e fosfatasi. Due fluorofori, tipicamente CFP (blu) e YFP (verde), sono collegati da una fosfo-dominio di legame (arancione) e una sequenza phosphorylatable (giallo). Fosforilazione (rosso) media il legame con i fosfo-dominio di legame, in modo da indurre un cambiamento conformazionale nella sonda. I risultati cambiamento conformazionale in una differenza nella distanza o l'orientamento tra i due fluorofori, che colpisce l'efficienza FRET tra CFP e YFP. FRET può essere visualizzato CFP emozionante e monitoraggio delle emissioni YFP (linee tratteggiate).
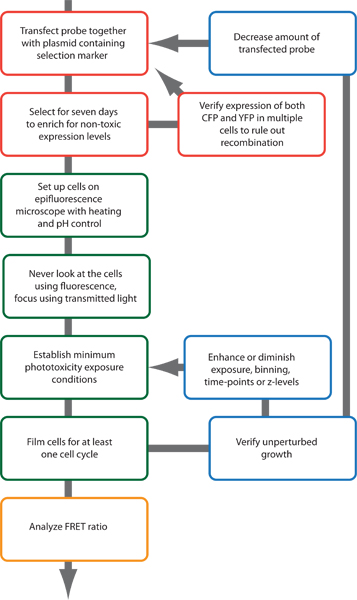
Figura 2. Delineare schematica della procedura sperimentale.
p_upload/3410/3410fig3.jpg "/>
Figura 3. Plk1 attività è il primo visibile nel nucleo in fase G2 e picchi durante la mitosi. U2OS cellule che esprimono un FRET monitoraggio basato sonda Plk1 attività sono state girate 9,14 per 60 ore utilizzando un sistema Deltavision Spectris Imaging dotato di un NA 20x 0,7 obiettivo aria e una lampada al mercurio. Condizioni di imaging sono stati selezionati per causare fototossicità minimo, come indicato nella sezione 2, con binning 4x e filtri a densità neutra che bloccano il 99% della luce in entrata. Una rappresentazione in falsi colori della invertito FRET-rapporto, a seguito di una cella a 4 divisioni. B, chimografo della cellula mostrata in A dopo l'applicazione di un filtro medio. C, la quantificazione del rapporto invertito FRET della cellula mostrata in A. D, ingresso mitotico cumulativo di 50 FRET-sonda cellule che esprimono, tra cui le divisioni di cellule figlie.
Discussione
Monitoraggio FRET durante il ciclo cellulare richiede considerazioni che sono meno cruciali nella valutazione a breve termine le risposte agli stimoli esterni. In primo luogo, la progressione del ciclo cellulare è facilmente perturbato da segnalazione stress, richiedendo che fototossicità è ridotto al minimo. In secondo luogo, tutti i giornalisti possono potenzialmente influenzare processi cellulari per titolazione di fuori chinasi, fosfatasi o domini di interazione. Il modo forse più semplice per valutare se le con...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori sono supportati dal Consiglio di ricerca svedese, la Fondazione svedese per la ricerca strategica, la società svedese cancro, la società svedese cancro infantile, Åke Wibergs fondazione e Jeanssons fondazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Numero di catalogo | Azienda | |
| Leibovitz L-15, senza rosso fenolo | 21083-027 | GIBCO, di Life Technologies | |
| DMEM + Glutamax-I | 31966 | GIBCO, di Life Technologies | |
| Siero fetale bovino (FBS) | SV30160.03 | Hyclone | |
| 0,05% tripsina EDTA | SH30236.01 | Hyclone | |
| Penicillina-Streptomicina | SV30010 | Hyclone | |
| DPBS | 14287 | GIBCO, di Life Technologies | |
| Puromicina | P8833 | Sigma-Aldrich |
Riferimenti
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon