Method Article
Dois registros eletrofisiológicos de sinapticamente evocadas Respostas astroglial e neuronal em fatias hipocampais agudas
Neste Artigo
Resumo
A preparação de fatias cerebrais agudas de isolado hipocampo, assim como as gravações simultâneas electrofisiológicas de astrócitos e neurónios em Stratum radiatum Durante a estimulação de schaffer colaterais é descrito. O isolamento farmacológica de potássio astroglial e as correntes do transportador de glutamato é demonstrada.
Resumo
Os astrócitos formam sinapses com os neurónios tripartidas, onde integrar e modular a atividade neuronal. Na verdade, os astrócitos sentir entradas neuronais através da ativação de seus canais iônicos e receptores de neurotransmissores, e informações do processo, em parte, através da atividade dependente de liberação de gliotransmitters. Além disso, os astrócitos constituem o sistema de captação de glutamato principal, contribuir para o buffer espacial de potássio, bem como a folga do GABA. Estas células, portanto, monitorar constantemente a atividade sináptica, e, assim, são indicadores sensíveis para alterações no glutamato sinapticamente-lançado, o GABA ea extracelular níveis de potássio. Além disso, alterações na atividade captação astroglial ou capacidade tampão pode ter efeitos graves sobre as funções neuronais, e pode ser negligenciada quando caracterizando situações fisiopatológicas ou camundongos knockout. Gravação dupla de atividades neuronais e astroglial é, portanto, um importante método para estudar alterações nasináptica associada à concomitante alterações da captação astrocitária e capacidade de buffer. Aqui descrevemos como preparar fatias de hipocampo, como identificar astrócitos estrato radiatum, e como gravar simultaneamente neuronais e astroglial respostas eletrofisiológicas. Além disso, descreve-se como isolar farmacologicamente as correntes evocadas sinapticamente-astrogliais.
Protocolo
1. Preparação do líquido cefalorraquidiano artificial e solução intracelular
- Antes de iniciar o experimento, uma necessidade de preparar a solução interna para as gravações patch clamp, bem como o fluido cerebroespinal artificial (ACSF) para a preparação do hipocampo. Você ainda precisa de um kit de dissecação consistindo de tesoura cirúrgica e tesoura íris bem, duas espátulas e pinças (ferramentas da ciência Belas), um dispositivo de gaseamento de vidro (micro-filtro de vela, Robu Alemanha) e grade de tecido (mosquiteiro ou nylon apertado), bem como supercola (Dent Uhu). A configuração da instalação de patch fatia electrofisiologia foi descrito por Finkel e Bookman, 2001 1.
- Para a solução interna, dissolver (em mM): 105 Gluconato de K, 30 KCl, 10 mM de HEPES e 0,3 EGTA em água desionizada (em 70-80% do volume final). Arrefece-se a solução a 4 ° C e adicionar (em mM): 4 ATP-Mg, 0,3 GTP-Tris e 10 fosfocreatina. Ajustar o pH para 7,4 com KOH e u fillp com água desionizada ao volume final. (Osmolaritiy: ~ 280 mOsm). Filtrar esta solução (tamanho de poro de 0,2 um). Solução alíquota é estável durante 3-4 semanas, a - 20 ° C. Por um dia experimental, ~ 1 ml de solução interna é necessária.
- Salvo indicação em contrário, o ACSF usado para a preparação do hipocampo e gravações de células na região CA1, contém (em mM): 119 NaCl, 2,5 KCl, 2,5 CaCl2, 1,3 MgSO4, 1 NaH 2 PO 4, 26,2 NaHCO 3 e 11 glucose. Dissolver destes sais em água desionizada (Osmolaridade ~ 320 mOsm), e esta solução para oxigenar pelo menos, 10 min (pH ~ 7,3-7,4) com carbogénio (95% O 2 e 5% CO 2). Preparar pelo menos 1 litro de solução por experiência. Cuidado especial deve ser tomado para a preparação de tecido do hipocampo que será utilizada para realizar experiências na região CA3 do hipocampo. De facto, esta região é propensa a actividade epileptiforme e morte neuronal subsequente. Assim SYNAPTic actividade deve ser fortemente reduzido durante a preparação de fatia, e isto é conseguido através da realização da dissecação do hipocampo em solução gelada de sacarose contendo (em mM): NaCl 87, 2,5 de KCl, 0,5 de CaCl2, 7 MgCl 2, 1 NaH 2 PO 4 , 25 de NaHCO3, 10 de glucose e 75 de sacarose. Nesta solução, a combinação de baixo teor de sódio, cálcio e magnésio de alta concentração em massa de disparo pré-sináptica e reduzir a probabilidade de libertação, bem como a actividade do receptor pós-sináptico NMDA, minimizando assim a actividade espontânea e morte celular. Uma vez preparadas, as fatias de hipocampo utilizadas para gravações de células a partir da região CA3 são perfundidos com ACSF modificado, contendo 4 mM de CaCl 2 e 4 MgSO 4, para minimizar a actividade polysynaptic.
2. Preparação Slice aguda Hippocampal
- Arrefecer ~ 300 ml de ACSF para a câmara de corte, bem como para a preparação a 4 ° C, enquanto constantemente com oxigenarcarbogênio. Preparar um pequeno copo com ACSF à temperatura ambiente (RT) para o armazenamento de fatia, que também é oxigenado com carbogénio (Esquema Figura 1).
- Anestesiar o mouse sob um capuz com uma toalha de papel umedecido com uma pequena isoflurano ml que é adicionado na gaiola.
- Depois de o rato é profundamente anestesiados, cortar a cabeça e adicioná-lo diretamente em um pequeno prato com gelado ACSF oxigenado. Retire o couro cabeludo com uma tesoura pequena e transferir a cabeça em tecido para as etapas subseqüentes. Iniciar a dissecção do hipocampo, como ilustrado e descrito na Figura 1.
- Corte 300-400 mm de espessura fatias transversais a baixa velocidade (3 m / s) e frequência de vibração de 70 Hz em gelada oxigenado ACSF, e transferi-los para uma câmara de armazenamento. Deixe o resto fatias à TA, durante pelo menos 1 h antes de gravação. Fatias de CA3 experiências são armazenados 25 min a 34 ° C e pelo menos 30 min à temperatura ambiente, para se recuperar a partir do processo de corte.
3. Gravação dupla de Evocados Correntes astroglial e potenciais de campo Neuronais
Nós aqui descrever como gravar sinapticamente evocadas respostas gliais e de neurônios, ou seja, as respostas induzidas pela ativação sinapse através da estimulação aferência usando um eletrodo extracelular.
- Perfundir constantemente a câmara de registo com ACSF oxigenado (1,5-2 ml / min, RT), que continha 100 mM picrotoxina (GABA antagonista A) para isolar as respostas excitatórias. Transferir uma fatia em uma poli-L-lisina (1,5 a 3 mg / ml) a lamela revestida, embeber o líquido para atingir uma adesão fatia bom e adicionar uma gota de ASCF em cima da fatia. Coloque a lamela na câmara de gravação. O bloqueio da transmissão inibitória por picrotoxina pode resultar em actividade epileptiforme, ou seja espontânea queima, síncrono de populações neuronais, o que vai distorcer a medição dos acontecimentos evocados. Assim, para evitar a actividade epileptiforme, fazer umacorte plana (apenas a superfície) entre as regiões CA1 e CA3 para impedir a propagação através da colaterais de Schaffer (como indicado na Figura 2a).
- Stratum radiatum astrócitos podem ser identificados pelo seu tamanho físico pequeno (~ 10 mm) e montagem processo stellate. Escolher uma célula de pelo menos 20-30 uM abaixo da superfície da fatia. Montar um eléctrodo de estimulação de vidro (resistência de ponta ~ 1 M) sobre o fio de prata que está ligado à caixa de isolamento de estímulo e ligação à terra para o banho (simplesmente envolver o fio de prata segundo em torno do vidro de pipeta). Coloque o eléctrodo de estimulação para a região colateral de Schaffer, como indicado na Figura 2A, a uma distância de 200-300 ^ M de distância do astrócito escolhido. Montar o eléctrodo de registo de campo (~ 2-5 MQ) para um fio de prata clorada ligado ao andar de entrada do amplificador. Ambos os eletrodos são preenchidos antes com ACSF. Escolha em multiclamp o modo I = 0, que desativa COM externomand de entrada e posicionar o eléctrodo ~ 50 mm de distância do astrócito no stratum radiatum região (Figura 2A). Registar as respostas de ganho com 2 a 10 e do filtro com um filtro de Bessel 2 kHz. Injeção de corrente elétrica no cérebro desencadeia fatia potenciais de ação nos cercam axônios colaterais Schaffer e liberação posterior transmissor nos terminais pré-sinápticos que projeto de pós-sinápticos CA1 neurônios piramidais. Os transmissores divulgados irá desencadear um fluxo de carga positiva para as células através de receptores ionotrópicos pós-sinápticos, o que é mensurável extracelularmente como um pequeno potencial negativo. Este campo potencial excitatório pós-sináptico (fEPSP) integra a actividade de um grupo de neurónios, simultaneamente activos, enquanto que a transmissão inibitória é bloqueado farmacologicamente. Aplicar alguns pulsos de teste (0,1 ms de duração) para evocar um fEPSP, alguns reposicionamento do eletrodo de estimulação pode ajudar a aumentar a fEPSP. Um típico CA1 estrato Radiathum fEPSP é ilustrado na Figura 2B. Mais pormenores sobre o posicionamento e as formas de onda de resposta pode ser encontrada em Yuan et al. 2003 2. A amplitude de uma fatia fEPSP saudável hipocampal deve geralmente ser mais do que duas vezes tão grande como a amplitude da rajada de fibra. Para a quantificação precisa dos fEPSP amplitude ou declive, o reponse evocado deve ser monossináptico, como atividade polysynaptic (detectável como uma resposta multi-pico) indica a atividade sináptica independente da estimulação elétrica, que pode ser um sinal de hiperexcitabilidade. Para as experiências realizadas na região CA3 do hipocampo, a estimulação e pipetas de gravação são posicionadas como ilustrado na Figura 3C. Para identificar claramente as entradas de fibras musgosas, que são fortemente facilitando, emparelhado pulso-estimulação (50 ms interpulso intervalo) e uma estimulação Hz por alguns segundos são aplicadas para aumentar maciçamente a amplitude inicialmente baixa evocado fEPSP responses.At finalda experiência, DCGIV, um antagonista do receptor mGluR2 / 3, podem ser lavadas em para comprovar que as entradas de fibras musgosas realmente foram estimuladas. A aplicação deste antagonista deve reduzir a fEPSP por ~ 90%, devido à elevada expressão de mGluR2 / 3 receptores, inibindo a libertação pré-sináptica de boutons fibras musgosas.
- Encha uma pipeta patch (~ 2-5 MQ), com solução filtrada interna e montá-lo em um fio de prata clorada ligado ao andar de entrada segundo, aplique pressão positiva, com uma seringa, a qual está ligada por meio da tubagem para o seu titular pipeta. Constantemente aplicar um pulso de teste 20 ms de 10 mV e passar a pipeta no tecido até chegar à superfície celular e uma deflexão na membrana torna-se visível. Zero a pipeta offset, remover a pressão positiva, e fixar a membrana de - 80 mV. Espere até que um gigaseal (pelo menos 1 GΩ) é atingido (que não deve demorar mais do que alguns segundos). Aplicação suave de alguma pressão negativa pode ajudar a alcançar agigaseal. Quebrar para dentro da célula é conseguida através de uma aplicação de curto ou de pressão negativa através da função em multiclamp zap. Iniciar a gravação simultânea da garantia Schaffer evocado fEPSP ea resposta astroglial na braçadeira de tensão (Vhold - 80 mV; freqüência 0,1 Hz ganho, filtro de Bessel 2 kHz, 10). A resposta astroglial atual é bifásica: primeiro, você vai ver uma corrente transitória rápida para fora, refletindo fEPSPs geradas por células adjacentes piramidais. Isto é seguido por uma lenta subida e decaindo interiores correntes (subsistem alguns segundos (> 10 s) após a cessação das respostas neuronais). Esta corrente é principalmente devido a entrada de potássio em astrócitos, após o lançamento cercando despolarizadas terminais pós-sinápticos. Um transportador de glutamato ativados simultaneamente rápido corrente transitória (GLT), desencadeada pela liberação de glutamato pré-sináptica é mascarada pela corrente de potássio. O potencial de retenção do astrócito, bem como a resistência ao acesso do sistema transdérmico deve ser monitored ao longo da experiência e não devem variar mais do que cerca de 20%, para evitar a monitorização imprecisa de reponses astrogliais, devido a alterações nas condições de gravação. Astrócitos apenas com um potencial de exploração inicial> -70 mV deve ser investigada para estudar as células saudáveis.
- Mudar de tensão para fixação de corrente, a fim de registrar a despolarização da membrana evocado astrocitária. Isolar o transportador glutamato glial (GLT) actual por perfusão do ácido ionotrópicos do glutamato bloqueador receptor cinurênico (5 mM), até que o fEPSP está completamente bloqueada e a amplitude da GLT atingiu um patamar. Para identificar claramente a corrente GLT, aplicar o antagonista específico de DL-treo-β-Benzyloxyaspartatic ácido (DL-TBOA, a 200 uM). Aumentar a resistência à estimulação por 2 vezes a 5 vezes, para registar as respostas neuronais e astroglial a força sináptica diferente, e aplicar dois estímulos espaçadas (50 intervalo msec) para investigar as respostas à estimulação de pulso emparelhado. Estabilidade de série resistance e potencial de membrana da célula glial deverá ser monitorizados durante a gravação.
- Para visualizar a extensão da abertura de junção, mediada redes astrogliais, corante de acoplamento de experiências devem ser realizadas no modo de fixação de corrente, sem qualquer injecção de corrente, para permitir a difusão passiva de baixa corantes molecular (<1,5 kDa), como sulforrodamina-B, através dos canais de junções de hiato. Para minimizar o extravasamento de corante para o tecido circundante, a pressão positiva deve ser aplicada através da pipeta patch de apenas ao entrar no tecido e o sistema deve ser alcançado mais rapidamente possível.
Resultados
Um representante de gravação simultânea de sinapticamente evocadas respostas gliais e neuronais (fEPSPs) na área CA1 do hipocampo é mostrado na Figura 2 AB. A corrente evocada astroglial é bifásico, ou seja, é constituído por uma corrente transiente para o exterior e uma corrente lenta decomposição dentro (> 10 s) (Figura 2B). A corrente externa reflete o fEPSP evocado, e é bloqueado após a inibição dos receptores de glutamato ionotrópicos pelo ácido quinurênico (cinza escuro traço, figura 2B) 3. A maior parte da corrente de entrada lenta para dentro reflecte potássio para o seguinte astrócito despolarização pós-sináptica, uma vez que também é abolido pelo ácido cinurênico, que inibe a actividade pós-sináptica do receptor de glutamato ionotrópicos (Figura 2B e Figura 2C 1) 3-6, conhecido por representar a principal fonte (80%) de libertação de potássio 7. O restante de um rápido aumentod actuais decomposição interior é inibido pelo antagonista GLT DL-TBOA (cinzento claro traço, Figura 2B e Figura 2C 2). Post-hoc subtracção da corrente remanescente na TBOA lenta (cinzento claro traço) a partir da corrente de ácido cinurênico (cinzento escuro traço) permite o isolamento do transportador de glutamato puro astroglial atual (traçado preto), como ilustrado na Figura 2C 2. A persistente lentamente decaindo corrente em ácido cinurênico e TBOA (cinzento claro traço, Figura 2B e Figura 2C 2) pode ser bloqueada por TTX (dados não mostrados), e reflecte muito provavelmente a acumulação de K + extracelular libertado durante a queima aferente presynaptic 3. A estimulação única de Schaffer colaterais moderada induz uma corrente relativamente grande sinapticamente evocado astroglial em comparação com o pequeno despolarização evocada gravado na mesma célula (Figura 2D). Isto é devido aoresistência da membrana baixo de astrócitos. Gravação dos sinapticamente evocadas dinâmica astrogliais potenciais de membrana, tal como ilustrado na Figura 2D, é uma medida directa de locais extracelulares níveis de potássio 8. Normalização das respostas evocadas gliais à atividade neuronal subjacente permite a comparação direta de experiências diferentes, como mostrou recentemente 6. Correntes astrogliais podem, além disso, controlar de forma muito confiável alterações na transmissão excitatória, como a corrente total de sinapticamente evocado astroglial segue linearmente ao aumento do fEPSP (Figura 2E). Correntes gliais também refletem curto prazo plasticidade sináptica, pois mostram, como neurônios, emparelhado pulso facilitação (Figura 2F). Emparelhado gravação de células inteiras de uma célula piramidal CA1 e um astrócito revelar muito diferente comportamento electrofisiológico em ambos os tipos de células, uma vez que os potenciais de acção neuronais de exibição em resposta a um pulso despolarizante,enquanto que o vizinho astrócitos é silencioso (Figura 3A-B). No entanto, a estimulação moderada da colaterais Schaffer pode evocar simultaneamente um potencial excitatório rápido posynaptic na célula piramidal CA1 e um meio rápido e lento correntes exteriores para dentro do astrócito adjacente (Figura 3B 2). Duais de gravações sinapticamente evocadas respostas neuronais e astroglial também pode ser gravada na área CA3 do hipocampo, como mostrado na Figura 3C. De fato, a estimulação única de CA3 fibras musgosas evoca em condições basais muito pequenas respostas neuronais, registrados como fEPSPs locais, associados a pequenos rápidos exteriores e interiores lento correntes em astrócitos (Figura 3D 1). Em contraste, uma estimulação Hz CA3 de fibras musgosas por alguns segundos fortemente potencia o fEPSP, enquanto apenas moderadamente aumenta a resposta astroglial (Figura 3D 2).
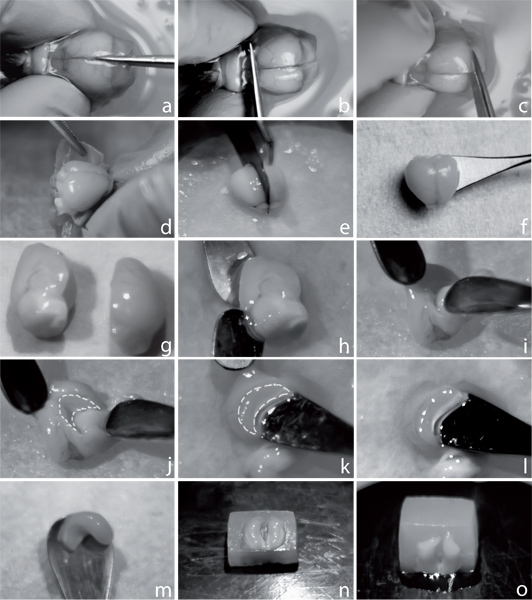
Figura 1. Hippocampus isolamento para preparar fatias transversais. Para dissecar o cérebro, o corte ao longo da linha média scull (a). Fazer um corte coronal ao nível do bolbo olfactivo (b) e, subsequentemente, ao nível do cerebelo (c). Cuidadosamente remover a scull com a ajuda de uma pinça (d), separar os dois hemisférios com uma lâmina (e), e transferi-los em uma colher pequena em ACSF oxigenado frio (f). Após ~ 5 minutos de equilíbrio, coloque um hemisfério de tecido seco com a superfície medial até (g). Com a ajuda de duas colheres de remover o diencéfalo (hj). O hipocampo é agora visível, tal como ilustrado pelas linhas a tracejado (k). Dissecar o hipocampo com uma colher para fora, a partir da fimbria, visível como estrutura branca (lm). Transferir o hipocampo de volta para o ACSF frio. Prepara-se uma pequena agarose-bloco, a posição do hipocampo duas com o lado alveus cima ea hippocamp ventralnos de frente para a borda do bloco de agar, e absorver todo o líquido cuidadosamente afastado para permitir uma boa fixação ao agar (n). Hipocampo a cola ligada ao bloco de agar para a parte ventral (o).
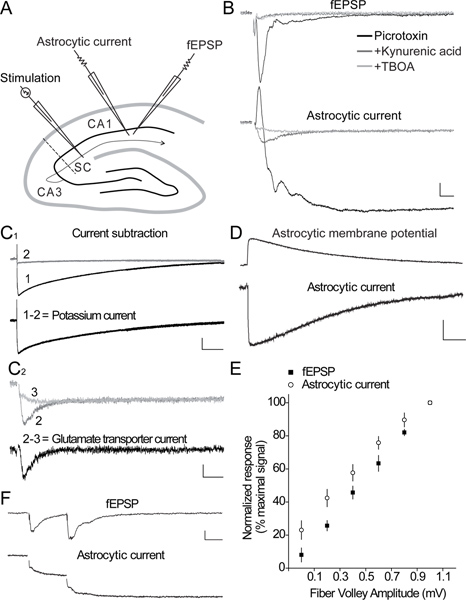
Figura 2. Simultaneous respostas neuronais e astroglial evocados-sinapticamente na área CA1 do hipocampo. A) Esquema da fatia de hipocampo que ilustra a disposição do eléctrodo estimulante, para activar a colaterais de Schaffer (SC), o eléctrodo de pipeta patch, para registar correntes astrocíticos e, o eléctrodo extracelular, para gravar fEPSP, evocados por estimulação SC no hipocampo área CA1. B) os traços representativos de gravações simultâneas de fEPSPs (painel superior) e correntes astrocíticos (painel inferior)-sinapticamente evocado por estimulação SC no presence de drogas farmacológicas. As respostas são primeiro registadas na presença de um bloqueador do receptor de GABA A (picrotoxina, 100 uM, traços negros) para isolar as respostas excitatórias. Aplicação subsequente de um bloqueador dos receptores ionotrópicos do glutamato (ácido cinurênico, 5 mM, escuras vestígios de cinzento), inibe a fEPSP e a maior parte da corrente de longa duração astroglial, revelando um componente pequeno e transitório rápido da resposta astrocitária actual, que é sensível a um bloqueador de transportador de glutamato (TBOA, 200 uM, traços cinza claro). Barra de escala, fEPSP 0,1 mV, astrocitária atual 15 pA, 10 ms. C 1). Trace amostra da corrente de potássio astroglial (1-2), que pode ser isolado a partir da resposta evocada, mostrada em B (painel inferior, preto traço), subtraindo-se o componente de corrente restante em ácido cinurênico (2) a partir de a corrente total ( 1). Barra de escala, 20 pA, 1 seg. C 2) rastreio de amostra do transportador de corrente de glutamato (2-3), obtido por subtracção do i TBOAcomponente lento nsensitive (3) a partir da corrente de ácido cinurênico (2). Barra de escala, 2,5 pA, 25 ms. D) Exemplos de vestígios de uma corrente de influxo gravado em tensão-grampo (painel inferior) e a despolarização da membrana correspondente gravado no grampo de corrente (painel superior), induzida em um astrócito por estimulação SC. Barra de escala, atual-braçadeira 1,5 mV, tensão braçadeira pA-5, 1 seg. E) de entrada-saída de curvas que ilustram a relação entre o pré-sináptica de fibra volleys (entrada) e a corrente total astroglial (output) gravado simultaneamente em resposta a estimulação SC (n = 6). Os aumentos astrogliais atuais linearmente com as rajadas de fibra aumentou, assim como o fEPSP neuronal. F) traçados de exemplo da resposta neuronal (fEPSP) ea corrente astrocítica são mostrados para pulsos emparelhados-estimulação com 40 intervalo interpulso mseg. Os sinapticamente evocadas astrogliais exposições atuais, como os neurônios, facilitação emparelhado pulso. Barra de escala, 0,1 mV, 5 pA, 20 mseg.
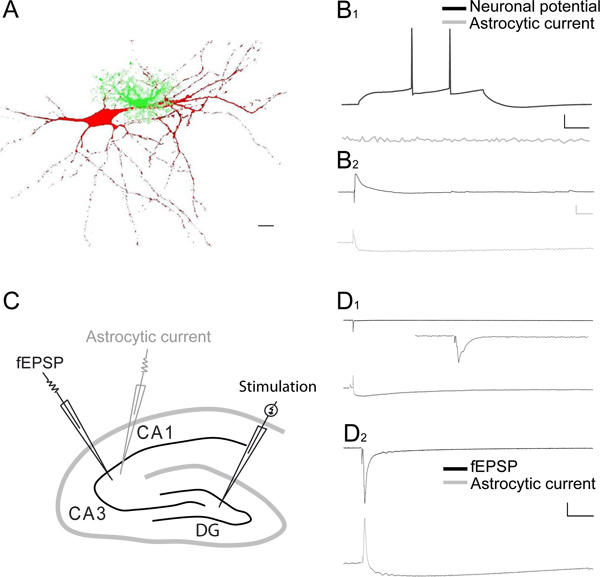
Figura 3. Gravações duplas de sinapticamente induzidas respostas neuronais e astroglial nas áreas CA1 e CA3 do hipocampo. A) Reconstrução de uma célula piramidal CA1 injectados com sulforodamina-B (vermelho, 0,1%) e um astrócito preenchido com fluoresceína dextrano (verde, 0,1%), utilizando a célula inteira técnica de patch-clamp. Barra de escala, 10 um. B 1) traços representativas dos simultâneas de célula inteira gravações de potenciais de membrana registrados no grampo de corrente de uma célula CA1 piramidal e uma astrócitos adjacente. Disparo neuronal potencial de ação (preto traço), evocada por injeção de um PA 20 despolarizante pulso de corrente, evoca nenhuma resposta no astrócitos adjacente (cinza traço). Barra de escala, 20 mV, 10 pA, 100 ms. B 2) traços de amostra da dupla de célula inteira gravações de uma célula CA1 piramidal em corrente moluscop e um astrócito vizinho na voltagem clamp-SC após estimulação, na presença de picrotoxina (100 uM). Estimulação SC evoca um potencial excitatório pós-sináptico (EPSP, preto traço), associadas a uma corrente pequena e de longa duração astrocítica (cinza de rastreamento). Barra de escala, 5 mV, 10 pA, 100 ms. C) Esquema da fatia do hipocampo representando no giro denteado (DG) e CA3 áreas do arranjo do eletrodo estimulante, para ativar as fibras musgosas, o eletrodo pipeta patch (cinza), para gravar correntes astrocíticos, eo eletrodo extracelular, a registro fEPSP, evocada por estimulação CA3 fibras musgosas. D, E) traços representativos de gravações pareadas de CA3 fEPSPs (painéis superiores, os traços negros em D 1 e D 2) e astrocíticos de célula inteira respostas (painéis inferiores, traços cinzentos em D 1 e D 2) à estimulação único de musgo CA3 fibras em 0,02 Hz (zoom na inserção) (D 1) ou em uma freqüência de estimulação Hz (D 2). Barra de escala para D 1 e D 2, 0,2 mV, 15 pA, tempo: D 1 1 seg; D 2 100 ms. Barra de escala Inset, 0,1 mV, 100 ms.
Discussão
Gravação dupla de sinapticamente induzidas respostas neuronais e gliais é um método útil para estudar alterações on-line em atividades pré e pós-sináptica associada a alterações nas propriedades astrogliais. A despolarização da membrana sinapticamente evocadas glial é uma medida direta do aumento extracelular de potássio 8, em parte devido ao disparo do potencial de ação pré-sináptico, mas principalmente para a despolarização pós-sináptica 7. Por conseguinte, as gravações de dinâmica de potenciais de membrana glial pode ser usado para investigar modificações pré-sináptico da excitabilidade pós-sináptica, a actividade, o volume do espaço extracelular e as capacidades de tamponamento de potássio 6, 8. A corrente transportador astroglial glutamato é uma medida sensível da liberação de glutamato pré-sináptica, capaz de monitorar mudanças de curto prazo na probabilidade de liberação 3, 5, 9. Ele pode, também, ser utilizados para caracterizar as sinapses funcionais da glia interações nas sinapses diferentes, ou em desenvolvimento st diferentemaiores de 10 anos. Deve-se ressaltar que MLDs são altamente sensíveis e temperatura 11 são movidos pelo gradiente eletroquímico de Na +, K + e H 12. Assim, a amplitude e a cinética da corrente GLT altamente dependente das condições experimentais escolhidas. Além disso, o curso de tempo real de folga astroglial glutamato derivado da corrente GLT gravado é conhecido por ser parcialmente obscurecida. Isto deve-se à filtragem de correntes GLT por factores tais como as propriedades de astrócitos electrotonic ou a libertação do transmissor assíncrono, que distorcem a sua cinética 13. Métodos de extracção das características temporais dos mecanismos de filtragem foram desenvolvidos e podem ser utilizados para derivar o tempo real do glutamato curso folga em situações fisiológicas ou patológicas, como recenly realizada 6,13,14. Além disso, a gravação simultânea da despolarização da membrana astroglial, na pinça de corrente, pode proporcionar INSIGhts em possíveis alterações de potássio extracelulares transientes. Astrócitos único contato até 100.000 sinapses dos neurônios diferentes ~ 100, e não, portanto, integrar e modular a atividade de redes locais neuronais.
Ao utilizar a técnica aqui apresentados, ou seja, a gravação eletrofisiológicas de células inteiras respostas de astrócitos para obter insights sobre a atividade sináptica basal, deve-se ter em mente que em astrócitos, patch-clamp gravações no nível soma permitir correntes de detecção principalmente proveniente da soma de células ou processos proximais. Na verdade, correntes detectadas na soma apenas parcialmente originam de multa processos distais quando uma forte ativação de receptores e canais que ocorrem em vários processos finas podem gerar correntes propagando a soma celular. Assim receptor basal e atividade de canal em pequenos processos individuais astrogliais cobrindo compartimentos sinápticas é dificilmente detectável. Isto é devido em parte ao limitado sementes nos coletorescontrole ial e temporal das correntes e tensões de membrana por células inteiras patch-clamp gravações de astrócitos in situ. No entanto, deve notar-se que a superfície das abundantes pequenos processos astrocíticos excede de longe a área da membrana dos processos de soma e principal. Além disso, estes microdomínios perisynaptic astrogliais contêm os receptores funcionalmente relevantes e os canais, o que provavelmente desempenham um papel importante na regulação da comunicação neuroglial e sináptica. A técnica que aqui apresentada é, por conseguinte, principalmente útil para estudar a actividade de integração astrocítica síncrono de conjuntos neuronais, que ocorrem em particular durante a estimulação aferência. Não deve ser usado para estudar o diálogo entre sinapses individuais e adjacentes finos processos astrocíticos que ocorrem durante a actividade espontânea basal. Um método alternativo para estudar as respostas locais astrogliais induzidas pela actividade sináptica basal seria realizar patch-clamp gravações de processos finos, como dum em dendrites 15. Embora remendar esses processos finas gliais é provável desafio devido ao seu pequeno tamanho, é provavelmente uma avenida para buscar a desvendar diálogo mais íntimo entre microdomínios gliais e sinapses individuais. No entanto, os prováveis pequenas eletrofisiológicos respostas gliais decorrentes de processos individuais finas gliais pode estar abaixo de detecção de limiar, já que o ruído elétrico atinge em média 3-5 pA em patch-clamp gravações. Outro método para estudar as respostas astrogliais a actividade sináptica é imagiologia de cálcio, uma vez que a activação de receptores de membrana astrocíticos ou transportadores de substâncias neuroactivas pode desencadear transientes de cálcio intracelular. No entanto, carregamento a granel de astrócitos com indicadores de cálcio também pode refletem principalmente somática atividade 16. A combinação de imagens de eletrofisiologia e cálcio também permite detectar sinais de cálcio a partir de pequenas finas processos gliais, ou ocorrendo espontaneamente ou desencadeada by mínimo de estimulação sináptica 17, 18. No entanto, deve-se ter em mente que os indicadores de alta afinidade de cálcio pode agir como amortecedores de cálcio, inibição das vias importantes de sinalização de cálcio, enquanto que de baixa afinidade indicadores pode funcionar abaixo do nível de detecção. Finalmente, uma técnica elegante e não-invasivo para estudar os eventos de cálcio em processos astrocíticos finas, o que também evita a lavagem de moléculas sinalizadoras intracelulares de células inteiras durante patch-clamp, consiste na utilização de uma membrana sensor de cálcio alvo, que pode ser expresso em astrócitos in situ, bem como in vivo 19. No entanto, a imagem de cálcio só pode fornecer informações sobre uma molécula de sinalização, que está envolvida em muitas, mas não todas as actividades celulares, ao passo que células inteiras de patch-clamp fornece informação quantitativa sobre todas as diferentes correntes iónicas provocadas sobre o canal e activação do receptor. Portanto simultâneas registros eletrofisiológicos de neurônios e astrócitossão um método único e poderoso para desvendar a dinâmica da linha de sinalização iônica neuroglial e seu papel de processamento de informação do cérebro.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Dana Kamalidenova, Morgan Autexier, e Roch Chopier, que fez o vídeo e animações, bem como Florian Beck para as fotografias e os de pós-produção do vídeo, voz-over. Este trabalho foi patrocinado pela Olympus e suportado por concessões do HFSPO (Prêmio de Desenvolvimento de Carreira), ANR (Programa Jeunes Chercheurs e do Programa de Neurociências Blanc), CRF (Federação pour la Recherche sur le Cerveau), INSERM e Pitié Salpêtrière La hospital (Investigação translacional contrato) para NR, de Francês de Investigação do Ministério e bolsas de pós-doutorado Deutsche Forschungsgemeinschaft à UP, e das escolas de doutoramento "Fronteiras da Ciência da Vida", da Universidade Paris Diderot, Bettencourt Schuller fundação, e FRM comunhão (Fondation pour la Recherche Médicale) doutorado para JS
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Picrotoxina | Sigma | P1675 | dissolver em DMSO |
| Ácido quinurênico | Tocris | 0223 | dissolver a 34 ° C sob agitação e sonicação |
| DL-TBOA | Tocris | 1223 | DCG IV Tocris 0975 |
Referências
- Finkel, A., Bookman, R., Crawley, J. N., et al. Chapter 6 The electrophysiology setup. Current protocols in neuroscience. , (2001).
- Yuan, Y. A., Atchison, W. D. Elelctrophysiological studies of neurotoxicants on central synaptic transmission in acutely isolated brain slices. Current Protocols in Toxicology. , (2003).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S., Bergles, D. E., Jahr, C. E. Glutamate release monitored with astrocyte transporter currents during LTP. Neuron. 21, 425-433 (1998).
- Luscher, C., Malenka, R. C., Nicoll, R. A. Monitoring glutamate release during LTP with glial transporter currents. Neuron. 21, 435-441 (1998).
- Pannasch, U., et al. Astroglial networks scale synaptic activity and plasticity. Proceedings of the National Academy of Sciences of the United States of America. 108, 8467-8472 (2011).
- Poolos, N. P., Mauk, M. D., Kocsis, J. D. Activity-evoked increases in extracellular potassium modulate presynaptic excitability in the CA1 region of the hippocampus. J. Neurophysiol. 58, 404-416 (1987).
- Amzica, F., Massimini, M., Manfridi, A. Spatial buffering during slow and paroxysmal sleep oscillations in cortical networks of glial cells in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 1042-1053 (2002).
- Diamond, J. S., Jahr, C. E. Transporters buffer synaptically released glutamate on a submillisecond time scale. The Journal of neuroscience : the official journal of the Society for Neuroscience. 17, 4672-4687 (1997).
- Oliet, S. H., Piet, R., Poulain, D. A. Control of glutamate clearance and synaptic efficacy by glial coverage of neurons. Science. 292, 923-926 (2001).
- Bergles, D. E., Jahr, C. E. Glial contribution to glutamate uptake at Schaffer collateral-commissural synapses in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7709-7716 (1998).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H., Diamond, J. S. Neuronal transporter regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 14581-14595 (2009).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature. 1, 1235-1247 (2006).
- Reeves, A. M., Shigetomi, E., Khakh, B. S. Bulk loading of calcium indicator dyes to study astrocyte physiology: key limitations and improvements using morphological maps. The Journal of neuroscience : the official journal of the Society for Neuroscience. 31, 9353-9358 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Castro, M. A. D. i., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nature. 14, 1276-1284 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature. 13, 759-766 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados