Method Article
Corsa di modellazione in Mouse: Coagulazione permanente dell'arteria cerebrale media distale
In questo articolo
Riepilogo
Vari modelli murini di occlusione dell'arteria cerebrale media (MCAO) sono ampiamente utilizzati nella ricerca sul cervello sperimentale. Qui, dimostriamo il modello di transcranica permanente distale MCAO che produce coerente infarto corticale di misura corrispondente al danno imposto dalla maggioranza degli ictus ischemici umani.
Abstract
L'ictus è la terza causa più comune di morte e una delle cause principali di disabilità adulta acquisita nei paesi sviluppati. Sono disponibili per una piccola percentuale di pazienti con ictus in fase acuta opzioni terapeutiche molto limitato. La ricerca attuale è intensamente alla ricerca di nuove strategie terapeutiche ed è sempre più concentrando sulla fase sub-acuta e cronica dopo il colpo perché più pazienti potrebbero beneficiare di interventi terapeutici in una finestra di tempo prolungato. Questi meccanismi ritardato includono importanti vie fisiopatologiche come post-ictus infiammazione, l'angiogenesi, la plasticità neuronale e la rigenerazione. Per analizzare questi meccanismi e valutare in seguito nuovi bersagli farmacologici, modelli di ictus sperimentali con rilevanza clinica, bassa mortalità e alta riproducibilità sono ricercati. Inoltre, i topi sono i mammiferi più piccoli in cui un tratto lesione focale può essere indotta e per i quali un ampio spettro di modelli transgenicidisponibili. Pertanto, si descrive qui il modello murino di transcranica, coagulazione permanente dell'arteria cerebrale media tramite elettrocoagulazione distale delle arterie lenticulostriatal, il cosiddetto "modello coagulazione". L'infarto conseguente questo modello si trova principalmente nella corteccia; il volume dell'infarto relativo rispetto alla dimensione del cervello corrisponde alla maggioranza dei tratti umani. Inoltre, il modello soddisfa i criteri sopra menzionati di riproducibilità e bassa mortalità. In questo video dimostriamo i metodi chirurgici di induzione ictus nel "modello di coagulazione" e riportiamo strumenti di analisi istologiche e funzionali.
Introduzione
L'ictus è la terza causa più comune di morte e uno dei principali motivi di disabilità adulta acquisita nei paesi sviluppati 1. Circa il 80% di questa malattia neurologica acuta è causata da ischemia cerebrale risultante da una ostruzione del flusso sanguigno cerebrale mentre circa il 15% è causato da una emorragia intracerebrale 2. Nonostante le ricerche in corso, la somministrazione endovenosa di attivatore tissutale del plasminogeno è il solo trattamento farmacologico approvato per l'ictus ischemico finora e disponibile solo per una minoranza di pazienti con ictus a causa della finestra temporale breve approvato 4.5 ore dopo l'insorgenza dell'ictus 3,4. Poiché non vi sono modelli in vitro, che può modellare adeguatamente le complesse interazioni tra il cervello, sistema vascolare e meccanismi fisiopatologici sistemici durante la corsa, i modelli animali sono essenziali per la ricerca preclinica ictus.
Pertanto, diversi modelli ictus ischemico sono stati sviluppati in una variabileety di specie. Uno dei modelli corsa più comunemente usato è il "modello filamento" in cui un filamento sutura viene transitoriamente introdotto nell'arteria carotide interna e trasmesso finché la punta occlude l'origine cerebrale media (MCA), con conseguente arresto del flusso sanguigno e il successivo infarto cerebrale di sottocorticali e in caso di occlusione prolungata anche regioni corticali 5,6. Nei modelli photothrombotic di ictus ischemico, una occlusione fotochimica del vaso corticale irradiato viene raggiunto dopo l'iniezione di un fotosensibilizzatore conseguente piccole lesioni circoscritte localmente 7. L'occlusione permanente della MCA distale delle arterie lenticulostriatal può essere ottenuto mediante una legatura dell'arteria, la sua compressione transitoria o permanente della coagulazione 8,9. L'infarto conseguente questo modello colpisce prevalentemente neocorteccia 10 perché l'occlusione della MCA in questo modello è distale al lenticoarterie ulostriatal, che forniscono i gangli della base.
Poiché la maggior parte delle lesioni tempi umani si trovano nel territorio dell'arteria cerebrale media, tutti i modelli comuni corsa assomigliano occlusioni di MCA o di uno dei suoi rami 11. Il MCA è una delle principali arterie che fornisce apporto di sangue al cervello; nasce dalla carotide interna, percorsi lungo il solco laterale dove poi rami e progetti alle gangli basali e le superfici laterali del frontale, parietale e lobi temporali, col motore primario e corteccia sensoriale. La destra e la sinistra MCA sono collegati alle arterie cerebrali anteriori e comunicante posteriore arterie che collegano le arterie cerebrali posteriori, creando il circolo di Willis (Figura 1).
Come precedentemente riportato da Carmichael et al. 11, infarti modellate dal distale Medio cerebrale Arteria Occlusion (MCAO) modello in topi comprendono circa il 10-15% dell'emisfero, simulando così una maggioranza di lesioni tempi umani che si trovano nel territorio corticale MCA 11,12. Nel 1981, Tamura et al. Ha descritto un, transcranica modello permanente della coagulazione MCAO nei ratti 8. Tuttavia, il modello descritto da Tamura ha coinvolto un occlusione prossimale del MCA al fine di eludere la biforcazione più distale dell'arteria. Pertanto, il "modello Tamura" originale non solo induce lesioni corticali ma anche striatali, simili alle lesioni ottenuti dal "modello filamento" 6. Qui, descriviamo distale modello MCAO permanente elettrocoagulazione transcranica nei topi. Inoltre, riportiamo istologici correlati e metodi funzionali per analizzare l'esito della corsa in questo modello. Tutti i metodi sono basati su procedure operative standard sviluppate e utilizzate nei nostri laboratori.
Protocollo
Dichiarazione etica
Gli esperimenti riportati in questo video sono state condotte secondo le linee guida nazionali per l'uso di animali da esperimento ed i protocolli sono stati approvati dai comitati governativi tedeschi (Regierung von Oberbayern, Monaco di Baviera, Germania). 10 settimane vecchie, topi C57BL/6J maschi sono utilizzati in questo studio. Gli animali sono stati alloggiati a temperatura controllata (22 ± 2 ° C), con un periodo di ciclo luce-buio 12 ore e l'accesso al cibo pellettato e acqua ad libitum. Analgesia e sedazione protocolli sono descritti come approvato dal comitato governativo locale, ma potrebbero differire da protocolli utilizzati in altri laboratori.
1. Preparazione del materiale e strumenti
- Collegare la coperta di calore per mantenere la zona di operazione caldo e mantenere la temperatura corporea mouse durante anestesia (37 ° C).
- Preparate le forbici in autoclave, pinze e cotoni, dexpanthenol occhio unguento e materiale di sutura. Preparare una siringa con soluzione salina (senza ago) per mantenere la zona di operazione idratata. Preparare il gas per anestesia (70% N 2 O + 30% O 2 + isoflurano).
- Iniettare analgesici per via intraperitoneale: Metamizol 200 mg / kg, Carprofene 4 mg / kg e buprenorfina 0,1 mg / kg.
- Posizionare il mouse nella camera di induzione con una portata isoflurano del 4% per anestetizzare fino movimento spontaneo del corpo e vibrisse si ferma.
- Trasferire il mouse in posizione laterale con il naso nella maschera di anestesia e mantenere la concentrazione di isoflurano al 4% per circa un altro minuto, poi ridurre e al approx.1.5% per mantenere l'anestesia appropriata.
- Applicare dexpantenolo occhio unguento su entrambi gli occhi.
2. Distale Modello MCAO
- Effettuare una incisione cutanea 1 centimetro tra l'orecchio e l'occhio utilizzando piccole forbici di funzionamento dopo la preparazione aseptical del sito usin chirurgicog disinfettante cutaneo.
- Separare la pelle e localizzare il muscolo temporale.
- Selezionare nel generatore ad alta frequenza della funzione di coagulazione, modalità bipolare, seleziona 12 W e collegare le pinze elettrocoagulazione con il cavo.
- Aggiungere una goccia di soluzione salina e utilizzare le pinze per staccare il muscolo temporale dal cranio nella sua parte apicale e dorsale, in tal modo, facendo un lembo muscolare senza rimuovere completamente il muscolo.
- Identificare la MCA sotto del cranio trasparente, nella parte rostrale della zona temporale, dorsale al seno retro-orbitale (Figura 2A). Se la biforcazione MCA non è visibile (a causa di una variazione anatomica normale) identificare la nave più rostrale.
- Aggiungete un po 'di soluzione salina sul cranio e sfoltire l'osso con il trapano proprio sopra il ramo MCA fino a quando non ha una consistenza sottile e traslucida (Figura 2B).
- Rimuovere con attenzione l'osso sopra l'arteria con un molto sottile pinza.
- Selezionare la modalità bipolare in il generatore ad alta frequenza a 7 W. Coagulate l'arteria con la elettrocoagulazione pinza prossimale e distale alla biforcazione (Figura 2C). Quando la biforcazione non è visibile a causa di una variante anatomica, coagulare il ramo MCA identificato correttamente (vedi sopra) in due siti di ca. Distanza di 1 mm. Non è necessario afferrare l'arteria con la pinza per coagulazione, cautamente l'arteria con la pinza su entrambi i lati da sopra è sufficiente e induce meno danni meccanici.
- Attendere 30 secondi e toccare delicatamente l'arteria con una pinza smussati per verificare l'eventuale flusso di sangue a causa di ricanalizzazione spontanea. In caso di ricanalizzazione ripetere l'elettrocoagulazione volta.
- Spostare il muscolo temporale alla sua posizione, che copre il foro cranico.
- Suturare la ferita e mettere l'animale in una scatola di infermieristica a 32 ° C per recuperare da anestesia e restituirlo alla gabbia. In generale ci vogliono 5-10 minuti per consentire all'animale di riprendersi da AnesthESIA.
- Iniettare analgesia postoperatoria (ip) dopo 24 ore e poi tutti i giorni fino al quinto giorno postoperatorio: Carprofene 4 mg / kg.
3. Sham Funzionamento
Effettuare le procedure identico al funzionamento sopra descritto - compreso assottigliamento del cranio e la sua rimozione - eccetto per non coagulare l'arteria esposto.
4. Prova Cylinder 13
- Posto l'animale in un cilindro trasparente in acrilico di vetro (diametro: 8 cm, altezza: 25 cm) di fronte a due specchi e videotape per 5 min. Regolare la telecamera centrale di fronte i due specchi e il cilindro di ottenere un ottimale video (Figura 3A).
- Per la valutazione dell'uso degli arti anteriori indipendenti, il punteggio (1) contatto della parete del cilindro, con una zampa anteriore durante l'intero posteriore e (2) atterraggio con una sola zampa anteriore sul pavimento dopo in pieno posteriore. Contare almeno 20 contatti per una zampa anteriore con movimento lento o frame-by-frfunzione ame del Cliente Video Lan (VLC) software freeware ( http://www.videolan.org/vlc ).
- Per l'analisi di base prima dell'intervento: eseguire il test due volte al topo, con una pausa di 1 ora tra le prove. Uso forelimb è espresso come rapporto di destra / sinistra dello schermo, l'uso degli arti anteriori indipendenti.
- Dopo la coagulazione MCA: eseguire nuovamente il test due volte al topo, con una pausa di 1 ora tra le prove come indicato sopra.
5. Perfusione
- Anestetizzare gli animali (ad esempio, da chetamina e xilazina 120/16 mg / kg di peso corporeo, rispettivamente).
- Fissare l'animale in posizione supina e aprire la cavità addominale con un taglio mediano. Rimuovere strappi e sterno. Fai una piccola incisione nell'atrio destro. Inserire una cannula di perfusione nel ventricolo sinistro e lentamente profumato con 20 ml di soluzione salina.
- Decapitare l'animale, aprire la calotta cranica e staccare delicatamente il cervello dalla base del cranio.
- Congelare il cervello a -40 ° C isopentano freddo per 10 min. Successivamente staccare il cervello dal isopentano e conservare fino ad ulteriore analisi a -80 ° C.
6. Infarto Volumetry
- Criosezionamento: Tagliare il cervello in serie su un criostato a 20 sezioni micron di spessore ogni 400 micron su vetrini e memorizzare le diapositive a -20 ° C.
- Violetto cresolo (CV) colorazione:
- Preparare la soluzione colorante: Miscelare 0,5 g di acetato di CV in 500 ml di H 2 O. Mescolare e calore (60 ° C) fino a cristallo sono dissolti. Lasciare raffreddare la soluzione e conservare in una bottiglia scura. Riscaldare a 60 ° C ed il filtro prima di ogni uso.
- Essiccare i vetrini a temperatura ambiente per 30 min. Poi metterli in etanolo al 95% per 15 min e poi in etanolo al 70% per 1 minuto e poi in etanolo al 50% per 1 min.
- Porre i vetrini in acqua distillata per 2 min, rinfrescare acqua distillata e metterli in per 1 min. Successivamente inserire i vetrini nella soluzione colorante (60 ° C) fo 10 min e lavarli due volte in acqua distillata per 1 min.
- Porre i vetrini in etanolo al 95% per 2 min. Poi metterli in 100% di etanolo per 5 minuti, aggiornare l'etanolo al 100% e metterli dentro per 2 min. Successivamente coprire i vetrini con mezzo di montaggio.
- Analisi:
Scansione i vetrini ed analizzare il volume dell'infarto indiretto con il metodo Swanson 14 per correggere edema:
(Area ischemica) = (area Cortex di lato controlaterale) - (area della corteccia non-ischemica di lato ipsilaterale) (Figura 4A).
Risultati
A causa del breve tempo di anestesia e moderato danno cerebrale, circa 10 minuti dopo il trasferimento a loro gabbie tutti gli animali erano svegli, muoversi liberamente nella gabbia e interagire con cucciolata. La mortalità durante l'intervento MCAO era inferiore al 5%, principalmente a causa di accidentali emorragia subaracnoidea o anestesia errato. Mortalità durante il tempo di osservazione di 7 giorni dopo l'induzione ictus si verifica molto raramente in circa il 1-2% degli animali. Nella serie funzionamento di 10 animali di questa relazione tutti gli animali sopravvissuti l'operazione e il periodo di osservazione di 7 giorni, nessuno di loro doveva essere esclusa a causa di criteri di esclusione.
Deficit comportamentali MCA dopo coagulazione, sono state valutate con il test cilindro uso 13 analisi zampa anteriore asimmetria. In questa prova, il rapporto di utilizzazione indipendente zampa sinistra e destra viene misurata nei punti temporali indicati dopo induzione ictus e rispetto ai valori basali ottenuti 24hr prima MCAO (Figura 3B). Gli animali hanno presentato un cambiamento significativo nell'uso degli arti asimmetria per l'esplorazione parete combinata nel cilindro di prova 24 ore (1,72 ± 0,326, p <0.05) e 3 giorni (1.36 ± 0.17, p <0.05), dopo MCAO. Sebbene il rapporto migliorata nel tempo di osservazione 1 Settimana, asimmetria motore era ancora significativo 7 giorni dopo MCAO (1.35 ± 0.29, p <0,05) rispetto ai valori basali.
Abbiamo eseguito infarto volumetria utilizzando violetto cresolo macchiato sezioni coronali di cervello di serie 7 giorni dopo l'induzione ictus (Figura 4B). Medio volume dell'infarto era 15,4 millimetri 3, rappresentando così il 12% di un emisfero cerebrale (Figura 4C). La variabilità di questo modello ictus è eccezionalmente bassa con una deviazione standard di circa il 10%. L'area della lesione comprende la somatosensoriale e la corteccia motoria con affetto solo minori di strutture sottocorticali. Inoltre, localizzazione dell'infartozona è altamente prevedibile con solo variabilità minima come mostrato nel diagramma schematico distribuzione (Figura 4D).
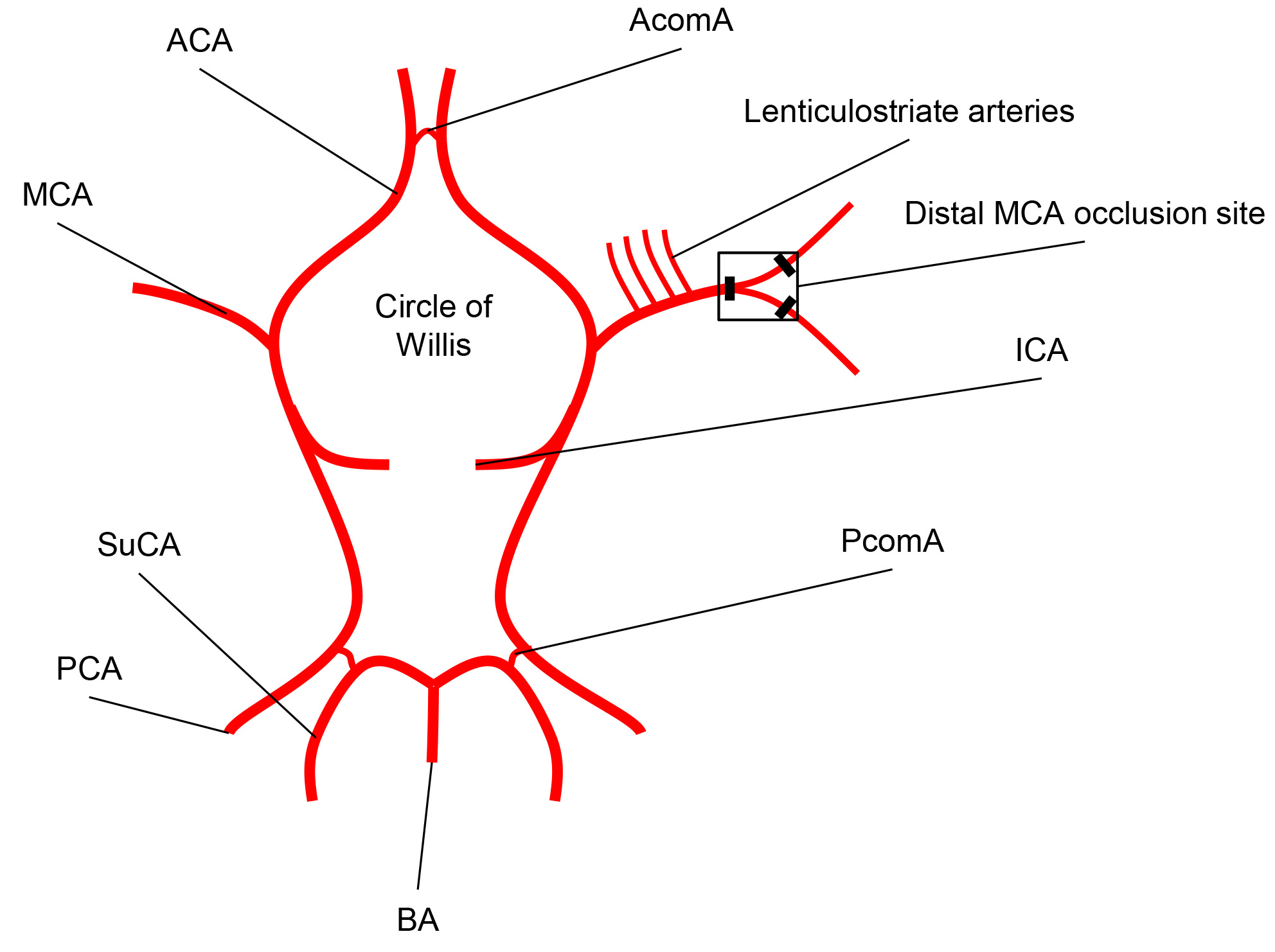
Figura 1. Rappresentazione schematica del Circolo di Willis. The Circle arterioso del Willis è formata da arterie cerebrale media (MCA) e le arterie cerebrali anteriori (ACA) che si dipartono dalla carotide interna (ICA), così come dal posteriori arterie cerebrali (PCA) e la comunicante posteriore arterie (PComA). L'MCA corre nel solco laterale dove si dirama alla corteccia cerebrale. Il ramo dominante MCA fornire la maggior parte della corteccia motoria e parte della corteccia somatosensoriale è occlusa definitivamente dal modello dimostrata (Acoma = anteriore dell'arteria comunicante; BA = arteria basilare; Suca = cervelletto Superiorlar arteria).
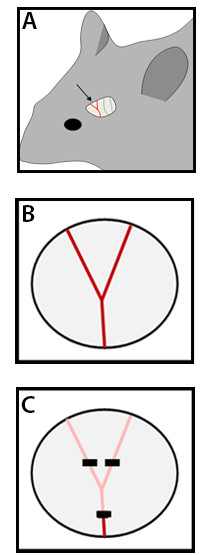
Figura 2. Vista Transcranial dopo la rimozione del muscolo temporale e schematicamente MCA occlusione. (A) Dopo aver rimosso il muscolo temporale arterie corticali possono essere visualizzati attraverso il cranio del mouse parzialmente traslucido (in 8-12 settimane di età topi). Il ramo dominante MCA può essere identificato nella parte rostrale della vista temporale, oltre che altre arterie corticali si diramano dalla MCA e il PCA nella parte caudale. (B) Rappresentazione schematica sul ramo dominante MCA nella sua variante predominante con una biforcazione sulla corteccia temporale laterale dopo un foro bava e la rimozione del cranio. (C) quadrati neri rappresentano i siti di coagulazione MCA ai prossimali e distali lati della biforcazione.
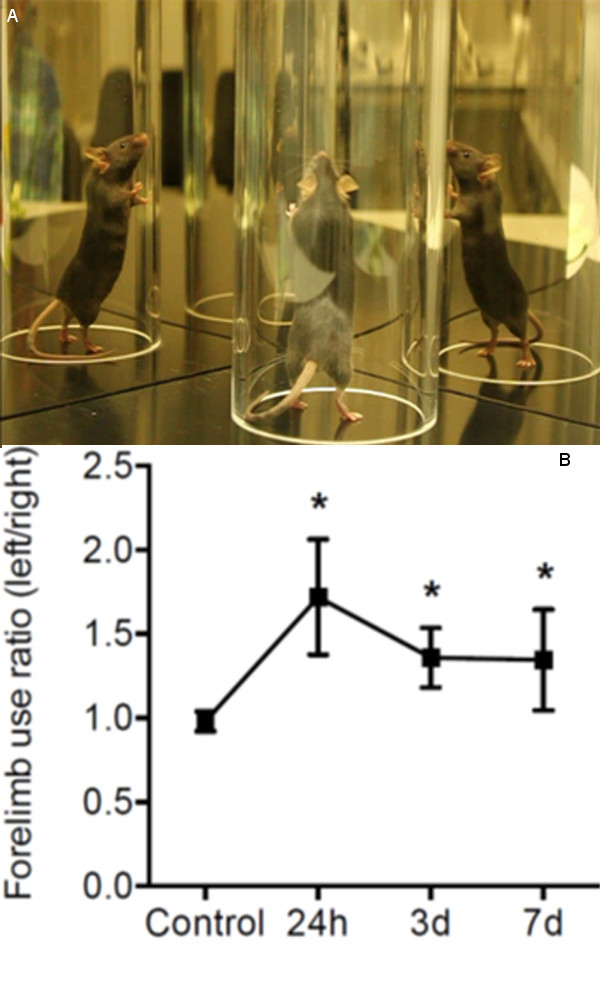
Figura 3. Analisi del deficit comportamentali. (A) prova Cilindro set-up: il mouse viene inserito in un cilindro verticale e specchi sono posti dietro al fine di registrare tutti i movimenti con una videocamera (B) l'uso degli arti anteriori asimmetria è stata analizzata utilizzando il test del cilindro.. Rapporti sinistra / destra di utilizzo degli arti anteriori indipendenti sono stati calcolati 24 ore prima MCAO e presso i punti temporali indicati dopo l'induzione della corsa. N = 10, * p <0.05 tra il punto di tempo indicato e basale (controllo) valore.
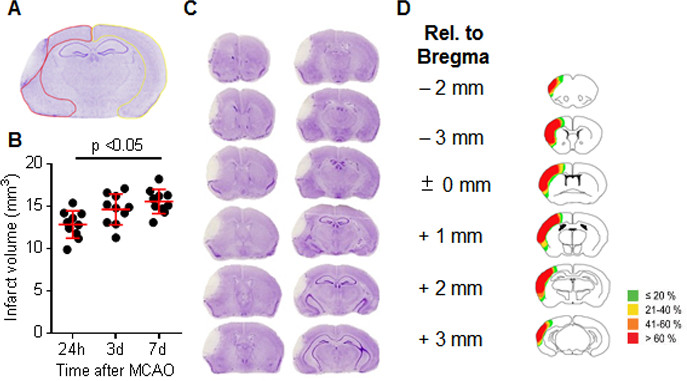
Figura 4. Volumetrico analisi infarto e l'esito infarto dopo distale MCAO. (A) l'immagine rappresentativa di un violetto cresolo macchiato reggiseno coronalenella sezione 7 giorni dopo MCAO. La linea gialla indica la selezione della corteccia controlaterale (a destra) e la linea rossa è la selezione della non-infartuato (macchiata) corteccia cerebrale omolaterale. L'area pallido l'emisfero sinistro rappresenta l'area di tessuto infartuato. (B) analisi del volume infartuale di 10 cervelli (ogni punto rappresenta una cervello individuale) 24 ore, 3 giorni e 7 giorni dopo distale MCA coagulazione. La linea rossa orizzontale rappresenta la media, barre di errore indicano la deviazione standard. (C) Rappresentante violetto cresolo sezioni coronali di cervello colorate ogni 400 micron a 7 giorni dopo la MCA coagulazione. (D) distribuzione schematica del tessuto cerebrale infartuato 7 giorni dopo MCAO. Ogni diapositiva raffigura le informazioni accumulate della distribuzione infarto (codice colore come indicato) alla sezione data in relazione al bregma (immagine modificata da:. Liesz A et al, Cervello, 2011; col permesso della Oxford University Press). Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il presente protocollo descrive il modello sperimentale colpo di distale, permanente MCAO da elettrocoagulazione transcranica - il cosiddetto "modello della coagulazione". Questo modello è nel frattempo diventato uno dei modelli animali usati più frequentemente nella ricerca sperimentale ictus 12. Rispetto ad altri modelli di ischemia cerebrale focale, il modello di coagulazione come presentato in questo video ha il vantaggio di un tempo di funzionamento molto breve di circa 10 minuti, quando eseguita da uno scienziato addestrato. Quindi, brevi tempi di anestesia possono essere raggiunti in questo modello, che è una caratteristica favorevole di un modello sperimentale di ictus perché l'impatto degli anestetici sul risultato neuroprotezione e ictus è ben noto 15. Inoltre, come precedentemente descritto da Carmichael et al. 11, ci confermano che il risultante volume dell'infarto e localizzazione dopo distale permanente MCA coagulazione corrisponde a lesioni cerebrali ischemiche nella maggioranza dei umanacolpi in proporzione alle dimensioni del cervello. Ictus umano è principalmente di piccole dimensioni con lesioni di circa il 5-15% della semisfera, sulla base di studi di popolazione e precedenti studi di imaging clinico 16-18, in contrasto con lesioni estese tempi con edema cerebrale compressione che si verificano in meno del 10% dei colpi clinica 19. In tal modo, lesioni ictus nel territorio MCA di circa il 12% dell'emisfero raggiunto dal modello presentato può essere considerato come un volume di ictus traduzionalmente rilevante. Tuttavia, si deve tener conto del fatto che diversi ceppi di topi o protocolli di anestesia utilizzati potrebbero influenzare il conseguente volume della lesione 20.
La mortalità durante il periodo di osservazione dopo induzione colpo in questo modello è praticamente assente. La mortalità totale inferiore al 5% è costituito principalmente da morti durante il funzionamento a causa di complicazioni anestesiologiche o sacrificio perché raggiungere dei criteri di esclusione. Al fine di garantire la bassa variability di questo modello e la sua eccellente riproducibilità, suggeriamo i seguenti criteri di esclusione: 1) Qualsiasi emorragia subaracnoidea durante l'operazione. 2) Tempo di funzionamento più di 15 min. 3) La ricanalizzazione della MCA dopo due tentativi di elettrocoagulazione con solo transitoria MCAO. Inoltre, gli animali devono essere esaminati al giorno dopo MCAO (comportamento fisiologico di base, l'aspetto della pelliccia e del peso corporeo) per il controllo del dolore, il disagio o il comportamento di malattia.
Diverse misure potrebbero essere attuate per l'analisi dei risultati della corsa come misura macchiolina laser, risonanza magnetica, test comportamentali o analisi istologica. In questo protocollo forniamo metodi esemplari per l'analisi del comportamento e analisi del volume dell'infarto. Diversi test analisi comportamentale dopo ischemia cerebrale focale sono stati sviluppati e utilizzati nella ricerca sperimentale ictus. Prove idonee per sensomotoria disfunzione precedentemente utilizzato dal nostro gruppo in questo modello stroke 21,22 siamore il test Rotarod 23, prova di etichetta Sticky 24, prova Angolo 25 e il test cilindro 13, che è dimostrato in questo video. Il test cilindro rappresenta costantemente asimmetria motore nella fase acuta dopo distale MCAO permanente e rileva anche ritrovare consecutivo della funzione motoria.
Nonostante gli evidenti vantaggi, alcuni limiti di questo modello corsa devono essere presi in considerazione. In primo luogo, una trapanazione del cranio è necessaria al fine di coagulare l'arteria, producendo in tal modo un potenziale accesso per peri-operative infezioni del cervello, sebbene infezioni batteriche della ferita chirurgica, muscolo temporale o il cervello stesso non sono mai stati rilevati da noi o documentata da altri che utilizzano questo modello. Inoltre, danni meccanici alla corteccia durante la preparazione e la coagulazione non può essere escluso, ma può essere limitato da un'attenta perforazione e rimozione del cranio, costante umidificazione del sito chirurgico e ne minima elettrocoagulazione sario (vedi criteri di esclusione). Anche se il corso della MCA come illustrato nella Figura 2 si trova nella maggior parte dei topi C57BL / 6, si descrive nel protocollo come procedere nei normali variazioni del corso nave per minimizzare modello variabilità. Inoltre, si consiglia l'uso di più (3 in caso di biforcazione; 2 senza biforcazione dei MCA) siti di occlusione per ridurre al minimo il rischio di ricanalizzazione parziale del MCA, che nella nostra esperienza è un fattore importante per la variabilità di questo modello.
In termini di test comportamentali, solo i deficit comportamentali minori possono essere rilevati nei test comportamentali sopra citate e la rigenerazione funzionale, possono essere osservati entro la prima settimana dopo l'ictus. Quindi, i sistemi di prova più avanzate con maggiore sensibilità e parametri di test qualitativi come il test raggiungendo esperto 27 potrebbero essere più adatto da rilevare risultato funzionale a lungo termine in questo modello.
ONTENUTO "> Infine, a causa della coagulazione permanente della MCA nessuna riperfusione può essere ottenuta, che è una caratteristica osservata in una percentuale significativa di pazienti con ictus causa spontanea lisi del coagulo o terapia 28. Tuttavia, un modello precedentemente descritto ictus tromboembolico 26 fornisce l'opzione per un modello ictus omaggio con riperfusione di ischemia cerebrale corticale. Presi insieme, l'alta riproducibilità, l'eventuale osservazione a lungo termine a causa della mortalità minimo e il comparabile volume relativo di infarto e localizzazione rispetto al tratto umano distinguere il "modello di coagulazione" come un modello importante per la ricerca di base e traslazionale ictus.Divulgazioni
Gli autori non hanno interessi in competizione da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato dal cluster di eccellenza della Fondazione di ricerca tedesca "Munich Cluster per sistemi Neurologia (Synergy)" e dalla Fondazione Daimler-Benz AL
Materiali
| Name | Company | Catalog Number | Comments |
| Camera Canon Eos 500D | Canon | Optics: 18-55 mm; 30 fps; 640 x 480 video function | |
| Mirror | Kristallform | 2677089 | 30 x 30 cm |
| Transparent acrylic glass cylinder | H&S Kunststofftechnik | Diameter: 8 cm, height: 25 cm | |
| Heating blanket | FHC DC Temperature Controller | ||
| Fine Scissors | FST | 15000-00 | |
| Mayo Scissors | FST | 1410-15 | |
| Forceps | FST | 11616-15 | |
| Cottons | NOBA Verbondmitel Danz | 974116 | |
| Saline solution | Braun | 131321 | |
| Bepanthen pommade | Bayer | ||
| Isoflurane | Abbot | B506 | |
| Anesthesia system for isoflurane | Drager | ||
| Stereomikroskop | Zeiss | Stemi DV4 | |
| Electrosurgical device | ERBETOM ICC 80/50 HF-Chirurgiegerät | ||
| Drill | Proxxon | D-34343 | |
| Ketamine | Inresa Arzneimittel GmbH | ||
| Xylacine | Albrecht | ||
| 5ml Syringe | Braun | ||
| Phosphate Buffered Saline PH: 7.4 | Apotheke Innestadt Uni Munchen | P32799 | |
| Isopentane | Fluka | 59070 | |
| Cryostat | Thermo Scientific CryoStarNX70 | ||
| Superfrost Plus Slides | Thermo Scientific | J1800AMNZ | |
| Cresyl violet | Sigma Life Science | C5042-10G | |
| Acetic acid | Sigma Life Science | 695092 | |
| Ethanol 70% | CLN Chemikalien Laborbedorf | 521005 | |
| Ethanol 96% | CLN Chemikalien Laborbedorf | 522078 | |
| Ethanol 99% | CLN Chemikalien Laborbedorf | ETO-5000-99-1 | |
| Roti-Histokit mounting medium | Roth | 6638.1 | |
| C57Bl/6J mice | Charles River | 000664 |
Riferimenti
- Donnan, G. A., et al. Stroke. Lancet. 371, 1612-1623 (2008).
- Di Carlo, A., et al. Frequency of stroke in Europe: A collaborative study of population-based cohorts. ILSA Working Group and the Neurologic Diseases in the Elderly Research Group. Italian Longitudinal Study on Aging. Neurology. 54, 28-33 (2000).
- Hacke, W., et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N. Engl. J. Med. 359, 1317-1329 (2008).
- Jauch, E. C., et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 44, 870-947 (2013).
- Longa, E. Z., et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- Engel, O., et al. Modeling stroke in mice - middle cerebral artery occlusion with the filament model. J. Vis. Exp. (47), e2423 (2011).
- Zhang, Z., et al. A new rat model of thrombotic focal cerebral ischemia. J. Cereb. Blood Flow Metab. 17, 123-135 (1997).
- Tamura, A., et al. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. J. Cereb. Blood Flow Metab. 1, 53-60 (1981).
- Chen, S. T., et al. A model of focal ischemic stroke in the rat: reproducible extensive cortical infarction. Stroke. 17, 738-743 (1986).
- Tureyen, K., et al. Infarct volume quantification in mouse focal cerebral ischemia: a comparison of triphenyltetrazolium chloride and cresyl violet staining techniques. J. Neurosci. Methods. 139, 203-207 (2004).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2, 396-409 (2005).
- Howells, D. W., et al. Different strokes for different folks: the rich diversity of animal models of focal cerebral ischemia. J. Cereb. Blood Flow Metab. 30, 1412-1431 (2010).
- Schallert, T., et al. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Swanson, R. A., et al. A semiautomated method for measuring brain infarct volume. J. Cereb. Blood Flow Metab. 10, 290-293 (1990).
- Kitano, H., et al. Inhalational anesthetics as neuroprotectants or chemical preconditioning agents in ischemic brain. J. Cereb. Blood Flow Metab. 27, 1108-1128 (2007).
- . Effect of intravenous recombinant tissue plasminogen activator on ischemic stroke lesion size measured by computed tomography. NINDS; The National Institute of Neurological Disorders and Stroke (NINDS) rt-PA Stroke Study Group. Stroke. 31, 2912-2919 (2000).
- Sowell, E. R., et al. Mapping cortical change across the human life span. Nat. Neurosci. 6, 309-315 (2003).
- Brott, T., et al. Measurements of acute cerebral infarction: lesion size by computed tomography. Stroke. 20, 871-875 (1989).
- Hacke, W., et al. Malignant' middle cerebral artery territory infarction: clinical course and prognostic signs. Arch. Neurol. 53, 309-315 (1996).
- Majid, A., et al. Differences in vulnerability to permanent focal cerebral ischemia among 3 common mouse strains. Stroke. 31, 2707-2714 (2000).
- Liesz, A., et al. Boosting regulatory T cells limits neuroinflammation in permanent cortical stroke. J. Neurosci. 33 (44), 17350-17362 (2013).
- Liesz, A., et al. Inhibition of lymphocyte trafficking shields the brain against deleterious neuroinflammation after stroke. Brain. 134, 704-720 (2011).
- Jones, B. J., Roberts, D. J. A rotarod suitable for quantitative measurements of motor incoordination in naive mice. Naunyn Schmiedebergs Arch. Exp. Pathol. Pharmakol. 259, 211 (1968).
- Bouet, V., et al. The adhesive removal test: a sensitive method to assess sensorimotor deficits in mice. Nat. Protoc. 4, 1560-1564 (2009).
- Zhang, L., et al. A test for detecting long-term sensorimotor dysfunction in the mouse after focal cerebral ischemia. J. Neurosci. Methods. 117, 207-214 (2002).
- Orset, C., et al. Mouse model of in situ thromboembolic stroke and reperfusion. Stroke. 38, 2771-2778 (2007).
- Farr, T. D., Whishaw, I. Q. Quantitative and qualitative impairments in skilled reaching in the mouse (Mus musculus) after a focal motor cortex stroke. Stroke. 33, 1869-1875 (2002).
- Kassem-Moussa, H., Graffagnino, C. Nonocclusion and spontaneous recanalization rates in acute ischemic stroke: a review of cerebral angiography studies. Arch. Neurol. 59, 1870-1873 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon