Method Article
Evaluación transcutánea de la función renal en roedores Conscious
En este artículo
Resumen
Determination of glomerular filtration rate (GFR) is the gold standard to assess overall kidney function. However, traditional procedures to measure this parameter are cumbersome and require a large investment of time. Here we describe a faster and minimally invasive method to determinate GFR transcutaneously.
Resumen
Glomerular filtration rate (GFR) is the gold standard to assess overall kidney function. However, traditional methods to evaluate GFR are cumbersome and time-consuming. In addition, serial blood or urine samples are required, with the associated stress for the experimental animals. A recent technique significantly reduces the investment in time and resources, minimizing the invasiveness and the animal stress, but being equally valid as the traditional approaches. The method measures transcutaneously renal function. Using an optical device and the exogenous renal marker fluorescein isothiocyanate (FITC)-sinistrin, this technique is capable of measuring the elimination kinetics of the marker through the skin. With neither blood nor urine samples nor the associated laboratory assays needed, the results of the transcutaneous measurement are almost instantaneously available. The method has been already validated in different species and successfully applied in several models of renal pathology. Moreover, due to its minimally invasive characteristics, it is suitable for sequential measurements within the same animal. Here is provided a detailed protocol to carry out the transcutaneous assessment of renal function in rodents.
Introducción
la tasa de filtración glomerular (TFG) es el mejor parámetro para evaluar la función renal global. El estándar de oro para determinar la TFG se basa en la eliminación urinaria o plasma de marcadores renales exógenos, tales como inulina 1. Sin embargo, estos procedimientos consumen mucho tiempo y complicado, que requiere la recogida de sangre en serie y / o muestras de orina y ensayos de laboratorio para su análisis posterior. Además, estos métodos son invasivos y estresante para los animales, lo que limita el número de veces y la frecuencia en la que las mediciones se pueden repetir. Una serie de enfoques alternativos han sido desarrollados para simplificar los procedimientos clásicos para determinar la TFG, pero todavía dependen de orina y plasma de muestreo 2-4 y / o requerir anestesia profunda 5,6, que se sabe que influyen en la hemodinámica y la función renal 7, 8. Productos finales de metabolismo, como la creatinina, son también ampliamente usados para estimar la función renal. Sin embargo, se sabe que el accurACY de estos marcadores endógenos no es óptima y, por otra parte, para analizar ellos, orina o muestras de sangre también es indispensable.
Aquí se describe una metodología transcutánea para evaluar la función renal en animales conscientes. Este método es más simple y más rápido que los métodos tradicionales, así como sólo mínimamente invasiva. Con esta técnica, el uso de un dispositivo óptico miniaturizado y la -sinistrin exógeno renal isotiocianato marcador de fluoresceína (FITC), es posible determinar la función renal casi en tiempo real sin necesidad de plasma o muestra de orina y sin cateterismo quirúrgico para la administración de la sustancia. Debido a estas características, el método es adecuado para llevar a cabo mediciones secuenciales en el mismo animal.
FITC-sinistrina es un marcador renal filtra libremente por el glomérulo, sin reabsorción tubular o la secreción. La parte óptica del dispositivo miniaturizado consta de dos diodos emisores de luz (LED), que excitanel marcador administrado y un fotodiodo para detectar la fluorescencia emitida por la piel. Los datos registrados se almacenan en la memoria interna integrada en el dispositivo y que pueden ser utilizados para generar la curva cinética de eliminación FITC-sinistrina. La energía es suministrada por una pequeña batería de litio recargable. Para obtener información más detallada sobre el dispositivo y sus componentes individuales se refieren a Schreiber et al. 9. El dispositivo se monta fácilmente en el cuerpo del animal utilizando un parche adhesivo de doble cara que lleva una ventana transparente para los componentes ópticos. Los resultados están disponibles después del período de grabación ha terminado.
Con el método y el protocolo proporcionado aquí, se introduce una tecnología prometedora que podría sustituir el actual estándar de oro para determinar la TFG, no sólo en la investigación sino también en el campo clínico.
Protocolo
experimentos necesarios para desarrollar el protocolo se realizaron de acuerdo a las regulaciones nacionales y fueron aprobados por el comité de ética local ciencia (Regierungspräsidium Karlsruhe).
1. Preparación de FITC-sinistrina solución inyectable
- Disolver FITC-sinistrina en solución salina fisiológica para preparar una solución madre. La dosis recomendada en ratones es 7,5 mg / 100 g de peso corporal (BW), mientras que en las ratas 5 mg / 100 g BW FITC-sinistrina es preferible. Para los ratones, preparar una solución de solución de FITC-sinistrina en 15 mg / ml, mientras que para las ratas preparar a una concentración de 40 mg / ml.
Nota: solución madre de FITC-sinistrina se puede preparar con antelación y se almacena a -20 ° C protegido de la luz.
2. Preparación de los animales
- Aclimatar los animales durante al menos una semana antes de su introducción en cualquier experimento.
- Anestesiar al animal usando 5% de isoflurano a 5 L / min O 2 Fluir durante 2 min.
- Confirmar que el animal está correctamente anestesiado mediante la observación de su respiración, que se vuelve más lento y más profundo, y verificar la falta de respuesta a la falta de una respuesta de dedo del pie.
- Una vez que el animal está dormido, reducir la anestesia con isoflurano al 2,5% en O2 velocidad de suministro 2 L / min y tomar el BW.
- Retire la piel desde el flanco de la parte posterior del animal usando una máquina de afeitar eléctrica. Afeitarse un área ligeramente más grande que el área que será ocupada por el parche adhesivo de doble cara, que tiene unas dimensiones de 3 cm x 6 cm.
- Posteriormente aplicar la crema de depilación para un corto período de tiempo (2-3 min) para eliminar la piel restante.
- Lavar completamente el área hasta que la crema se ha eliminado por completo, como la crema en sí puede ser fluorescente.
Nota: Evitar rascarse la piel del animal, ya que puede producir irritación / edema. Si el área depilada muestra la pigmentación en la piel, afeitarse un área más grande hasta un punto no pigmentada para laparte óptica del dispositivo se encuentra. Se recomienda para afeitar 24 hr de antemano para minimizar la exposición de la anestesia.
3. dispositivo de preparación de
- Coloque el dispositivo óptico para medir la función renal en un lado del parche adhesivo de doble cara, el posicionamiento de la parte óptica por encima de la ventana transparente (Figura 1) que sale de la parte opuesta con la lámina protectora.
Nota: Cuando se trabaja con pequeños roedores, reducir el tamaño del parche como se muestra en la Figura 2. - Coloque una pieza de parche de doble cara adhesiva de juego del tamaño de la batería como se muestra en la Figura 3.
4. La fijación del dispositivo en el animal
- Calcular el volumen apropiado de inyección basado en el peso corporal del animal.
- Anestesiar al animal con isoflurano como se ha indicado anteriormente en las secciones 2.1-2.3.
- Cortar un trozo de gasa tubular vendaje elástico of aproximadamente 1 cm más largo que el ancho del parche adhesivo de doble cara para ser utilizados.
- Tire de la venda de gasa elástica sobre la cabeza del animal y el lugar en su parte posterior, dejando la zona afeitada al descubierto.
Nota: Como alternativa, fijar el dispositivo usando solamente cinta adhesiva, pero estar al tanto de una presión indebida sobre el dispositivo. - Conectar la batería al dispositivo enchufando el conector de la batería al puerto correspondiente en el dispositivo. Después de que retire la lámina protectora de la pieza de parche y montar la batería en la superficie superior del dispositivo (Figura 4A). Asegúrese de que la batería está correctamente conectado mediante la comprobación de que el dispositivo comienza a parpadear.
Nota: En las ratas, la batería puede ser también unido directamente sobre el parche adhesivo, junto al dispositivo (Figura 4B). - Retire la cubierta protectora del parche con el dispositivo de mando y colóquelo sobre la zona afeitada en la parte posterior del animal manteniéndolos bordes hasta que quede fijado correctamente.
- Cubrir el dispositivo con el vendaje de gasa tubular elástico se adhiere a la superficie adhesiva del parche (Figura 5).
- estirar adecuadamente el vendaje tubular en el abdomen del animal, asegurando que los miembros pueden moverse libremente.
- Para una mejor fijación y la protección del dispositivo, aplicar una tira de cinta adhesiva después de la forma del dispositivo y que cubre los cables de la batería.
- Medir el fondo de 1 a 3 minutos, sin ejercer presión sobre el dispositivo
5. Administración de FITC-sinistrina y Procedimiento de medición
- Si es necesario, calentar la cola del animal con agua tibia antes de la inyección o una placa de calentamiento de temperatura controlada a lo largo de todo el procedimiento.
- Se inyecta a través de la vena caudal del volumen apropiado de solución de FITC-sinistrina de valores. El volumen de inyección depende de BW de los animales y, por tanto, debe ser calculado para cada contras individualesidering la dosis deseada y la concentración de la solución madre, antes mencionados en la sección 1.1.
- Asegúrese de que toda la solución de FITC-sinistrina se administra por vía intravenosa y no por vía subcutánea.
Nota: Como alternativa, FITC-sinistrina se puede administrar utilizando un catéter intravenoso pre-implantado salido en la nuca del cuello en los roedores o mediante inyección retro orbital en ratones. - Con cuidado, devolver el animal a su jaula evitando movimientos fuertes y cualquier presión sobre el dispositivo, ya que podría introducir artefactos de movimiento.
- Coloque la jaula de alojamiento en un lugar tranquilo para evitar que el animal se altera.
- Realizar la medición durante al menos 1 hora si se trabaja con ratones y 2 horas cuando se utiliza ratas. Durante ese período, el dispositivo óptico medirá a través de la piel de la fluorescencia emitida por FITC-sinistrina.
Nota: Durante el período de registro del animal debe estar alojado solo. Además el suministro de agua, así como que sobresaleestructuras tales como las tapas de alambre, deben ser removidos para evitar daños de los artefactos y dispositivos electrónicos de movimiento debido a los impactos con objetos.
La eliminación 6. Dispositivo
- Una vez que el período de grabación ha terminado, retire el dispositivo sin anestesia; sin embargo, si es necesario, anestesiar al animal brevemente bajo 5% de isoflurano en / min O 2 velocidad de suministro 5 L durante 2 min.
- Con cuidado, tire de la cinta adhesiva en primer lugar, a continuación, el vendaje tubular.
- separar suavemente el parche adhesivo de doble cara de la piel y devolver el animal a su jaula normal.
7. Leer de datos
- Desconectar la batería del dispositivo y retire el parche adhesivo.
Nota: Los datos se almacenan en el dispositivo hasta que se inicie una nueva medición. Cuando una batería está conectada a los datos almacenados se sobrescriben con las nuevas grabaciones. Por lo tanto, no vuelva a conectar la batería antes de descargar los datos de ladispositivo. Hay un período de gracia de 10 seg destinados a reconexiones accidentales de la batería. - Conectar el dispositivo a un PC mediante un cable micro USB y descargar los datos utilizando el software proporcionado. El archivo de salida es un archivo .csv que se puede abrir y modificado con un programa de hoja de cálculo.
- Abrir el archivo de datos con el software específico para el dispositivo óptico y generar la curva cinética de eliminación utilizando los protocolos de software.
- Analizar la curva siguiendo las instrucciones proporcionadas con el dispositivo óptico. En breve, para la evaluación de los datos, establece la señal de fondo medido administración FITC-sinistrina anterior y marcan el comienzo de la fase de excreción exponencial del marcador, que generalmente se produce 15 min y 45 min después de la inyección en bolo, en ratones y ratas, respectivamente .
Nota: El software mostrará automáticamente la vida media FITC sinistrina (t 1/2) junto con un valor de R 2, determinado por un 1-comparmodelo tamento. t 1/2 puede ser utilizado para calcular la TFG mediante el uso de un factor de conversión 9,10.
Resultados
La configuración de la medición transcutánea es muy simple y rápido: el dispositivo se coloca sobre el parche adhesivo de doble cara (Figura 1) y se ajustó en tamaño si es necesario (Figura 2), la batería se prepara (Figura 3) y conectado (figura 4).
Este método para evaluar la función renal ya ha sido validado en diferentes especies en comparación con el enfoque tradicional del aclaramiento plasmático 9,11,12. Siguiendo el protocolo expuesto aquí, Schreiber et al. demostrado la validez de la técnica en diferentes modelos de ratón, que muestra resultados altamente comparables entre el aclaramiento de medición y plasma transcutánea para todos los grupos estudiados (Tabla 1) 9. En este trabajo el t 1/2 obtenido se convirtió en FG mediante una conversión específica semi-empírica de ratónfactor.
La consistencia de la evaluación transcutánea de la función renal se ha demostrado también el uso de diferentes cepas de ratones. Una secuencia de mediciones dentro de 3 días en el mismo animal mostró un coeficiente de varianzas de 3,0 a 6,2% 13. En este estudio no hubo conversión a la tasa de filtración glomerular, pero los resultados se expresaron y se interpreta directamente en términos de t 1/2.
La posibilidad de tener los resultados casi en tiempo real, es una de las grandes ventajas de este método. Después de que el período de registro, los resultados están disponibles inmediatamente para el análisis y el software proporcionado muestra la curva de excreción de FITC-sinistrina instantáneamente (Figura 6). Dentro del mismo software el t medio de FITC-sinistrina se puede obtener, que puede ser utilizado directamente como el parámetro para evaluar la función renal de convertido en términos de tasa de filtración glomerular. Figura 7 muestra cómo se ve la curva de excreción de FITC-sinistrina determinación transcutánea de un animal con insuficiencia renal. Cuando la función renal está afectada, FITC-sinistrina t 1/2 aumenta debido a la reducción de la excreción de la sustancia y la aparición de la curva cambia. Por lo general, la curva de medición no vuelve al nivel de fondo y presenta una mayor área bajo la curva. En el mismo animal, mediciones de pre- a post-lesión puede experimentar un aumento en la intensidad máxima de fluorescencia debido a la acumulación del marcador causada por su excreción reducida. En presencia de insuficiencia renal, la curva medida transcutánea de FITC-sinistrina puede mostrar un estado estable debido a la función gravemente alterada (Figura 7B).
El uso del dispositivo miniaturizado en varias cepas de roedores con diferente estado de salud ha demostrado que esta técnica es adecuada y suficientemente sensible para detectar cambios due a la enfermedad renal y el envejecimiento. La Tabla 2 muestra un resumen de los modelos murinos estudiados hasta la fecha con este método.

Figura 1. La colocación del dispositivo en el parche adhesivo de doble cara. El dispositivo se monta en el parche adhesivo de posicionamiento su parte óptica en la ventana transparente.

Figura 2. Adaptación del parche adhesivo para roedores de pequeño tamaño. Para su uso en animales pequeños, se recomienda reducir el tamaño del parche. A: utilizar el dispositivo como una guía para cortar el parche correctamente. B: Una vez que se ha obtenido el tamaño deseado, el dispositivo se puede colocar en la superficie adhesiva del parche. Parrendar clic aquí para ver una versión más grande de esta figura.

Figura 3. Preparación de la batería. Para colocar la batería en el dispositivo, cortar un pequeño trozo de parche adhesivo de doble cara (A y B) y colocarlo sobre la superficie de la batería (C). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Conexión y colocación de la batería durante la medición. (A) En pequeños roedores tales como ratones, debido al espacio reducido, la batería debe ser colocado en la parte superior del dispositivo. (B) En los animales más grandes de la batería cun ser colocado al lado del dispositivo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
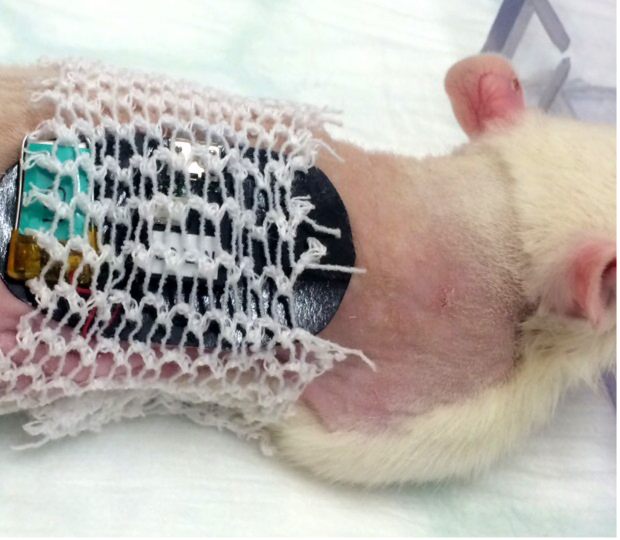
Figura 5. La colocación del vendaje de gasa elástica tubular en una rata. El vendaje tubular debe cubrir el parche adhesivo de doble cara sin interferir con la libre circulación de las extremidades para la comodidad del animal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. Imagen representativa de una curva de eliminación de FITC-sinistrina. La señal generada por FITC-sinistrina se detecta transcuneamente y se almacena en la memoria interna del dispositivo. Cuando los datos grabados se descargan en un ordenador, el software genera una curva comparable a la presentada en la imagen. Eje Y muestra la intensidad de fluorescencia registrada [UA], emitida por el marcador FITC sinistrina inyectada, mientras que el eje X representa la duración de la medición en el tiempo [min]. Por favor, haga clic aquí para ver una versión más grande de esta figura.
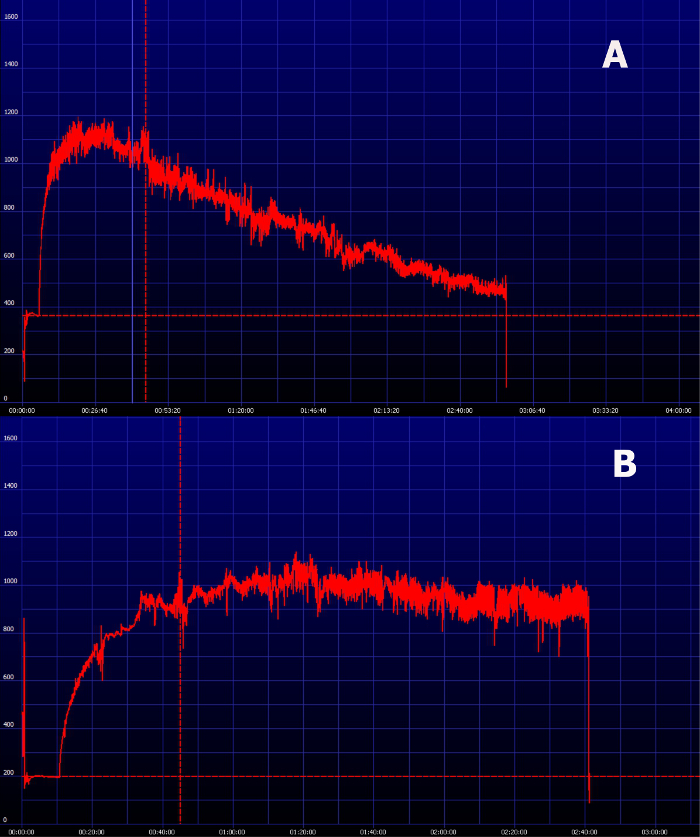
Figura 7. Imagen representativa de una curva de eliminación de FITC-sinistrina en animales con insuficiencia renal. (A) curva de eliminación FITC sinistrina en animales con función renal reducida por lo general muestra un aumento del área bajo la curva y la incapacidad para llegar a la línea de base dentro de la períodos normales de medición . (B) En los animales con deficiencias graves de la curva medida transcutánea puede mostrar un estado de equilibrio que indica insuficiencia renal. Haga clic aquí para ver una versión más grande de esta figura.

Tabla 1. Validación de la medición transcutánea mediante la comparación con el aclaramiento plasmático tradicional. La medición transcutánea de la función renal se ha validado en diferentes modelos de ratón (sano y nefrectomizadas unilateralmente (UNX C57BL) / 6-129 SV ratones y modelo de ratón de nefronoptisis ( PCY)) en comparación con el aclaramiento de plasma. Los valores son medias ± SD. TFG, la tasa de filtración glomerular 9.
/53767/53767table2.jpg "/>
Tabla 2. Los modelos murinos estudiados usando la medición transcutánea UNX, nefrectomizados unilateralmente.; ECA: enzima convertidora de la angiotensina; T gumodwt / peso, transgénico knockout Uromodulina, SD, ratas Sprague Dawley; PKD, enfermedad renal poliquística.
Discusión
En el presente documento se describe el procedimiento para determinar la función renal en roedores conscientes usando un dispositivo miniaturizado y el marcador exógeno renal FITC sinistrina. Como se dijo antes, este método tiene varias ventajas en comparación con los procedimientos tradicionales de aclaramiento urinario y plasma. Uno de ellos es la independencia de la toma de muestras de sangre y orina que conduce a un gran ahorro en términos de consumibles, el tiempo y, por supuesto, el estrés del animal.
Como se muestra en la Tabla 2, el exógeno marcador renal FITC-sinistrina y la medición de su cinética de eliminación a través de la piel permiten que el impacto de patologías renales en la función renal a estudiar 9,10,14-18. La colección de serie de muestras de sangre necesarias para evaluar el aclaramiento plasmático o biomarcadores de la enfermedad renal son estresante para el animal, engorroso y requiere mucho tiempo para los investigadores. Por lo tanto, las mediciones secuenciales dentro del mismo animal han sido limited por el bienestar de los animales y las razones metodológicas. El resultado reproducibilidad de los animales de la medición transcutánea 13 hace que sea un método ideal para la detección de cambios en la función del riñón debido a la progresión de la enfermedad o envejecimiento. Por la misma razón, también puede ser muy útil para estudiar la eficacia de los enfoques terapéuticos.
Dos pasos críticos para una aplicación exitosa de esta tecnología son la fijación del dispositivo óptico en el animal y la correcta administración del marcador. El dispositivo debe establecerse adecuadamente para evitar artefactos de movimiento. Para ello, la prevención de la unión y separación del parche adhesivo de doble cara es crucial ya que puede conducir a la pérdida de sus propiedades adhesivas y en última instancia una fijación inapropiado en el animal. Como se mencionó en el protocolo, la inmovilización y la protección del dispositivo óptico, cubriéndola con cinta adhesiva es un método eficaz para garantizar una adequate fijación. Al realizar la inyección en bolo FITC-sinistrina es crucial para administrar toda la sustancia por vía intravenosa y no por vía subcutánea. La liberación del marcador en el tejido subcutáneo puede ser fácilmente identificado por un anillo amarillo rodeando la cola del animal producido por propio color de FITC-sinistrina. Una inyección subcutánea normalmente se manifiesta como una curva más plana y el tiempo de excreción prolongada marcador. La posible limitación de este método es más relacionado con el marcador utilizado que con la tecnología per se. Cuando un edema está presente en la piel de un animal, no se recomienda la evaluación transcutánea de la función renal, ya que existe un compartimiento adicional que podría alterar la dinámica de excreción de FITC-sinistrina. Del mismo modo, la piel pigmentada puede limitar el uso de la técnica debido a la excitación y emisión espectros de superposición de FITC-sinistrina y melanina. Sin embargo, en los animales con pigmentación de la piel en los parches, el problema se resuelve mediante la colocación de la ópticaparte del dispositivo en un área sin pigmentar.
Es posible modificar diferentes aspectos de la evaluación transcutánea de la función renal con el fin de adaptar el procedimiento a diferentes especies y / o enfoques animales. Por ejemplo, la dosis FITC-sinistrina recomendada o la duración de la medición se puede ajustar en función del objetivo del experimento, así como para diferentes especies o modelos animales. Esta capacidad de adaptación del método ya ha sido confirmada por su aplicación con éxito en diferentes especies de roedores y varios tipos de cepas con variadas condiciones de salud. Además, la evaluación transcutánea de la función renal ha sido recientemente validado en perros y gatos 12 con excelentes resultados. Debido a las diferencias indudables entre estos animales y roedores, este estudio se determinó la dosis apropiada de FITC-sinistrina para ambos, los perros y los gatos, y se lleva a cabo una medición de tiempo mucho más largo, 4 horas en lugar de los 1 o 2 horas usod en roedores.
En su conjunto, el uso de esta técnica nos puede ayudar a hacerse una idea más precisa en nefrología, incluyendo una mejor comprensión de la progresión de la enfermedad renal y el efecto de las terapias. Las características de la evaluación transcutánea de la función renal lo coloca como una técnica adecuada para ser aplicado en campos clínicos humanos y veterinarios en el futuro, y deben ser considerados como una tecnología prometedora para sustituir a los enfoques tradicionales.
Divulgaciones
GN tiene una patente sobre la producción de FITC-sinistrina.
Agradecimientos
ZHP was supported by the Marie-Curie project: NephroTools.
Materiales
| Name | Company | Catalog Number | Comments |
| NIC-Kidney device | Mannheim Pharma & Diagnostics GmbH | Software, batteries and chargers are provided together with the device/s. Orderings should be done through info@mapdiagnostics.com | |
| FITC-sinistrin | Mannheim Pharma & Diagnostics GmbH | Orderings should be done through info@mapdiagnostics.com | |
| Double-sided adhesive patch | Mannheim Pharma & Diagnostics GmbH | Orderings should be done through info@mapdiagnostics.com | |
| Isis Rodent electric shaver | Braun Aesculap | GT420 | |
| Isoflurane | Abbott GmbH | PZN4831850 | |
| Leukosilk adhesive tape | BSN medical | 102200 | |
| Tubular elastic gauze bandage | MaiMed Medical GmbH | 73012 | There are different sizes available. Size 1 is recommended for mice. |
| Veet depilation cream | Reckitt Benckiser | PZN7768307 | Sensitive skin formulation is recommended as is more gentle with the skin of the animals |
| Micro USB cable | Samsung | APCBU10BBE | |
| Deltajonin Physiologic solution | AlleMan Pharma GmbH | 3366954 | Alternatively, it can be used saline or PBS |
Referencias
- Stevens, L. A., Levey, A. S. Measured GFR as a confirmatory test for estimated GFR. J Am Soc Nephrol. 20, 2305-2313 (2009).
- Katayama, R., et al. Calculation of glomerular filtration rate in conscious rats by the use of a bolus injection of iodixanol and a single blood sample. J Pharmacol Toxicol Methods. 61, 59-64 (2010).
- Reinhardt, C. P., et al. Functional immunoassay technology (FIT), a new approach for measuring physiological functions: application of FIT to measure glomerular filtration rate (GFR). Am J Physiol Renal Physiol. 295, F1583-F1588 (2008).
- Rieg, T. A high-throughput method for measurement of glomerular filtration rate in conscious mice. J Vis Exp. , e50330 (2013).
- Yu, W., Sandoval, R. M., Molitoris, B. A. Rapid determination of renal filtration function using an optical ratiometric imaging approach. Am J Physiol Renal Physiol. 292, F1873-F1880 (2007).
- Wang, E., Sandoval, R. M., Campos, S. B., Molitoris, B. A. Rapid diagnosis and quantification of acute kidney injury using fluorescent ratio-metric determination of glomerular filtration rate in the rat. Am J Physiol Renal Physiol. 299, F1048-F1055 (2010).
- Colson, P., et al. Does choice of the anesthetic influence renal function during infrarenal aortic surgery?. Anesth Analg. 74, 481-485 (1992).
- Fusellier, M., et al. Influence of three anesthetic protocols on glomerular filtration rate in dogs. Am J Vet Res. 68, 807-811 (2007).
- Schreiber, A., et al. Transcutaneous measurement of renal function in conscious mice. Am J Physiol Renal Physiol. 303, F783-F788 (2012).
- Schock-Kusch, D., et al. Transcutaneous measurement of glomerular filtration rate using FITC-sinistrin in rats. Nephrol Dial Transplant. 24, 2997-3001 (2009).
- Schock-Kusch, D., et al. Transcutaneous assessment of renal function in conscious rats with a device for measuring FITC-sinistrin disappearance curves. Kidney Int. 79, 1254-1258 (2011).
- Steinbach, S., et al. A pilot study to assess the feasibility of transcutaneous glomerular filtration rate measurement using fluorescence-labelled sinistrin in dogs and cats. PLoS One. 9, e111734 (2014).
- Schock-Kusch, D., et al. Reliability of transcutaneous measurement of renal function in various strains of conscious mice. PLoS One. 8, e71519 (2013).
- Cowley, A. W., et al. Progression of glomerular filtration rate reduction determined in conscious Dahl salt-sensitive hypertensive rats. Hypertension. 62, 85-90 (2013).
- Giani, J. F., et al. Renal angiotensin-converting enzyme is essential for the hypertension induced by nitric oxide synthesis inhibition. J Am Soc Nephrol. 25, 2752-2763 (2014).
- Sadick, M., et al. Two non-invasive GFR-estimation methods in rat models of polycystic kidney disease: 3.0 Tesla dynamic contrast-enhanced MRI and optical imaging. Nephrol Dial Transplant. 26, 3101-3108 (2011).
- Trudu, M., et al. Common noncoding UMOD gene variants induce salt-sensitive hypertension and kidney damage by increasing uromodulin expression. Nat Med. 19, 1655-1660 (2013).
- Zollner, F. G., et al. Simultaneous measurement of kidney function by dynamic contrast enhanced MRI and FITC-sinistrin clearance in rats at 3 tesla: initial results. PLoS One. 8, e79992 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados