Method Article
Hochdurchsatz-Screening von Kohlenhydrat-abbauenden Enzymen Neuartige Unlöslich chromogenen Assays Kits
In diesem Artikel
Zusammenfassung
A high-throughput assay for enzyme screening is described. This multiplexed ready-to-use assay kit comprises of pre-chosen Chromogenic Polymer Hydrogel (CPH) substrates and complex Insoluble Chromogenic Biomass (ICB) substrates. Target enzymes are polysaccharide degrading endo-enzymes and proteases.
Zusammenfassung
Carbohydrates active enzymes (CAZymes) have multiple roles in vivo and are widely used for industrial processing in the biofuel, textile, detergent, paper and food industries. A deeper understanding of CAZymes is important from both fundamental biology and industrial standpoints. Vast numbers of CAZymes exist in nature (especially in microorganisms) and hundreds of thousands have been cataloged and described in the carbohydrate active enzyme database (CAZy). However, the rate of discovery of putative enzymes has outstripped our ability to biochemically characterize their activities. One reason for this is that advances in genome and transcriptome sequencing, together with associated bioinformatics tools allow for rapid identification of candidate CAZymes, but technology for determining an enzyme's biochemical characteristics has advanced more slowly. To address this technology gap, a novel high-throughput assay kit based on insoluble chromogenic substrates is described here. Two distinct substrate types were produced: Chromogenic Polymer Hydrogel (CPH) substrates (made from purified polysaccharides and proteins) and Insoluble Chromogenic Biomass (ICB) substrates (made from complex biomass materials). Both CPH and ICB substrates are provided in a 96-well high-throughput assay system. The CPH substrates can be made in four different colors, enabling them to be mixed together and thus increasing assay throughput. The protocol describes a 96-well plate assay and illustrates how this assay can be used for screening the activities of enzymes, enzyme cocktails, and broths.
Einleitung
Techniques for mining genomes and metagenomes have developed rapidly in recent years, and so have medium- and high-throughput strategies for cloning and expressing recombinant enzymes. Furthermore, bioinformatic resources and associated depositories, such as (CAZy)1,2 have expanded greatly. However, there are considerable challenges inherent in the exploitation of microbial enzyme diversity for industrial purposes and the empirical determination of enzyme activities has now become a serious bottleneck. For example, it is estimated that, using current methods, we can safely predict the activities of no more than 4% of the proteins within the CAZy database. Although numerous methods are available for monitoring enzyme activities they all have some limitations. Well-established techniques based on chromatography combined with mass spectrometry are available for assessing the oligomeric fragments of glycosyl hydrolase (GH) activities3,4. However, these approaches are labor intensive and generally low-throughput. Methods based on the measurement of reducing sugars such as the dinitrosalicylic acid5 and Nelson-Somogyi6 assays are widely used for assessing GH activities. However, these assays have limited throughput and can be prone to side-reactions. Individual chromogenic polysaccharide substrates, such as azurine cross-linked (AZCL) are widely used for determination of enzyme activities, but purchasing all of the substrates separately and manually distributing the substrate powders within the assay plate can be cumbersome and costly7.
We have developed a new generation of chromogenic polymer hydrogel (CPH) substrates based on chlorotriazine dyes that, when used in conjunction with a 96-well filter plate, form a high-throughput assay system. Additional Insoluble Chromogenic Biomass (ICB) substrates were developed which provide information about substrate availability within complex polymer mixtures, such as those that exist in lignocellulosic biomass. Each substrate can be produced in one of four colors, and different colored substrates can be combined in a single well. In this protocol is shown that this methodology can be applied to a wide variety of polysaccharides and proteins and the potential for screening GHs, lytic polysaccharide monooxygenases (LPMOs) and proteases. Specific protocols are provided for the use of 96 well plates and representative results illustrate the high efficiency of the CPH and ICB substrate kits as tools for enzyme screening.
One significant advantage of the assay kits described, regardless of the substrate, is that the kits are ready to use within 15 minutes, after the activation step. This eliminates the need for time-consuming assembly of the assay from raw substrate materials as it is the case with some other methods7. The CPH and ICB substrates have excellent storage (at least one year at room temperature), pH and temperature stability 8 and require no specialized equipment or training. The CPH or ICB assays are based on 96-well filter plate within which the reaction with the enzyme is conducted. If the enzyme is active with a given substrate, soluble dyed oligomers are generated, producing a colored supernatant which can then be filtered into a regular clear-well 96-well plate using a vacuum manifold or a centrifuge 8.
The substrates are dyed with chlorotriazine dyes which absorb in the visible spectrum (VIS) range and individual colors (red, blue, yellow and green) can be resolved using linear regression if different CPH substrates of different colors are mixed in a single well, and the enzyme acts on more than one substrate. The resulting plate with the supernatants can be measured using a standard microtiter-plate reader capable of measuring absorbance in the VIS range. Mixing different substrates with different colors in one well increases the throughput of the assay system, to a total of 384 experiments in a 96-well plate (4 different substrates of different colors per well).
CPH substrates provide a valuable tool for assessing the specific activity of an enzyme while ICB substrates are used to evaluate the capacity of an enzyme to digest a component within the context of complex substrate mixtures that enzymes usually encounter within biomass. Although ICB substrates do not provide information about individual enzyme specificities, they are nonetheless useful tools for assessing the commercial performance of enzymes, cocktails or broths.
Protokoll
1. chromogenen Assay mit CPH Substrate in einer 96-Well-Plattenformat
- Die Aktivierung des Assay - Kit Platte
- Aktivieren Sie den 96-Loch-Filter-Testkit Platte (Materialliste) durch Zugabe von 200 & mgr; l Aktivierungslösung (erhalten mit dem Kit) in jede Vertiefung, gefolgt von 10 Minuten Inkubation bei Raumtemperatur ohne Rühren (blau CPH-Xylan enthält).
- Vakuum ziehen einen Vakuumverteiler mit (mit dem Abstandsblock innerhalb und jeder Standard, transparent 96-Well-Platte als Sammelplatte) erhaltenen Aktivierungslösung zu entfernen. Es ist auch möglich, eine Zentrifuge bei 2.700 xg für 10 min für diesen Schritt an Stelle des Vakuumverteiler zu verwenden.
- Waschen Sie die CPH Substrate von 100 & mgr; l sterilem Wasser hinzufügen und anwenden Vakuum (oder Zentrifugalkraft), um den Stabilisator zu entfernen. Wiederholen Sie diesen Schritt noch zweimal, und die Platten sind nun einsatzbereit.
- Die Enzymreaktion
HINWEIS: Immer auch Pufferallein als negative Kontrolle, und wenn möglich, zuvor als positive Kontrollen gekennzeichnet Enzyme. Verwenden Sie eine statistisch entsprechende Anzahl an Wiederholungen. Die CPH Substrate sind stabil zwischen pH 3,0 bis 10,0 und die Gesamtmenge an Pufferende Enzymlösung in jeder Vertiefung sollten nicht 180 & mgr; l nicht übersteigen. Pflanzenextrakt oder Kulturbrühe kann auch anstelle von gereinigter Enzymlösung verwendet werden.- Zugabe von 150 & mgr; l 100 mM Natriumacetatpuffer, pH 4,5 , und 5 ul endo -cellulase - Lösung (bis zu einer Endkonzentration von 1 U / ml) zu jeder Vertiefung der Testkit Platte.
- Legen Sie die Produktplatte (eine klare-Well-Platte kompatibel mit dem Mikrotiterplatten-Leser) unterhalb der Assay-Kit Platte beim Schütteln eine mögliche Leckage von der Reaktionsplatte zu sammeln.
- Inkubieren der Testkit Platte bei 25 ° C für 30 min in einem Horizontalschüttler bei 150 Upm.
HINWEIS: Mischen die Reaktion in der Testkit Platte während der Inkubation ist entscheidend für eine konsistente Verwirklichung und Reproproduzierbar Ergebnis. CPH Substrate sind stabil bis zu 90 ° C. Die Inkubationszeit sollte bis zu 24 Stunden erhöht werden, wenn Kulturbrühen Prüfung unbekannte Enzymkonzentrationen mit CPH haltigen Substraten. Man beachte, dass geeignete Inkubationszeiten auf die Aktivität des Enzyms abhängt (s), aber im allgemeinen, wenn es keine nachweisbare Aktivität innerhalb von 24 Stunden ist, ist es wahrscheinlich, dass das Enzym nicht das getestete Substrat abgebaut wird. Ein aktives Enzym Abbau der unlöslichen chromogenen Polysaccharide des CPH Substrat in lösliche chromogenen Oligosaccharide, die als farbige Überstand sichtbar sind. - Legen Sie die saubere Produktplatte im Inneren der Vakuumkammer mit dem Abstandsblock im Inneren.
- Legen Sie die Assay-Kit Platte oben und gelten Vakuum (maximale Unterdruck von -60 kPa). Es ist auch möglich, eine Zentrifuge bei 2.700 xg für 10 min zu verwenden.
HINWEIS: Das Filtrat die farbigen Oligosaccharide als Reaktionsprodukt ist jetzt in der Produktplatte zur weiteren Analyse mit 8 .
- Nachweis und Quantifizierung
- Prüfen, dass das Volumen der Flüssigkeit in jeder Vertiefung der Produktplatte durch visuelle Inspektion in etwa gleich ist.
- Lesen Sie die Absorption der Sammelplatte bei 595 nm für blau CPH-Xylan einen Plattenleser.
- Wenn die Datenanalyse zu tun, subtrahieren die puffer nur negative Kontrollwerte aus den Werten aus den Vertiefungen, in denen ein Enzym hinzugefügt wurde. Berechnen Sie den Mittelwert und die Standardfehler der Mittelwerte (SEM) aus den Wiederholungsvertiefungen 8.
2. chromogenen Assay mit ICB Substrate in einer 96-Well-Format
- Die Enzymreaktion
- Fügen Sie die 150 & mgr; l 100 mM Natriumacetat - Puffer, pH 4,5 und 5 & mgr; l 31 U / ml endo -xylanase Lösung zu jeder Vertiefung der Assay - Kit - Platte mit roten ICB-Weizenstroh (endgültige Enzymkonzentration in dem Schacht: 1 U / ml) .
HINWEIS: Die Assay-Kit Platten (96-Well-Filter plAtes ICB Substrate) enthalten, werden in der Literatur hergestellt (siehe Liste der Materialien), wie beschrieben. Die ICB Substrate sind stabil in Puffer mit einem pH-Bereich zwischen pH 3,0 bis 10,0. Immer auch allein als negative Kontrolle, kommerzielle Enzyme als positive Kontrolle Puffer und eine statistisch entsprechende Anzahl von Repliken.- Sie nicht die ICB Substrate wie die CPH Substratplatte zu aktivieren, sondern entfernen Sie den Stabilisator durch dreimaliges Waschen mit 100 & mgr; l Wasser, gefolgt von Vakuumfiltration oder Zentrifugation.
- Legen Sie die Produktplatte unterhalb der Substratplatte während des Schüttelns eine mögliche Leckage von der Substratplatte zu sammeln.
- Inkubieren der Reaktion bei 25 ° C bei 150 Upm für 2 Stunden schütteln.
HINWEIS: Ein aktives Enzym die unlöslichen chromogenen Polysaccharide in dem ICB Substrat in lösliche Oligosaccharide degradiert, die als farbige Überstand sichtbar sind. ICB Substrate sind stabil bis zu 90 ° C. Die Inkubation time sollte bis 24 Stunden erhöht werden, wenn nicht gereinigten Enzyme wie Kulturbrühen verwendet werden. - Stellen Sie das Produkt Platte im Inneren der Vakuumkammer mit dem Abstandsblock im Inneren.
- Legen Sie die Assay-Kit Platte oben und gelten Vakuum (maximale Unterdruck von -60 kPa) oder eine Zentrifuge verwenden das Produkt aus dem Assay-Kit Platte in die Vertiefung der Produktplatte zu filtrieren.
HINWEIS: Das Filtrat die farbigen Oligosaccharide als Reaktionsprodukt ist jetzt in der Sammlung Platte zur weiteren Analyse 8 enthält.
- Fügen Sie die 150 & mgr; l 100 mM Natriumacetat - Puffer, pH 4,5 und 5 & mgr; l 31 U / ml endo -xylanase Lösung zu jeder Vertiefung der Assay - Kit - Platte mit roten ICB-Weizenstroh (endgültige Enzymkonzentration in dem Schacht: 1 U / ml) .
- Nachweis und Quantifizierung
- Prüfen, dass das Volumen der Flüssigkeit in jeder Vertiefung der Sammelplatte durch visuelle Inspektion in etwa gleich ist.
- Lesen Sie die Absorption der Sammelplatte bei 517 nm für rot ICB-Weizenstroh einen Plattenleser.
- Wenn die Datenanalyse zu tun - den Puffer subtrahieren - nur negative Kontrollwerte aus den Werten aus den Vertiefungen, in denen ein Enzym,wurde hinzugefügt. Berechnen Sie den Mittelwert und die Standardfehler der Mittelwerte (SEM) aus den Wiederholungsvertiefungen 8.
HINWEIS: Bei unbekannten Enzyme Screening, schlagen wir vor, eine Verdünnungsreihe, um zu machen detailliertere Daten über den Dynamikbereich von Enzymaktivität zu erhalten.
Ergebnisse
Der Hochdurchsatz und Multiplexkapazität dieses Assay basiert auf unlöslichen chromogenen Polymer (oder Protein) Hydrogel (CPH) Substrate in Filterplatten mit 96 Vertiefungen angeordnet. Enzyme sowie negative Kontrollen werden dem Testkit Platte (1A) hinzugefügt und die Enzyme zersetzen die entsprechende Substrat eine gefärbte Überstand (1B) zu erzeugen. Nachdem die Reaktion beendet ist, wird der Überstand in ein klares Produkt-well - Platte überführt und die Extinktion direkt ein Spektrophotometer für Platten mit 96 Vertiefungen (1C) verwendet , gemessen werden.
Ein Beispiel für eine Dosis - Antwort der CPH-Arabinoxylan zu Xylanase bei verschiedenen Konzentrationen des Enzyms (0,00 bis 0,75 U / ml) ist in Figur 1D gezeigt , wo die abnehmende Enzymkonzentration visuell beobachtet werden kann. Eine ausführlichere spektrophotometrische Quantifizierung können die Absorption gegen die Enzymkonzentration (Abbildung 1E) zum Plotten verwendet werden. Die Signalintensität entspricht der Enzymaktivität. Die Reproduzierbarkeit des Assays wird durch die Fehlerbalken (Standardfehler des Mittelwerts, SEM, von drei Replikaten) gezeigt. Genauere Untersuchungen über die Reproduzierbarkeit dieses Tests werden an anderer Stelle 8 veröffentlicht.
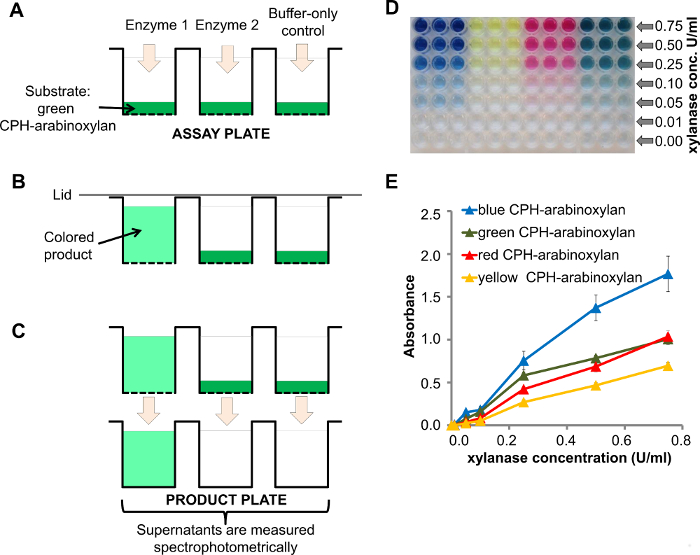
Abbildung 1. Xylanase Behandlung von CPH-Arabinoxylan. A) Ein Schema des Assay - Kits Platte mit dem CPH Substrat (zB CPH-Arabinoxylan) geladen in 96-Well - Filterplatte Brunnen direkt vor der Zugabe von Enzymen 1 und 2 und dem Puffer -nur Steuerung (enzyme 1 hatte endo -xylanase Aktivität), b) Abbau von CPH-Arabinoxylan durch Enzym - 1 erzeugt einen farbigen Überstand; C) nach der vakuumunterstützten FiltratD) Produktplatte , enthaltend die Reaktionsprodukte nach der Behandlung von CPH-Arabinoxylan in 4 verschiedenen Farben mit unterschiedlichen Konzentrationen von endo -β-1,4-Xylanase in 100 mM; Ionen der Überstände in dem Produkt Platte wird die Absorption spektrophotometrisch gemessen Natriumacetat - Puffer, pH 4,5 für 60 Minuten bei Raumtemperatur, e . ) Quantifizierung der Reaktionsprodukte von D Spektrophotometrie Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Es gibt verschiedene Optionen für die Verwendung dieses Assays in Enzym-Screening. Eine Möglichkeit ist , eine 96-Well - Platte zu verwenden , die verschiedene Polysaccharide für das Screening, beispielsweise eine kleine Anzahl von (gereinigten) endo -enzyme mit unbekannter Aktivität. In diesem Fall zeigt das Ergebnis, das Polysaccharide sind Degraddurch das Zielenzym können. Um dieses Prinzip zu zeigen , wurde eine endo -cellulase bei 25 ° C gegen verschiedene CPH Substrate getestet. Drei verschiedene Enzymkonzentrationen (0,5 U / ml, 1,0 U / ml und 5 U / ml) wurden für 30 min inkubiert. Das Ergebnis ist deutlich sichtbar in der Produktplatte (2A). Das Produktblatt für dieses endo -cellulase des Lieferanten gibt Nebenaktivität für Xyloglucan (Tamarinde), Gerste β-Glucan, Glucomannan, Birkenholz - Xylan und Low - Side-Aktivität für Galactomannan. In Übereinstimmung damit Aktivität zusätzlich zu Cellulase gefunden wurde gegen CPH-β-Glucan (Gerste), CPH-Xyloglucan (Tamarinde), CPH-Xylan (Buche) und eine geringe Aktivität gegen CPH-Galactomannan (2B). Glucomannan wurde nicht geprüft. Die gleichen CPH Substrate wurden mit kommerziell erhältlichen Enzyme (drei verschiedene Enzymkonzentrationen: 0,1 U / ml, 0,5 U / ml und 1,0 U / ml) verdaut, die als Positivkontrollen unter denselben Bedingungen als der vorherigeExperiment. Alle Substrate wurden durch die positive Kontrolle Enzym abgebaut und die Signalintensität auf höhere Enzymkonzentration (2C) erhöhte sich entsprechend.
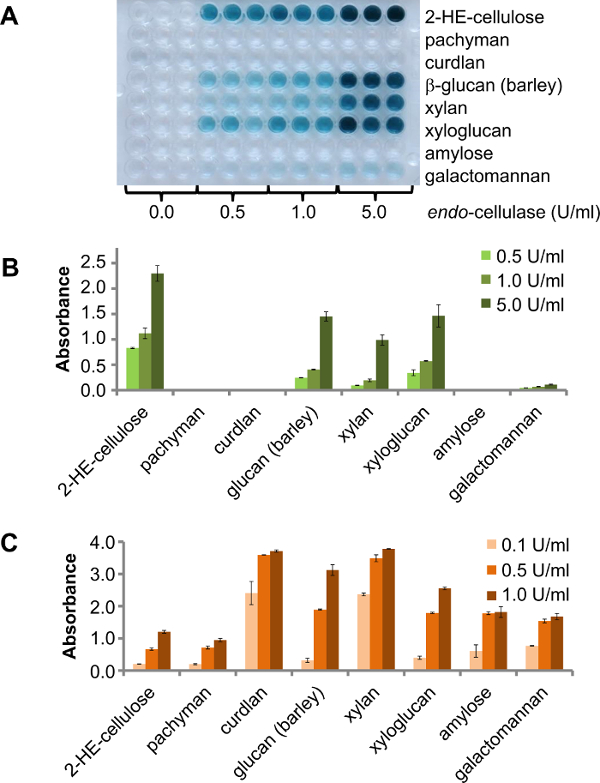
Abbildung 2. Acht verschiedene CPH Substrate wurden unter Rühren inkubiert bei 25 ° C für 30 min. A) Das Produkt Platte verschiedener CPH Substrate mit einer endo -cellulase verdaut, mit unterschiedlichen Konzentrationen. B) Quantifizierung der Aktivität und verschiedene Nebenaktivität die endo -cellulase. Die Fehlerbalken stellen die Standardabweichung vom Mittelwert von drei Replikaten C) Aktivität von verschiedenen kommerziellen Enzyme zu dem entsprechenden CPH Substrat (Endo-Cellulase und 2-HE-Cellulose;. E-LAMSE und CPH-pachyman, CPH-Curdlan, CPH- β-Glucan (Gerste); E-XYAN4 und CPH-Xylan, E-XEGP und CPH-Xyloglucan, E-BLAAM und CPH-Amylose, E-BMACJ und CPH-Galactomannan; alle Enzyme aus Megazyme). Die Fehlerbalken stellen die Standardfehler des Mittelwerts von zwei Repliken. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Die unlöslichen chromogenen Biomasse (ICB) Substrate sind eine sinnvolle Ergänzung zu dem chromogenen Substrat Repertoire, weil sie teilweise die natürliche Anordnung von Polysacchariden in Pflanzenzellwänden, die sind der Hauptbestandteil von Biomasse zu halten. CPH und ICB Substrate werden in unserem Beispiel verwendet , um die sezerniert Enzyme von Phanerochaete chrysosporium , wenn in einem flüssigen Medium kultiviert zu analysieren. Die Platte Aufbau der Testkit Platte ist mit 19 CPH Substraten und 5 ICB Substrate (4 Vertiefungen für jedes Substrat, 3B). P. in 3A gezeigten chrysosporium war cultivated für drei Tage und dann analysiert der Kulturüberstand. Daher wurde 125 & mgr; l 200 mM Puffer in jede Vertiefung gegeben und 25 & mgr; l Kulturüberstand überführt. Drei verschiedenen pH - Bedingungen wurden unter Verwendung von Natriumacetat - Puffer getestet , pH 4,0, Natriumphosphat - Puffer pH 6,0 oder pH 8,0 (3C). Die Platte wurde Schütteln (150 rpm) inkubiert bei 25 ° C für 2 Stunden.
Die Reaktionsprodukte wurden in der Produktplatte (3D) übertragen und ausgewertet. P. chrysosporium erzeugten Enzyme für den Abbau von verschiedenen Glukane, Stärke und Xylane (Figur 3E). Niedrigere Signale für die Hemicellulosen Arabinan (Zuckerrübe) und Pektinsäure Galactan sowie für RGI (Soyabohne) nachgewiesen werden konnte. Die Enzyme hergestellt waren aktiver unter sauren Bedingungen (pH 4,0) als in neutralen oder leicht basischen Bedingungen (pH 8,0). Geringere Aktivität gegenüber ICB Substrate (3F)zeigt, dass, wenn die Polysaccharide in einem natürlichen Kontext sind, als mit einem reinen Polysaccharid die Wirksamkeit des Enzyms ist nicht das gleiche, und deshalb ICB Substrate, die eine realistischere Sicht auf die Enzymeffizienz zu demonstrieren, wenn sie roh oder Pre- angewendet wurde behandelten Pflanzenmaterial.
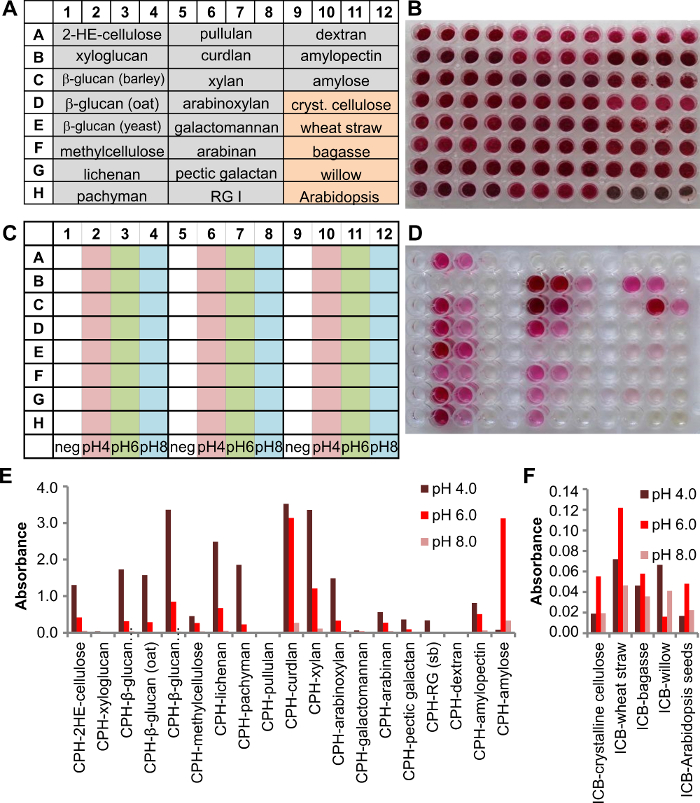
Abbildung 3. Screening von einem Kulturüberstand von einem 3-Tage alten Flüssigkultur von Phanerochaete chrysosporium ein Multi - Substratplatte mit mit 19 CPH und 5 ICB Substraten. A) Ein Schema des Plattenaufbau mit 4 Vertiefungen für jedes einzelne Substrat (grauer Hintergrund = CPH Substrate, orange Hintergrund = ICB Substrate). B) Bild der Testplatte mit dem Substrat. C) zeigt Schema der Pufferbedingungen in diesem Experiment verwendet (200 mM Natriumacetat pH 4,0, Natriumphosphat pH 6,0 und Natriumphosphat pH 8,0). D) Bild der Produktplatte nach 2 h bei 25 ° C. E) Die Extinktionen wurden bei 517 nm detektiert und aufgezeichnet für jeden einzelnen CPH Substrat und F ) ICB Substrat Ergebnisse für die jeweiligen Enzyme. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Die chromogenen Substrate können auch durch Verwendung einer Mischung von verschiedenen farbigen CPH Substrate in einer Vertiefung und der Analyse der Reaktionsüberstand nach Behandlung mit einzelnen Enzymen oder Enzymcocktails zu studieren synergistische Effekte verwendet werden.
In dem folgenden Beispiel wird in Figur 4 wurden mit einer annähernd equ zusammen gemischt rot CPH-Cellulose und gelb CPH-Xylan Substrate gezeigtAl - Verhältnis in 96-Well - Filterplatte Vertiefungen. 4A zeigt die farbigen Reaktionsprodukte nach 1 Stunde Behandlung bei Raumtemperatur ohne Enzym (Kontrolle), Cellulose cel (2 U / ml), Xylanase xyl (1 U / ml) und einem Gemisch beider Enzyme (3 Wiederholungen für jede approach) in 100 mM Natriumacetat-Puffer pH 4,5. Zur Analyse wurde das Reaktionsprodukt spektrophotometrisch durch Abtasten des Absorptionsspektrums von 350 nm bis 700 nm (4B) quantifiziert. Oft allein visuelle Inspektion kann einen Hinweis darauf geben , ob das Enzym auf ein oder mehrere Substrate wirkt, jedoch Absorptionsspektren von verschiedenen Farbstoffen stamm aufgezeichnet wurden, können auch einfache lineare Regression 8 geben eine genauere Anzeige des Ausmaßes des Abbaus jedes Verwendung gelöst werden Substrat aus der Mischung.
CPH Substraten als Mischungen fügt im wesentlichen dem Durchsatz des Assays ermöglicht screening gegen bis zu 4 verschiedene Substrate in einem Experiment (ein Loch). In dem gezeigten Beispiel sind vier verschiedene Substrate verwendet: blau CPH-β-Glucan (Gerste), gelb CPH-Xylan (Buchenholz), grüne CPH-Amylose und rot CPH-pectic Galaktan (Lupine). Das Layout der Substratplatte wird in 4C und ein Bild von der Testplatte in 4D gezeigt. Die Reaktion wurde in 100 mM Natriumacetat-Puffer pH 4,5 für 30 min bei 25 ° C und 150 rpm durchgeführt. Erste einzelne Enzyme mit steigender Enzymkonzentration wurden mit dem entsprechenden CPH Substrat (4E) und der gefärbten Überstand getestet empfangen wurde , wie in der Produktplatte (4F, row 1A - 12D) erwartet. Zeile E enthielt die zwei verschiedene Substrate CPH gelb CPH-Xylan und blauen CPH-β-Glucan, das mit unterschiedlichen Verhältnissen der entsprechenden Enzyme abgebaut wurden endo -xylanase und endo - Glucanase. Nach der Reaktion ist das Ergebnis Visible in der Produktplatte: die Farbe des Reaktionsprodukts war dunkler grün-blau, wenn mehr endo -Glucanase vorhanden war (4F, 4E-6E) und verwandelte sich in eine leichtere gelb-grün, wenn der endo -xylanase Konzentration erhöht ( 4F, 10-12E). Das gleiche ist in der Reihe F, wobei die beiden Substrate rot CPH-pectic Galaktan und gelb CPH-Xylan abgebaut wurden mit Endo -galactanase und endo -xylanase gesehen. Alle vier verschiedenen farbigen CPH Substrat vorhanden waren (4F, 1G-12F) und einzelne Enzyme die entsprechende CPH Substrat abgebaut und durch Zugabe von zusätzlichen Enzymen eine Kombination der farbigen Reaktionsprodukte empfangen wurde.
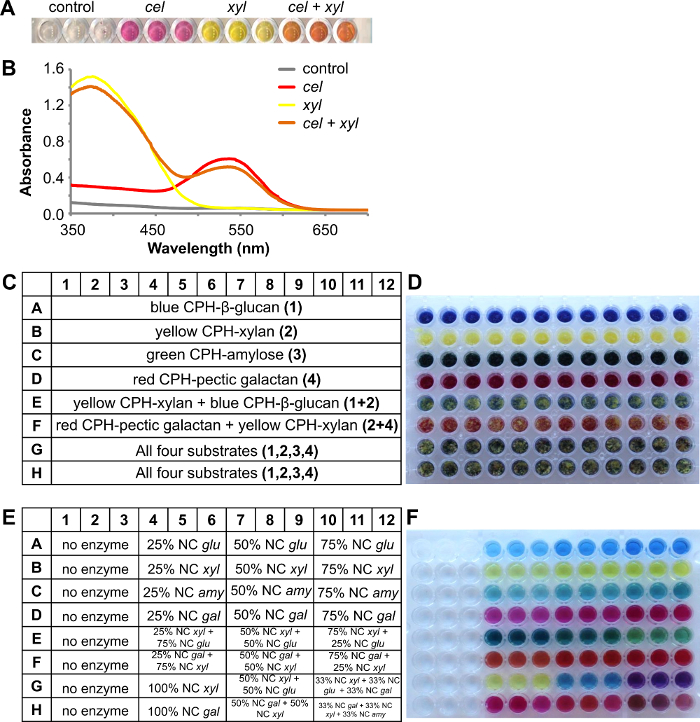
Figur 4. Eine Kombination von zwei verschiedenen CPH Substrate, rot CPH-Cellulose und gelb CPH-Xylan, mit verschiedenen Enzymen behandelt. EIN) Reaktionsüberstand nach der Behandlung von zwei Substraten mit endo -cellulase (cel) oder endo -xylanase (xyl) oder beide Enzyme. B) Die Absorptionsspektren der Reaktionsstände. Eine Kombination aus vier verschiedenen CPH Substrate mit unterschiedlichen Enzymen behandelt C) Schema der Substratplatte die CPH Substrate enthält. Blau CPH-β-Glucan (Gerste), gelb CPH-Xylan (Buchenholz), grüne CPH-Amylose und rot CPH- pectic Galaktan (Lupine) D) Abbildung des Plattentest die verschiedenen CPH Substrate E) Schema der Produktplatte zeigt das Verhältnis der zugesetzten Enzyme (nominale Konzentration (NC) enthält:.. glu = 1 U / ml endo - Glucanase, Xyl = 1 U / ml endo -xylanase, amy = 5 U / ml endo - Amylase und gal = 0,5 U / ml endo -galactanase). F) Bild von der Produktplatte nach 30 Minuten Inkubation bei 25 ° C. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Substrat | Quelle |
| CPH-2-Hydroxyethylzellulose | N / A |
| (CPH-2-HE-Cellulose) | |
| CPH-Amylopektin | Kartoffel |
| CPH-Amylose | Kartoffel |
| CPH-Arabinan | Zuckerrübe |
| CPH-Arabinoxylan | Weizen |
| CPH-Casein | Kuhmilch |
| CPH-chitosan | tierischen Ursprungs |
| CPH-Curdlan | Alcaligenes faecalis |
| CPH-Dextran | Leuconostoc spp. |
| CPH-Galactomannan | Johannisbrotbaum |
| CPH-Laminarins | Laminaria digitata |
| CPH-Lichenan | Isländisch Moos |
| CPH-Methyl | N / A |
| CPH-pachyman | Poria cocos |
| CPH-pectic Galaktan | Kartoffel |
| CPH-Pullulan | Aureobasidium pullulans |
| CPH-Rhamnogalacturonan I (RG I) | Kartoffel |
| CPH-Rhamnogalacturonan I (-Gal) * | Kartoffel |
| CPH-Rhamnogalacturonan | Sojabohnen |
| CPH-Xylan | Buchenholz |
| CPH-Xyloglucan | Tamarinde |
| CPH-β-Glucan aus Gerste | Gerste |
| CPH-β-Glucan aus Hafer | Hafer |
| CPH-β-Glucan aus Hefe | Hefe |
| ICB-Arabidopsis | Rosette Blätter von Arabidopsis thaliana Col-0 (Erwachsene Pflanze) |
| ICB-Arabidopsis Samen | Arabidopsis thaliana |
| ICB-Bagasse | Saccharum officinarum (getrocknete erwachsenen Pflanze, Stengel und Blätter) |
| ICB kristalline Cellulose (Filterpapier) | kommerzielle Whatman 3MM Chr Chromatographie Papier |
| ICB-Bockshornkleesamen | Trigon spp. Samen |
| ICB-Hanf | Cannabis spp. (Getrocknete erwachsenen Pflanze, Stengel und Blätter) |
| ICB-Lupinensamen | Blaue Lupine Samen |
| ICB-Pollen P. pratense | Phleum pratense Pollen |
| ICB-Fichte | Picea spp. (Miullt Baumstamm) |
| ICB-Tabak | Blätter von Nicotiana benthamiana (junge Pflanze) |
| ICB-Weizenstroh | Triticum spp. (Getrocknete erwachsenen Pflanze, Stengel und Blätter) |
| ICB-Weide | Salix spp. (Getrocknete erwachsenen Pflanze, gefräste Baumstamm) |
| ICB-Sorghum | Sorghum spp. (Blätter von erwachsenen Pflanze) |
| * (β-1,4-D-Galactan Seitenketten entfernt mit endo -β-1,4-D-Galactanase) | |
Tabelle 1 : Liste der verfügbaren Chromogene Polymer - Hydrogel (CPH) und unlöslich Chromogene Biomasse (ICB) Substrate.
Diskussion
Wir sind eine neue Generation von mehrfarbigen CPH und ICB Substraten , die auf Basis angeordnet sind entworfen Kit im Handel erhältlichen Test in einem benutzerdefinierten auf Chlortriazin Farbstoffe (vollständige Liste der Substrate in Tabelle 1). Enzymverdauung der Substrate ergibt kleinen, löslichen, gefärbten Produkte , die in der Testlösung nachweisbar sind und 9 unter Verwendung eines Plattenlesegerät quantifiziert werden. Dieser Test zur Bewertung der endo - wirkende Enzyme und die Empfindlichkeit des Assays entwickelt wird , ist ähnlich der, Azurin vernetztem (AZCL) Substrate 10 verwendet, während andere Verfahren zur exo - wirkenden Enzymen 11,12 verfügbar sind. Die Einschränkung dieser Testkit liegt in der Erkennung von endo -Enzym - Aktivität, wie CPH sowie die ICB Substrate nicht abgebaut werden durch exo -enzyme wahrscheinlich aufgrund der sterischen Hinderung die sich aus dem Farbstoff und Vernetzermoleküle 8.
Der Test wird in einer 96-wel durchgeführtl Format und individuelle Reaktionen in den Vertiefungen. Die Reaktion muss in der Platte gemischt werden reproduzierbare Daten zu empfangen. Die resultierenden Überstände werden in eine Produktplatte filtriert, wo die Absorption jeder Vertiefung quantifiziert werden können Absorptionsspektroskopie verwendet wird. Die Grundprinzipien und die Anordnung des Assays sind in Abbildung 1 dargestellt. Der Assay einer Testplatte aus (a 96-Well - Filterplatte) mit den Substraten, und nach der Inkubation mit den Enzymen wird der Überstand durch in eine klare Well - Platte gefiltert und die Extinktionen gelesen eine semi-quantitative Messung der Enzymspezifität und Aktivität bietet. Es hat sich gezeigt, dass diese Screening - Assay CPH Substraten können auch in einer Agarplatte Format verwendet werden, wobei die löslichen Reaktionsprodukte eines farbigen Halo Nach Inkubation über Nacht erstellen. 8
Die Assay-Kits können verwendet werden, gereinigte Enzyme zu screenen und ihre möglichen Nebenaktivitäten wie gezeigt inFigur 2. Nebenaktivitäten aus einem einzigen Enzym entstehen und seine promiskuitive Spezifität , sondern auch von einer Tatsache , dass die analysierte Probe eine Mischung von verschiedenen Enzymen und deren synergistischen Effekt muss untersucht werden. Zusätzlich kann , wie es in früheren Studien gezeigt wurde, das Enzym - Cocktails, Darmmikrobiota 13 und Kulturbrühen aus Pilzen 8 sowie endogene Pflanzenenzym und Bakterien (nicht veröffentlichte Daten) können als Enzymquelle verwendet werden.
ICB Substrate adressieren komplexe Mischungen von Zellwandkomponenten, die häufig in industriellen Prozessen von Biomasse Abbau aufgetreten. Diese Substrate sind so konzipiert, Polysaccharid Verfügbarkeit zu bewerten und geben Auskunft darüber, wie effektiv Abbau Cocktails für eine effizientere Abbau Ausgabe zu optimieren. Wie in Figur 3 CPH und ICB dargestellten Substrate können in Enzymscreening nebeneinander verwendet werden , - eine Fülle von Informationen über eine Enzymspezifität enthülltd Aktivität sowohl im Zusammenhang mit dem bevorzugten Substrat (CPH) und eine natürlichere Komplex enthält andere Komponenten zusätzlich zu dem bevorzugten Substrat enger eine makromolekulare Anordnung in der Natur (ICB) gefunden nachahmt. Die Verwendung mehrerer Farben ermöglicht die gleichzeitige Detektion verschiedener Enzymaktivitäten gegen verschiedene Substrate, die den Hochdurchsatz und Multiplexität des Assays erhöht. Spektren verschiedener Farbstoffe können durch einfache lineare Regression und in den meisten Fällen Multisubstrat-Aktivität durch visuelle Inspektion können allein beobachtet gelöst werden. Ein simuliertes Beispiel eines solchen Experiments und die Ergebnisse ist in Figur 4 dargestellt ist .
Dieser Test Toolbox und die Vielseitigkeit ihrer Anwendung sind sehr gut geeignet für die First-Level-Screening von Enzymen und Kulturbrühen mit unbekannten Aktivitäten. Die wichtigsten Aspekte dieses Assays sind die Hochdurchsatz-Art, Anpassbarkeit, Benutzerfreundlichkeit und Flexibilität. Mit dem im Verstand, we glauben, dass diese neue Reihe von Werkzeugen wird erheblich verbessern und Enzym Screening-Verfahren in der industriellen sowie akademischen Anwendungen beschleunigen.
Offenlegungen
Es gibt zwei Patent eingereichten Anmeldungen die 96-Well-Platte CPH Substrat-Assay sowie bezüglich der 96-Well-ICB Substrat-Assay (WO2015036000 und Dänemark PA 2015 70311).
Danksagungen
Wir möchten Prof. J. Paul Knox (University of Leeds, UK), der Zugang für die Dreharbeiten zu seinen Laboratorien zu danken und Susan E. Marcus für hervorragende technische Unterstützung. JS das WallTraC Projekt (Europäische Kommission Siebten Rahmenprogramm (Finanzhilfevereinbarung nicht anerkennt. 263916) und das Projekt Biomasse für das 21. Jahrhundert (Innovationsstiftung Dänemark, Fall-Nr .: 103408) SKK das SET4Future Projekt (Danish Strategic Research Council) ist zu danken, die Bio-Wert Strategic vom dänischen Rat für strategische Forschung, der dänischen Rat für Technologie und Innovation (Zuschuss Fall Nr .: 0603-00522B) gegründet, und ein Biologie-orientierten Ansatz für die enzymatische Abbau komplexer Polysaccharide Systeme (Grants Fall Verständnis keine .:. nur für die Finanzierung 107.279) spiegelt diesem Beitrag werden die Ansichten der Autoren die Europäische Union haftet nicht für die weitere Nutzung enthalten hierin der Informationen gemacht werden können..
Materialien
| Name | Company | Catalog Number | Comments |
| assay kit plates | Glycospot | customized assay kit plates | |
| activation solution | Glycospot | for activating CPH substrates | |
| 350 ml receiver plate spacer block for vacuum manifold | Pall Corporation | 5015 | spacer block |
| 96-well MultiScreen HV filter plate, 0.45 µm, clear, non-sterile | Millipore | MSHVN4510 | assay plate |
| 96-Well Microplates, Polypropylene | Greiner Bio-One | 651201 | collection plate after washing the substrates |
| Nunc™ MicroWell™ 96-Well Microplates | Thermo Scientific | 269620 | product plate |
| Diaphragm pump MZ 2 NT | Vacuubrand | 732000 | vacuum pump used with the vacuum manifold |
| Infors HT Ecotron | Infors HT | 4950132 (Buch & Holm) | horizontal shaker |
| SpectraMax M5 | Molecular Devices | 10067-750 (VWR) | 96-well plate absorbance reader |
| Vacuum manifold | Pall Corporation | 5017 | vacuum manifold |
| endo-cellulase (EGII) (Trichoderma longibrachiatum) | Megazyme | E-CELTR | cellulase [cel] |
| endo-β-1,4-mannanase (Cellvibrio japonicus) | Megazyme | E-BMACJ | mannanase [man] |
| endo-β-1,3-glucanase (Trichoderma spp.) | Megazyme | E-LAMSE | β-glucanase [glu] |
| endo-b-1,4-D-galactanase (Aspergillus niger) | Megazyme | E-EGALN | galactanase [gal] |
| endo-β-1,4-xylanase M4 (Aspergillus niger) | Megazyme | E-XYAN4 | xylanase [xyl] |
| endo-xyloglucanase (GH5) (Paenibacillus sp.) | Megazyme | E-XEGP | xyloglucanase [xg] |
| α-amylase (Bacillus licheniformis) | Megazyme | E-BLAAM | amylase [amy] |
Referenzen
- Lombard, V., Ramulu, H. G., Drula, E., Coutinho, P. M., Henrissat, B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Res. 42 (Database issue), D490-D495 (2014).
- Cantarel, B. L., et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics. Nucleic Acids Res. 37, D233-D238 (2009).
- Agblevor, F. A., Murden, A., Hames, B. R. Improved method of analysis of biomass sugars using high-performance liquid chromatography. Biotechnol. Lett. 26 (15), 1207-1211 (2004).
- Black, G. E., Fox, A. Recent progress in the analysis of sugar monomers from complex matrices using chromatography in conjunction with mass spectrometry or stand-alone tandem mass spectrometry. J. Chromatogr. A. 720 (1-2), 51-60 (1996).
- Miller, G. L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31, 426-428 (1959).
- Somogyi, M. Notes on Sugar Determination. J. Biol. Chem. 195 (1), 19-23 (1952).
- Zantinge, J. L., Huang, H. C., Cheng, K. J. Microplate diffusion assay for screening of beta-glucanase-producing microorganisms. Biotechniques. 33 (4), 798 (2002).
- Kračun, S. K., et al. A new generation of versatile chromogenic substrates for high-throughput analysis of biomass-degrading enzymes. Biotechnol Biofuels. 8, (2015).
- Leemhuis, H., Kragh, K. M., Dijkstra, B. W., Dijkhuizen, L. Engineering cyclodextrin glycosyltransferase into a starch hydrolase with a high exo-specificity. J. Biotechnol. 103 (3), 203-212 (2003).
- Nyyssonen, M., et al. Coupled high-throughput functional screening and next generation sequencing for identification of plant polymer decomposing enzymes in metagenomic libraries. Front Microbiol. 4, 282 (2013).
- Sweeney, M. D., Xu, F. Biomass Converting Enzymes as Industrial Biocatalysts for Fuels and Chemicals: Recent Developments. Catalysts. 2 (2), 244-263 (2012).
- Biely, P., et al. Action of xylan deacetylating enzymes on monoacetyl derivatives of 4-nitrophenyl glycosides of beta-D-xylopyranose and alpha-L-arabinofuranose. J. Biotechnol. 151 (1), 137-142 (2011).
- Mackenzie, A. K., et al. A polysaccharide utilization locus from an uncultured bacteroidetes phylotype suggests ecological adaptation and substrate versatility. Appl Environ Microbiol. 81 (1), 187-195 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten