Method Article
Kombinasyon tedavisi Trichostatin A ve C vitamini fareler somatik hücre nükleer Transfer tarafından klonlama daha etkili olmasını sağlar.
Bu Makalede
Özet
Biz fare klonlama trichostatin A, C vitamini ve deiyonize sığır serum albümin kullanarak büyük ölçüde geliştirilmiş bir yöntem açıklanmaktadır. Verimli klonlanmış embriyo gelişimini destekleyen bir basitleştirilmiş, tekrarlanabilir protokol gösteriyoruz. Bu nedenle, bu yöntemi fare klonlama için standart bir prosedür haline gelebilir.
Özet
Somatik hücre nükleer transfer (SCNT) doğrudan bir donör hücreden klonlanmış hayvan üretmek için eşsiz bir fırsat sağlar ve usta tekniklerin kullanımı gerektirir. Ayrıca, klonlama verimliliği Klonlanmış hayvanlar, özellikle fareler başarılı üretim beri düşük kalmıştır. Klonlama etkinliğini artırmak için birçok girişimler olmuştur ve trichostatin A (TSA), Histon deacetylase inhibitörü yaygın klonlama verimliliği artırmak için kullanılmıştır. Burada, büyük ölçüde geliştirilmiş bir klonlama yöntemi farelerde raporu. Bu somatik hücre nükleer transfer yöntemi karıştırmak kullanım-in Japonya zarf (HVJ-E), kolayca idare sağlayan Hemagglutinating virüs. Ayrıca, iki küçük molekül, TSA ve deiyonize sığır serum albumin (dBSA), (VC), C vitamini kullanarak tedavi embriyonik geliştirme için son derece etkilidir. Bu yaklaşım ne ek enjeksiyon ne de genetik manipülasyon gerektirir ve böylece pratik kullanımı basit ve uygun bir yöntem sunar. Bu yöntem kültürlü hücre genetiği değiştirilmiş hayvanları üretmek araştırmacılar için teknik açıdan bir yaklaşım haline gelebilir. Ayrıca, nesli tükenmekte olan hayvanları klonlama yoluyla kurtarılması için kullanışlı bir yol olabilir.
Giriş
SCNT teknoloji üretim klonlanmış hayvanların enucleated bir yumurta transfer edilecek tek bir somatik hücre ya da bir çekirdek kullanarak sağlar. Nükleer transfer embriyonik kök hücreleri (NT-ESCs) hatları klonlanmış embriyo türetme SCNT tekniği amaçlarından biridir. 1998 yılında, Wakayama ve ark., bildirilen Cumulina için ilk zaman1adında bir başarıyla klonlanmış fare üreten. O zamandan beri fareler klonlama yaygın olarak incelenmiştir ve somatik çekirdekleri nükleer yeniden programlama içine birçok önemli bilgiler elde edilmiştir. Öte yandan, bu teknik oldukça zor olan çok sayıda Embriyolardan adımlar eşliğinde usta, 3 ay2' in yoğun eğitim gerektiren.
Üretim klonlanmış farelerin SCNT kullanarak özgün Honolulu yöntem1, electrofusion yöntem3, Japonya (HVJ)4Hemagglutinating virüs tarafından hücre füzyon yöntemine gelişmiştir. Ancak, bir hücre çekirdeği cytomembrane aracılığıyla doğrudan enjeksiyon yapmayacaktır oosit hayatta kalma etkiler eğilimindedir. Electrofusion verimliliği, düşük olduğu için farklı sertlik, en uygun bir durumu belirlemek üzere her hücre zarı vardır. Araştırmacılar ve laboratuvar hayvanlarının güvenliği için özel ekipman gerektirdiğinden HVJ kullanımı zahmetli. Son zamanlarda, donör yumurta ve hücre sitoplazma sigorta için HVJ-E kullanılan5oldu. HVJ-E sadece membranlar virüslerin proliferatif veya bulaşıcı yetenek olmadan sigorta için yeteneğine sahiptir. Genomik RNA'ların HVJ HVJ-E. içinde tamamen Inaktif HVJ-E kullanımı böylece hücre füzyon SCNT sırasında kolay kullanım destekler.
Çeşitli raporlar SCNT embriyo TSA, Histon deacetylase inhibitörü ile tedavisinde önemli %6,5 %16,7' den daha az üzerinden canlı yavru üretim verimliliğini geliştirir göstermiştir. TSA tedavi Histon işaretleri SCNT embriyo8değiştirme yoluyla yeniden programlama hızlandırır. Son zamanlarda, belirli mRNA'ların, Histon lizin demethylase alt Histon H3 lysin 9 (H3K9) kaldırmak 4 (KDM4), enjeksiyon trimethylation REPROGRAMING dayanıklı bölgeleri, özellikle de SCNT embriyo gelişimi artırmak için gösterilen klonlanmış fare embriyo9. Bu arada, aynı zamanda bir Histon değiştiricisi olarak hizmet vermektedir, VC H3K910trimethylation azalmıştır. Ayrıca, VC embriyonik gelişim domuz SCNT10artırır. Bu dBSA enjeksiyon SCNT embriyo içine embriyonik geliştirme11gelişmesine yol açar bildirilmiştir.
Daha önce küçük moleküller, yani TSA ve VC, dBSA, birlikte kombinasyonu önemli ölçüde SCNT embriyo12gelişimi gelişmiş bulduk. Burada, son derece verimli ve basit klonlama yordamlar12temsil eden daha önce raporlanmış SCNT yöntemi fareler için ayrıntılı. Biz de HVJ-E. işleme tarif Bunlar pek çok araştırmacı gelişimsel ve üreme biyolojisi alanında genetik kaynakları korumak ya da genetik olarak değiştirilmiş hayvanlar bu SCNT yöntemle üretmek için yardımcı olabilir.
Protokol
Tüm hayvan yordamları Kindai Üniversitesi yönergeleri için bakım ve kullanım laboratuvar hayvanları için standartlarla uyumlu.
1. Kültür medya hazırlanması
- Değiştirilmiş KSOM (mKSOM) orta oluşan 95 mM NaCl, 2.5 mM KCl, 0.35 mM KH2PO4, 0.2 mM MgSO4 · embriyo kültürü için hazırlamak 7H2O, 1,71 mM CaCl2 · 2H2O, 0.2 mM D (+)-glikoz, 0.2 mM sodyum Pyruvate, 1.0 mM L-glutamin, 1.0 g/L Polyvinylpyrrolidone (PVP), 25.07 mM NaHCO3, 10 mM sodyum DL-laktat, 0,05 g/L penisilin ve 0,05 g/L streptomisin steril su.
- CZB (HCZB) Hepes tampon orta 81.5 mM NaCl, 4.8 mM KCl, 1.7 mM CaCl2 · oluşan embriyo manipülasyon için hazırlamak 2H2O, 1,18 mM MgSO4 · 7H2O, 1,18 mM KH2PO4, 0.11 mM EDTA · 2Na, 36.1 mM sodyum DL-laktat, 5,55 mM D (+)-glikoz, 0.025 g/mL penisilin, 0.035 g/L streptomisin, 0,014 mM fenol Red, 1.0 g/L polivinil alkol, 5.0 mM NaHCO3ve 20,0 mM Hepes sodyum tuzu steril su.
- Oosit harekete geçirmek için harekete geçirmek orta hazırlamak: 50 nM TSA, 2 mM EGTA, 5 µg/mL cytochalasin B (CB) ve 5 mM SrCl2takıma mKSOM orta.
2. hazırlık, deiyonize sığır Serum Albumin (dBSA)
- Sığır serum albumin (BSA) 1,2 g 10 mL steril su oda sıcaklığında (% 12'si son bir konsantrasyon) geçiyoruz.
- BSA, oda sıcaklığında hafif karıştırarak ile steril su % 12'si hazırlanan yaklaşık 0.12 g karışık iyon değiştirme reçine boncuk yukarıda ekleyin.
- Boncuk mavi-yeşil renk değiştirdiğinizde bir pipet kullanarak süpernatant çözüm altın için yeniden elde etmek. Boncuk ile taze yerine olanlar (şekil 1).
Not: Boncuk yerine normal olarak yalnızca bir kez gerçekleştirilir. Muhtemelen tam Deiyonizasyon için birkaç değişiklik gerektirir. Renk boncuk üzerinden değişmeden kalırsa sadece bir rehber olarak, mavi-yeşil altın, bu iyon değişimi tamamlandıktan gösterir. - Çözüm boncuk renk değişikliği yok olduğunu onayladıktan sonra yeniden elde etmek.
Not: kurtarılan çözüm bulutlu hale gelirse, bu filtre (175 x g, 5 min) tıkanma santrifüj kapasitesi. - Kurtarılan ek 250 µL % 10.5 NaHCO3ile belgili tanımlık eriyik.
Not: Bu işlem dBSA çözüm pH durumu etkisiz hale getirmek için tasarlanmıştır. Ancak, NaHCO3 gereksiz olabilir. - 0.45 µm filtre kullanarak süpernatant sterilize ve dBSA hisse senedi çözüm olarak-20 ° C'de depolayın.
3. yumurta toplama
Not: Tüm fareler ışık kontrol edilir ve klimalı odalarda muhafaza.
- Süper yumurtlamak-her kadın B6D2F1 fare (yaşında 8-10 hafta) hamile kısrak serum gonadotropin (PMSG) 7.5 IU mayi enjeksiyonu ile ve insan Korionik gonadotropin (hCG) 48 saat sonra PMSG enjeksiyon 7.5 IU.
- Ötenazi servikal çıkığı 14-16 h gerçekleştirmek sonra hCG enjeksiyonu. Üreme sistemi standart diseksiyon teknikleri13kullanarak erişmek için karın deşmek. Kısaca, Cilt pinch ve küçük bir yan kesi orta hat makasla olun. Cilt sıkıca üstünde ve altında belgili tanımlık kesme tutun ve deri baş ve kuyruk doğru çekin. Makas kullanarak karın zarını kesmek, gut bobinleri yoldan itmek ve rahim, oviducts ve yumurtalıklar iki korna varlığını doğrulamak.
- Oviducts küçük düz makas ve cımbız ile imha etmek, bir filtre yüzeyi kapalı kan silmek için kağıt üzerine yerleştirin. Oviducts madeni yağ içinde ayarlayın. O zaman, diseksiyon iğne kullanarak ovidukt ampulla kadar kesilmiş ve 200 µL damla %0,1 hyaluronidase ile HCZB orta ovidukt ampulla girdiği kümülüs oosit kompleksleri taşıyın. 5 dakika ısınma plaka üzerinde kuluçkaya.
Dikkat: %0,1 hyaluronidase ile HCZB ortamda 10 dk daha uzun bir pozlama için yumurta zararlı olur. - Kümülüs hücreleri dan cumulus oosit kompleksleri transfer ikinci segregasyonun metafaz (MII) sahne yumurta ile bazı kalan kümülüs hücreleri mKSOM orta içeren %0,3 dBSA için bir stereomicroscope altında yayımlanan onaylayın. Sonra MII sahne yumurtalar yukarı ve aşağı pipetting tarafından dört kez yıkayın (bir pipet kullanarak < 100 µm iç çap) içinde kalan kümülüs hücreleri ayırma için mKSOM orta içeren %0,3 dBSA.
Not: Dekolmanı kümülüs hücreleri küçük bir pipet kullanımını kolaylaştırır. - Mll sahne yumurta mKSOM orta içeren % 0,3 dBSA 37 ° c altında %5 içinde kuluçkaya CO2 kuluçka enükleasyon kadar.
Not: Biraz yumurta daha büyük bir çap ile küçük bir pipet önerilir.
4. nükleer Transfer için donör hücreleri hazırlanması
- 3.3-3.5, adımları sonra denuded yumurta cumulus oosit kompleksleri izole edilmiştir. Küçük bir miktar (yaklaşık 2 µL) %0.1 hyaluronidase ile HCZB ortamda kümülüs oosit kompleksleri gelen HCZB orta % 6 dBSA ile bir stereomicroscope altında bir pipet kullanarak dağınık kalan kümülüs hücreleri transferi.
- Kümülüs hücreleri SCNT için ihtiyaç kadar 37 ° C'de ısınma plaka üzerinde % 6 dBSA ile HCZB ortam yerleştirin.
Not: Zaman fibroblast hücreleri (örn., fare fetal fibroblast hücreleri) çoğu donör hücreleri olarak kullanılan, doku kültürü çanak hücrelerden bağlantısını kesin ve onları bir Pelet santrifüj kapasitesi. Pelet hücrelerinin % 6 dBSA içeren HCZB orta resuspend.
5. enükleasyon yumurta
- 10 mL HCZB Orta-0.9 g PVP ekleyerek % 9 PVP orta hazırlamak, buzdolabında gecede (4 ° C) tutmak ve sonra 0,45 µm filtre kullanarak sterilize.
- CB hisse senedi Çözümleri (konsantrasyonu 1 mg/mL) Dimetil sülfoksit (DMSO) için 5 mL 5 mg CB ekleyerek hazırlayın. HCZB orta (5 µg/mL nihai bir konsantrasyon) CB hisse senedi Çözümle sulandırmak ve enükleasyon çözüm kullanın.
- Teneffüs edilmesi ve sterilize pipet exhaling Mll sahne yumurta 5 µg/mL CB (enükleasyon çözüm) içeren HCZB orta 20 µL içinde yıkayın (iç çapı: 200 µm için 150 µm). Yıkama işlemi beş kez tekrarlayın. Yaklaşık 10 dk enükleasyon çözümde ısınma plaka üzerinde enükleasyon işlemine başlamadan önce bekleyin.
- Enükleasyon odası şekil 2Agösterildiği gibi hazırlayın. Teneffüs edilmesi ve pipet kullanarak exhaling enükleasyon odasına Mll yumurta transferi (iç çapı: 200 µm için 150 µm); enükleasyon çözüm 4 µL yerleştirin ve odası mineral yağ ile kaplayın.
Not: 60 mm Petri kabına bir kapak bir oda yerine kullanılabilir. - İğler ve MII sahne yumurta oda sıcaklığında (400 X) mikroskopla, kromozomlar tanımlar. Mll sahne oosit belirgin ilk kutup gövdeli iğ ve kromozom konumlandırma 3 ya da saat 9'dan bir holding pipet ve micropipette kullanarak (şekil 2B) konumunu biridir gelecek şekilde yönlendirin.
Not: kullanılan mikroskop toplam 400 X büyütme lensler var. Objektif lens N.A 5 X / 0,12 ve 40 X / 0.55 da. Piezo darbe pipet sürüş hızlı zona pelusida sondaj izin verir. Buna ek olarak, bir lazer sistemi (örneğin, XYClone) de zona pelusida piezo sürüş sistemi yerine delme için kullanılabilir. - 3-6 için piezo darbe yoğunluk ayarlamak ve sürüş piezo darbe ile Embriyolardan pipet (7-8 µm iç çapı düz uçlu tıp) kullanarak zona pelusida matkap. Zona pelusida içinde bir delik açtıktan sonra tamamen İğler ve kromozomlar sitoplazma (şekil 2C) en az bir miktarı ile enucleate.
Not: Bu işlem sırasında yumurtalar sıkıca çanak alt eklemek veya BSA14olmadan orta nedeniyle pipet eğilimindedir. 10 dk içinde enükleasyon işleminin tamamlanması gereken ve enucleated yumurta kuluçka makinesi için iade edilmesi gerekir. Uygun bir enükleasyon manipüle edilebilir yumurtalar 10 ile 20 arasında sayısıdır. Yumurtalar daha büyük gruplar için enükleasyon yordamı tekrarlanır. - Görünür ışık (şekil 2C, orta) altında sitoplazma içinde kromozomlar yokluğu onaylayın, sonra enucleated yumurta iyice CB eksik % 0,3 dBSA içeren mKSOM ortamda yıkayın. 37 ° C'de % 5 'un altında kuluçka çanak tanıtmak CO2 hücre füzyon kadar.
Not: enükleasyon sonra İğler ve kromozomlar ooplasm kaldırıldı sitoplazma içerir.
6. füzyon Enucleated bir yumurta ve bir donör hücre
-
HVJ-E hazırlanması
- Buz gibi HVJ-E süspansiyon çözüm 260 µL liyofilize HVJ-E Ekle ( Malzemeleri masaseti, görmek) ve yukarı ve aşağı tamamen askıya kadar pipet.
Not: Bir şişede liyofilize HVJ-E uygun miktarda hazırlanır ve 260 µL HVJ-E süspansiyon çözüm Seti'nde bulunur. - 5 µL aliquots HVJ-E çözüm hazırlamak ve hücre füzyon kadar-80 ° C'de depolayın.
Dikkat: sıcaklığa duyarlı olduğundan dikkatli bir şekilde HVJ-E buz üzerinde tedavi. Deney, uygun şekilde otoklav HVJ-E malzemeleri ve kapsayıcılar tamamen virüs bileşenleri devre dışı bırakma tamamlandıktan sonra.
- Buz gibi HVJ-E süspansiyon çözüm 260 µL liyofilize HVJ-E Ekle ( Malzemeleri masaseti, görmek) ve yukarı ve aşağı tamamen askıya kadar pipet.
-
Hücre Füzyon
- Hücre Füzyon arabelleği kullanımdan hemen önce 20 µL ile HVJ-E çözüm µL 5 oranında seyreltin. Seyreltilmiş HVJ-E çözüm kadar kullanmak Buza koyun.
Not: Hücre füzyon arabellek HVJ-E Seti'nde bulunur. - Hücre Füzyon odası şekil 3Aiçinde gösterildiği gibi hazırlayın. Enucleated yumurta HCZB Orta olarak hücre füzyon odası pipet kullanarak transfer (iç çapı: 200 µm için 150 µm); yer 4 µL her çözüm (% 6 -BSA için donör hücreleri, HVJ-E çözüm, HCZB orta, % 9 içeren HCZB orta HCZB orta PVP) ve odası yaklaşık 1 mL mineral yağ ile kaplayın.
Not: Uygun düzenleme sırasında bir hücre füzyon yordamı için odasına transfer enucleated yumurta 5'ten 30'a sayısıdır. Yumurtalar daha büyük gruplar için hücre füzyon yordamı tekrarlanır. Odası yerine, 60 mm Petri kabına kapak, varsa kullanılabilir. - Enucleated yumurta HCZB orta 400 X magnificationat oda sıcaklığında bir mikroskop altında yerleştirin. Embriyolardan pipet (6-7 µm iç çapı düz uçlu tıp) kullanarak donör hücreleri Aspire edin ve HVJ-E süspansiyon çözümde hücreleri sınırdışı.
- O zaman kümülüs hücreleri birer birer eşit birbirinden, seri hücre füzyon etkinleştirme ayrılması için HVJ-E süspansiyon solüsyonu ile Aspire edin. Enucleated yumurta bir holding pipet kullanarak HCZB ortamda tutmak. Piezo darbe (yoğunluğu 3-6, hızına göre 2-3) ile Embriyolardan pipet ile zona pelusida matkap.
- Zona pelusida delik açtıktan sonra oosit membran gitmeden kümülüs oosit membran, HVJ-E süspansiyon çözüm bir birim 5 kere kümülüs hücre hacmi ile birlikte sıkıca hücreye yerleştirin.
Not: 6-7 µm iç çapı düz uçlu ipuçları Embriyolardan Pipetler, kümülüs hücreleri için hazır olun. Pipetler % 9 PVP orta yumuşak hücre yayın korumak için düzenli olarak kullanarak yıkanmalıdır. Adımları 6.2.3 - 6.2.5 10 dk içinde bitirilmesi gereken veya hücre füzyon verimliliği düşük olacaktır. Membran füzyon faaliyet HVJ-e ısıyla, deterjan veya % 70 etanol ile tedavi tarafından inaktive. Bunu deneyden sonra HVJ-E çözüm uygun şekilde bertaraf gerekir. - Hücre Füzyon manipülasyon sonra derhal yumurta mKSOM orta içeren %0,3 dBSA için transfer ve 37 ° C'de % 5 'un altında bir kuluçka gitme CO2 1 h için.
- Hücre Füzyon arabelleği kullanımdan hemen önce 20 µL ile HVJ-E çözüm µL 5 oranında seyreltin. Seyreltilmiş HVJ-E çözüm kadar kullanmak Buza koyun.
7. etkinleştirme yeniden yumurta ve tedavi ile Trichostatin A ve C vitamini
-
TSA hazırlanması
- 5 mM TSA çözüm 3 µL aliquots dağıtmak ve çözüm-20 ° C'de depolayın
- 5 mM TSA hisse senedi çözüm 2.5 µL DMSO (12,5 µM konsantrasyonu) için 1 mL ekleyin.
- 8 µL 12.5 µM TSA hisse senedi çözüm mKSOM orta ve harekete geçirmek orta 2 ml seyreltik (son bir konsantrasyon 50 nM).
-
VC hazırlanması
- VC 1 mg 1 mL steril endotoksin ücretsiz su içine ekleyin ve -20 ° C'de depolayın
- VC hisse senedi çözüm mKSOM orta (son 10 µg/mL konsantrasyonu) ekleyin.
-
Yeniden oluşturulan yumurta aktivasyonu
- Bir saat sonra hücre füzyon, mikroskop (400 X) kullanarak erken kromozom yoğunlaşma (PCC) yeniden yumurta (şekil 3B) içinde kontrol.
- Yeniden oluşturulan yumurta harekete geçirmek ortamına aktarmak (bkz. Adım 1.3) TSA içeren ve 37 ° c altında %5 6 h için kuluçkaya CO2 hava (şekil 3 c). Pro-çekirdek içinde SCNT embriyo oluşumu gözlemlemek sonra 2 saat daha mKSOM orta içeren % 0.3 dBSA (şekil 2C) tedavisinde TSA uygulayın.
- 7 saat için şekil 3Dgösterildiği gibi kuluçkaya ve VC ile desteklenmiş mKSOM orta TSA tedavi edilen embriyolar transfer.
- 7 saat VC tedavi sonra mKSOM orta içeren %0,3 dBSA için VC-tedavi embriyo transfer ve 37 ° c altında %5 4 gün kuluçkaya havada CO2 .
Not: klonlanmış farelerin üretmek için morfolojik normal 2-hücre sahne embriyo içine sözde hamile kadın fareler (MCH(ICR)) vajinal bir fiş (gün 0,5 pseudopregnancy)15bulunduğunda günü. oviducts transfer 19,5 gün sonra sezaryen sonra implantasyon siteleri ve yeni doğanların sayısı kaydedilir.
Sonuçlar
Klonlanmış fare embriyo üretmek için kümülüs hücreleri ve fetal fibroblast hücreleri kullanılmıştır. Yeniden oluşturulan yumurtalar ve yumurta harekete geçirmek sonra 2 hücreli aşamaya geliştirme sayısını Tablo 1' de gösterilir. Pronuclear oluşumu (89-%100) ve geliştirme 2-hücre sahneye (77-%89) çok yüksek bir oranı tüm koşullar altında gözlendi. Kümülüs hücrelerinden elde edilen ve 2 hücreli aşamaya geliştirilen, klonlanmış embriyolar, bazıları için sözde hamile kadın oviducts transfer edildi. 72 transfer edilen embriyo dışarı altı klonlanmış yavru üç hamile kadın TSA ve VC (şekil 4) seri tedavisi tarafından üretildi. Klonlanmış embriyo yaklaşık % 15'i bu SCNT yordamlar12takip ederek bir süre için geliştirmek için rapor edilmiştir. Buna ek olarak, diğer kurumlarda klonlanmış 2 hücreli embriyo transferi klonlanmış embriyolar tek TSA tedavisine daha iyi gelişme gösterir % 9-15 canlı yavru elde etti. Ayrıca, TSA ve VC ile tedavi vitro embriyonik gelişim blastosist aşamasına verimliliğini önemli ölçüde geliştirilmiş (Tablo 2, P < 0,05, Öğrenci t-Testi). Bu vitro gelişimsel veri TSA ve VC olumlu etkisi ne fare suşları tarafından ne de hücre tipleri tarafından sınırlı olduğunu göstermektedir. Bu sonuçlar bu SCNT yöntem klonlanmış embriyoların gelişim yeteneği kolaylaştırır öneririz.

Resim 1: DBSA hazırlanması.
DBSA çözüm hazırlanması için adım adım yordamlar tasvir edilmektedir. İyon değiştirme ölçüde boncuk renk değişikliği tarafından değerlendirilecektir olabilir. Üst sol şekil gösterir BSA o 1,2 g, 10 mL steril su oda sıcaklığında erimiş. BSA çözünmüş sonra iyon değiştirme reçine boncuk (sağ üst) eklenir. BSA çözüm iyon değiştirme reçine boncuk ile karışımı mavi-yeşil renk değiştirdiğinizde altın (sağ alt), boncuk taze olanlar ile değiştirin. Sol alt şekil renk boncuk mavi-yeşil kalır ve iyon değiştirme tamamlandıktan gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
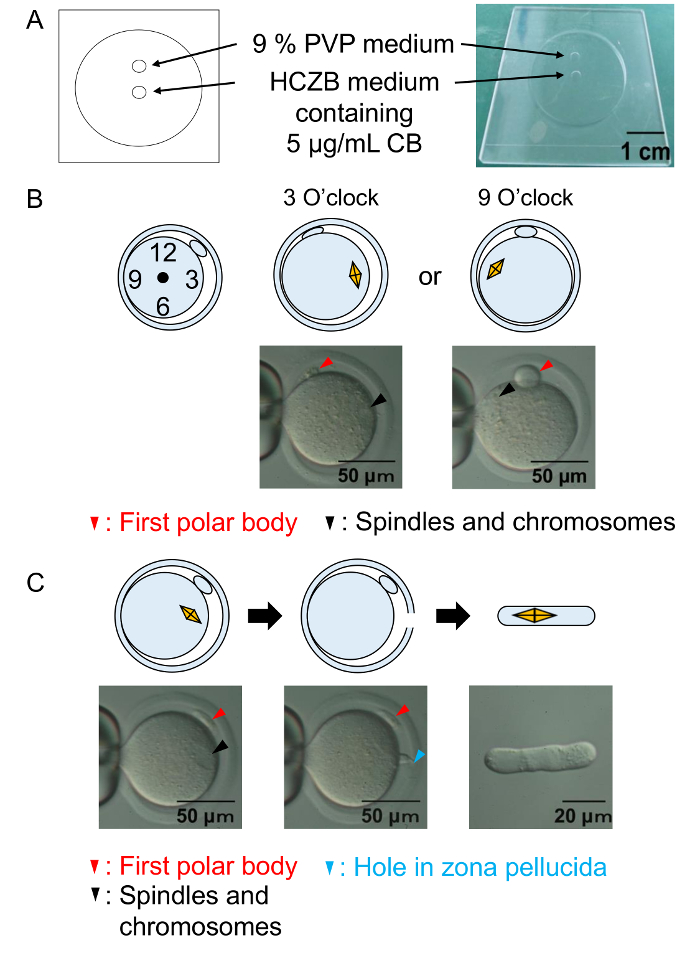
Resim 2: Enükleasyon yordamlar.
(A) enükleasyon odası görülmektedir. Yumurtalar enükleasyon HCZB orta CB ile gerçekleştirilir. Piezo sürüş sistemi için bir yer % 9 PVP orta cam pipet enükleasyon için hazırlamak için kullanılır. Noktaları madeni yağ tarafından karşılanmaktadır. (B) A diyagramı ve bir test İğler ve kromozomlar enükleasyon önce konumunu gösterir. Siyah ok uçları: iğ ve kromozomlar. Kırmızı ok uçları: ilk kutup vücut. (C) A Diyagram ve başarılı enükleasyon göstermek için bir test. Siyah ok uçları: iğ ve kromozomlar. Kırmızı ok ucu: ilk kutup vücut. Mavi ok ucu: zona pelusida delik. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
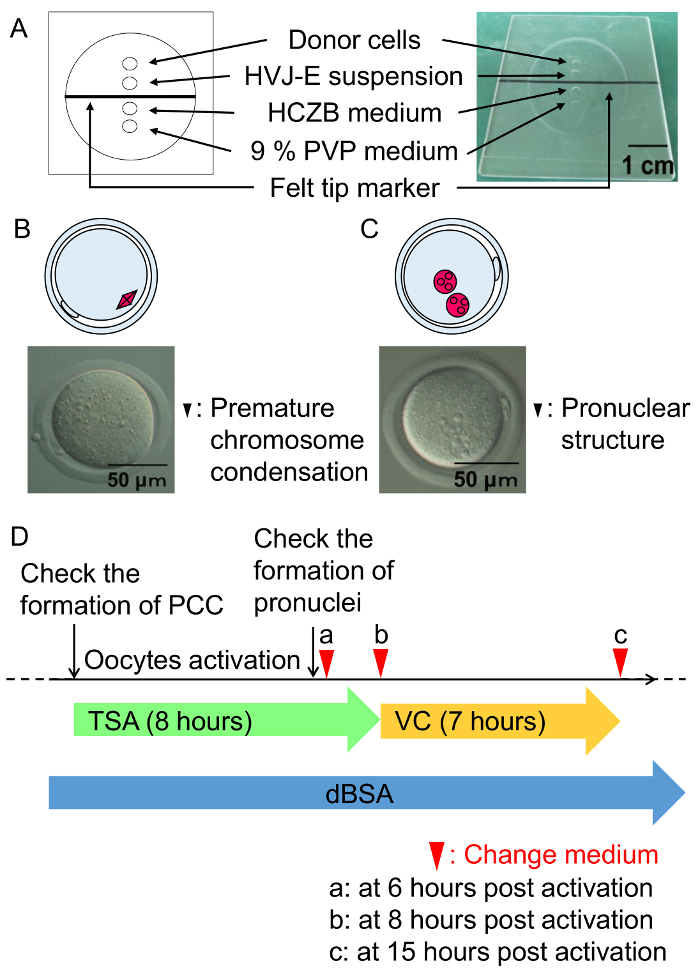
Şekil 3: füzyon yordamlar hücre ve koşul SCNT embriyo kültür.
(A) hücre füzyon odası görülmektedir. Hücre Füzyon % 6 dBSA içeren HCZB ortamda gerçekleştirilir. % 9 PVP orta bir nokta için hücre füzyon cam pipet hazırlamak için kullanılır. Noktaları madeni yağ tarafından karşılanmaktadır. (B) A diyagramı ve erken kromozom yoğunlaşma test bir saat geçtikten sonra hücre füzyon (siyah ok ucu) kurdu. (C) A diyagramı ve bir test pronuclear yapısının altı saat sonra harekete geçirmek (siyah ok uçları) kurdu. (D) şeması SCNT embriyolar için TSA, VC ve dBSA tedavi. Yeşil ok, TSA, kuluçka VC (sarı ok) ile % 0.3 dBSA (mavi ok) içeren mKSOM orta altında takip ile tedavi temsil eder. Ok uçları orta değiştirmek için zamanlama belirtin. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
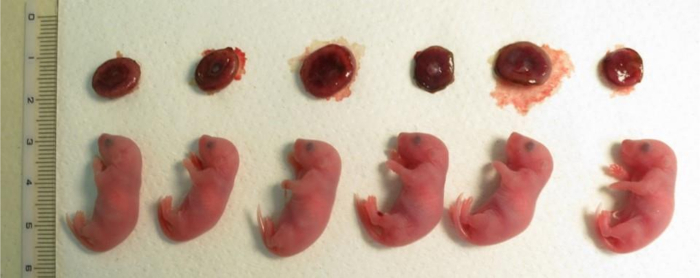
Şekil 4: Klonlanmış yavru hemen sonra sezaryen gebeliğin 19,5 gün sonra kümülüs hücrelerden türetilmiş.
Üst satır placentae vardır. Burada gösterilen klonlanmış yavru bir nükleer transfer deneme üç üvey anne üretildi. Plasenta boyutu 1,5-2 katı bu vitro fertilizasyon tarafından üretilen boyutunu daha büyüktü. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Grup | Donör hücre tipi | Fare zorlanma | No kullanılan yumurta | No yumurta erimiş | No erken kromozom yoğunlaşma gösterilen yumurta | No pronuclei oluşumu (%) gösterilen yumurta | No geliştirilen pronuclei oluşan yumurta 2 hücreli embriyo (%) | |
| TSA, VC | Kümülüs | C57BL/6 × DBA/2 | 84 | 82 | 82 | 81 (99) | 72 (89) | |
| tedavi edilmemiş | Kümülüs | C57BL/6 × DBA/2 | 84 | 82 | 82 | 82 (100) | 68 (83) | |
| TSA, VC | Fetal fibroblast | MCH(ICR)×MCH(ICR) | 202 | 171 | 169 | 151 (89) | 124 (82) | |
| tedavi edilmemiş | Fetal fibroblast | MCH(ICR)×MCH(ICR) | 201 | 171 | 147 | 142 (97) | 109 (77) | |
Tablo 1: tedavisinde üzerine TSA ve VC vitro 2-hücre sahneye klonlanmış fare embriyo gelişimi.
| Grup | Donör hücre tipi | Fare zorlanma | No kullanılan 2 hücreli embriyo | No 2-hücre embriyoların geliştirilen her aşamaları (%) | |||
| 4 hücreli | morula | blastosist | |||||
| TSA, VC | Kümülüs | C57BL/6 × DBA/2 | 152 | 152 (100) | 149 (98) | 135 (89) bir | |
| tedavi edilmemiş | Kümülüs | C57BL/6 × DBA/2 | 83 | 47 (57) | 41 (49) | 32 (39) b | |
| TSA, VC | Fetal fibroblast | MCH(ICR)×MCH(ICR) | 124 | 110 (89) | 101 (81) | 88 (71) c | |
| tedavi edilmemiş | Fetal fibroblast | MCH(ICR)×MCH(ICR) | 109 | 54 (50) | 45 (41) | 29 (27) d | |
| a-b, c-d Aynı donör hücreleri içinde farklı fontlarda üst simgeler temsil önemli farklılıklar (P < 0,05) | |||||||
Tablo 2: tedavisinde üzerine TSA ve VC vitro geliştirme klonlanmış fare embriyoların blastosist aşamasına.
Tartışmalar
Sonuç olarak, bu sonuçları sunulan SCNT yöntemi teknik sorunlar, azaltmak ve genetik değişiklikler ve mRNA takviyesi (Tablo 1, Tablo 2) gerek kalmadan SCNT verimliliğini artırmak ve sağlamak öneririz istikrarlı üretim klonlanmış embriyo. Bu yöntem daha iyi sağkalım oranı ve Basitleştirilmiş protokol nedeniyle geleneksel yöntemlere göre daha fazla SCNT embriyo yeniden bize sağlar. Bu protokol için bir kritik adım hücre birleşimidir. Başarıyla klonlanmış farelerin üretmek için HVJ-E iletişim kuralında tanımlanan uygun miktarda hücre füzyon işlemi sırasında korunur ve yumurta kuluçka makinesi 10 dk içinde belgili tanımlık merdiven 6.2.3 - 6.2.5 sırasında iade edilebilir gerekir emin olmak için hayati önem taşımaktadır. 20-30 donör hücreleri HVJ-E ile birlikte işleme pipet döneminde Aspire bu yana, bir işlem tarafından alınan yumurta sayısı varolan bir yöntemi daha büyük. Sonunda, yaklaşık 20 ila 30 10 dakika içinde yeniden yapılacak yumurta üretebilir. Düz ne zaman yumurta (100 veya daha fazla), büyük bir toplu işlemle hücre füzyon yordam çalışma bir saat sürer veya daha az adımları 6.2.3 - 6.2.5 tekrar tarafından. Yöntem ve teknikleri burada sunulan Basitleştirilmiş teknik şartlar ile etkili iletişim kuralları olarak hizmet verebilir.
Şu anda, SCNT embriyo gelişimi temel moleküler mekanizmaları hala pek açık değildir. Bu geliştirilmiş SCNT yöntem da bu yöntem yalnızca bir denemede fazla klonlanmış embriyo üretebilir beri böyle programlama mekanizmaları, eğitim için katkıda bulunur. Bu yöntemde somatik hücre hücre füzyon için sağlam hücre zarlarında ile kullanılır. Böylece,16kuyruk ucu hücreleri, sertoli hücreleri17ve18(ES) embriyonik kök hücreleri gibi diğer hücrelere bu yaklaşım uygulamak mümkün olabilir. Geleneksel SCNT yöntemleri gibi kuyruk ucu hücreleri, nispeten büyük hücreleri enjekte için kullanılan doğrudan oosit sitoplazma bile canlı embriyo elde etmek teknik açıdan daha zorlu hale gelir. Buna ek olarak, sertoli hücreleri gibi nispeten zor hücreleri enjekte için pipetting tarafından kırmaya zordur. Bu çeşitli hücre tiplerinin düşünüldüğünde, HVJ-E kullanan hücre füzyon yöntemi basit ve etkili. Belgili tanımlık değer ve güven HVJ-e inandırıcı gösterdiği19,20olmasına rağmen Klonlanmış hayvanlar tarım veya Biyomedikal amaçlar için üretmek için HVJ-E kullanarak fizibilite yeniden düşünmeye önemli olabilir.
Ayrıca, son zamanlarda bir grup başarıyla üretilen klonlanmış farelerin idrar hücreleri21türetilmiş. Soyu tükenen memeli kurtarmak için bundan sonra idrar hücre gibi non-invaziv bir şekilde toplanan hücre kullanarak SCNT ideal olacak. Daha yakın zamanlarda, başka bir grup doğrudan klonlanmış farelerin antijen spesifik CD4 kullanarak üretti+ T hücreleri22. Bu yöntem aynı zamanda verimli klonlamak fareler böyle hücrelerden uygulanabilir ise incelemek için ilginç olabilir. Ayrıca, Latrunculin A enükleasyon ve SCNT yumurta23parthenogenetic aktivasyonu sırasında aktin polimerizasyon inhibe için daha iyi bir alternatif olarak bildirilmiştir. Gelecekte Latrunculin A tedavi, cytochalasin B, yerine daha da klonlanmış yavru üretimi artırır olup olmadığını ortaya çıkarabilir. Ayrıca, TSA tedavi başarıyla fare, domuz24ve tavşan25 tedavi süresi, süre ve konsantrasyon değiştirerek kullanılmıştır. Ayrıca, VC sadece domuz SCNT10embriyonik gelişim artırır, ama Ayrıca IPS hücre üretimde insan ve fare26artırır. Böylece, TSA ve VC tedavi memeli diğer türler için de uygulanabilir ve TSA ve VC tesir süresi her tür için en iyi duruma getirmek ihtiyacımız olabilir spekülasyon akla yatkın.
Sonuç olarak, bu yöntem basit işlemleri ile verimliliği pratik düzeyde klonlanmış farelerin üretmek olanaklı olur. Bu nedenle, bu çalışmanın sonuçlarını bize nadir hayvan genetik kaynaklarının korunması ve nükleer yeniden programlama ve erken embriyonik gelişme moleküler mekanizmaları anlama SCNT teknoloji kullanmak neden olabilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser JSP'ler KAKENHI grant numaraları JP15H06753, JP16H01321, JP16H01222, JP17H05045 km Sumitomo Vakfı Hibe temel bilim ve araştırma projelerine (150810 km) tarafından desteklenmiştir. Kindai Üniversitesi Araştırma Bursu (15-I-2 km ve yüksek lisans için). Yöntem kabul kanser araştırmaları İngiltere (C6946/A24843) ve Wellcome Trust (203144/Z/16/Z) tarafından sağlanan çekirdek desteği. Bayan N. Backes-Kamimura ve Bay J. Horvat ispat okuma için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich, Co., Lcc. | 28-2270-5 | For medium |
| KCl | Wako Pure Chemical Industries, Ltd. | 169-03542 | For medium |
| KH2PO4 | Wako Pure Chemical Industries, Ltd. | 165-04242 | For medium |
| MgSO4 · 7H2O | Wako Pure Chemical Industries, Ltd. | 137-00402 | For medium |
| CaCl2 · 2H2O | Wako Pure Chemical Industries, Ltd. | 039-00431 | For medium |
| D(+)-Glucose | Wako Pure Chemical Industries, Ltd. | 041-00595 | For medium |
| Sodium Pyruvate | Wako Pure Chemical Industries, Ltd. | 199-03062 | For medium |
| L-Glutamine | Sigma-Aldrich, Co., Lcc. | G3126 | For medium |
| Polyvinylpyrrolidone | Wako Pure Chemical Industries, Ltd. | 168-17042 | For medium |
| NaHCO3 | Nacalai tesque, Inc. | 31213-15 | For medium |
| Sodium DL-Lactate | Nacalai tesque, Inc. | 31605-72 | For medium |
| Penicillin | Meiji Seika Pharma Co., Ltd. | 4987222637671 (GTIN-13) | For medium |
| Streptomycin | Meiji Seika Pharma Co., Ltd. | 4987222665643 (GTIN-13) | For medium |
| Sterile water, endotoxin free | Wako Pure Chemical Industries, Ltd. | 196-15645 | For medium |
| EDTA · 2Na | Dojindo Lab. | 345-01865 | For medium |
| Phenol red | Sigma-Aldrich, Co., Lcc. | P0290 | For medium |
| HEPES sodium salt | Sigma-Aldrich, Co., Lcc. | H3784 | For medium |
| Polyvinyl alcohol | Sigma-Aldrich, Co., Lcc. | P8136 | For medium |
| Bovine serum albumin | Sigma-Aldrich, Co., Lcc. | A3311 | For medium |
| BT AG 501-X8 (D) Resin | Bio-Rad Lab., Inc. | 143-7425 | For preparation of dBSA |
| Hyaluronidase | Sigma-Aldrich, Co., Lcc. | H3506 | For collection of oocytes and cumulus cells |
| Cytochalasin B | Wako Pure Chemical Industries, Ltd. | 034-17554 | For enucleation and oocytes activation |
| Piezo micro manipulator | Prime tech, Co., Ltd. | PMM-150FU | For micromanipulation |
| HVJ Envelope Cell Fusion Kit GenomONE-CF | Ishihara sangyo kaisha, Ltd. | CF001 | Containing 0.5 mL of HVJ-E suspension solution and 10 mL of cell fusion buffer for cell fusion |
| SrCl2 · 6H2O | Wako Pure Chemical Industries, Ltd. | 193-09442 | For oocytes activation |
| EGTA | Sigma-Aldrich, Co., Lcc. | E8145 | For oocytes activation |
| Dimethyl sulfoxide | Wako Pure Chemical Industries, Ltd. | 045-24511 | For solvent |
| Trichostatin A | Sigma-Aldrich, Co., Lcc. | T1952 | For incubating with SCNT embryos |
| L-Ascorbic acid | Sigma-Aldrich, Co., Lcc. | A5960 | For incubating with SCNT embryos |
| Mineral oil | Sigma-Aldrich, Co., Lcc. | M8410 | For covering medium |
Referanslar
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Kishigami, S., et al. Production of cloned mice by somatic cell nuclear transfer. Nat Protoc. 1 (1), 125-138 (2006).
- Ogura, A., Inoue, K., Takano, K., Wakayama, T., Yanagimachi, R. Birth of mice after nuclear transfer by electrofusion using tail tip cells. Mol Reprod Dev. 57 (1), 55-59 (2000).
- Ono, Y., Shimozawa, N., Ito, M., Kono, T. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer. Biol Reprod. 64 (1), 44-50 (2001).
- Matoba, S., et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell. 159 (4), 884-895 (2014).
- Kishigami, S., et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem Biophys Res Commun. 340 (1), 183-189 (2006).
- Rybouchkin, A., Kato, Y., Tsunoda, Y. Role of histone acetylation in reprogramming of somatic nuclei following nuclear transfer. Biol Reprod. 74 (6), 1083-1089 (2006).
- Bui, H. T., et al. Effect of trichostatin A on chromatin remodeling, histone modifications, DNA replication, and transcriptional activity in cloned mouse embryos. Biol Reprod. 83 (3), 454-463 (2010).
- Chen, J., et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet. 45, 34-42 (2013).
- Huang, Y., et al. Vitamin C enhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos. Biochem Biophys Res Commun. 411 (2), 397-401 (2011).
- Isaji, Y., Yoshida, K., Imai, H., Yamada, M. An intracytoplasmic injection of deionized bovine serum albumin immediately after somatic cell nuclear transfer enhances full-term development of cloned mouse embryos. J Reprod Dev. 61 (6), 503-510 (2015).
- Miyamoto, K., et al. Reprogramming towards totipotency is greatly facilitated by synergistic effects of small molecules. Biol Open. 6, 415-424 (2017).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the mouse embryo: A laboratory manual. , (2014).
- Nakagata, N., Okamoto, M., Ueda, O., Suzuki, H. Positive effect of partial zona-pellucida dissection on the in vitro fertilizing capacity of cryopreserved C57BL/6J transgenic mouse spermatozoa of low motility. Biol Reprod. 57 (5), 1050-1055 (1997).
- Hogan, B., Costantini, F., Lacy, E. . Manipulating the mouse embryo. , (1986).
- Wakayama, T., Yanagimachi, R. Cloning of male mice from adult tail-tip cells. Nat Genet. 22 (2), 127-128 (1999).
- Ogura, A., et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature sertoli cells. Biol Reprod. 62 (6), 1579-1584 (2000).
- Wakayama, T., Rodriguez, I., Perry, A. C., Yanagimachi, R., Mombaerts, P. Mice cloned from embryonic stem cells. Proc Natl Acad Sci U S A. 96 (26), 14984-14989 (1999).
- Tachibana, M., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 461 (7262), 367-372 (2009).
- Yamada, M., et al. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 510 (7506), 533-536 (2014).
- Mizutani, E., et al. Generation of cloned mice and nuclear transfer embryonic stem cell lines from urine-derived cells. Sci Rep. 6, 1-8 (2016).
- Kaminuma, O., et al. Hyper-reactive cloned mice generated by direct nuclear transfer of antigen-specific CD4+ T cells. EMBO Rep. 18 (6), 885-893 (2017).
- Terashita, Y., et al. Latrunculin A can improve the birth rate of cloned mice and simplify the nuclear transfer protocol by gently inhibiting actin polymerization. Biol Reprod. 86 (6), 180 (2012).
- Zhao, J., et al. Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos. Cell Reprogram. 12 (1), 75-83 (2010).
- Shi, L. H., et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos. Dev Dyn. 237 (3), 640-648 (2008).
- Esteban, M. A., et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell. 6 (1), 71-79 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır