Method Article
Híbrido claro/azul electroforesis nativa para la separación y análisis de Supercomplejos de cadenas respiratorias mitocondriales
En este artículo
Resumen
Aquí presentamos un protocolo para extraer, resolver e identificar los supercomplejos mitocondriales que minimizan la exposición a los detergentes y al azul de Coomassie. Este protocolo ofrece un equilibrio óptimo entre la resolución y la preservación de las actividades enzimáticas, al tiempo que minimiza el riesgo de pérdida de interacciones entre proteínas y proteínas del lábil.
Resumen
Los complejos de la maquinaria de fosforilación oxidativa forman arreglos proteicos supramoleculares denominados supercomplejos (SCs), que se cree que confieren ventajas estructurales y funcionales a las mitocondrias. Los SCs se han identificado en muchas especies, desde la levadura hasta el mamífero, y un número cada vez mayor de estudios informan de la alteración de su organización en las enfermedades humanas genéticas y adquiridas. Como resultado, un creciente número de laboratorios están interesados en el análisis de SCs, que puede ser metodológicamente desafiante. En este artículo se presenta un protocolo optimizado que combina las ventajas de los métodos de página azul y Clear-Native para resolver y analizar los SCs de una manera eficaz en el tiempo. Con este método híbrido CN/BN-PAGE, los SCs mitocondriales extraídos con cantidades óptimas del detergente suave digitonina se exponen brevemente al colorante aniónico Coomassie Blue (CB) al comienzo de la electroforesis, sin exposición a otros detergentes. Esta corta exposición a CB permite separar y resolver SCS de manera tan eficaz como con los métodos tradicionales BN-Page, evitando al mismo tiempo el impacto negativo de los altos niveles de CB en los ensayos de actividad en gel, y las interacciones de proteína-proteína lábil dentro de SCS. Con este protocolo es posible combinar de forma precisa y rápida las mediciones de la actividad en gel con técnicas analíticas que implican electroforesis 2D, inmunodetección y/o proteómica para el análisis avanzado de SCs.
Introducción
Las mitocondrias producen energía a través de la fosforilación oxidativa, donde los complejos respiratorios I-II-III-IV oxidan sustratos y transfieren electrones al oxígeno, generando un gradiente que permite la fosforilación de ADP por la ATP sintasa (CV). En los últimos años, estudios extensos han demostrado que los complejos de cadenas respiratorias no se incorporan únicamente de forma lineal en la membrana mitocondrial interna, sino que también se organizan en arreglos de supercomplejos (SCS)1,2. En las mitocondrias de mamíferos, los SCs existen en diferentes estequiomecitries: CI/CIII2/CIV1-4 (que se llama respirasoma, y que es capaz de NADH:O 2 oxidoreduction in vitro)2, CI/CIII2, y CIII2 /CIV1-23,4. Además, los complejos respiratorios se distribuyen bajo diferentes proporciones entre su forma libre y los arreglos de SCs. Por lo tanto, se estima que el 85% – 100% de CI, 55% – 65% de CIII, y 15% – 25% de CIV se encuentran en SCs4. Estas estructuras supramoleculares se cree que disminuyen la producción de ROS, estabilizar o ayudar en el montaje de complejos individuales, regular la actividad de la cadena respiratoria, y prevenir la agregación de proteínas en la membrana mitocondrial interior rica en proteínas5 ,6,7,8. Su capacidad de remodelación sobre la variación en la demanda de energía y su importancia en la patogénesis de enfermedades está siendo investigada en varios laboratorios3,7,9,10, 11 , 12 , 13 , 14. estudios han demostrado que los cambios patológicos en el conjunto de SCS están presentes en una variedad de trastornos, incluyendo, pero no limitado a, defecto genético en la síntesis de cardiolipina15, insuficiencia cardíaca16, isquemia-reperfusión17, diabetes12y envejecimiento18.
La electroforesis nativa y la inmunodetección se utilizan ampliamente en los estudios de SCS para resolver los arreglos cuaternarios de los complejos de OXPHOS2,19,20,21. La electroforesis nativa también se puede combinar con específicos en ensayos de actividad de gel o página 2D-SDS para permitir la determinación molecular precisa de los diversos conjuntos de SCS1,19. La capacidad de estudiar SCs depende críticamente de las condiciones de extracción, incluido el tipo y la concentración de detergente utilizado, la fuerza iónica y el pH, así como las condiciones de migración electroforética, que comprenden la composición del tampón, la presencia de CB, el gel tamaño y el porcentaje de acrilamida2.
Los protocolos y la resolución de banda SCs varían mucho entre los documentos, lo que dificulta la comparación entre estudios y la adaptación de los métodos desafiantes22. Por lo tanto, este artículo propone un protocolo robusto y óptimo para extraer SCs de las mitocondrias aisladas de diferentes fuentes con el detergente no iónico digitonin, y para resolver las bandas SCs de alto peso molecular. La concentración de detergente optimizada, la composición del tampón de extracción y la ausencia de Coomassie Blue en la preparación de muestras minimizan la interrupción de los complejos proteicos. Este protocolo (consulte la figura 1 para obtener información general) combina CN-Page y BN-Page para obtener una resolución óptima de los ensamblajes de SCS en un gel grande, y es compatible con los ensayos de actividad en gel, lo que permite una mejor visualización de las bandas reactivas, junto con el uso de inmunodetección para un análisis detallado de arreglos y composición de SCs.
Protocolo
1. extracción SC
- Preparar 100 mL de tampón de extracción (ver tabla 2) disolviendo EDTA en agua. Aumente el pH con KOH hasta que se disuelva por completo y, a continuación, ajuste el pH a 7,5 con HCl. Agregue los componentes restantes a la solución, complete el volumen final con agua y manténgase en hielo. En un tubo, disolver digitonin en el tampón de extracción para hacer una solución del 10%, vórtice a fondo hasta que se disuelva por completo, y mantener en el hielo.
Nota: el tampón de extracción se puede preparar por adelantado y mantenerse a 4 ° c durante 2 meses como máximo. Si las bandas onduladas empiezan a aparecer en la parte inferior del gel, significa que el búfer de extracción es demasiado viejo. Al preparar la solución de digitonin al 10%, prepare un recuento de volumen de existencias de 500 μL por muestra si utiliza mitocondrias hepáticas del ratón. La solubilidad de digitonin varía según la procedencia y el lote de productos (ver tabla de materiales). - Las mitocondrias aisladas del tejido animal (corazón del ratón, músculo, hígado, corazón de rata) o células (fibroblastos humanos) utilizando los protocolos estándar23,24,25 se pueden utilizar para la extracción de SCS. Una vez obtenidas las mitocondrias, cuantificar el contenido de proteínas utilizando el kit de ensayo de ácido bicinchonínico según las recomendaciones del fabricante. Suplemento mitocondrias aisladas con proteasas y fosfatasas inhibidores en este paso según sea necesario.
Nota: los SCs se pueden extraer en mitocondrias frescas o descongeladas. Se recomienda extraer SCs de todas las muestras al mismo tiempo, para asegurar que se traten con los mismos lotes de soluciones y en las mismas condiciones. - Sobre la base de la concentración de proteína mitocondrial obtenida, y la relación digitonina/proteína final deseada, calcule el volumen de la solución de digitonina y el tampón de extracción requeridos según la tabla 1. Para la extracción SC, añadir 1 μL de tampón de extracción (tabla 2) que contenga digitonina por cada 10 μg de proteína mitocondrial. La relación digitonina/proteína puede variar de 2 a 8 g/g. Siempre se debe realizar una valoración digitonin para cada nuevo tipo de muestra utilizado (consulte la figura 2 para ver un ejemplo).
- Mitocondrias de pellet, en un tubo de 1,5 mL por centrifugación a 16.000 x g durante 10 min a 4 ° c.
- Deseche el sobrenadante y vuelva a suspender el pellet mitocondrial en el volumen calculado de tampón de extracción con hielo frío que contiene digitonin. Coloque los tubos en un minirotador e incube durante 30 min a 4 ° c a una velocidad de rotación media. Asegúrese de que las muestras se estén mezclando correctamente.
- Centrifugar muestras a 20.400 x g para 45 min a 4 ° c para eliminar fragmentos insolubilizados.
- Transfiera el sobrenadante en un nuevo tubo sobre hielo y cuantifique las proteínas. Esta fracción representa el extracto de supercomplejos respiratorios. Si la electroforesis no se realiza el mismo día, almacene las muestras a-80 ° c.
Nota: 1) evitar los ciclos de congelamiento/descongelación del extracto, ya que esto altera los arreglos moleculares más elevados de SCs. aliquot muestra antes del primer ciclo de congelación/deshielo si es necesario. 2) para realizar un experimento estándar BN-PAGE, CB se debe agregar al extracto de SCs en este paso. CB se debe añadir en una proporción de 1g/8g en relación con la cantidad de detergente utilizado.
2. fundición de gel de gradiente y electroforesis
- Prepare el tampón de gradiente 3x y las existencias de acrilamida para hacer el gel de gradiente, alícuota y almacenar a-20 ° c (ver tabla 3).
- Prepare los tampones de ánodo y cátodo y Manténlos a 4 ° c (ver tabla 5).
- Abra la cámara de fundición y coloque una placa de vidrio exterior (20 cm x 22 cm) en la cámara. Coloque un conjunto de espaciadores (1,5 mm) utilizando la tarjeta de alineación para asegurarse de que se sientan firmemente contra el lado y las esquinas de la cámara. Coloque una placa de vidrio interior (20 cm x 20 cm) en la parte superior de los espaciadores (esto forma el sándwich de gel), y poner una hoja de separación de plástico en la parte superior de la placa de vidrio.
- Repita el paso 2,3 hasta alcanzar el número deseado de geles a lanzar. Para este protocolo, 4 geles son moldeados. El sistema de cámara de fundición que utilizamos (ver tabla de materiales) permite la fundición de un máximo de 10 geles a la vez. Recoger el espacio restante en la cámara añadiendo primero tantos bloques de acrílico como sea necesario, y luego placas de vidrio si es necesario.
Nota: el montaje tiene que estar herméticamente sellado; no debe haber espacio entre los sándwiches de gel en la cámara. - Coloque una tira de Parafilm en la ranura antes de colocar la junta firmemente en la muesca de la Junta. Coloque la placa de sellado en la cámara y apriete los 6 tornillos. Soporte la cámara de fundición.
- Coloque la primera pendiente en una placa de agitación con un agitador magnético en la cámara de mezcla "ligera". Conecte el tubo de la cámara de fundición a la primera gradiente, asegure el tubo en el cassette de la bomba peristótica, y asegúrese de que el llave del degradado anterior está cerrado.
- Para lanzar 4 geles, preparar 60 mL de 4% y 60 mL de soluciones de gel al 12% (ver tabla 4) en un matraz Erlenmeyer y agitar bien para mezclar. Vierta 60 mL de solución de gel al 4% en la cámara de mezcla "ligera" y 60 mL de 12% en la cámara de depósito "pesada" del degradado anterior. Ajuste la velocidad de agitación de la placa de agitación a 350 RPM. Abra la llave y encienda la bomba a 35 rpm.
- Una vez que la fracción de luz es más baja que la fracción pesada, detenga la bomba y abra el vástago de la válvula entre embalses "ligeros" y "pesados", deje que el volumen de las fracciones se equilibre y reinicie la bomba.
Nota: es importante que no entren burbujas en el sistema y se atrapen entre placas de vidrio. Si esto sucede, deshacer el montaje, lavar y rehacer. - Una vez que el gel de gradiente se vierte por completo, detenga la bomba y sobreponga el agua (aproximadamente 1 mL) en cada sándwich de gel para evitar el secado del gel. Dejar polimerizar durante 2 h.
- Prepare 25 mL de gel de apilamiento en erlenmeyer y remolino para mezclar bien. Retire el agua e inserte 15 peines de pozo en cada sándwich de gel. Vierta el gel de apilamiento y deje polimerizar durante 2 h.
Nota: los geles pueden ser moldeados y mantenidos a 4 ° c durante 1 semana. - Inserte el gel en las pinzas de sándwich y retire el peine. Con la placa de vidrio corta hacia abajo, inserte el sándwich de gel en el núcleo de enfriamiento. Repita en el otro lado, y coloque el núcleo en el tanque de electroforesis.
- Verter 300 mL de tampón de Caturo azul en la cámara interior del tanque de electroforesis. Vierta 2 L de tampón de ánodo en la cámara exterior del tanque de electroforesis.
Nota: el electrodo tiene que ser sumergido en el tampón del cátodo, que requiere aproximadamente 300 mL. - Carga entre 75 μg y 175 μg de proteína por pozo. Ejecutar gel a 150 V para 1,5 h (o hasta que todas las muestras hayan entrado en el gel de gradiente) en la sala fría (4 ° c).
Nota 1:1) se requiere un mínimo de 75 μg por pozo para una buena resolución de las bandas de actividad en gel. La carga de más de 175 μg de proteína dará lugar a una pérdida de bandas claras debido a la excesiva actividad enzimática. 2) las réplicas de la muestra deben cargarse en pozos separados para permitir la determinación paralela de las actividades en gel y el análisis de inmunoblot de los complejos de OXPHOS. La determinación paralela de IGA para CI, CII, CIV y CV requiere un mínimo de 300 μg. el análisis de inmunoblot paralelo de CI, CII, CII, CIV y CV requiere un mínimo de 375 μg. - Retire el tampón de cátodo azul con Pipet o vacío, sustituya por 300 mL de Coomassie Blue-Free Caturo buffer, y ejecute el gel a 200 V durante la noche (16 – 20 h) en la sala fría (4 ° c). Proceda al paso 3 o 4 para la medición de la actividad en gel o el inmunobloteo.
3. actividad in-gel para complejos I, II, IV y CV
- Antes del final de la electroforesis, prepare amortiguadores de actividad en gel de acuerdo con la tabla 6, y manténgase en la oscuridad en RT. 20 ml de tampón de actividad en gel es suficiente para 3 carriles de muestra.
Nota: este ensayo de actividad de CV en gel se basa en la actividad inversa de ATPsynthase (es decir, la hidrólisis de ATP) y utiliza el calcio como cofactor, que se precipina en el gel. El calcio es menos dañino que el plomo utilizado en otros protocolos. Además, el uso de este Protocolo no requiere una pre-activación/acondicionamiento del gel23. - Detenga la electroforesis y recupere el gel. Cortar carriles, si es necesario, y transferir carriles de gel en bolsas de plástico (3 lados cortados, y bolsa de plástico se abrió como un libro). Selle 2 de los 3 lados con un sellador térmico.
Nota: para comparar la composición de las bandas SC entre grupos experimentales, se recomienda ejecutar las mismas muestras en réplicas en el mismo gel. Corte carriles para incubar cada réplica en diferentes búfers de actividad en gel (CI, II, IV, V). Para confirmar la especificidad de los ensayos, se pueden preparar réplicas adicionales para realizar actividades en gel en presencia de inhibidores específicos de la cadena respiratoria. - Para 3 muestras experimentales (es decir, 3 pozos), agregue 20 mL de tampón de actividad en gel, quite las burbujas y selle el lado 4 de la bolsa de plástico.
Nota: Añadir inhibidores en experimentos de control negativo si se realiza: IC: ROTENONE 1 μM; CII: malonato sódico 10 mM; CIII: antimicina-A 8 μM; CIV: KCN 0,6 mM; CV: oligomicina 0,5 μM. - Incubar carriles de gel a 37 ° c en la oscuridad y comprobar cada 15 minutos. el tiempo de incubación varía dependiendo de la cantidad de proteínas y complejos. CI reaccionará más rápido que CIV o CV. la tinción óptima generalmente se produce después de 2 h para CI, 4 h para CIV y 6 h para CII y CV.
- Enjuague carriles de gel en el agua para detener la reacción, e imagen sobre un fondo blanco para CI, CII, CIV, o fondo negro para CV.
Nota: los geles se pueden conservar en bolsas de plástico en RT o 4 ° c durante varios meses.
4. inmunoblotting
- Prepare el búfer de transferencia de acuerdo con la Tabla 7y manténgase en RT. Prepare la tbst y MANTÉNLA en RT.
- Coloque todo el gel, o carriles seleccionados, en un recipiente y agregue un búfer de transferencia complementado con SDS (0,25% final en búfer de transferencia). Coloque el recipiente sobre el balancín e incube durante 1 h.
- Cortar la membrana de PVDF (tamaño correspondiente al tamaño del gel) y activar en 20 mL de metanol bajo agitación durante 2 min. sustituir por 20 mL de tampón de transferencia y colocar bajo agitación durante 2 min.
- Prepare el sándwich de transferencia, de abajo a arriba, asegurándose de que no haya burbujas entre el gel y la membrana PVDF activada: lado claro del cassette/esponja negra/papel secante/membrana/gel/papel secante/esponja negra/lado negro del cassette. Cierre y bloquee el cassette.
- Coloque el sándwich de transferencia en el tanque de transferencia, con el lado claro del sándwich hacia el lado rojo del electrodo, y vierta el búfer de transferencia para fusionar el gel. Conecte el sistema de enfriamiento al tanque de transferencia y fije a 4 ° c. Conecte a la fuente de alimentación, fije en 40 mA, y funcione para 24 h.
- Recuperar las membranas, bloquear por 1 h en 5% BSA en TBST, e incubar en solución de anticuerpos primarios preparado en 5% BSA en TBST durante la noche a 4 ° c.
Nota: ver Tabla 8 para los anticuerpos utilizados. - Enjuague las membranas en TBST 3x durante 10 min cada una.
- Incubar las membranas en soluciones de anticuerpos secundarios preparadas en 5% BSA en TBST para 2 h a temperatura ambiente.
- Enjuague las membranas en TBST 3x durante 10 min cada una.
- Añadir solución quimiluminiscente a las membranas y la imagen.
5. Análisis
- Las imágenes de ensayo de actividad en gel o los inmunoblots se pueden utilizar para analizar SCs. Para analizar la composición de las bandas, alinee las réplicas y valide qué complejo reaccionó positivamente para cada banda dada.
- Para analizar la distribución de los complejos, en varios ensamblajes supramoleculares, abra imágenes en ImageJ y utilice la herramienta de análisis gel (consulte la figura 5 para ver un ejemplo).
- Seleccione carriles con la herramienta Rectángulo y carriles de trazado.
- Dibuje líneas para cerrar el área bajo la curva de cada banda de interés y haga clic en cada área con la herramienta Varita para generar una tabla que contenga el área bajo los valores de la curva.
- Para calcular la distribución del complejo, informe de los valores de cada banda en relación con el del monómero.
Resultados
La figura 2 muestra los resultados de un experimento de titulación digitonin con el objetivo de identificar la cantidad adecuada de digitonin necesaria para la extracción de SCS. Esta cantidad variará dependiendo del tipo de tejido/célula y si la muestra se congeló o no. Para este experimento, se realizó una actividad de CIV en gel para visualizar los SCs aislados de las mitocondrias hepáticas frescas del ratón. Se probaron ratios de 2/1 a 10/1 g de proteína digitonina/g de proteínas. La cantidad óptima de digitonin para esta muestra es de 4 g/g, ya que proporciona una buena resolución de CIV monomérica y SCs de alto peso molecular. En una proporción más baja, las bandas no son claras y se resuelven en un frotis durante la electroforesis, mientras que el uso de una mayor proporción de digitonin conduce a la alteración del SC de alto peso molecular.
La figura 3 y la figura 4 muestran los resultados de un experimento completo realizado en una preparación de las mitocondrias hepáticas del ratón extraídas con 4 g de proteína digitonina/g. Las proteínas se separaron mediante el uso de BN/CN-PAGE híbrido, BN-PAGE estándar o CN-PAGE. Los tres geles fueron arrojados al mismo tiempo y los carriles fueron cargados con réplicas de la misma muestra. Después de la electroforesis, se cortaron y procesaron carriles individuales para la medición de la actividad en gel (CI, CII, CIV y CV en la figura 3) e inmunobloteo (CI, CII, CIII, CIV, CV en la figura 4).
La adición de CB, ya sea momentáneamente en el búfer de cátodo (es decir, híbrido CN/BN-PAGE) o en el tampón de muestra y cátodo a través de la electroforesis (es decir, BN-PAGE), mejora considerablemente la movilidad y la resolución de las bandas SC, y los complejos respiratorios individuales Comparado con CN-PAGE (figura 3). Las bandas son fácilmente distinguibles con la técnica híbrida o BN-PAGE después de la actividad in-gel para CIV, mientras que en la misma muestra resuelta por CN-PAGE, SCs y las bandas reactivas CIV monoméricas no pueden ser identificadas.
La figura 3 y la figura 4 muestran que la resolución y el patrón de bandas de los monómeros y los ensamblajes supramoleculares de OXPHOS son CUALITATIVAMENTE comparables entre CN/BN-PAGE y BN-Page híbridos. Sin embargo, existen diferencias notables. En primer lugar, la movilidad electroforética de los complejos OXPHOS se reduce ligeramente cuando las proteínas se separan utilizando las condiciones híbridas CN/BN-PAGE frente a BN-Page estándar, debido a la reducción de la cantidad de CB. Este cambio de movilidad es mayor para los monómeros CIV, seguidos por monómeros de CV y CI (figura 3 y figura 4). En segundo lugar, el fondo azul es menor en el híbrido CN/BN-PAGE en comparación con BN-PAGE (figura 3, carriles de la izquierda). Como resultado, altos niveles de fondo después de BN-PAGE enmascara completamente la tinción de actividad en gel para CII, y mejora el ruido de fondo asociado con la actividad de los dímeros CIV (figura 3). En tercer lugar, la actividad de CV es mayor cuando las muestras se ejecutan en condiciones híbridas de CN/BN-PAGE en comparación con BN-PAGE (figura 3), debido a la cantidad reducida de CB, que se sabe que interfiere con la actividad catalítica CV. 26 CN/BN-Page también permite una mejor conservación de los ensamblajes supramoleculares CV, como muestra una mayor proporción de la actividad total de CV asociada a los dímeros de CV (figura 3). Por otra parte, los oligomeros CV son visibles bajo CN/BN-PAGE, mientras que están completamente disociados bajo condiciones BN-PAGE. Curiosamente, las distintas bandas que muestran la actividad de CV también se observan entre los monómeros de CV y los dímeros, cuando las muestras se ejecutan bajo CN/BN-PAGE (figura 2).
La figura 5 muestra un análisis representativo de la distribución compleja de OXPHOS en ensamblajes supramoleculares. La imagen muestra CI en la actividad de gel de muestras obtenidas de 4 preparaciones de mitocondrias hepáticas sanas de ratón distintas. El análisis de densitometría permite medir el área bajo la curva de las bandas CI-reactiva, y presentar la distribución relativa de la actividad C1 en las formas monoméricas (I1) y Supramolecular (i1III2, i1III2IV 1, I1III2IVn). Se puede realizar un análisis similar siguiendo el inmunoblot.
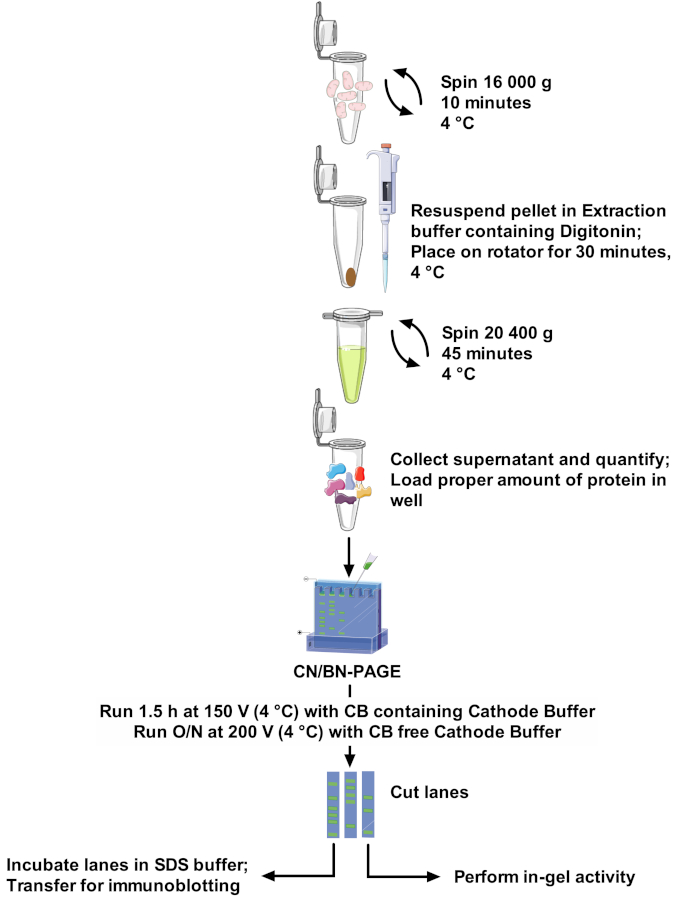
Figura 1: flujo de trabajo de ensayo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
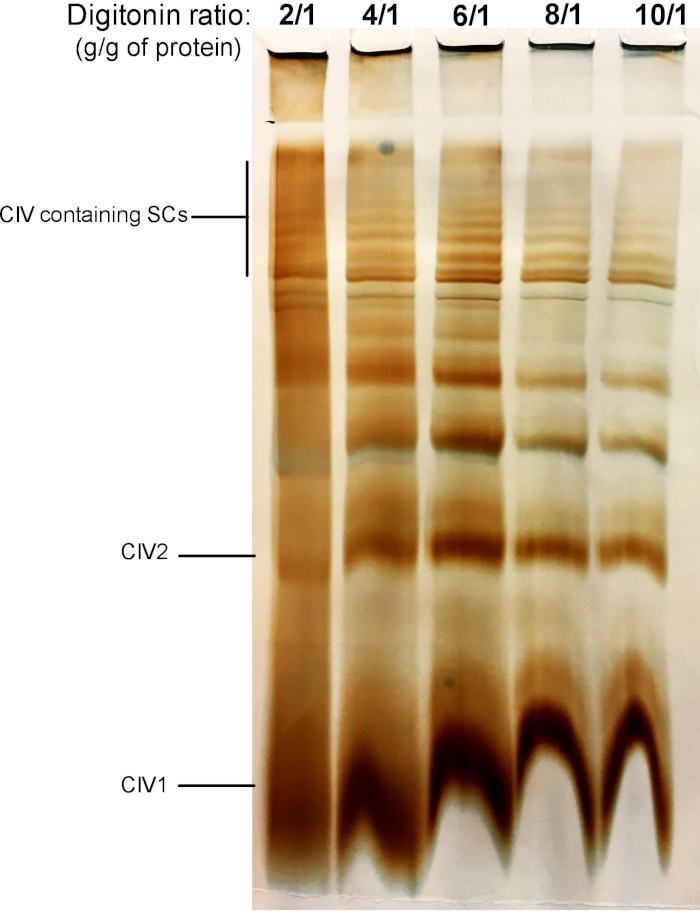
Figura 2: titulación Digitonin para extraer supercomplejos de las mitocondrias hepáticas frescas del ratón. Este ejemplo muestra alícuas de las mitocondrias hepáticas del ratón, aisladas de un animal que fue tratada con cantidades crecientes de digitonin para extraer supercomplejos respiratorios. Las muestras fueron resueltas entonces por la página híbrida CN/BN, y se determinó la actividad en gel de CIV. CIV1: monómeros complejos IV; CIV2: dímeros complejos IV; SC: supercomplejos. Por favor, haga clic aquí para ver una versión más grande de esta figura.
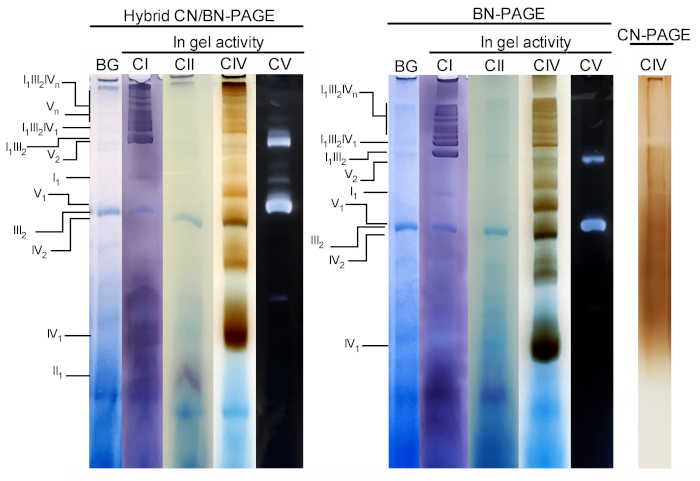
Figura 3: actividad en gel de los complejos OXPHOS después de CN/BN-Page híbrido, BN-page o CN-Page. Las mitocondrias hepáticas aisladas de un ratón fueron tratadas con digitonina (proporción 4 g/g de digotonina/proteína) para extraer supercomplejos respiratorios. Las alícuas de esta muestra se cargaron en varios pozos en tres geles distintos y se sometan a CN/BN-PAGE, BN-PAGE o CN-PAGE. Cada carril replicante dentro de cada gel fue cortado e inmediatamente utilizado para los ensayos de actividad en gel (etiquetados como CI, CII, CIV y CV). Se usó un carril como control para mostrar el fondo (etiquetado BG) manchado con Coomassie Blue. Los complejos de OXPHOS y los conjuntos supramoleculares se identifican utilizando la nomenclatura estándar, con números en índices que indican la estequiometría molecular de cada complejo de OXPHOS. Cabe señalar que la posición de los conjuntos supramoleculares que contienen CIII se basa en la inmunodetección, ya que la actividad en gel para el CIII no se realizó en este experimento en particular. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis de inmunoblot de los complejos OXPHOS después de CN/BN-Page híbrido o BN-Page. Las réplicas de los experimentos descritos en la leyenda de la figura 3 fueron electro-transferidas en una sola membrana. Después de la transferencia, los carriles individuales fueron cortados e incubados con anticuerpos específicos reconociendo CI, CII, CIII, CIV y CV. los complejos OXPHOS y los conjuntos supramoleculares se identifican utilizando la nomenclatura estándar, con números en índices que indican la estequiometría molecular de cada complejo de OXPHOS. Por favor, haga clic aquí para ver una versión más grande de esta figura.
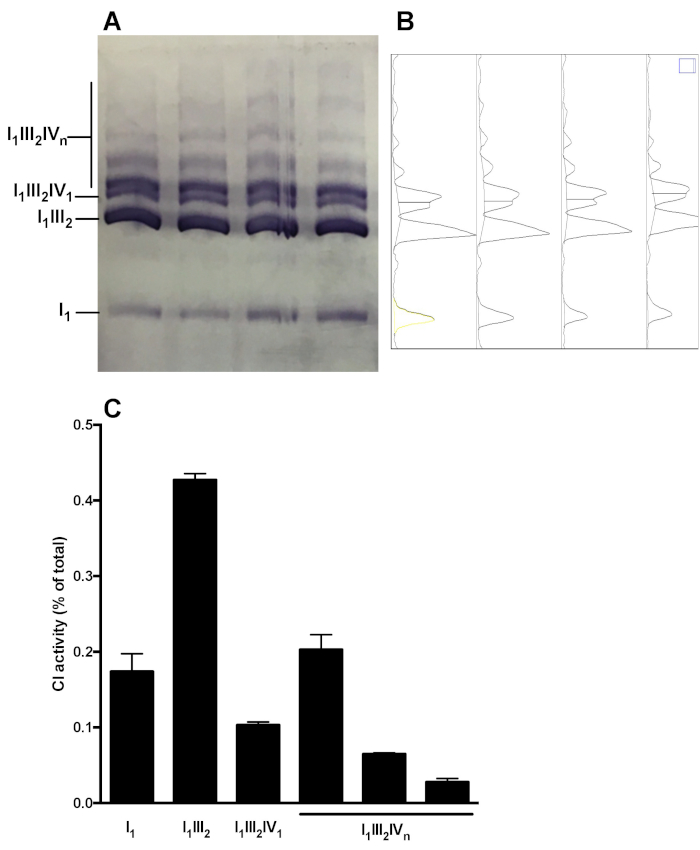
Figura 5: cuantificación de la distribución de CI en ensamblajes monoméricos y supramoleculares. (A) actividad in-gel CI determinada después de CN/BN-página híbrida de extractos de mitocondria SC en el hígado obtenidos a partir de 4 ratones. (B) densitogramas obtenidos utilizando la herramienta de análisis de gel de ImageJ mostrando picos distintos correspondientes a los monómeros CI (i1) y a varios complejos supramoleculares que contienen CI (i1III2, i1III2IV1 , e I1III2IVn). (C) cuantificación de la distribución relativa de la actividad C1. Los datos representan la media y SEM de los 4 ratones. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Relación digitonina/proteína (g/g) | 2 g/g | 4 g/g | 6 g/g | 8 g/g |
| Volumen del búfer de extracción (μL) | 400 | 300 | 200 | 100 |
| Volumen de 10% digitonin de stock (μL) | 100 | 200 | 300 | 400 |
| Volumen total de búfer de extracción (μL) | 500 | 500 | 500 | 500 |
Tabla 1: volúmenes requeridos para extraer SCs de 5 mg de proteínas mitocondriales utilizando diversas proporciones de digitonina/proteína.
| complejo habitacional | Concentración final |
| EDTA, pH 7,5 | 1 mM |
| HEPES | 30 mM |
| Acetato de potasio | 150 mM |
| Glicerol | 12 |
| 6-ácido aminocaproico | 2 mM |
Tabla 2: tampón de extracción SC (concentraciones finales). Mantener a 4 ° c durante un máximo de 3 meses.
| complejo habitacional | Concentración final |
| 3x tampón de gel: Alícuota y mantener a-20 ° c, pH 7,5 | |
| Imidazol/HCl pH-7,0 | 75 mM |
| 6-ácido aminocaproico | 1.5m |
| Tampón de acrilamida: Alícuota y mantener a-20 ° c | |
| Acrilamida | 99,5% |
| Bis-acrilamida | 3 |
Tabla 3: buffers de stock de gel.
| Para 2 geles: | 4% (60 mL) | 12% (60 mL) | Apilado (4%) (25 mL) |
| 3X gel buffer | 19,8 mL | 19,8 mL | 8,25 mL |
| Tampón de acrilamida | 4,8 mL | 14,4 mL | 2 mL |
| H2O | 35 mL | 13,1 mL | 14,6 mL |
| Glicerol | - | 12 mL | - |
| APS 10% | 360 μL | 60 μL | 150 μL |
| Temed extraída | 24 μL | 12 μL | 10 μL |
Tabla 4:4% – 12% gel degradado.
| complejo habitacional | Concentración final |
| Tampón de ánodo: mantener a 4 ° c, pH 7,5 | |
| Imidazol | 25 mM |
| Tampón de cátodo: mantener a 4 ° c, pH 7,5 | |
| Tricine | 50 mM |
| Imidazol | 7,5 mM |
| Con o sin azul de Coomassie (G250) | 0,022% |
Tabla 5: tampones electroforesis.
| complejo habitacional | Concentración final |
| Complejo I actividad tampón: preparar fresco en 5 mM TRIS-HCl pH 7,4 | |
| Nitrotetrazolium Blue | 3 mM |
| Nadh | 14 mM |
| Complejo II actividad tampón: preparar fresco en 5 mM TRIS-HCl pH 7,4 | |
| Succinato | 20 mM |
| Pmsf | 0,2 mM |
| Nitrotetrazolium Blue | 3 mM |
| Complejo IV actividad tampón: preparar fresco en 50 mM na-fosfato pH 7,2 | |
| Citocromo C | 0,05 mM |
| Diaminobenzidina | 2,3 mM |
| ATPsynthase buffer de actividad: preparar fresco en agua, ajustar el pH a 8 con KOH | |
| Glicina | 50 mM |
| MgCl2 | 5 mM |
| HEPES | 50 mM |
| CaCl2 | 30 mM |
| Atp | 5 mM |
Tabla 6: búferes de ensayo de actividad en gel.
| complejo habitacional | Concentración final |
| Búfer de transferencia | |
| Tris base | 25 mM |
| Glicina | 192 mM |
| Sds | 4 |
| Metanol | 20 |
| TBST | |
| Tris base | 20 mM |
| Nacl | 137 mM |
| Tween 20 | 0,1% |
Tabla 7: búferes de Inmunobloteo.
| complejo | Subunidad | clon |
| Me | NDUFA9 | 20C11B11B11 |
| Ii | SDHA | 2E3GC12FB2AE2 |
| Iii | UQCRC2 | 13G12AF12BB11 |
| Iv | COX4 | 1D6E1A8 |
| V | ATPB | 3D5 |
Tabla 8: anticuerpos utilizados para la inmunobloteo para detectar la cadena respiratoria SC. Consulte la tabla de materiales para empresas y números de lote.
Discusión
Los supercomplejos mitocondriales están siendo estudiados activamente para dilucidar su papel fisiológico, y su importancia en la patogénesis de numerosas enfermedades humanas, ya sean adquiridas o enfermedades mitocondriales genéticas3,7 , 9 , 10 , 11 , 12 , 13 , 14. a fin de obtener resultados fiables, es necesario tener en cuenta varios aspectos. Este protocolo ha sido probado con las mitocondrias hepáticas del ratón, las mitocondrias del músculo esquelético del ratón (resultados no mostrados), las mitocondrias de corazón de rata, y las mitocondrias de fibroblastos humanos (resultados no mostrados), pero sin duda podrían ser adaptados a otras fuentes de aislados Mitocondrias. El método combina óptimamente diversos aspectos de los protocolos BN y CN-Page, que permiten reducir al mínimo la exposición a los detergentes y a los compuestos aniónicos en comparación con los protocolos publicados20,27,28.
Preparación de muestras
La preparación de muestras representa un paso crucial para la separación exitosa de SCs. la composición del tampón debe seleccionarse cuidadosamente para lograr una solubilización adecuada de las proteínas y de los conjuntos de proteínas, preservando al mismo tiempo lo más posible su funcional y la integridad estructural. La fuerza iónica y el pH del tampón de extracción son dos factores importantes a tener en cuenta. Las concentraciones de sal que son demasiado bajas (< 50 mM K-acetato o NaCl) resultará en una solubilización deficiente de las proteínas en presencia de detergentes no iónicos, mientras que las concentraciones de sal por encima de 500 mM promoverán el apilamiento/agregación de proteínas, y la precipitación de CB y proteínas29. Por lo tanto, los SCs deben extraerse utilizando buffers a una fuerza iónica casi fisiológica. Con respecto al pH, se recomienda el uso de un pH fisiológico cercano.
El tipo de detergente y la relación detergente/proteína también son fundamentales para una extracción óptima de SC. Para la preservación máxima de SCs nativos, se prefiere la digitonin26. Como se muestra en el presente Protocolo y otros métodos publicados23,30,31,32, este detergente suave preserva la composición Supramolecular de múltiples asambleas de SC, y el dimérico y estructura oligomérica de ATPsynthase (figura 3 y figura 4). La titulación de las muestras de interés con varias cantidades de digitonina es fundamental para identificar las condiciones que permiten una solubilización óptima, preservando al mismo tiempo la actividad enzimática y las interacciones fisiológicas de las proteínas. La titulación debe realizarse con ratios que oscilan entre 2 y 8 g/g26. Los resultados óptimos para el hígado, el músculo esquelético y las mitocondrias cardíacas se obtienen respectivamente con 4, 5 y 6 g de proteína digitonina/g. Cabe señalar que la digitonin puede sustituirse por Triton X-100, que en condiciones óptimas da como resultado una migración similar y una composición SC como las observadas con digitonin2. Sin embargo, este detergente debe utilizarse con precaución, ya que un aumento relativamente pequeño de la relación entre el detergente y la proteína (p. ej., de 1 a 1,5 g/g) puede resultar en una disociación completa de los conjuntos SCs2, lo que puede dar lugar a inconsistencias experimentales. Después de la extracción, las muestras se complementan tradicionalmente con Coomassie azul para dar a las proteínas una carga cuando se aplica al gel, excepto para la tradicional CN-página20,26. Con el fin de minimizar la exposición a proteínas al azul de Coomassie y la posible disociación de las proteínas labiles, las muestras no se complementan con el azul de Coomassie en este protocolo.
Electroforesis
Tanto CN-PAGE como BN-PAGE se han utilizado para estudiar complejos de OXPHOS mitocondriales, cada uno de ellos con distintas ventajas y limitaciones. Las condiciones más leves utilizadas en CN-PAGE (principalmente la ausencia de CB, que tiene un efecto de detergente), permite una mejor preservación de la actividad en gel de la sintasa de ATP, y limita la disociación de las proteínas labiles en SCs de alto peso molecular y ATP sintasa Asambleas26. Sin embargo, la ausencia del colorante aniónico CB en el extracto proteico y los tampones de electroforesis hace que las proteínas migren en base a su carga intrínseca y punto isoeléctrico, lo que reduce la movilidad electroforética de las proteínas dentro del gel26. Además, en ausencia de CB, las proteínas con una carga negativa insuficiente tienden a agregar, reduciendo así la resolución de los complejos proteicos en el gel20,26. Para eludir estas limitaciones, la llamada CN-PAGE de alta resolución ha sido desarrollada por Wittig y Schragger20. En este protocolo, se añaden desoxicolato sódico (DOC) y varios detergentes leves no iónicos (DDM, Triton X100) al tampón cátodo para mantener las proteínas de membrana solubilizadas e imponer un cambio de carga negativo en las proteínas, lo que resulta en una mejora considerable de la resolución20.
Una característica distintiva del actual protocolo híbrido CN/BN es que se puede alcanzar una resolución comparable sin estos detergentes. La adición momentánea de CB al tampón de cátodo al comienzo de la electroforesis es suficiente para limitar la agregación de proteínas y mejorar la movilidad en el gel (figura 3 y figura 4). Como resultado, esta técnica híbrida permite una excelente resolución de conjuntos de SC diferentes y muy baja o ninguna exposición a los detergentes. La presencia de bajas cantidades de CB también permite una mejor preservación de la actividad de CV, la preservación mejorada de conjuntos de CV diméricos y oligoméricos (figura 3 y Wittig y schägger 200526), y una reducción del ruido de fondo azul que puede obstaculizar la cuantificación de las actividades en gel, particularmente para CII y CIV (figura 2). Por otra parte, la ausencia de CB en el extracto proteico limita la alteración de las interacciones de las proteínas labiles dentro de SCs. Por ejemplo, la asociación física de la ATP sintasa con ANT para formar el synthasome 33 o con Cyclophilin-D para regular la apertura de ptp 34 se ven mejor en ausencia de CB. La exposición momentánea a CB durante la electroforesis solo puede, por lo tanto, ser útil para revelar nuevas interacciones de proteínas dentro de SCs. en general, este protocolo híbrido CN/BN-PAGE permite combinar mediciones precisas y rápidas en la actividad del gel con análisis técnicas que implican electroforesis 2D, inmunodetección y/o proteómica para el análisis avanzado de SCs. Cabe señalar que con el creciente interés por SCs, un número creciente de estudios utilizan pequeños geles de 10 x 10 cm para la página nativa. Si bien este enfoque puede ser suficiente para identificar los cambios brutos en las Asambleas de la abundancia SC, la menor capacidad de separación de los geles pequeños se limita probablemente a resolver reordenamientos sutiles o a cortar bandas distintas para el análisis proteómico. Además, varios estudios que utilizan geles más pequeños han reportado que el respirasoma migra al mismo tamaño que el dímero ATPsynthase, lo que dificulta la disociación de22. Por lo tanto, el uso de geles grandes debe ser favorecido.
Divulgaciones
ninguna
Agradecimientos
A los autores les gustaría agradecer a Jenna Rossi por su asistencia técnica, y al Dr. Mireille Khacho, al Dr. David Patten y al Dr. Ujval Anil Kumar por su útil discusión mientras desarrollaba este método. Esta obra fue financiada por los institutos canadienses de investigación sanitaria (CIHR) y el Consejo Nacional de Ciencias e ingeniería de Canadá (NSERC). AC es galardonado con el Premio de doctorado-Frederick Banting y Charles Best Canada Graduate becas (CIHR).
Materiales
| Name | Company | Catalog Number | Comments |
| 3,3'-Diaminobenzidine tetra-hydrochloride hydrate | Sigma | D5637 | |
| 6-amino caproic acid | sigma | A2504 | |
| Acrylamide | Sigma | A3553 | |
| Adenosine 5'-triphosphate disodium salt hydrate | sigma | A3377 | |
| Anti-ATPB antibody [3D5] - Mitochondrial Marker | Abcam | ab14730 | Lot number GR3174539-12, RRID AB_301438 |
| Anti-SDHA antibody [2E3GC12FB2AE2] | Abcam | ab14715 | Lot number GR3235943-1, RRID AB_301433 |
| Anti-UQCRC2 antibody [13G12AF12BB11] | Abcam | ab14745 | Lot number GR304308-3, RRID AB_2213640 |
| Bis N,N'-Methylene-Bis-Acrylamide | Biorad | 1610201 | |
| Brilliant Blue G | Sigma | 27815 | |
| COX4 Monoclonal Antibody (1D6E1A8) | Invitrogen | 459600 | Lot number TI2637158, RRID AB_2532240 |
| Cytochrome c from equine heart | sigma | C7752 | |
| Digitonin | Sigma | D141 | |
| Fisherbrand FH100M Multichannel Peristaltic Pumps | Thermo Fisher | 13-310-660 | |
| Imidazole | Sigma | I0250 | |
| Inner Glass Plates. Pkg of 2, 20 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with outer plate | Biorad | 1651823 | |
| Model 485 Gradient Former. 40-175 ml acrylamide gradient former, includes valve stem and tubing kit, for use with Mini-PROTEAN multi-casting chamber systems | Biorad | 1654120 | |
| NDUFA9 Monoclonal Antibody (20C11B11B11) | Invitrogen | 459100 | Lot number TD2536591, RRID AB_2532223 |
| Nitrotetrazolium Blue chloride | Sigma | N6639 | |
| Outer Glass Plates. Pkg of 2, 22.3 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with inner plate | Biorad | 1651824 | |
| Phenylmethanesulfonyl floride | Sigma | P7626 | |
| Powerpack 1000 | Biorad | Serial Number 286BR 07171 | |
| PROTEAN II Sandwich Clamps. Pkg of 2, clamps for running gels, for 20 cm PROTEAN II xi electrophoresis cell, 1 left and 1 right | Biorad | 1651902 | |
| PROTEAN II xi Cell. Large format vertical electrophoresis cell, 16 x 20 cm gel size, 4 gel capacity, spacers and combs | Biorad | 1651811 | |
| PROTEAN II xi Comb. Pkg of 1, 15-well, 1.5 mm, comb for PROTEAN II xi electrophoresis cell | Biorad | 1651873 | |
| PROTEAN II xi Multi-Gel Casting Chamber. Multi-gel casting chamber, 20 x 20 cm gel size, for up to ten 1.5 mm thick gels, includes sealing plate, gasket, separation sheets, acrylic blocks, PROTEAN II XL alignment cards | Biorad | 1652025 | |
| PROTEAN II xi Spacers. Pkg of 4, 1.5 mm, spacers for 20 cm PROTEAN II xi electrophoresis cell | Biorad | 1651849 | |
| SCIENCEWARE Utility Bags (10 x 12") 4 mil, Bel-Art, Box of 100 | VWR | 11215-388 | |
| Thick Blot Paper. Pkg of 25 sheets, 15 x 20 cm, absorbent filter paper, for use with Trans-Blot cassette | Biorad | 1703956 | |
| Trans-Blot Cell With Plate Electrodes and Super Cooling Coil. Transfer cell and cooling coil (#170-3912), includes 2 gel holder cassettes, buffer tank, lid with cables, fiber pads, 1 pack blot paper | Biorad | 1703939 |
Referencias
- Shagger, H. Respiratory Chain Supercomplexes. IUBMB Life. 52 (3-5), 119-128 (2001).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular Cell. 32 (4), 529-539 (2008).
- Greggio, C., et al. Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle. Cell Metabolism. 25 (2), 301-311 (2017).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. Journal of Biological Chemistry. 276 (41), 37861-37867 (2001).
- Milenkovic, D., Blaza, J. N., Larsson, N. G., Hirst, J. The Enigma of the Respiratory Chain Supercomplex. Cell Metabolism. 25 (4), 765-776 (2017).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochimica et Biophysica Acta. 1837 (4), 444-450 (2014).
- Vartak, R., Porras, C. A., Bai, Y. Respiratory supercomplexes: structure, function and assembly. Protein Cell. 4 (8), 582-590 (2013).
- Lapuente-Brun, E., et al. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science. 340 (6140), 1567-1570 (2013).
- Lazarou, M., Smith, S. M., Thorburn, D. R., Ryan, M. T., McKenzie, M. Assembly of nuclear DNA-encoded subunits into mitochondrial complex IV, and their preferential integration into supercomplex forms in patient mitochondria. The FEBS Journal. 276 (22), 6701-6713 (2009).
- Sun, D., Li, B., Qiu, R., Fang, H., Lyu, J. Cell Type-Specific Modulation of Respiratory Chain Supercomplex Organization. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Aurelio, M., Gajewski, C. D., Lenaz, G., Manfredi, G. Respiratory chain supercomplexes set the threshold for respiration defects in human mtDNA mutant cybrids. Human Molecular Genetics. 15 (13), 2157-2169 (2006).
- Antoun, G., et al. Impaired mitochondrial oxidative phosphorylation and supercomplex assembly in rectus abdominis muscle of diabetic obese individuals. Diabetologia. 58 (12), 2861-2866 (2015).
- Kanaan, G. N., Patten, D. A., Redpath, C. J., Harper, M. -. E. Atrial Fibrillation Is Associated With Impaired Atrial Mitochondrial Energetics and Supercomplex Formation in Adults With Type 2 Diabetes. Canadian Journal of Diabetes. , (2018).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochimica et Biophysica Acta. 1862 (4), 741-753 (2016).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial Respiratory Chain Supercomplexes Are Destabilized in Barth Syndrome Patients. Journal of Molecular Biology. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovascular Research. 80 (1), 30-39 (2008).
- Jang, S., et al. Elucidating Mitochondrial Electron Transport Chain Supercomplexes in the Heart During Ischemia-Reperfusion. Antioxidants & Redox Signaling. 27 (1), 57-69 (2017).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Experimental Gerontology. 45 (7), 563-572 (2010).
- Krause, F. Detection and analysis of protein-protein interactions in organellar and prokaryotic proteomes by native gel electrophoresis: (Membrane) protein complexes and supercomplexes. Electrophoresis. 27 (13), 2759-2781 (2006).
- Wittig, I., Karas, M., Schagger, H. High Resolution Clear Native Electrophoresis for In-gel Functional Assays and Fluorescence Studies of Membrane Protein Complexes. Molecular Cell Proteomics. 6, 1215-1225 (2007).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Jang, S., Javadov, S. Current Challenges in Elucidating Respiratory Supercomplexes in Mitochondria: Methodological Obstacles. Frontiers in Physiology. 9, 238-238 (2018).
- Cuillerier, A., et al. Loss of hepatic LRPPRC alters mitochondrial bioenergetics, regulation of permeability transition and trans-membrane ROS diffusion. Human Molecular Genetics. 26 (16), 3186-3201 (2017).
- Pallotti, F., Lenaz, G. . Methods in Cell Biology. 80, 3-44 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nature Protocols. 4, 1582 (2009).
- Wittig, I., Schägger, H. Advantages and limitations of clear-native PAGE. PROTEOMICS. 5 (17), 4338-4346 (2005).
- Jha, P., Wang, X., Auwerx, J. Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Beutner, G., Porter, G. A. Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution. Journal of Visualized Experiments. (124), e55738 (2017).
- Von Hagen, J. . Proteomics Sample Preperation. , 485 (2008).
- Couoh-Cardel, S. J., Uribe-Carvajal, S., Wilkens, S., García-Trejo, J. J. Structure of dimeric F1F0-ATP synthase. The Journal of Biological Chemistry. 285 (47), 36447-36455 (2010).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Wittig, I., Schägger, H. Structural organization of mitochondrial ATP synthase. Biochimica et Biophysica Acta - Bioenergetics. 1777 (7), 592-598 (2008).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proceedings of the National Academy of Sciences of the United Stated of America. 110 (15), 5887 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados