Method Article
Caratteristiche di imaging della malattia polmonare interstiziale associata alla sclerosi sistemica
In questo articolo
Riepilogo
Qui presentiamo raccomandazioni pratiche per l'esecuzione di tomografia computerizzata ad alta risoluzione toracica toracica per la diagnosi e la valutazione della malattia polmonare interstiziale correlata alla sclerosi sistemica.
Abstract
La diagnosi precoce della malattia polmonare interstiziale correlata alla sclerosi sistemica (SSc-ILD) è importante per consentire la somministrazione di trattamenti con un ritardo minimo. Tuttavia, la diagnosi SSc-ILD è complessa perché i sintomi chiave non sono specifici. La tomografia computerizzata ad alta risoluzione (HRCT) del torace è riconosciuta come metodo di imaging sensibile per la diagnosi e la valutazione di SSc-ILD. L'esposizione dei pazienti alle radiazioni ionizzanti può essere considerata come una limitazione, anche se possono essere adottate misure metodologiche per moderare questo. Presentiamo raccomandazioni pratiche per l'esecuzione di scansioni HRCT e l'interpretazione dei risultati. Le caratteristiche principali di SSc-ILD su HRCT includono un modello di polmonite interstiziale non specifica (NSIP) con opacità periferiche in vetro terra e una bronchiectasi di trazione estesa. Nonostante le somiglianze tra SSc-ILD e fibrosi polmonare idiopatica (IPF), HRCT può essere utilizzato per distinguere tra queste condizioni: in SSc-ILD rispetto all'IPF, c'è una maggiore percentuale di opacità del vetro del suolo e la fibrosi è meno grossolana. Un esofago dilatato, pieno d'aria con diametro >10 mm, suggestivo di dismioturazione esofagea è comunemente visto in SSc-ILD. La dimensione dell'arteria polmonare maggiore dell'aorta ascendente adiacente suggerisce un'ipertensione polmonare coesistente. I noduli devono essere monitorati a causa dell'aumento del rischio di cancro ai polmoni. Una grande quantità di malattia sulle Risorse Umane (-20%) o un alto punteggio di fibrosi suggerisce un aumento del rischio di mortalità. HrCT è fondamentale per diagnosticare SSc-ILD e le valutazioni seriali possono essere utili per monitorare la progressione della malattia o la risposta al trattamento.
Introduzione
La sclerosi sistemica (SSc) è una malattia autoimmune complessa, eterogenea. Può manifestarsi come vasculopatia, fenomeno di Raynaud e fibrosi della pelle e organi interni1. SSc è classificato in sottotipi come segue: cutaneo limitato, cutaneo diffuso, scleroderma sinusoidale (senza coinvolgimento della pelle), e sindrome di sovrapposizione SSc1.
SSc non è ereditato nella moda mendeliana, ma i fattori genetici sembrano influenzare la suscettibilità alla malattia. I tassi di incidenza differiscono tra i gruppi etnici e sono aumentati tra gli individui con una storia familiare della malattia2,3. Sembrano inoltre esistere fattori di rischio ambientale, con un'elevata esposizione alla silice o ai solventi organici che sembrano aumentare l'insorgenza di SSc4. La prevalenza globale di SSc è di circa 1 su 10.0001. Più femmine che maschi sono affetti da SSc, con rapporti femminili/maschili segnalati compresi tra 3:1 e 8:1, e la fascia di età con la più alta incidenza della malattia è 45-54 anni5.
Il polmone è il secondo organo viscerale più comunemente colpito nei pazienti con SSc6. Ci sono due principali manifestazioni polmonari di SSc: malattia polmonare interstiziale (ILD), e ipertensione polmonare7. L'ILD è solitamente fibrotico; si verifica in circa l'80% dei pazienti affetti da SSc ed è più comune nella sclerodermia cutanea che nella forma limitata della malattia1,8. L'ipertensione polmonare può manifestarsi come ipertensione arteriosa polmonare isolata (PAH, che ha una prevalenza del 13-35% in SSc) o ipertensione polmonare risultante da coinvolgimento ventricolare sinistro/disfunzione diastolica o ILD/ipoxemia7. I profili degli anticorpi differiscono tra i pazienti con SSc-ILD e quelli con SSc-PAH. Ad esempio, la presenza di anticorpi anti-Scl-70 è associata a SSc-ILD8, mentre gli anticorpi anticentromeri sono più comuni nei pazienti SSc con PAH rispetto a quelli senza PAH9.
I sintomi di SSc-ILD includono dispnea, tosse, dolore al torace, e limitazione dell'esercizio fisico. ILD è uno dei principali contributori alla morbilità in SSc10,11,12. Di conseguenza, i costi annuali di assistenza sanitaria per tutte le cause sono stati segnalati per essere più elevati nei pazienti con SSc-ILD rispetto a quelli con SSc e senza ILD: 31.285-55.446 dollari contro 18.513–23.268, rispettivamente13.
SSc-ILD è la principale causa di mortalità nei pazienti con SSc, che rappresenta il 30-35% dei decessi in questo gruppo10,14. La sopravvivenza mediana tra i pazienti affetti da SSc-ILD è stata segnalata essere 5-8 anni10,15; in confronto, circa il 76% della popolazione complessiva con SSc sopravvive per più di 10 anni dall'insorgenza della malattia16. I predittori significativi della mortalità in SSc-ILD includono l'età, la capacità vitale forzata (FVC), la capacità di diffazione del polmone per il monossido di carbonio (DLCO), l'estensione della malattia sulla tomografia computerizzata ad alta risoluzione (HRCT), la presenza di ipertensione polmonare e livelli di antigene Kerbs von den Lungren 6 (KL-6)17,18.
La diagnosi precoce è importante per consentire la somministrazione di trattamento con un ritardo minimo e, nei pazienti con fenotipo progressivo, la progressione della malattia può potenzialmente essere rallentata. Tuttavia, la diagnosi SSc-ILD è difficile perché sintomi non specifici di tosse, dispnea e affaticamento possono essere scambiati per altri aspetti di SSc, come la malattia cardiaca e il coinvolgimento muscolo-scheletrico. Le valutazioni per la diagnosi degli ILD includono: presentazione clinica, storia, stato del fumo, funzione polmonare, imaging e, in alcuni casi, biopsia polmonare. L'affermazione della diagnosi SSc-ILD richiede diverse indagini, che sono spesso utilizzate nella combinazione19. Le valutazioni più utilizzate includono test di funzione polmonare e HRCT20,21,22,23. Altri metodi di imaging, come la radiografia toracica e l'imaging che risparmia radiazioni (ad esempio, la risonanza magnetica [RM], gli ultrasuoni polmonari) possono essere impiegati22. I test di funzione polmonare vengono utilizzati per valutare la gravità dell'ILD e monitorarne il corso. Tuttavia, l'uso di test di funzione polmonare da solo è di uso limitato per la diagnosi SSc-ILD24,25. HRCT del torace è visto come il mezzo non invasivo più sensibile per facilitare la diagnosi differenziale di SSc-ILD19. I risultati di base delle HRCT, così come i cambiamenti nel tempo, possono essere utilizzati per prevedere il futuro decorso della malattia polmonare e la potenziale risposta alla terapia26.
L'esposizione alle radiazioni con HRCT è talvolta considerata un fattore limitante per lo screening regolare27,28; limitare il numero di fette è un potenziale metodo per ridurre il rischio di radiazioni, e la dose può anche essere ridotta diminuendo la tensione o l'attuale29,30,31. In alternativa, possono essere presi in considerazione diversi metodi di valutazione. Ad esempio, la risonanza magnetica sembra avere qualche potenziale per la valutazione e il follow-up dei pazienti affetti da ILD22. In uno studio che utilizza immagini di risonanza magnetica ponderate T2 con sincronizzazione respiratoria, HRCT è stata eseguita in parallelo come la valutazione 'gold-standard'; Sensibilità al 100% e 60% di specificità sono stati segnalati con la risonanza magnetica per determinare la presenza di ILD32. Un accordo analogo tra RM e HRCT nel rilevamento e nella categorizzazione dell'ILD è stato riportato in un altro studio33. Nonostante i risultati promettenti, la risonanza magnetica è attualmente una metodologia di ricerca e non è ancora pronta per l'uso clinico generalizzato.
Qui, forniamo una panoramica pratica dell'interpretazione dei risultati dell'imaging, con particolare attenzione alle RISORSE umane, per diagnosticare il coinvolgimento polmonare nella SSc, determinare la prognosi e anche esplorare gli sviluppi futuri che possono migliorare i metodi di imaging e l'interpretazione dei risultati. Le immagini HRCT provenienti da casi rappresentativi sono incluse nel documento.
Protocollo
1. Scansione HRCT
- Eseguire la scansione di acquisizione HRCT volumetrica del torace36. Gli agenti di contrasto non sono necessari36,37.
- Ottenere le seguenti acquisizioni con i parametri illustrati nella tabella 136,37.
- Acquisire una scansione inspiratoria supina (volumetrica) dagli apici polmonari alla base polmonare.
- Acquisire una scansione espiratoria supina (sequenziale con spazi di 10-20 mm) da 2 cm sotto gli apici polmonari alla base polmonare.
- Acquisire un opzionale inspiratorio incline (sequenziale con 10-20 mm di distanza) dalla carina alla base polmonare.
- Dare istruzioni di respirazione al paziente prima di ogni acquisizione36,37. Per una scansione ispiratrice, dite "Prendete un respiro profondo... e lasciatelo fare. Prendi un altro respiro profondo... e lascialo uscire. Fai un altro respiro profondo e trattenere il respiro. Continuate a trattenere il respiro"37.
- Ottenere scansioni ispiratrici a ispirazione completa35,36.
- Utilizzare la collisione più sottile, il tempo di rotazione più breve e il passo più alto per garantire che le immagini senza movimento siano ottenute36 . I parametri di scansione suggeriti sono descritti in dettaglio nella tabella 137.
- Per una qualità ottimale delle scansioni volumetriche, ottenere immagini di sezione sottile (<2 mm) con ricostruzione ad alta risoluzione spaziale35,36.
- Rivedere le scansioni immediatamente dopo l'acquisizione e ripetere se uno dei movimenti artefatto è presente o inadeguata ispirazione si è verificato37.
2. Segnalazione
- Preparare un report interpretativo.
- Condividi il report e le immagini HRCT con il team di assistenza del paziente e aggiungile alle cartelle cliniche del paziente.
Risultati
Diagnosi
Le caratteristiche principali di SSc-ILD su HRCT includono in genere un modello di polmonite interstiziale (NSIP) non specifico con opacità periferico del vetro terra e bronchiectasi di trazione estesa (Figura 1 e Figura 2). Le opacità del vetro terra hanno un'ampia eziologia e sono spesso non specifiche40,41,42. La predominanza centrale o la distribuzione periferica con parsimonia subpleurale sono altamente suggestive di NSIP (Figura 3).
Tipicamente, i modelli ILD nelle immagini HRCT includono reticolazioni con distorsione architettonica con conseguente bronchiectasi di trazione/bronchioletasi (coerente con una forma fibrotica di NSIP). Infatti la bronchiectasi di trazione e la bronchiolectasi di trazione sono spesso le caratteristiche predominanti di SSc-ILD (Figura 4)43. Ulteriori risultati possono includere la fala nido (Figura 5; più comune in forme limitate di SSc), ispessimento settale interlobulare e linee intralobulari, e micronoduli40,44. Il melofarare si riferisce agli spazi aerei cistici raggruppati di diametro tipicamente costante (3-10 mm) con pareti spesse e ben definite31. La bronchiectasi a nido d'ape e di trazione sono caratteristiche chiave della normale polmonite interstiziale (UIP) su HRCT. Anche se questo modello è più comunemente associato alla fibrosi polmonare idiopatica (IPF), il prototipo fibrosing ILD con un fenotipo progressivo, a volte può essere visto in pazienti con SSc-ILD10. Recentemente, diversi segni sono stati identificati in pazienti con ILD correlato alla malattia del tessuto connettivo (incluso SSc-ILD) e il modello UIP su HRCT, ma non in quelli con IPF. Questi sono il segno dritto (cioè l'isolamento della fibrosi alle basi polmonari con tagliente demarcazione nel piano craniocaudale senza estensione sostanziale lungo i margini laterali dei polmoni su immagini coronali), il segno predominante (o esuberante) a nido d'ape (>70% delle porzioni fibrotiche del polmone) e il segno del lobo anteriore superiore (cioè, concentrazione di fibrosi all'interno dell'aspetto anteriore dei lobi superiori, con relativo risparmio degli altri aspetti dei lobi superiori e coinvolgimento concomitante del lobo inferiore)45. Il segno di bordo dritto è stato associato anche con patologia NSIP46, che è il modello principale CT in SSc-ILD10.
L'esofago dilatato pieno d'aria è frequentemente osservato nei pazienti con SSc (Figura 6)47,48,49 e in pazienti con SSc-ILD47,48. Mentre non esiste un limite di età superiore accettato in cui un esofago dilatato non può più aiutare a differenziare SSc-ILD e IPF, un esofago dilatato può essere più difficile da interpretare in pazienti di età superiore 65 a causa della crescente incidenza di disturbi della motilità esofagea. La linfofino mediastinale (solitamente reattiva), in cui l'asse corto del linfonodo supera i 10 mm, è spesso osservata anche nei pazienti con SSc-ILD47,50. La dimensione dell'arteria polmonare maggiore dell'aorta ascendente adiacente suggerisce un'ipertensione polmonare coesistente (Figura 6), anche in pazienti senza malattia polmonare fibrotica51,52,53. Le aree di consolidamento suggeriscono un'infezione sovrapposta, l'aspirazione, l'organizzazione di polmonite, emorragia o malignità. I noduli devono essere monitorati a causa dell'aumento del rischio di cancro ai polmoni in SSc-ILD7; il cancro primario più comune che si verifica nei pazienti con SSc-ILD è l'adenocarcinoma7,54.
SSc-ILD condivide una serie di somiglianze cliniche, meccanicistiche e patologiche con IPF15,55. Tuttavia, alcune caratteristiche radiologiche consentono la differenziazione di questi due ILD15,45. In SSc-ILD, rispetto all'IPF, c'è una maggiore percentuale di opacità del vetro macinato e la fibrosi è meno grossolana. Nei casi di UIP in SSc, il nido d'ape può essere osservato in oltre il 70% del tessuto fibrotico-polmone - l'esuberante segno di nido d'ape56,57. Inoltre, il segno a quattro angoli (noto anche come segno del lobo superiore anteriore) è significativamente più comune in SSc-ILD che in IPF; questo è un modello di infiammazione e/o fibrosi che coinvolge focalmente o sproporzionatamente i lobi superiori anterolaterali bilaterali e i lobi inferiori posterosuperiori58.
Le radiografie toraciche possono inizialmente rilevare ILD; tuttavia, non offrono una risoluzione di contrasto sufficiente per una diagnosi affidabile. Nelle radiografie toraciche di pazienti con SSc-ILD, il modello più frequente è la reticazione predominante basale59. Ulteriori caratteristiche possono includere bronchiectasi visibile, perdita di volume e honeycombing. Come per HRCT, la presenza di un esofago dilatato pieno d'aria può essere utile per sostenere la diagnosi di SSc-ILD47.
Prognosi
Diversi risultati di imaging hanno dimostrato di essere associati alla prognosi in SSc-ILD. Il rischio di mortalità è stato segnalato per essere più elevato nei pazienti con un'estensione della malattia di almeno il 20% sulle HRCT (la sopravvivenza decennale era del 43% contro il 67%, rispettivamente, nei pazienti con malattia che si eleva al di sopra rispetto alla soglia del 20%)60. Allo stesso modo, un alto punteggio di fibrosi sulle HRCT (basato sull'entità della reticolazione e del nido d'ape) è stato associato ad un aumento della mortalità61. I grandi diametri esofagei sono associati a una maggiore gravità ILD e alla diminuzione del DLCO48. La densità polmonare e il diametro dell'arteria polmonare possono essere potenzialmente utilizzati per prevedere il rischio di ipertensione polmonare62. I parametri di TC quantitativi informatizzati potrebbero anche essere sfruttati per identificare il rischio dei pazienti di declino o mortalità della funzione polmonare. Uno studio ha suggerito che l'entità dell'ILD, quantificata da HRCT, potrebbe essere utilizzata per prevedere il calo dell'FVC nell'arco di 12 mesi63. In un altro studio, i parametri quantitativi della TC toracica hanno fornito risultati di rischio di mortalità coerenti con i modelli di previsione clinica64. Nonostante il loro potenziale apparente, i biomarcatori basati sull'imaging sono attualmente meglio considerati a livello di popolazione, poiché la loro utilità clinica nei singoli pazienti non è stata stabilita.
Risposta al trattamento
La mofetilla di ciclofosfamina e micopofilla fornisce un modesto beneficio nei pazienti con SSc-ILD. Nel punto di riferimento Scleroderma Lung Study I, il trattamento con ciclofosfamide ha portato a una progressione più lenta della fibrosi rispetto al placebo65. Più recentemente, lo Studio polmonare Scleroderma II ha riferito un'efficacia simile e una migliore tollerabilità con la mofetil del micophenolato rispetto alla cicloforomide66. Tuttavia, rimane la necessità di migliorare le opzioni di trattamento per i pazienti con SSc-ILD. Le terapie attualmente in fase di studio includono anticorpi monoclonali (ad esempio rituximab, abituzumab), agenti antifibrotici (ad esempio, nintedanib, pirfen), l'inibitore del trombino dettino diretto dal bassoapplicando, l'inibitore proteasoboree e il trapianto di cellule staminali ematopoietiche19,67.
Scansioni HRCT seriali che mostrano la progressione della malattia in un paziente con SSc-ILD
Le valutazioni HRCT eseguite in tempi diversi possono essere utilizzate per studiare la progressione della malattia. Figura 7 Mostra due serie di immagini assiali e coronali torace HRCT scattate a 10 anni di distanza in un paziente con SSc-ILD. Le immagini assiali e coronali iniziali (Figura 7A,B) del torace HRCT mostrano l'opacità e la ricomposizione del vetro terra predominanti al basilare con bronchiectasi a trazione lieve e paromorale subpleurale coerente con NSIP in questo paziente con SSc. Quest'ultima serie di immagini (Figura 7C, D) scattate 10 anni dopo, mostrano una maggiore bronchiolectasi di reticolazione e trazione alle basi polmonari con diminuzione dell'opacità del vetro terra sulle immagini assiali e coronale (Figura 7C,D) della TC toracica coerente con lieve peggioramento della fibrosi polmonare. Le scansioni HRCT seriali possono essere utilizzate anche per monitorare la risposta al trattamento68,69,70; questo è stato dimostrato nello Scleroderma Lung Study II, in cui sono stati utilizzati punteggi diagnostici assistiti da computer basati su scansioni HRCT per confrontare l'efficacia della ciclofosfamide con la mofetilla micophenola in pazienti con SSc-ILD68.
| Fase | Rivelatore Collimazione | Tensione (kV) | Corrente (mam) | Scansione Intervallo | Passo | Rotazione | Corrente tubo Modulazione |
| Inspiratorio supino | Elicico 1,2 mm | 120 (può essere abbassato) | 230 (può essere abbassato) | N/D | 1,0 USD | 0,5 secondi o più veloce | Attivato |
| Espiratorio supino | Assia 2 x 1,0 mm | 120 | 150 | 20 mm | N/D | 1,0 secondi | Attivato |
| Inspiratorio incline | Assia 2 x 1,0 mm | 120 | 150 | 20 mm | N/D | 1,0 secondi | Attivato |
Tabella 1: Parametri di acquisizione della tomografia computerizzata37. N/D - non applicabile.
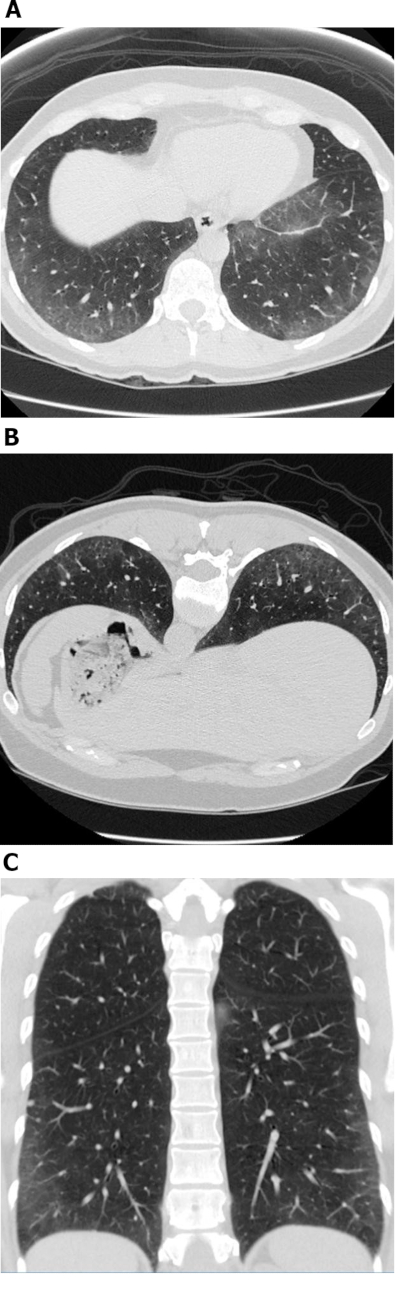
Figura 1: Sclerosi sistemica con un modello cellulare Di Malattia NSIP. Le immagini di tomografia computerizzata ad alta risoluzione axial (A), inclini a( B) e coronale (C) mostrano un'estesa opacità periferica e basale prevalente di vetro terra; queste sono osservazioni tipiche con NSIP. La mancanza di bronchiectasi di trazione è suggestiva di un modello cellulare NSIP di malattia. NSIP - polmonite interstiziale non specifica. Fare clic qui per visualizzare una versione più grande di questa figura.
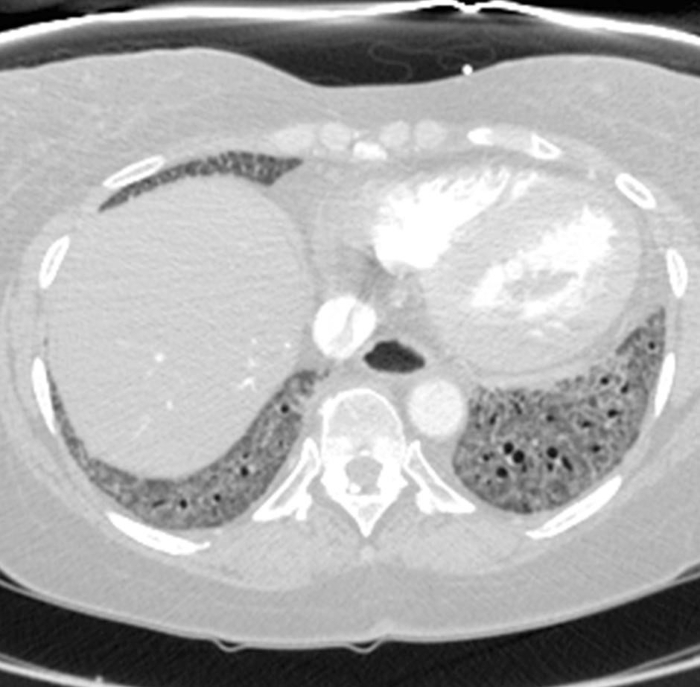
Figura 2: Sclerosi sistemica con un modello di polmonite interstiziale non specifico fibrotico di malattia. L'immagine della tomografia computerizzata assiale mostra ampie opacità basale-vetro predominante con bronchiectasi di trazione associata. In particolare, l'esofago mostra una marcata dilatazione; questo è tipico dello scleroderma. Fare clic qui per visualizzare una versione più grande di questa figura.
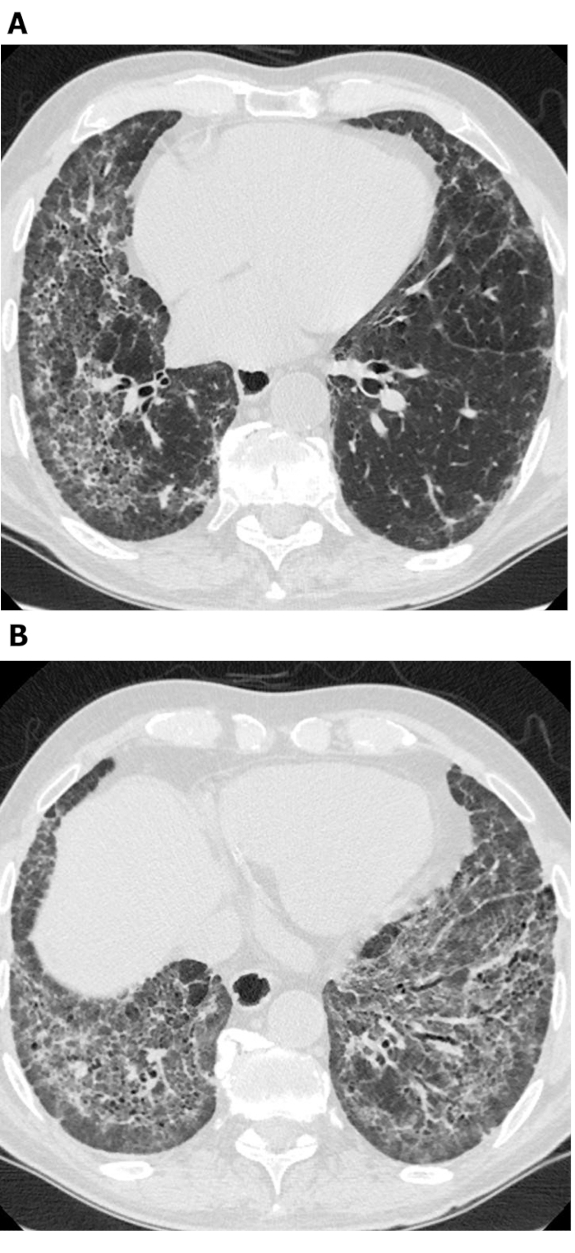
Figura 3: Sclerosi sistemica con modello NSIP fibrotico. Le immagini assiche di tomografia computerizzata ad alta risoluzione (A e B) mostrano ampie opacità di vetro del suolo, reticulation, distorsione architettonica e bronchiectasi di trazione. In particolare, la parsimonia subplore è evidente; questo è tipico di NSIP ed è visto in circa il 50% dei casi. NSIP - polmonite interstiziale non specifica. Fare clic qui per visualizzare una versione più grande di questa figura.
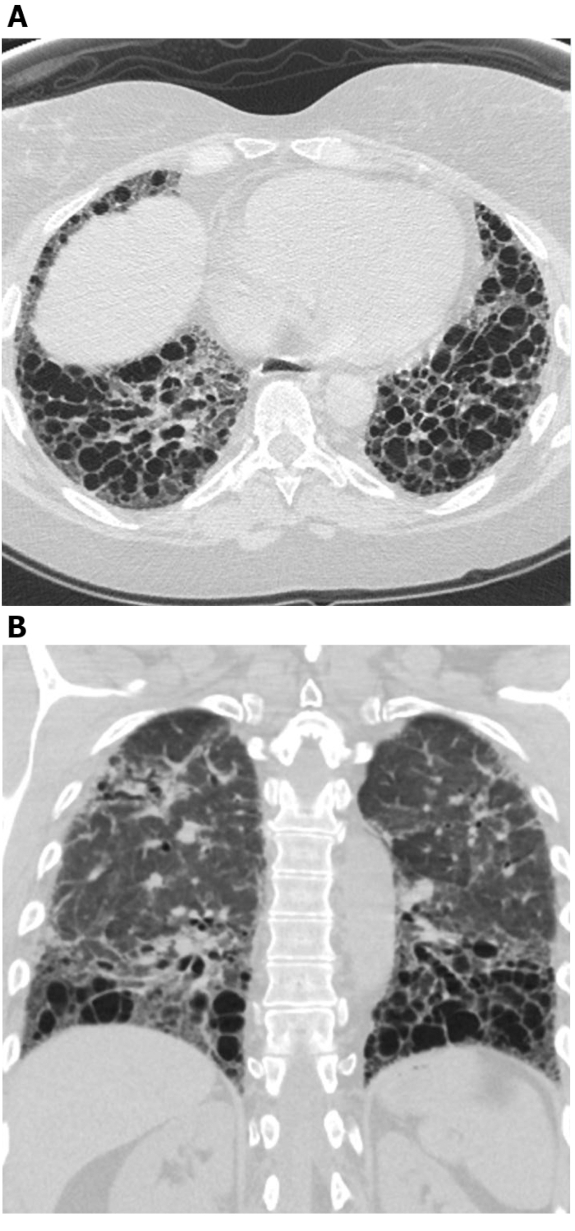
Figura 4: Sclerosi sistemica con bronchiectasi di trazione esuberante. Le immagini di tomografia computerizzata ad alta risoluzione axial (A) e coronale (B) mostrano un'estesa zona polmonare media e inferiore, prevalente dalla bronchiectasi di trazione. Mentre questo può essere scambiato per la meale, le aree cistiche si collegano tra loro e risparmiano l'immediato polmone subploreico; questo è tipico della bronchiectasi. Fare clic qui per visualizzare una versione più grande di questa figura.
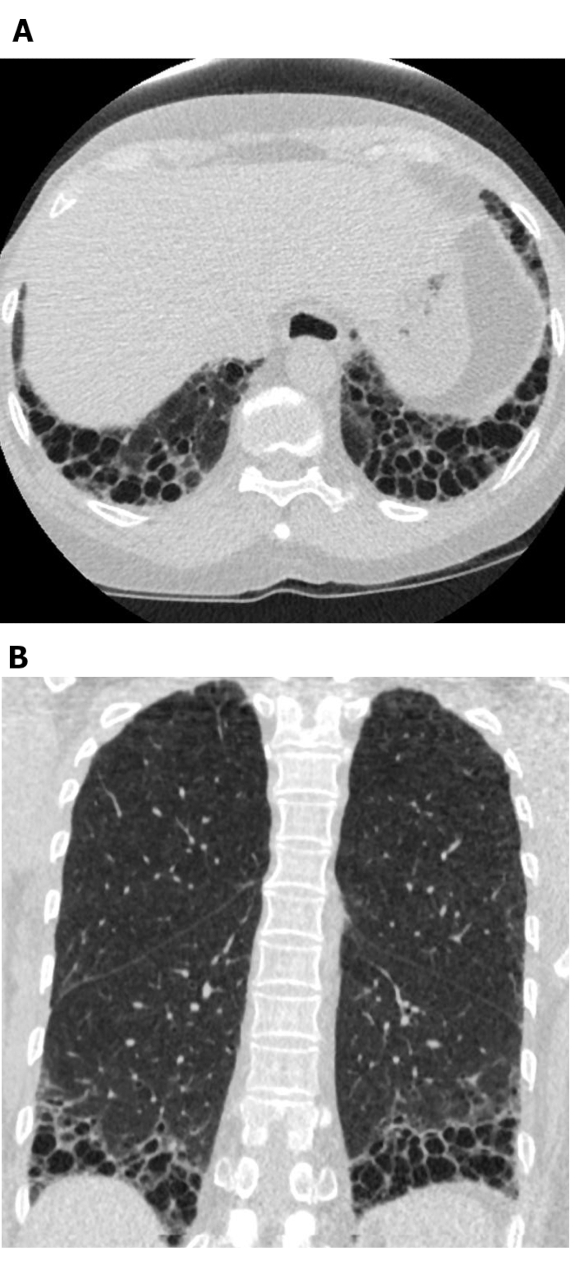
Figura 5: Sclerosi sistemica con un modello UIP di fibrosi polmonare. Le immagini di tomografia computerizzata Axial (A) e coronale (B) mostrano la bronchiectasi a nido d'ape e di trazione predominante a nido d'ape e basale per le periple e basale in linea con il tipico modello UIP della fibrosi polmonare. Si noti l'esofago dilatato (attribuibile allo scleroderma) e il nido d'ape "esuberante" (suggestivo di ILD relativo alla malattia del tessuto connettivo piuttosto che alla fibrosi polmonare idiopatica). UIP - normale polmonite interstiziale. Fare clic qui per visualizzare una versione più grande di questa figura.
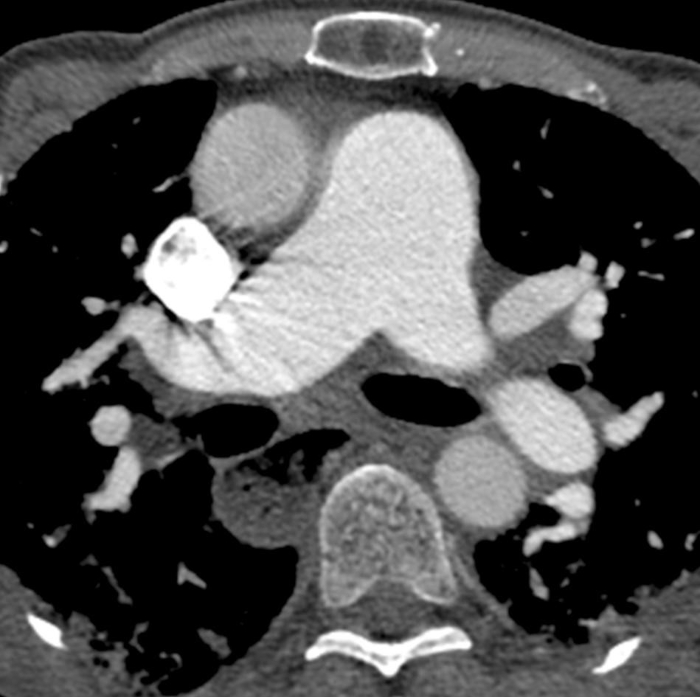
Figura 6: Sclerosi sistemica con ipertensione polmonare ed esofago dilatato. La tomografia computerizzata al torace potenziata dal contrasto mostra un marcato allargamento del tronco polmonare, con una misura più grande rispetto all'aorta ascendente adiacente che suggerisce l'ipertensione polmonare sottostante. L'esofago è marcatamente dilatato; questo è attribuibile allo scleroderma. Fare clic qui per visualizzare una versione più grande di questa figura.
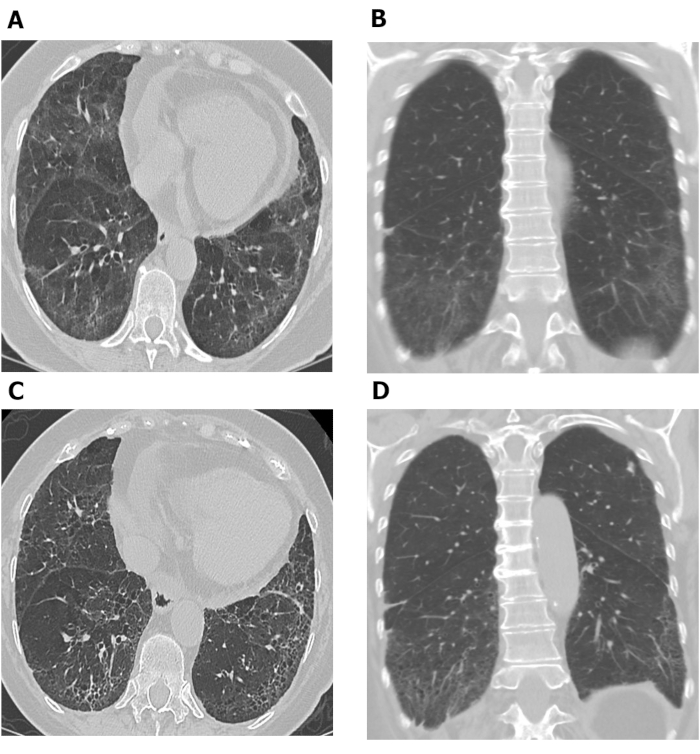
Figura 7: Immagini HRCT toraciche seriali che mostrano la progressione della fibrosi polmonare nel paziente con SSc-ILD. Le immagini assiali (A) e coronale (B) dell'HRCT toracica mostrano l'opacità e la reticolazione basilari predominanti al suolo con bronchiectasi a trazione lieve e subpleuriche, coerentemente con la polmonite interstiziale non specifica in questo paziente con SSc. Dopo 10 anni, una maggiore bronchiolectasi di reticoli e di trazione alle basi polmonari con diminuzione dell'opacità del vetro terra si osserva sulle immagini HRCT toraciche assiali (C)e coronale (D),coerenti con un lieve peggioramento della fibrosi polmonare. HRCT - tomografia computerizzata ad alta risoluzione; SSc-ILD - malattia polmonare interstiziale associata allo scleroderma sistemica. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Sebbene HRCT sia attualmente il metodo di imaging definitivo per la diagnosi e la valutazione di SSc-ILD, utilizza radiazioni ionizzanti ed è relativamente costoso. Le radiografie toraciche possono invece essere intraprese, anche se queste non facilitano la diagnosi differenziale nella stessa misura dell'HRCT, e una normale radiografia toracica non elimina la possibilità di ILD. Forse l'uso migliore delle radiografie toraciche è quello di monitorare la malattia progressiva tra le scansioni HRCT e l'esclusione di malattie complicanti, come la polmonite infettiva, nell'impostazione di un peggioramento acuto dei sintomi.
Una limitazione percepita della HRCT è l'esposizione alle radiazioni. Come descritto in precedenza, nuovi metodi di conduzione delle scansioni TC possono consentire di ridurre l'esposizione alle radiazionidi 31, e inoltre, gli attuali scanner CT forniscono una serie di tecniche avanzate che offrono in futuro la possibilità di una minore esposizione alle radiazioni a livelli di radiografie quasi toraciche. In alternativa, metodi di imaging come la risonanza magnetica o l'ecografia polmonare potrebbero potenzialmente essere utilizzati per evitare di esporre il paziente alle radiazioni in futuro32,71,72,73. Riteniamo che, sebbene esistano considerazioni sui benefici del rischio associati all'utilizzo dell'imaging, i vantaggi della TC nella diagnosi e nella gestione dei pazienti superano di gran lunga i rischi potenziali.
I dati di imaging, in particolare HRCT, forniscono probabilmente le informazioni più importanti per consentire la diagnosi di SSc-ILD. La considerazione dettagliata dei modelli e delle caratteristiche delle scansioni HRCT è di solito sufficiente per distinguere SSc-ILD da altre malattie polmonari, con il vantaggio di evitare la necessità di una procedura di biopsia invasiva.
La valutazione visiva delle scansioni HRCT introduce un grado di soggettività e la possibilità di variabilità tra gli osservatori. I metodi computerizzatati di interpretazione della scansione HRCT sono stati studiati come un possibile approccio per migliorarel'accuratezza 63,74. Ad esempio, gli approcci quantitativi alla valutazione della fibrosi polmonare o dell'entità della malattia possono essere utilizzati per valutare la risposta al trattamento68,70,75. Tuttavia, questi metodi non sono ampiamente utilizzati nella pratica clinica quotidiana in questo momento.
Ci auguriamo che le informazioni presentate in questo manoscritto servano da guida pratica per assistere i medici nell'uso delle scansioni HRCT per diagnosticare SSc-ILD e determinare la prognosi. Metodi migliorati per ottenere immagini e per interpretare le scansioni hanno il potenziale per ridurre l'esposizione dei pazienti alle radiazioni e migliorare l'accuratezza diagnostica/prognostica.
Divulgazioni
Jonathan Chung non dichiara potenziali conflitti di interesse per quanto riguarda la ricerca, la paternità e/o la pubblicazione descritte di questo articolo; Christopher Walker dichiara la ricezione di royalties da Amirsys (Elsevier); e Stephen Hobbs dichiara la ricezione di royalties da Elsevier e Wolters Kluwer Health. La pubblicazione open Access di questo articolo è sponsorizzata da Boehringer Ingelheim Pharmaceuticals, Inc.
L'autore o gli autori soddisfano i criteri di paternità, come raccomandato dal Comitato Internazionale degli Editori del Giornale Medico (ICMJE). Gli autori non hanno ricevuto alcuna compensazione diretta relativa allo sviluppo del video. Il supporto per la scrittura medica per lo script video è stato fornito da Leon Newman, PhD, di GeoMed, una società Ashfield, che è stata contratta e finanziata da Boehringer Ingelheim Pharmaceuticals, Inc. BIPI ha avuto l'opportunità di rivedere il video finale per la precisione medica e scientifica, nonché considerazioni di proprietà intellettuale.
Riconoscimenti
Gli autori soddisfano i criteri di paternità, come raccomandato dal Comitato Internazionale degli Editori del Giornale Medico (ICMJE). Gli autori non hanno ricevuto alcuna compensazione diretta relativa allo sviluppo del manoscritto. L'assistenza alla scrittura è stata fornita da Ken Sutor, BSc, di GeoMed, una società Ashfield, parte di UDG Healthcare plc, che è stata oggetto di contratto e finanziato da Boehringer Ingelheim Pharmaceuticals, Inc. BIPI ha avuto l'opportunità di rivedere il manoscritto per l'accuratezza medica e scientifica, nonché per considerazioni di proprietà intellettuale.
Materiali
| Name | Company | Catalog Number | Comments |
| CT scanners | Philips | NA | Multiple |
Riferimenti
- Denton, C. P., Khanna, D. Systemic sclerosis. Lancet. 390 (10103), 1685-1699 (2017).
- Arnett, F. C., et al. Familial occurrence frequencies and relative risks for systemic sclerosis (scleroderma) in three United States cohorts. Arthritis & Rheumatism. 44 (6), 1359-1362 (2001).
- Barnes, J., Mayes, M. D. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Current Opinion in Rheumatology. 24 (2), 165-170 (2012).
- Marie, I., Gehanno, J. F. Environmental risk factors of systemic sclerosis. Seminars in Immunopathology. 37 (5), 463-473 (2015).
- Silman, A. J. Epidemiology of scleroderma. Annals of the Rheumatic Diseases. 50, 846-853 (1991).
- Scholand, M. B., et al. Interstitial lung disease in systemic sclerosis: diagnosis and management. Rheumatology. 1, 008 (2012).
- Solomon, J. J., et al. Scleroderma lung disease. European Respiratory Review. 22 (127), 6-19 (2013).
- Walker, U. A., et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials And Research group database. Annals of the Rheumatic Diseases. 66 (6), 754-763 (2007).
- Hinchcliff, M., Fischer, A., Schiopu, E., Steen, V. D., Investigators, P. Pulmonary hypertension assessment and recognition of outcomes in scleroderma (PHAROS): baseline characteristics and description of study population. The Journal of Rheumatology. 38 (10), 2172-2179 (2011).
- Giacomelli, R., et al. Interstitial lung disease in systemic sclerosis: current and future treatment. Rheumatology International. 37 (6), 853-863 (2017).
- Sanchez-Cano, D., et al. Interstitial lung disease in systemic sclerosis: data from the spanish scleroderma study group. Rheumatology International. 38 (3), 363-374 (2018).
- Silver, K. C., Silver, R. M. Management of systemic-sclerosis-associated interstitial lung disease. Rheumatic Diseases Clinics of North America. 41 (3), 439-457 (2015).
- Fischer, A., Kong, A. M., Swigris, J. J., Cole, A. L., Raimundo, K. All-cause healthcare costs and mortality in patients with systemic sclerosis with lung involvement. The Journal of Rheumatology. 45 (2), 235-241 (2018).
- Tyndall, A. J., et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Annals of the Rheumatic Diseases. 69 (10), 1809-1815 (2010).
- Herzog, E. L., et al. Review: interstitial lung disease associated with systemic sclerosis and idiopathic pulmonary fibrosis: how similar and distinct. Arthritis & Rheumatology. 66 (8), 1967-1978 (2014).
- Rubio-Rivas, M., Royo, C., Simeon, C. P., Corbella, X., Fonollosa, V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Seminars in Arthritis and Rheumatism. 44 (2), 208-219 (2014).
- Stock, C., et al. Serum KL-6 as a marker of disease progression in SSc-ILD. European Respiratory Journal. 52, (2018).
- Winstone, T. A., et al. Predictors of mortality and progression in scleroderma-associated interstitial lung disease: a systematic review. Chest. 146 (2), 422-436 (2014).
- Khanna, D., et al. Ongoing clinical trials and treatment options for patients with systemic sclerosis-associated interstitial lung disease. Rheumatology (Oxford). 58 (4), 567-579 (2019).
- Behr, J., Furst, D. E. Pulmonary function tests. Rheumatology (Oxford). 47, 65-67 (2008).
- Hax, V., et al. Clinical algorithms for the diagnosis and prognosis of interstitial lung disease in systemic sclerosis. Seminars in Arthritis and Rheumatism. 47 (2), 228-234 (2017).
- Molberg, O., Hoffmann-Vold, A. M. Interstitial lung disease in systemic sclerosis: progress in screening and early diagnosis. Current Opinion in Rheumatology. 28 (6), 613-618 (2016).
- Raghu, G., Goldman, L., Schafer, A. I. Interstital lung disease. Goldman-Cecil Medicine. , 575-588 (2016).
- Showalter, K., et al. Performance of forced vital capacity and lung diffusion cutpoints for associated radiographic interstitial lung disease in systemic sclerosis. The Journal of Rheumatology. 45 (11), 1572-1576 (2018).
- Suliman, Y. A., et al. Brief report: pulmonary function tests: high rate of false-negative results in the early detection and screening of scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 67 (12), 3256-3261 (2015).
- Roth, M. D., et al. Predicting treatment outcomes and responder subsets in scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 63 (9), 2797-2808 (2011).
- Kalra, M. K., Maher, M. M., Rizzo, S., Kanarek, D., Shepard, J. A. Radiation exposure from chest CT: issues and strategies. Journal of Korean Medical Science. 19 (2), 159-166 (2004).
- Siegel, J. A., Pennington, C. W., Sacks, B., Welsh, J. S. The birth of the illegitimate linear no-threshold model: an invalid paradigm for estimating risk following low-dose radiation exposure. American Journal of Clinical Oncology. 41 (2), 173-177 (2018).
- Frauenfelder, T., et al. Screening for interstitial lung disease in systemic sclerosis: performance of high-resolution CT with limited number of slices: a prospective study. Annals of the Rheumatic Diseases. 73 (12), 2069-2073 (2014).
- Kubo, T., et al. Radiation dose reduction in chest CT: a review. American Journal of Roentgenology. 190 (2), 335-343 (2008).
- Nguyen-Kim, T. D. L., et al. The impact of slice-reduced computed tomography on histogram-based densitometry assessment of lung fibrosis in patients with systemic sclerosis. Journal of Thoracic Disease. 10 (4), 2142-2152 (2018).
- Muller, C. S., Warszawiak, D., Paiva, E. D. S., Escuissato, D. L. Pulmonary magnetic resonance imaging is similar to chest tomography in detecting inflammation in patients with systemic sclerosis. Revista Brasileira de Reumatologia English Edition. 57 (5), 419-424 (2017).
- Pinal-Fernandez, I., et al. Fast 1.5 T chest MRI for the assessment of interstitial lung disease extent secondary to systemic sclerosis. Clinical Rheumatology. 35 (9), 2339-2345 (2016).
- Sverzellati, N. Highlights of HRCT imaging in IPF. Respiratory Research. 14, 3 (2013).
- Lynch, D. A., et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. The Lancet Respiratory Medicine. 6 (2), 138-153 (2018).
- Raghu, G., et al. Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 198 (5), 44-68 (2018).
- . Exam: CT thorax for interstitial lung disease Available from: https://www.pulmonaryfibrosis.org/docs/default-source/medical-community-documents/ct-chest-for-ild-protocol.pdf?sfvrsn=0 (2019)
- Doyle, T. J., Hunninghake, G. M., Rosas, I. O. Subclinical interstitial lung disease: why you should care. American Journal of Respiratory and Critical Care Medicine. 185 (11), 1147-1153 (2012).
- Peroni, D. G., Boner, A. L. Atelectasis: mechanisms, diagnosis and management. Paediatric Respiratory Reviews. 1 (3), 274-278 (2000).
- Branley, H. M. Pulmonary fibrosis in systemic sclerosis: diagnosis and management. Respiratory Medicine CME. 3, 10-14 (2010).
- Engeler, C. E., Tashjian, J. H., Trenkner, S. W., Walsh, J. W. Ground-glass opacity of the lung parenchyma: a guide to analysis with high-resolution CT. American Journal of Roentgenology. 160 (2), 249-251 (1993).
- Goldin, J. G., et al. High-resolution CT scan findings in patients with symptomatic scleroderma-related interstitial lung disease. Chest. 134 (2), 358-367 (2008).
- Strollo, D., Goldin, J. Imaging lung disease in systemic sclerosis. Current Rheumatology Reports. 12 (2), 156-161 (2010).
- Pandey, A. K., et al. Significance of various pulmonary and extrapulmonary abnormalities on HRCT of the chest in scleroderma lung. Indian Journal of Radiology and Imaging. 23 (4), 304-307 (2013).
- Chung, J. H., et al. CT Features of the usual interstitial pneumonia pattern: differentiating connective tissue disease-associated interstitial lung disease from idiopathic pulmonary fibrosis. American Journal of Roentgenology. 210 (2), 307-313 (2018).
- Zhan, X., et al. Differentiating usual interstitial pneumonia from nonspecific interstitial pneumonia using high-resolution computed tomography: the "Straight-edge Sign". Journal of Thoracic Imaging. 33 (4), 266-270 (2018).
- Farrokh, D., Abbasi, B., Fallah-Rastegar, Y., Mirfeizi, Z. The extrapulmonary manifestations of systemic sclerosis on chest high resolution computed tomography. Tanaffos. 14 (3), 193-200 (2015).
- Salaffi, F., et al. Relationship between interstitial lung disease and oesophageal dilatation on chest high-resolution computed tomography in patients with systemic sclerosis: a cross-sectional study. La Radiologia Medica. 123 (9), 655-663 (2018).
- Vonk, M. C., et al. Oesophageal dilatation on high-resolution computed tomography scan of the lungs as a sign of scleroderma. Annals of the Rheumatic Diseases. 67 (9), 1317-1321 (2008).
- Chowaniec, M., Skoczynska, M., Sokolik, R., Wiland, P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 56 (4), 249-254 (2018).
- McCall, R. K., Ravenel, J. G., Nietert, P. J., Granath, A., Silver, R. M. Relationship of main pulmonary artery diameter to pulmonary arterial pressure in scleroderma patients with and without interstitial fibrosis. Journal of Computer Assisted Tomography. 38 (2), 163-168 (2014).
- Pandey, A. K., et al. Predictors of pulmonary hypertension on high-resolution computed tomography of the chest in systemic sclerosis: a retrospective analysis. Canadian Association of Radiologists Journal. 61 (5), 291-296 (2010).
- Raymond, T. E., Khabbaza, J. E., Yadav, R., Tonelli, A. R. Significance of main pulmonary artery dilation on imaging studies. Annals of the American Thoracic Society. 11 (10), 1623-1632 (2014).
- Colaci, M., et al. Lung cancer in scleroderma: results from an Italian rheumatologic center and review of the literature. Autoimmunity Reviews. 12 (3), 374-379 (2013).
- Distler, O., et al. Design of a randomised, placebo-controlled clinical trial of nintedanib in patients with systemic sclerosis-associated interstitial lung disease (SENSCIS). Clinical and Experimental Rheumatology. 35 (4), 75-81 (2017).
- Desai, S. R., et al. CT features of lung disease in patients with systemic sclerosis: comparison with idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia. Radiology. 232 (2), 560-567 (2004).
- Mira-Avendano, I., et al. Interstitial lung disease and other pulmonary manifestations in connective tissue diseases. Mayo Clinic Proceedings. 94 (2), 309-325 (2019).
- Walkoff, L., White, D. B., Chung, J. H., Asante, D., Cox, C. W. The four corners sign: a specific imaging feature in differentiating systemic sclerosis-related interstitial lung disease from idiopathic pulmonary fibrosis. Journal of Thoracic Imaging. 33 (3), 197-203 (2018).
- Kotnur, M. R., Suresh, P., Reddy, V. S., Sharma, T., Salim, N. A. Systemic sclerosis with multiple pulmonary manifestations. Journal of Clinical & Diagnostic Research. 10 (6), 16-17 (2016).
- Goh, N. S., et al. Interstitial lung disease in systemic sclerosis: a simple staging system. American Journal of Respiratory and Critical Care Medicine. 177 (11), 1248-1254 (2008).
- Takei, R., et al. Radiographic fibrosis score predicts survival in systemic sclerosis-associated interstitial lung disease. Respirology. 23 (4), 385-391 (2018).
- Bakker, M. E., et al. Lung density and pulmonary artery diameter are predictors of pulmonary hypertension in systemic sclerosis. Journal of Thoracic Imaging. 32 (6), 391-397 (2017).
- Khanna, D., et al. Predictors of lung function decline in scleroderma-related interstitial lung disease based on high-resolution computed tomography: implications for cohort enrichment in systemic sclerosis-associated interstitial lung disease trials. Arthritis Research & Therapy. 17, 372 (2015).
- Ariani, A., et al. Quantitative chest computed tomography is associated with two prediction models of mortality in interstitial lung disease related to systemic sclerosis. Rheumatology (Oxford). 56 (6), 922-927 (2017).
- Goldin, J., et al. Treatment of scleroderma-interstitial lung disease with cyclophosphamide is associated with less progressive fibrosis on serial thoracic high-resolution CT scan than placebo: findings from the scleroderma lung study. Chest. 136 (5), 1333-1340 (2009).
- Tashkin, D. P., et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. The Lancet Respiratory Medicine. 4 (9), 708-719 (2016).
- Distler, O., et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. New England Journal of Medicine. 380, 2518-2528 (2019).
- Cappelli, S., et al. Interstitial lung disease in systemic sclerosis: where do we stand. European Respiratory Review. 24 (137), 411-419 (2015).
- Goldin, J. G., et al. Longitudinal changes in quantitative interstitial lung disease on CT after immunosuppression in the Scleroderma Lung Study II. Annals of the American Thoracic Society. 5 (11), 1286-1295 (2018).
- Wangkaew, S., Euathrongchit, J., Wattanawittawas, P., Kasitanon, N. Correlation of delta high-resolution computed tomography (HRCT) score with delta clinical variables in early systemic sclerosis (SSc) patients. Quantitative Imaging in Medicine and Surgery. 6 (4), 381-390 (2016).
- Kim, H. J., et al. Transitions to different patterns of interstitial lung disease in scleroderma with and without treatment. Annals of the Rheumatic Diseases. 75 (7), 1367-1371 (2016).
- Tardella, M., et al. Ultrasound B-lines in the evaluation of interstitial lung disease in patients with systemic sclerosis: cut-off point definition for the presence of significant pulmonary fibrosis. Medicine (Baltimore). 97 (18), 0566 (2018).
- Hassan, R. I., et al. Lung ultrasound as a screening method for interstitial lung disease in patients with systemic sclerosis. Journal of Clinical Rheumatology. , (2018).
- Wang, Y., Gargani, L., Barskova, T., Furst, D. E., Cerinic, M. M. Usefulness of lung ultrasound B-lines in connective tissue disease-associated interstitial lung disease: a literature review. Arthritis Research & Therapy. 19 (1), 206 (2017).
- Ariani, A., et al. Quantitative CT indexes are significantly associated with exercise oxygen desaturation in interstitial lung disease related to systemic sclerosis. The Clinical Respiratory Journal. 11 (6), 983-989 (2017).
- Kim, H. J., et al. Quantitative texture-based assessment of one-year changes in fibrotic reticular patterns on HRCT in scleroderma lung disease treated with oral cyclophosphamide. European Radiology. 21 (12), 2455-2465 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon