Method Article
İnsan İmmünolojik Sinaps Görüntüleme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol hem immünolojik sinaps oluşumunu hem de sonraki polarize salgı trafiğini immünolojik sinapsa doğru görüntüler. Hücresel konjugates bir süperantijen-darbeli Raji hücre (bir antijen sunan hücre olarak hareket) ve Jurkat klonu (bir efektör yardımcı T lenfosit olarak hareket) arasında kuruldu.
Özet
Yöntemin amacı, bir antijen sunan hücre (APC) ve efektör yardımcı T lenfosit (Th) hücretarafından oluşturulan hücre-hücre çekiminin bir örneği olan immünolojik bir sinaps (IS) oluşturmak ve İd oluşumu ve sonraki kaçakçılık olayları (Hem APC'de hem de Th hücresinde meydana gelmektedir). Bu olaylar eninde sonunda İd'de kutuplaşmış bir salgıya yol açacaktır. Bu protokolde, Jurkat hücreleri Staphylococcus enterotoxin E (GDA)-darbeli Raji hücreleri ile bir hücre sinaps modeli olarak meydan kullanılmıştır, biyolojik gerçekliğe bu deneysel sistemin yakınlığı nedeniyle (Th hücre-APC sinaptik konjugates). Burada sunulan yaklaşım hücreden hücreye çekim, zaman atlamalı edinimi, geniş alan floresan mikroskobu (WFFM) ve ardından görüntü işleme (edinme sonrası dekonvolution) içerir. Bu, görüntülerin sinyal-gürültü oranını (SNR) artırır, zamansal çözünürlüğü artırır, ortaya çıkan sinaptik konjuge birkaç florokrom senkronize edinimi sağlar ve floresan ağartma azaltır. Buna ek olarak, protokol de daha fazla immünoffloresan boyama ve analizler sağlayacak bitiş noktası hücre fiksasyon protokolleri (paraformaldehit, aseton veya metanol) ile eşleşir. Bu protokol aynı zamanda lazer tarama konfokal mikroskopi (LSCM) ve diğer son teknoloji mikroskopi teknikleri ile de uyumludur. Ana bir uyarı olarak, z ekseni boyunca odak düzlemine doğru 90° açıda olan yalnızca T hücre-APC sınırları (IS arabirimleri olarak adlandırılır) düzgün bir şekilde görüntülenebilir ve analiz edilebilir. Z boyutunda ve aşağıdaki görüntü analizlerinde görüntülemeyi basitleştiren diğer deneysel modeller vardır, ancak bu yaklaşımlar Bir APC'nin karmaşık, düzensiz yüzeyini taklit etmez ve İd'deki fizyolojik olmayan etkileşimleri teşvik edebilir. Bu nedenle, burada kullanılan deneysel yaklaşım, İd'de meydana gelen bazı biyolojik karmaşıklıkları çoğaltmak ve yüzleşmek için uygundur.
Giriş
Yöntemin temel amacı, gda süperantijenleri ve efektör Th hücresi ile darbeli bir antijen sunan hücre (APC) tarafından oluşturulan immünolojik sinaps (IS) hücre-hücre konjugatları oluşturmak ve immünolojik sinaps oluşumunun ilk aşamalarına ve sonraki insan ticareti olaylarına (hem APC hem de Th hücresinde meydana gelen) görüntüleri kaydetmektir ve bu da sonunda IS'de kutuplaşmış salgılanmasına yol açacaktır. APC üzerinde MHC-II bağlı antijenlere hücre reseptörü (TCR) bağlanması üzerine T lenfositler tarafından IS kurulması antijen özgü, humoral ve hücresel immün yanıtlar dahil son derece dinamik, biçimlendirilebilir ve kritik bir örnek düzenler1,2. IS, aktin yeniden yapılanma süreci3ile karakterize özel bir supramoleküler aktivasyon kompleksi (SMAC) deseni oluşumu ile tanımlanır. Bir APC ile T lenfositler tarafından IS inşaat üzerine, Is doğru salgı veziküllerin polarizasyon sinaptik boşluğunda polarize salgı ile ilgili gibi görünüyor. Bu odaklanmış makine açıkça T lenfositlerin kritik salgı layıcı etki rollerinin etkinliğini artırmak için mükemmel düzenlenmiş bir stratagem ile bağışıklık sistemi kaynağı gibi görünüyor, seyirci hücrelerinin nonspesifik azaltırken, sitokin-tahkim uyarılması, alakasız hedef hücrelerin öldürülmesi ve aktivasyonkaynaklı hücre ölümü yoluyla apoptotik intihar (AICD)4.
İd'in sonucu hem T lenfositinin hem de APC'nin doğasına göre değişir. Th hücrelerinin sinaptik teması (genellikle CD4+ hücreleri) APC ile antijen gösteren MHC-II ile ilişkili T hücresinin aktivasyonu üretir (sitokin salgısı, proliferasyon, vb) ve, bazı durumlarda, AICD üzerinden apoptoz4. Sitotoksik T lenfositler için (CTLs) (esas olarak CD8 + hücreleri) APC mhc-I ile ilişkili antijen sunan etkileşim, sonuç ön stimülasyon veya antijen ile CTLs farklı. Böylece, APC antijen-MHC-I kompleksleri tanımlayan naif CTLs hedef hücreleri yok etmek ve bölmek için "astarlı" vardır. Astarlı CTLs da hedef hücreleri ile sinaps kurmak (yani, virüsler veya tümör hücreleri tarafından enfekte hücreleri) antijene özgü hücre imha üreten5,6.
İmmünolojik sinaps ekzozomların polarize salgıları ilgili immün yanıtlar dahil araştırma gelişmekte olan ve zorlu bir alandır7. İntralinal veziküller taşıyan multiveziküler cisimlerin (MVB) antijen le TCR stimülasyonu üzerine IS8,9 (Video 1)yönünde polarize ulaşım yaşadıkları gösterilmiştir. Sinaptik membranda bu MVB füzyon onların degranülasyon ve sinaptik yarık8ekzozomlar olarak ILVs salınımını indükler8 ,10. Bu APC11olarak hareket SEE süperantijen kaplı Raji hücreleri ile meydan th-tipi Jurkat hücreleri tarafından oluşturulan IS oluşur , TCR uyarılmış CD4+ lenfoblastlar, ve astarlı CTLs. Bu nedenle Jurkat hücreleri tarafından yapılan sinapslar ekzozomların polarize salgı trafiğini incelemek için değerli bir model oluşturur. Buna ek olarak, soruşturma birkaç on yıl TCR sinyalizasyon içine birçok temel anlayışlar dönüştürülmüş T-hücre hatları ile çalışmalardan geldiğini göstermiştir, ve gerçekten de bu model sistemlerinin en iyi bilinen Jurkat lösemik T-hücre hattı12.
Tam gelişmiş bir İd oluşumu, anerji veya AICD5dışında, astarlı CTLs tarafından naif CTLs aktivasyonu, naif CTLs aktivasyonu veya hedef hücre öldürme de dahil olmak üzere birçok önemli biyolojik sonuçlar üretir. Bu nedenle, salgı iki ana türü vardır T lenfositler tarafından kurulan çok çeşitli sonuç, ama benzer kritik, bağışıklık etkiedici fonksiyonları1,6,13. Bir yandan, astarlanmış sitotoksik T lenfositler (CTLs) IS is doğru litik granüllerin ("sekretin lizozomlar" denir) hızlı polarizasyon (saniye ile birkaç dakika arasında değişen) neden OLUR. Litik granüllerin degranülasyonu pro-apoptotik moleküller olan sinaptik yarık14'eperforin ve granzymes salgısını indükler. Salgılanan perforin ve granzymes daha sonra hedef hücrelerin öldürülmesine neden15,16. CtLs geçici sinapsgeliştirmek, sadece birkaç dakika süren, hedef hücreleri3öldürülür gibi,17. Bu muhtemelen en iyi CTL görev çok sayıda hedef hücrelere mümkün olduğunca çok sayıda ölümcül grev dağıtmak için hızlı ve geçici bir temas gerektirir durum nedeniyle3,17. Buna karşılık, Jurkat hücreleri gibi Th lenfositler kararlı üretmek, uzun süredir IS (kadar 10-30 dk saat), Bu sitokinler uyarıcı hem yönlü ve sürekli salgılayıcı için gerekli gibi görünüyor beri3,17. Sitokinler de salgı vezikülleri ile çevrilidir ve bazıları (il-2, IFN-γ) IS17 ve salgıya polarize ulaşım deneyimi. IS'nin temel özelliklerinden biri, TCR'nin dişli antijen-MHC komplekslerini tanımlaması ve uygun ko-uyarıcı bağlantıların kurulması koşuluyla, Daha güçlü bir etkileşim ve olgun bir IS'nin kurulmasını sağlayıp, Thücresi ileAPC(Video 1)arasında keşif niteliğinde, zayıf ve geçici temasların oluşmasıdır. Hem ilk temasların başlangıcı hem de olgun, tamamen üretken bir IS'nin kurulması doğal olarak stokastik, hızlı ve eşzamanlı süreçler5,18. Ayrıca, hücreden hücreye konjugatların oluşturulmasında az bir frekans vardır19, görüntüleme teknikleri için bir sorun teşkil edebilir (Sonuçlar ve Tartışma bölümlerine bakın).
Mikrotübül organize merkezinin (MTOC) ve T lenfositlerinde salgı granüllerinin polarizasyonunu incelerken bir diğer önemli zorluk da tüm sürecin hızlı (saniye-kaç dakika), özellikle CTL'lerde olmasıdır. Bu olgular göz önüne alındığında, en erken yaklaşımlar APC / hedef hücreleri ve T lenfositler ortaklaşa karıştırılır ve düşük hızlı santrifüj ile yakınsama, hücre-hücre eşleç oluşturma lehine, birkaç dakika kuluçka, sabit ve daha sonra değerlendirildi bir bitiş noktası stratejisi karşı karşıya MTOC ve/veya salgı veziküllerinin IS20'yedoğru taşınması. Bu yaklaşımın iki önemli sınırlaması vardır: canlı kaçakçılık verisi elde edilmiştir ve muhtemelen İd kuruluşunun stokastik karakteri nedeniyle, arka plan MTOC / sekretasyon granülpolarizasyon yüksek düzeyde elde edilmiştir18. Ayrıca, TCR uyarılmış, ilk sinyal olayları (yani, hücre içi kalsiyum yükselir, aktin yeniden yapılanma) ve sekretra vezikül polarizasyonu arasındaki herhangi bir korelasyon araştırmak için sorunludur. Böylece, canlı hücrelerde İd'in uygun şekilde görüntülenmesi için zorunlu hükümler hücreden hücreye eşlegate materyalizasyonu geliştirmek, İd'in neslini senkronize etmek ve mümkünolduğunda tanımlanmış mikroskop XY alanları ve Z pozisyonlarında hücresel konjugaklerin kurulmasını garanti etmek için biraraya gelir. Tüm bu sorunları önlemek için çeşitli stratejiler geliştirilmiştir. Bu yöntemler, yararları ve zayıflıkları açıklamak için bu yazının kapsamı dışındadır. Lütfen bu önemli noktaları1,4,5,21mücadele daha önce yayınlanmış değerlendirmeleri bakın.
Th lenfositler tarafından yapılan IS uzun ömürlü olması ve Durum Th lenfositler MTOC, lenfokin içeren salgı granülleri ve MVB hareket etmek ve IS 22 dock birkaç dakika kadar sürebilir ve IS22 için dock Th-APC burada açıklanan protokolü kullanarak görüntüleme için ideal bir aday yapar.
Protokol
1. Raji Hücrelerine Yapışmak Için Slaytların Hazırlanması
- 8 mikrokuyu bir hazne slaytA (plastik alt hazne kaydırağı) kuyu başına 150 μL (100 μg/mL) ekleyin ve 37 °C'de 30 dakika ile 1 saat arasında kuluçkaya yatırın. Bu yapışma substratı Raji hücrelerinin kuyu dibine (Step 2), Jurkat hücreleri (Step 4) hücreleri ile yaşayan konjugaklerin oluşumunu ve zaman atlamalı mikroskopi yakalama (adım 6) ile bağlanmasını ve daha sonra isteğe bağlı paraformaldehit (PFA) fiksasyonu (adım 7) ile uyumlu olmasını sağlayacaktır.
NOT: Aseton fiksasyonu için, aseton plastik çözünür beri, cam alt oda slaytlar ve poli-L-lizin (20 μg/ mL) fibronektin yerine kullanın. 8 microwell haznesi slayt (1 cm2 kuyu, 300 μL maksimum hacim) veya eşdeğeri esnek ve uygun bir biçimdir. - 200 μL otomatik pipet kullanarak fibronektin aspirasyon ve 2 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 000 000 00 00 00 00 00 00 00 00 00 00 00 00 0 Bu yıkamayı bir kez daha tekrarlayın. Hazne slaydı bu aşamada PBS ile 4 °C'de 1-2 hafta saklanabilir.
2. Raji Hücrelerinin Oda Slaytlarına Yapışması ve 7-amino-4-klorometilcoumarin (CMAC) Etiketleme
- Raji hücrelerinin 10 mL'lik (1-2 x 106 hücre/mL) ön kültürünü 15 mL, V-alt tüpüne aktarın. İyi bir şekilde karıştırın ve Neubauer odasındaki veya eşdeğerindeki hücreleri saymak için 10 μL kullanın.
- Kalan hücreleri oda sıcaklığında 5 dk 300 x g'da santrifüj edin. Aspire ve supernatant atın.
- 106 hücre/mL konsantrasyonda (RPMI 1640 %10 FCS, 2 mM glutamin, 10 mM HEPES, 100 U/mL penisilin ve 100 μg/mL streptomisin ile desteklenmiş) hücre peletini yavaşça askıya alın. Aşağıda verilen denklemi kullanın:
[[ ]başlangıç x Vbaş = [ ]son x Vfinal), [ ]ilk hücre konsantrasyonu temsil eder, Vbaşlangıç = hücre süspansiyonunun ilk hacmi, [ ]son = son hücre konsantrasyonu, Vfinal = hücre süspansiyonunun son hacmi.
NOT: Başlangıç kültürünün hücre konsantrasyonuna bağlı olarak, gerekenden daha fazla hücre toplamak mümkündür ancak olası sorunları önlemek için kalan hücreleri deney sonuna kadar kültürde (37 °C) tutmak önemlidir (bkz. Adım 2.6). - Sinaptik eşleç oluşumu sırasında kimliklerinin belirlenmesine izin vermek için Raji hücrelerini etiketle. Bu deneyde, 7-amino-4-kloromtilkoumarin (CMAC) etiketleme adım 2.4.2 yapılır.
- Kültür ortamındaki raji hücrelerinin gerekli sayısını 2 mL'lik bir tüpe aktarın. 8 mikrokuyu hazne slaytı için hücre süspansiyonunun toplam 1,6 mL'si gereklidir (kuyu başına 200 μL).
- CMAC'in 10 μM'lik son konsantrasyonuna CMAC ekleyin. 200 μL içeren 2 x 105 Raji hücreleri 1 cm2 kuyu başına ihtiyaç vardır. Bu nedenle, 8 kuyu hazırlanması gerekiyorsa, 1.6 x 106 Raji hücreleri gereklidir.
NOT: Raji hücrelerini hücre izci mavisi (CMAC, UV uyarma ve mavi emisyon) ile etiketlemek, sinaptik konjugatlar oluştuğunda onları Th hücrelerinden ayırır. Bu boya PFA ve aseton fiksatifler ile uyumludur ve daha fazla immünoresans prosedürleri sağlar. Işık teşriyi önlemek için deneyin. Raji hücrelerinin CMAC ile bir havuzda etiketlenmesi ve ardından Raji hücrelerinin fibronektin kaplı oda slaytlarına yapışması öncesinde yeniden askıya alınması, Raji hücrelerinin farklı kuyular arasında CMAC ile homojen etiketlemesini sağlar.
- CMAC lekeli hücreleri yeniden askıya alın ve 1.2.adımdan itibaren haznedeki PBS'nin aspirasyonundan sonra, 1.1-1.2 adımda hazırlanan fibronektin kaplı oda slaytlarının her bir kuyusuna hücre süspansiyonunun 200 μL'lik kısmını aktarın. 37 °C'de oda kaydırak, 30 dk-1 saat için %5 CO2'de kuluçkaya yatırın.
NOT: Yapışma ve CMAC etiketleme aynı anda bu adımda gerçekleşir ve bu zaman kazandırır. Raji hücrelerinin hızlı bir şekilde çökelteceğini ve tohumlamadan önce hücre süspansiyonunda homojen bir konsantrasyonu korumak için dikkatli olunması gerektiğini lütfen unutmayın. CMAC yıkama 2.7 adımda daha kolay yapılacağından (etiketli Raji hücreleri zaten oda slaytlarına yapıştığında) CMAC'ı santrifüj le yıkamak gerekmez. CMAC hücre süspansiyonu büyük fazla mevcut olduğundan, mavi floresan arka plan mavi lekeli hücreleri ayırt etmek için çok yüksektir. CMAC yıkandıktan sonra hücre CMAC floresanını adım 2.7'de kontrol edin. - Raji hücrelerinin mikroskop üzerindeki oda slaytlarının hafifçe sallayarak kuyuların dibine yapışmasını sağlayın. Hücrelerin birbirleri arasındaki boşlukları görüntülediğinden ve konakıcı olmadığından emin olun(Şekil 1, orta panel). Hücre birleşmesi %50-60'ı uygundur.
- Hücrelerin çoğu oda slaytına etkin bir şekilde yapışırsa ve hücre boşlukları gözlenmezse, her kuyuyu sıcak tam orta ile yıkayın ve hücre fazlasını ayırmak için 200°L otomatik pipetle ortamı yeniden askıya alın. Her askıya alma adımından sonra birleşimi kontrol edin.
- Hücreler yapışmazsa, yapışma adımını tekrarlayın ve yapışma süresini ve/veya hücre numarasını artırın.
NOT: Burada durmak, oda kaymasını 37 °C, %5 CO2 gece (O/N) olarak kuluçkaya yatırmak ve ertesi gün protokole devam etmek mümkündür. Lütfen ertesi gün Raji hücrelerinin floresan mikroskopi ile bağlı ve CMAC etiketli kaldığını onaylayın.
- Fazla CMAC'i ortadan kaldırmak ve floresan mikroskobu ile mavi emisyon olup olup yok olup yok kontrol etmek için sıcak takviyeLI RPMI ile her iyi tekrar dikkatlice yıkayın (Şekil 1).
NOT: Daldırma yağı (yapışkan ve viskoz) ve yüksek sayısal diyafram yağı hedefleri nin kullanılmasını önlemek için, floresan mikroskobu kullanarak CMAC etiketlemeyi hızlı bir şekilde kontrol etmek için ekstra uzun mesafe (yani, 20x veya 40x) hedefleri kullanılabilir.
3. CMAC Nabız — Stafilokokal Enterotoksin E etiketli Raji Hücreleri
- Her kuyuya Stafilokokal Enterotoksin E (GDA, 1 μg/mL) ekleyin. GDA, gda dondurulmuş stoklarından (PBS'de 1 mg/mL) hücre kültürü ortamında (100 μg/mL'de çalışma çözeltisi) rahatlıkla seyreltilebilir. 200 μL mikrokuyu başına 2 μL'lik 100x çalışma çözeltisi kullanın.
DİkKAT: Bu adım için eldiven kullanın ve kullanılan ucu biyolojik tehlike kutusuna atın. - 37 °C'de oda kaydırak, en az 30 dakika için% 5 CO2 kuluçka. GDA etkisi en az 3-4 saat sürer.
NOT: See, gerektiğinde farklı zaman atlamalı kurulumlar planlanıyorsa (adım 5) ve/veya bitiş noktası denemeleri için başlangıç noktası noktasına bağlı olarak gerektiğinde kuyulara farklı zaman noktalarında eklenebilir (adım 6).
4. Jurkat Hücrelerinin Hazırlanması
- Bu deney için jurkat hücrelerinin daha önce büyüyen kültürünü (1-2 x 106 hücre/mL) kullanın. Daha önce açıklandığı gibi, standart bir kültür şişesi veya standart elektroporasyon protokolleri aşağıdaki önceki bir transfection hücreleri kullanın23. Jurkat hücrelerinin transfeksiyon canlı hücrelerde salgı granüllerinin trafik zaman atlamalı görselleştirme sağlayacaktır. Örneğin, GFP-CD63 (MVB bir belirteç) GFP-CD63 dekore edilmiş veziküllerin hareketi ifade edildiğinde kaydedilebilir (Video 1).
- Bir faz kontrast mikroskobu altında hücreleri gözlemleyin. Ölü hücrelerin fazlalığı ise (>20-30%) gözlenir, ficoll yoğunluk gradyan santrifüj santrifüj standart protokolleri kullanarak gerçekleştirmek24, ölü hücrelerin aşırı ortadan kaldırmak için (ölü hücreler canlı hücrelerden daha yüksek yoğunlukta sergilemek) kullanmadan önce (Tartışma bakınız).
- Hücreleri 15 mL'lik bir tüpe, V-alt tüpüne aktarın ve hemositometre kullanarak saymak için 10 μL kullanın.
- Adım 2.2'de açıklandığı gibi kalan hücreleri santrifüj edin. Supernatant atın ve raji hücreleri (1 x 106/ mL) taze, sıcak kültür ortamı kullanarak aynı konsantrasyonda hücreleri resuspend. 2.2-2.3 adımlarını izleyin.
- Adım 4'ü beklerken Jurkat hücrelerini kültürde (37 °C, %5 CO2)koruyun.
NOT: İkinci seçenekte (transfeksiyon), canlı hücre sayısı ilkine göre çok daha düşük olacaktır. Bu nedenle, deney için yeterli hücreye sahip olmak için daha yüksek bir başlangıç hücre kültürü hacmi kullanmayı düşünün. Elektroporasyon cuvette ve transfeksiyon başına 10 x 106 Jurkat hücrelerinden sadece 2-4 x 106 Jurkat hücreleri 48 saat transfeksiyondan sonra hayatta kalır ve bu hücrelerin bazıları Ficoll adımı sırasında kaybolur. Böylece, bir elektroporasyon cuvette genellikle 8 mikro kuyulardan (1.6 x 106 transfected Jurkat hücreleri gerekli) bağlı SEE-darbeli Raji hücreleri meydan okumak için yeterlidir.
5. Raji ve Jurkat Hücrelerinin birlikte tohumlanması
- CMAC etiketli, GDA darbeli, raji hücrelerini içeren oda slaytlarını 3.2 adımdan kuvözden çıkar. Bu daha önce Adım 2.7 yapıldı beri bu aşamada CMAC yıkamak için gerekli değildir.
- Otomatik 200 μL pipet kullanarak kuyunun bir köşesinden her kuyunun kültür ortamını tek tek aspire edin. Kuyudaki ortamın tamamen kurumasına izin vermeyin.
- 4.5 adımda hazırlanan hücre kültürü ortamında (1 x 10 6/mL) yeniden açığa alınmış Jurkat hücrelerinin 200 μL'lik kısmı ile hemen ortayı değiştirin. Zaman atlamalı görüntüleme yapılırsa, Jurkat hücreleri çok hızlı bir şekilde tortu ve form sinaptik konjugasyoneğilimindedir beri, bu adımdan hemen sonra adım 6 gidin. Kolaylık sağlamak için, Bu aşamada Jurkat hücreleri ile tohumlama alamayan GDA-darbeli, bağlı Raji hücreleri içeren mikrowelller Jurkat hücreleri ile sonraki sorun kadar hücre kültürü orta ile muhafaza edilmelidir. Bu esnek ek zaman atlamalı veya ters kinetik, bitiş noktası deneysel yaklaşımlar için Jurkat hücreleri ile sonraki sorun sağlayacaktır.
- Bir zaman atlamalı gerçekleştirilecekse, hızlı bir şekilde adım 6'ya geçin. Bu, mikroskop aşamasında kuvözde1-2 saat ortak kültürü içerir veya 37 °C'de eşdeğeri, %5 CO 2 sinaptik konjuge oluşumuna ve eşzamanlı görüntü edinimi sağlar. Eğer uç nokta analizi, ancak zaman atlamalı, hücreleri sabitlemeden önce mikroskop kullanarak eş-kültür döneminden sonra kontrol eşlenik oluşumu öngörülür (Şekil 1)hücreleri sabitlemeden önce (adım 7).
6. Ortaya Çıkan Sinaptik Konjugatların Zaman Atlamalı Görüntülemesi
- Görüntülemeden önce mikroskop ve kuluçka odasını hazırlayın. Video 1'de gösterilen örnekte, ayrıntılı mikroskopi ayarları Şekil 2'degösterilmiştir.
NOT: Bir zaman atlamalı deney planlanıyorsa, tüm mikroskop ayarları ve tamamlayıcıları (ortam hücre kültür odası, vb) bağlı Raji hücreleri ile oda slayt Jurkat süspansiyon eklemeden önce hazırlanmalıdır. Ticari bir mikroskop(Malzeme Tablosu)için aşağıdaki adımlar açıklanmıştır. Ancak, herhangi bir ters floresan mikroskop bir hücre kültürü kuluçka ile donatılmış kullanılabilir.- Polarize trafiği görüntülerken 60x yağ daldırma, yüksek sayısal diyafram ile bir mikroskop kullanın.
- Otomatik odaklama sisteminin açık olduğundan emin olun ve alt yüzeye bağlı Raji hücrelerini odaklayacak şekilde ofset ayarlayın. Lütfen Şekil 1, Video 1 ve Video 2'yebakın.
- Adım 5.3'te bağlı Raji hücrelerini içeren her kuyuya Jurkat ilaveedildikten sonra, önceden ısıtılmış (1-2 saat) mikroskop aşaması kuluçka makinesindeki mikrokuyu haznesini hızlı bir şekilde bulun ve mikroskoplu bazı XY konumlarını seçin. örneğin, Jurkat transfected bir hücrenin mikroskop odağına düşmesi sonucu ortaya çıkan bir İd oluşumunu kaydetmesi muhtemeldir.
- Isı stabilize bir aşamanın kararlı X,Y,Z pozisyonlarını koruduğu gözlendiği için önceden ısıtılmış bir mikroskop aşama kuluçka makinesi kullanın. Uygun bir XY alanı için kriterler şunlardır: iyi odaklanmış ve uyumsuz olmayan Raji hücreleri (yani, hücreler arasında boşluklar gösteren) ve transfected Jurkat hücrelerinin varlığı (bu iletim ve UV veya GFP kanalları birleştirerek kontrol edilebilir). Jurkat hücreleri çok hızlı bir şekilde tortu olacak (birkaç dakika) oda slayt üzerinde, ve görüntü ortaya çıkan sinapslar görüntü şansı zamanla azalacaktır(Şekil 1). Deneyi tanımlanan zaman atlamaından sonra bitirmek veya Adım 7'ye geçmek ve sonraki immünfloresans ve analizler için konjugeleri onarmak mümkündür.
NOT: Uygun zamansal çözünürlükte (kare başına 1-2 dk) eşzamanlı, çok iyi zaman atlamalı kazanım için en fazla 4 farklı mikroskop alanından en fazla 16 farklı mikroskop alanı seçmek mümkündür. Sınırlama, görüntülenecek çeşitli floresan ların (CMAC dışında ifade edilen floresan protein sayısına bağlı olarak) hem sayısına hem de yoğunluğuna (kamera sergisini etkileyen) bağlıdır. Kare hızını artırmanın bir yolu, CMAC kanalı için GFP için her "n" zaman diliminden yalnızca birinde kayıt yapmaktır (yani, n = 8, Şekil 2'degösterildiği gibi), Raji hücreleri iyi alta yapışır ve Jurkat hücreleri olarak kolayca hareket etmez. Buna ek olarak, sık UV ışığına maruz kalma hücrelere zarar verebilir, çünkü bu, hücre canlılığı yararları. MVB'nin kutuplaşmasının tamamlanması birkaç dakika aldığından, zaman dilimi hızını her 1 dakikada bir veya daha az (yani Video 1'dekare başına 20 s)1 kare olarak ayarlamaya çalışın. Bu çok kanallı yakalamayı gerçekleştirmek için motorlu epi-floresan taret ve uygun bant geçişli floresan filtreleri veya eşdeğerleri ile donatılmış bir mikroskop gereklidir.
7. Sinaptik Konjugatların Son Nokta Oluşumu ve Fiksasyon
- Sadece bir uç nokta deneyi planlanıyorsa (sinaptik eşleç oluşumuna izin vermek için 1-2 saatlik kuluçka uygundur), oda slaytını 37 °C'de, %5 CO2'yi 1-2 h. Kültür döneminden sonra konjuge oluşumunu kontrol edin (Şekil 1'deolduğu gibi) kontrol edin ve daha sonra aseton veya PFA ile konjugeleri düzeltin (fiksasyon sonraki immünorlarda kullanılacak antijen ve antikorlara bağlıdır). Bu durumda kuluçka mikroskop evre kuluçka gerektirmez. Bir örnek için lütfen Video 3'e bakın.
- Hücreleri düzeltmek için, fcs olmadan sıcak RPMI (37 °C) orta ile hafifçe sallayarak kuyuyı yıkayın (serumdan albumin aseton fiksasyonu ile çökebilir). Aspire edin ve her kuyuya 200 μL PFA veya önceden soğutulmuş aseton ekleyin. Oda sıcaklığında (RT) veya buz üzerinde, sırasıyla, 20 dakika için oda slayt kuluçka.
NOT: Aseton fiksasyonu için asetonu -20 °C'de önceden soğutun ve 4 °C'de haznesini önceden soğutun. Aseton 8 iyi cam alt oda slaytlar kültürlü hücreleri düzeltmek için kullanıldığında plastik kapakları çıkarın. - Her birini PBS ile iki kez yıkayın ve 200 μL söndürme çözeltisi (PBS, 50 mM NH4Cl) ekleyin. 4 °C'de oda kaydırak kuluçka.
NOT: Bu aşamada oda slayt ı 8açıklandığıgibi, immünoreskence protokolünü gerçekleştirmeden önce 4 °C'de en az bir ay kalabilir. Kapak buharlaşmayı önler.
8. Görüntü İşleme
- Sabit hücrelerin zaman atlamalı serisinin ve/veya hareketsiz fotoğraflarının edinim sonrası görüntü dekonvolution (yani Huygens deconvolution veya eşdeğeri, Malzeme Tablosu)gerçekleştirin. Uygun bir yazılım (yani, Huygens "geniş alan" optik seçeneği kullanarak) ve doğru optik parametreleri kullanarak deconvolute. Mikroskobun ölçülen nokta yayma fonksiyonunun (PSF) görüntü işlemesi için dekonvolution gerekir4.
- Alternatif olarak, mikroskop dosyaları meta veriler arasında yer alan optik parametrelerin otomatik yükleme ile idealize PSF hesaplamak için yazılımı kullanın. Bu optik parametreler florokrom dalga boyu, kırılma indeksi, hedefin sayısal diyafram açıklığı ve görüntüleme tekniğini (konfokal, geniş alan, vb.) içerir. 4 .
- Daha sonra, görüntüleme yazılımı PSF ve çeşitli deconvolution algoritmaları kullanır (yani, QMLE ve CMLE Huygens yazılım), bir adım-adım birikimli, hesaplama süreci, olan sonuçları sürekli görselleştirilmiş ve durdurulabilir (veya devam) kullanıcı tarafından gerekli. Bu aşamada kullanıcı kıvrım ların ve/veya sinyalin sayısını gürültü oranına değiştirebilir ve dekonvolutiona devam edebilir. Deconvolution yazılımı zaman atlamalı serisi (X,Y,T) (Video 2) ve Z-yığınları (X,Y,Z)(Video 3)ile iyi çalışır. Deconvoluted kanalları daha sonra CMAC, ham kanal, sitosolik beri birleştirilmiştir, diffüz florokromlar dekonvolution ile geliştirmek değil4,9.
Sonuçlar
Jurkat-Raji immün sinaps konjugatlarını oluşturmak ve İd oluşumunun erken evrelerini düzgün bir şekilde görüntülemek için açıklanan protokolü uyguladık. Amacımız, MTOC'un ve salgı makinelerinin İd'e karşı kutuplaşmasını incelemek için daha önce takip edilen20 erken yaklaşımları iyileştirmekti. Bu yaklaşımlar, İd oluşumunun veya erken sinaptik olayların görüntülenmesine izin vermeyen bir uç nokta stratejisine dayanıyordu, çünkü bu stratejilerde İd oluşumu zorunlu olarak mikroskopta değil, karışık, santrifüjlü hücrelerin peletinde meydana geldi. Protokolümüz bu ana uyarıyı önlemek için tasarlanmıştır, çünkü yaklaşım uygun bir hücre konsantrasyonu (Adım 2 ve 3) kullanımına dayanıyordu, hücreden hücreye IS'nin oluşumunu lehine, kendi mikroskop odası slaytları (8 mikro kuyu odası slaytı) üzerinde, önceden ısıtılmış mikroskop aşaması inkübatöre monte edilmiş (Adım 4'te). Bu strateji, aynı anda zaman atlamalı görüntüleme yakalama(Video 1)için, IS oluşumunu neden olur.
Şekil 1 protokolden sonra elde edilen sinaptik Jurkat-Raji konjugatlarını temsil eder (adım 5.2). Görüntü, temsili, hızlandırılmış bir deneyin ilk karesini temsil eder. 2 x 105 Raji hücreleri ve 2 x 105 Jurkat hücresi 1 cm2 kuyuya eklendi. Üst panel iletim kanalını, orta panel CMAC (mavi) kanalını (Raji hücreleri) ve alt panelde hem iletim artı CMAC birleştirilmiş kanalları gösterir. Sarı oklar bazı sinaptik konjugatları referans olarak etiketlerken, yeşil oklar bir Jurkat hücresi ve birkaç Raji hücresi (karmaşık konjugatlar) tarafından yapılan sinaptik konjugatları gösterir. Azalan hücre konsantrasyonları (1 cm2 kuyuda 105 veya daha az hücre) karmaşık hücresel konjugaların oluşumunu atlatacaktır, ancak polarize trafiğin sonraki analizi için yeterli hücre konjugatörü olmayabilir (aşağıya bakın), bu da ortaya çıkan sinaptik konjugatları bulma ve görüntüleme şansını da azaltacaktır.
Şekil 2, Video 1'ekarşılık gelen bir temsili zaman atlamalı deneyde uygun yazılım (yani NIKON NIS_AR) kullanılarak iki farklı florokromun (CMAC ve GFP-CD63) eşzamanlı olarak yakalanması için kullanılan görüntüleme parametrelerine karşılık gelen ekran görüntülerini temsil etmektedir.
Video 1 (İmmünolojik sinapslar, ham) GFP-CD63 (multiveziküler organların bir belirteci-MVB, yeşil veziküller) ve 1 Jurkat hücre ve 2 Raji hücreleri arasında çift sinaps oluşumunu ifade eden bir Jurkat T lenfosit temsil eder CMAC ile etiketlenmiş, mavi (bunlardan biri yutma uğrar). Jurkat hücresi içindeki MVB'nin sinaps alanlarına eşzamanlı hareketi kaydedildi (yakalama kare hızı = GFP-CD63 için her 20 saniyede 1 kare; video çoğaltma hızı = her s başına 2 kare). Sinaptik konjugatlar, yukarıda açıklanan protokol (Step 6.2) izleyerek elde edilmiştir ve görüntülenmiştir (Video 1). Hem GFP-CD63 hem de CMAC floresan kanallarının eşzamanlı olarak yakalanması uygun bir yazılım kullanılarak gerçekleştirildi (örn. NIS-AR, Malzeme Tablosu). Video, bir temsilci, hızlandırılmış denemeden elde edilen ham verileri temsil eder. Otomatik odaklama sistemi, deney boyunca istikrarlı bir odak sağlamak için, cam alt bağlı Raji hücreleri ile ilgili uygun bir ofset ile tanımlanmıştır.
Video 2 (immünolojik sinapslar, dekonvolution sonra) Video 1karşılık gelir, ancak GFP-CD63 floresan kanal görüntülerin deconvolution uygun bir dekonvolution yazılımı istihdam tarafından yapıldı (yani, Huygens), "geniş alan" optik seçeneği ve uygun optik parametreleri kullanarak (adım 8). Bu deconvoluted kanal daha sonra CMAC, ham kanal ile birleştirildi. Hem sinyal-gürültü oranının hem de görüntünün netliğinin iyileştirilmesi açıktır. Deconvolution, yukarıda açıklandığı gibi, satın alma sonrası yapıldı. Deconvolution yazılımı ile ilgili özel ayrıntılar için lütfen4'ebakın.
Video 3 (immünolojik sinaps, sabitleme ve immünoforesan sinaps boyama sonra) protokol (aseton fiksasyon) adım 6 sonra sabit bir IS eşlekofil bir Z-yığını (z-adım boyutu = 0.8 μm, 5 kare) temsil eder. Fiksasyondan sonra, f-aktini (yeşil), anti-CD63'ü görselleştirmek için Phalloidin kullanılarak standartprotokol25'e göre immünororeskans yapıldı, MTOC'u görselleştirmek için anti-γ-tubulin (kırmızı). CMAC (mavi) Raji hücresini etiketler. Daha sonra eşleç epifloresan ve çeşitli kanallar "geniş alan" optik seçeneği ve uygun optik parametreler (adım 7) kullanılarak deconvoluted tarafından görüntülendi. Deconvoluted kanalları daha sonra cmac, ham kanal, farklı panellerde belirtildiği gibi (CMAC artı Transmittance-TRANS, CMAC plus Phallodin, CMAC artı anti-CD63 ve CMAC artı anti-γ-tubulin, sırasıyla) birleştirildi. Beyaz ok sinapsi etiketlerken, yeşil ok MVB'yi ve sarı ok mtoc'u etiketler. MVB ve MTOC polarizasyonunun ayrıntılı niceliği başka bir yerde25olarak açıklanmıştır.
Burada sunulan yaklaşım hücre-hücre konjugatlarının oluşumunu ve aynı zamanda geniş alan floresan mikroskobu (WFFM) tarafından zaman atlamalı edinimini ve ardından görüntü işlemeyi (post-acquisition deconvolution) içerir. Bu taktik, görüntülerin sinyal-gürültü oranı (SNR) geliştirilmiş, onların zamansal çözünürlüğünü geliştirilmiş ve ortaya çıkan sinaptik konjugatlar birkaç florokrom senkronize edinimi izin4. Buna ek olarak, protokol de sonraki nokta hücre fiksasyon yöntemleri ile eşleşir (paraformaldehit, aseton veya metanol), hangi daha fazla immünororesans boyama sağlayacak ve analizleri25 (Video 3). Bu protokol aynı zamanda lazer tarama konfokal mikroskopi ve diğer son teknoloji mikroskopi teknikleri ile de uyumludur.
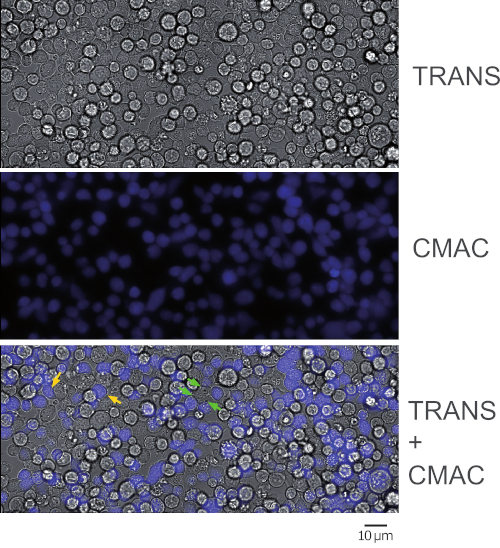
Şekil 1: Sinaptik konjugatların temsili çift boyutlu mikroskopi alanı. Görüntü, protokolü izleyen bir temsilci, hızlandırılmış denemenin ilk karesini temsil eder. Üst panel iletim kanalını, orta panel CMAC kanalını (Raji hücreleri) ve alt panelin her ikisi de birleştirilmiş kanalları gösterir. Sarı oklar bazı sinaptik konjugatları referans olarak etiketler. Yeşil oklar karmaşık sinaptik konjugatları (yani birden fazla Raji hücresi olan bir Jurkat hücresi) gösterir. 40x EWD (0.6 NA) hedefiyle yakalanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
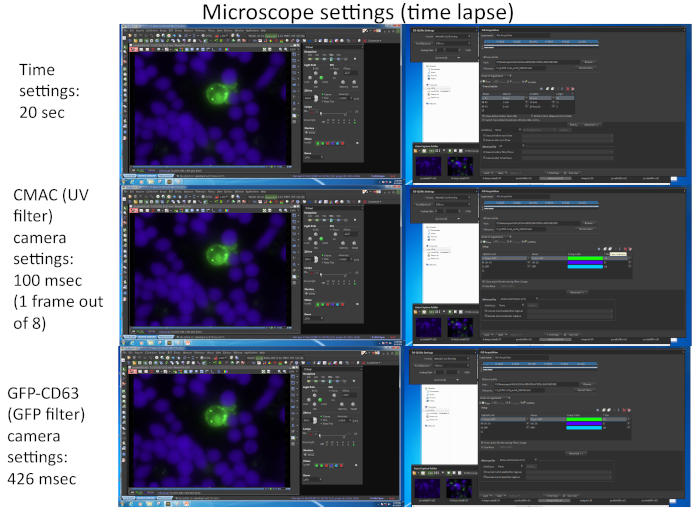
Şekil 2: Zaman atlamalı mikroskop ayarları. Görüntü, Video 1'ekarşılık gelen bir temsili zaman atlamalı deneyde uygun yazılım (yani, NIKON NIS_AR) kullanılarak iki farklı florokromun (CMAC ve GFP-CD63) eşzamanlı olarak yakalanması için kullanılan görüntüleme parametrelerine karşılık gelen birkaç ekran görüntüsüne karşılık gelmektedir. GFP-CD63 kanalının her karesi her 20'de bir ele geçirildi. GFP kanalı için sekiz kareden sadece bir UV kanalı için sadece bir kare, deney boyunca hücre canlılığını korumak için yakalandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
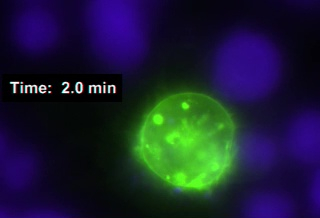
Video 1: GFP-CD63'ü ifade eden bir Jurkat hücresi tarafından yapılan immünolojik sinapslar, ham veriler. Hücre izci mavisi (CMAC, mavi) etiketli Raji B hücreleri 30 dakika boyunca SEE ile darbelendi ve GFP-CD638'i ifade eden Jurkat hücreleri ile sinapslar oluşturuldu. GFP-CD63 ve CMAC kanallarına karşılık gelen zaman atlamaları yakalandı (kare başına 20 s; video çoğaltma hızı = her bir kare) ve temsili bir örnek gösterilmiştir. 60x PLAN APO (1.4 NA) hedefi ile yakalanır. Bu videoyu görüntülemek için lütfen buraya tıklayın (İndirmek için sağ tıklayın).
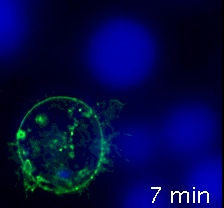
Video 2: Dekonvolution sonrası GFP-CD63'ü ifade eden bir Jurkat hücresi tarafından yapılan immünolojik sinapslar. Video 1ile aynı, ancak görüntüler bir deconvolution yazılımı kullanılarak deconvoluted edildi. Gelişmiş sinyal-gürültü oranı ve gelişmiş netlik, odak floresan dışında kirletici ortadan kaldırılması nedeniyle, açıktır. Bu videoyu görüntülemek için lütfen buraya tıklayın (İndirmek için sağ tıklayın).
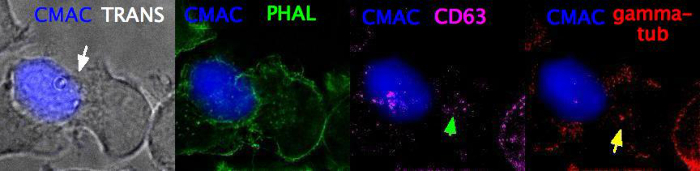
Video 3: Sabit ve immünostained immünolojik sinaps. Görüntü, Protokol'ün 7. CMAC (mavi) etiketler raji hücreleri, iletim (TRANS) sinaptik konjuge göstermek için (beyaz ok), Phalloidin etiketleri F-actin (yeşil), anti-CD63 etiketleri MVB (macenta, yeşil ok) ve anti-γ-tubulin etiketleri MTOC (kırmızı, sarı ok), sırasıyla. Bu kanallar epifloresan tarafından görüntülendi, deconvoluted ve belirtildiği gibi birleştirilmiş. Video bir Z-yığını (z-adım boyutu = 0,8 μm, 5 kare) içerir. Beyaz ok sinaptik temas alanını etiketlerken, yeşil ok MVB'yi ve sarı ok MTOC'u etiketler. Bu videoyu görüntülemek için lütfen buraya tıklayın (İndirmek için sağ tıklayın).
Tartışmalar
Bu protokolün bir sınırlama tüm sinapsideal optik eksene dik odaklı olacaktır. Bu tekniği kullanarak, immün sinaps görüntüleme için ideal oryantasyonu tahmin etmenin ve/veya etkilemenin bir yolu yoktur. Bu sorunu gidermek için, sonraki analizlerden, sonunda ideal kriterleri karşılamayan rasgele yakalanan tüm sinapsları hariç tutarız. Bu sinapslar, uygun bir şekilde yeterince sık değildir. Ancak, çeşitli deneysel yaklaşımlar4kullanarak bu sınırlamayı aşmak mümkündür.
Polarize CD63 sürümü (degranulation) cd63 hücre yüzeyi boyama gibi diğer tamamlayıcı teknikler tarafından ölçülebilir (CD63 hücre yüzeyine cd63 relocalization) canlı hücrelerde (sabit değil ve permeabilized), adım sonra 6, ve sonraki yıkama ve fiksasyon, daha önce gösterildiği gibi8. Buna ek olarak, exosomes8CD63 sürümü 8,9 ve nanopartikül izleme analizleri ile ekzozom nicelleştirme9,25 yapılabilir. Bu yaklaşımlar kesinlikle bizim protokol ile uyumludur, sabitlenme canlı hücrelerin hücre yüzeyimmünüörasyon sonra yapılmaktadır sağlanan.
İdeal hücre sayısını bulduk (8 kuyulu bölmedeki slaytta 1 cm2 kuyu için) 4 x 105 hücredir (2 x 105 Raji hücreleri ve 2 x 105 Jurkat hücreleri) kuyunun dibine verimli bir şekilde yapıştıkları için. Plastik (fibronektin kullanarak) veya cam alt (poli-L-lizin kullanarak) mikroslaytlar için bağlayıcı verimlilik genellikle bir sorun değildir. Daha yüksek hücre sayıları bağlı hücreler arasında boşluk oluşturmayabilir ve daha sonra karmaşık sinaptik konjugatlar(Şekil 1); tek hücreden hücreye konjugatların örneğin MTOC veya sekresyon granül polarizasyon deneylerinde görüntülenmesi gerektiğinde her iki durum da istenmez. Daha düşük sayıda hücre konjugat bulma şansını azaltabilir, özellikle transfected Jurkat hücreleri sinaps oluşturmak için APC ile meydan okunduğunda. Protokolün başlangıcından önce mikroskop X/Y aşamasında yer alan sıcaklık stabilize bir evre kuluçka makinesinin (yani, evre/mikroskop kurulumunu stabilize etmek için önceden 1-2 saat) sabit X,Y,Z parametrelerini koruduğunu gözlemledik ve bu da uygun görüntüleme için çok önemlidir. Otomatik odaklama sistemi sonunda küçük Z varyasyonları telafi edecektir.
Elektroporasyon gibi bazı gen transdüksiyon teknikleri Jurkat klonları(Video 1)floresan şimerik proteinleri (yani GFP-CD63) ifade etmek için kullanıldığında, hücrelerin önemli bir kısmı elektroporasyondan sonra ölebilir. Ölü hücreler sinaps oluşturmasalar da, canlı, transfected hücreler üzerinde aşırı olduklarında, yaşayan Th hücreleri tarafından yapılan konjugalerin oluşumunu engelleyebilir, çünkü bu bir sorun olabilir. Eşleyolsel formasyon adımından önce standart protokolleri izleyerek yoğunluk gradyan ortamı kullanarak transfected kültürlerden ölü hücrelerin dikkatli bir şekilde ortadan kaldırılmasının konjuge konjuge görüntülenme şansını gerçekten artırabileceğini bulduk. Buna ek olarak, düşük transfeksiyon verimliliği (<%20) bu, ılımlı bir konjuge oluşum verimliliği (%60)25ile birlikte, transfected hücreler tarafından yapılan konjuge bulmak için olasılığını azaltacaktır bu yana önemli bir uyarı olabilir. Transfected olmayan hücreler bitiş noktası deneyleri ve sonraki fiksasyon konjugates elde etmek için kullanıldığında bu bir sorun değildir. 8 microwell oda slaytlar konvansiyonel immünofloresan protokolleri ile uyumludur. Bu, yukarıdaki protokolün esnekliğini farklı amaçlarla artırır. Aseton ile fiksasyon plastik alt kuyuları ile oda slaytlar kullanırken göz önünde bulundurulması gereken bir sorun olabilir. Ancak, aseton fiksasyonu ile uyumlu cam dipleri içeren ticari olarak kullanılabilir 8 mikrokuyu mikroskop odası slaytlar vardır. Aseton 8 microwell cam alt oda slaytlar kültürlü hücreleri düzeltmek için kullanıldığında plastik kapakları çıkarın.
Mikroskopun motorlu XY aşaması, motorlu epi-floresan taret ve otomatik odaklama sistemi (örn. Mükemmel Odak Sistemi) veya eşdeğer takviyelerle donatılmış olması önerilir. Çok iyi edinimi gerektiğinde25, otomatik odaklama sistemi deneme boyunca istikrarlı bir odak sağlayacaktır. Önceki deneyimler, Raji hücrelerine uygun bir odak ofset oluşturarak, Hem T hücrelerinin hareketinin(Video 1)hem de XY çok noktalı deneylerdeki mikroskop aşaması/hazne slayt hareketlerinin telafi edilebilebileebileceğini göstermektedir. Bu gerçekten çok iyi zaman atlamalı yakalama için uygundur.
Siyah ve beyaz, pankromatik ve soğutulmuş şarjlı cihaz (CDD) kamera kullanılmış, ancak yüksek hassasiyetli, floresan bilimsel tamamlayıcı metal-oksit yarı iletken (sCMOS) kamera arzu edilir, bu kamera maruz kalma sürelerini azaltacak ve zamansal çözünürlüğü artıracak tır. Kullandığımız kısa kamera pozlama süreleri (sıralama formu 100 ms ila 500 ms) otomatik floresan deklanşörle birlikte, önemli floresan ağartma ve/veya hücre canlılığı kaybı olmaksızın yeterli zaman çözünürlüğü (dakikada 1 kare veya daha az, 16 XY pozisyonu için) ile uzun süreli hızlandırılmış yakalama (24 saate kadar) sağlar. Motorlu sahne çok noktalı (XY) yakalama sağlar ve ideal yönde ortaya çıkan ve gelişmekte olan sinapslar bulmak ve görüntü şansını artırır, ama aynı zamanda farklı Jurkat klonları aynı anda 25 konjuge olması gerektiğinde çok kuyulu oda slaytlarda görüntü edinimi sağlar25. Salgı granüllerinin trafiğini analiz ederken en iyi sonuçları elde etmek için amacın yüksek sayısal diyafram açıklığı (yani 60x, 1.4) gereklidir.
RAJI-SEE-Jurkat başlangıçta11açıklandığı bu yana araştırmacıların sayısız tarafından kullanılan iyi kurulmuş bir immünolojik sinaps modeli oluşturmaktadır. İd oluşumunun erken aşamalarını doğru bir şekilde görebilmek için protokolümüzü bu modele uyarladık. Amacımız, MTOC'un ve salgı makinelerinin İd'e karşı kutuplaşmasını incelemek için daha önce takip edilen20 erken yaklaşımları iyileştirmekti. Bu protokol ile yapılan konjugatlar sinaps F-aktin yeniden yapılanma üretmek dikkat çekicidir, bir kanonik SMAC yapılandırma, birlikte MVB polarize trafik25. Bu önemli olaylar da konfokal mikroskopi25ile analiz edilmiş ve doğrulanmıştır.
Polarize trafikteki kinetik farklılıklar farklı İd türleri arasında mevcuttur. Örneğin, CtLs litik granüllerin polarize nakli saniye veya çok birkaç dakika içinde gerçekleşir, Th lenfositler birkaç sitokin içeren veziküller birkaç dakika kadar bitirmek için sürer. Bu zamansal farklılıklar, en iyi stratejiyi tasarlamak ve en uygun deneysel ve görüntüleme yaklaşımını seçmek için önceden dikkate alınmalıdır, çünkü bazı görüntüleme stratagemleri (yani lazer tarama konfokal mikroskopisi (LSCM)), yakalama süresi uygun zaman çözünürlüğünden çok daha yüksek olduğundan zaman sınırlayıcı bir faktör olabilir (1 dk veya daha az)4. Yukarıdaki protokolde açıklandığı gibi geniş alan floresan mikroskobu (WFFM) kullanıldığında bu bir sınırlama değildir. CTLs beri, sinaps doğru MTOC polarizasyon sadece birkaç dakika sürer3,6,17, çeşitli özel devlet-sanat mikroskobu yaklaşımlar burada açıklanan farklı (ama daha yüksek mekansal ve zamansal çözünürlük barındıran) düzgün bu sinaps görüntü için gereklidir26,27, özellikle birkaç mikroskop alanları (çok noktalı yakalama) görüntülendiğinde. Bu yüksek çözünürlüklü, yeni yaklaşımlar da Th lenfositler tarafından yapılan sinapsların görüntülenmesi için kullanılabilir, ekonomik ve / veya lojistik nedenlerle (yani, bu görüntüleme teknikleri nin bazıları için gerekli çekirdek ekipman maliyeti 6-7 kat daha fazla burada açıklanan) kesinlikle sanat görüntüleme yöntemleri bu devlet için bir sınırlama teşkil edebilir4. Th lenfositler tarafından yapılan is uzun ömürlü olması, ve durum Th lenfositler MTOC, lenfokin içeren salgı veziküller ve MVB birkaç dakika kadar saat taşımak ve IS22dock almak , bu protokol th-APC IS görüntüleme için ideal, uygun fiyatlı bir yaklaşım yapar.
WFFM, satın alma sonrası görüntü dekonvolution ile birlikte ilginç bir yaklaşım teşkil etmektedir ve sadece ekonomik nedenlerle bu stratejiyi desteklemekle kalmıştır. Z eksenindeki içsel zayıf çözünürlük (tekniğin en önemli ihtar) satın alma sonrası görüntü deconvolution4 kullanılarak geliştirilebilir (Video 1 ile Video 2karşılaştırın). Deconvolution, sinyalin gürültü oranına ve görüntü çözünürlüğünü vekontrastı 27'ye kadar 2 kat, XY ekseninde 150-100 nm'ye ve Z ekseninde 500 nm'ye kadar geliştirebilen, hesaplama tabanlı, görüntü işleme yaklaşımını kullanır4.
Yüksek hassasiyet, yüksek okuma hızı ve geniş dinamik aralık, yeni floresan sCMOS fotoğraf makinelerinin kullanımı görüntülerin kalitesini artıracak ve floresan ağartma azaltacaktır. Burada açıklanan hücreden hücreye çekim protokolünün sunduğu esneklik, açıklanan hücresel yaklaşımın hem canlı hücrelerde hem de sabit hücrelerde beklenen sonuç olan çeşitli art mikroskobu teknikleri ile birleştirilmesine olanak sağlar. gerçekten immünolojik sinaps bilgimizi artıracaktır.
Biz uygulanan ve kolay ele, iyi kurulmuş hücre hatları kullanarak protokolü doğruladı rağmen, potansiyel yaklaşım birincil T hücreleri ve antijen sunan hücrelerin farklı türleri (makrofajların dendritik hücreleri gibi) kullanıldığında daha fizyolojik etkileşimlerin görselleştirilmesine izin verebilir5. Bu bağlamda, bu protokol de genişletilmiş ve superantigen kullanılarak doğrulanmış (SEB)-darbeli fare EL-4 hücre hattı APC olarakkullanılan, birincil fare T lenfoblastlar meydan 9 . Nitekim birincil T lenfositler, özellikle CTLs, daha kısa ömürlü ve dinamik sinaptik kişiler işlendi (Referans Ek Video 8 bakınız8 9) SEE-Raji ve Jurkat modeli ile görülen. Sinaptik temas modlarının değişkenliği en iyi dendritik hücreler veya B hücreleri ile birincil T-hücre etkileşimleri için de bu protokol kullanılarak kaydedilebilir ve analiz edilebilir iki boyutlu in vitro doku eşdeğerleri görülebilir. Buna ek olarak, süperantijenler dışında, teknik sinaps diğer türleri görüntü için kullanılabilir. Örneğin, bir TCR transgenik, antijenspesifik T hücre modelinde, örneğin ovalbumin spesifik murine OT1/OT2 sistemi kullanılarak veya T hücrelerinin antijene özgü T hücre reseptörleri ile transfeksiyonu ile kullanılabilir. Bu, yakın gelecek için sayısız deneysel olasılık açar.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan etmezler.
Teşekkürler
Biz cömert katkıları için laboratuvar tüm geçmiş ve mevcut üyeleri kabul ediyoruz. Bu çalışma İspanya Ministerio de Economía y Competitividad (MINECO), Plan Nacional de Investigación Científica (SAF2016-77561-R'den M.I.'a verilen ve kısmen FEDER-EC finansmanı ile verilen bağışlarla desteklenmiştir). Facultad de Medicina (UAM) ve Facultad de Medicina'nın Departamento de Audiovisuales'ini desteklerinden ve videoyu oluşturmak için sağlanan olanaklardan dolayı kabul ediyoruz. NIKON-Avrupa'yı sürekli ve mükemmel teknik ve teorik destek için kabul ediyoruz. Bu makaleye ücretsiz erişim Nikon tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Camera Nikon DS-QI1MC | Nikon | MQA11550 | Cooled Camera Head |
| CMAC | ThermoFisher Scientific | C2110 | Cell tracker blue |
| JURKAT cells | ATCC | ATCC TIB-152 | Effector T lymphocytes |
| μ-Slide 8 well ibiTreat, μ-Slide 8 well Glass-Bottom | IBIDI | Cat.No: 80826, 80827 | Cell culture and cell imaging supports |
| Microscope NIKON Eclipse Ti-E | Nikon | NIKON Eclipse Ti-E | Wide-field fluorescence, fully-motorized microscope equipped with Perfect Focus System (PFS) option |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | Cell culture atmosphere |
| Raji Cells | ATCC | ATCC CCL-86 | APC |
| RPMI medium GIBCO | ThermoFisher Scientific | 21875034 | Culture medium |
| Streptococcus Enterotoxin E (SEE) | Toxin Technology, Inc | EP404 | Bacterial Toxin |
| Software Huygens Essential | SVI | Huygens Essential | Image Deconvolution software |
| Software Image J | NIH | Image J | Image software |
| Software Nikon NIS-AR | Nikon | NIS-Elements AR | Image capture and analysis software |
Referanslar
- Fooksman, D. R., et al. Functional anatomy of T cell activation and synapse formation. Annual Review of Immunology. 28, 79-105 (2010).
- de la Roche, M., Asano, Y., Griffiths, G. M. Origins of the cytolytic synapse. Nature Reviews. Immunology. 16, 421-432 (2016).
- Griffiths, G. M., Tsun, A., Stinchcombe, J. C. The immunological synapse: a focal point for endocytosis and exocytosis. The Journal of Cell Biology. 189, 399-406 (2010).
- Calvo, V., Izquierdo, M. Imaging Polarized Secretory Traffic at the Immune Synapse in Living T Lymphocytes. Frontiers in Immunology. 9, 684 (2018).
- Friedl, P., den Boer, A. T., Gunzer, M. Tuning immune responses: diversity and adaptation of the immunological synapse. Nature Reviews. Immunology. 5, 532-545 (2005).
- Xie, J., Tato, C. M., Davis, M. M. How the immune system talks to itself: the varied role of synapses. Immunological Reviews. 251, 65-79 (2013).
- Colombo, M., Raposo, G., Théry, C. Biogenesis, Secretion, and Intercellular Interactions of Exosomes and Other Extracellular Vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Alonso, R., et al. Diacylglycerol kinase alpha regulates the formation and polarisation of mature multivesicular bodies involved in the secretion of Fas ligand-containing exosomes in T lymphocytes. Cell Death & Differentiation. 18, 1161-1173 (2011).
- Mazzeo, C., Calvo, V., Alonso, R., Merida, I., Izquierdo, M. Protein kinase D1/2 is involved in the maturation of multivesicular bodies and secretion of exosomes in T and B lymphocytes. Cell Death & Differentiation. 23, 99-109 (2016).
- Mittelbrunn, M., et al. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nature Communications. 2, 282 (2011).
- Montoya, M. C., et al. Role of ICAM-3 in the initial interaction of T lymphocytes and APCs. Nature Immunology. 3, 159-168 (2002).
- Abraham, R. T., Weiss, A. Jurkat T cells and development of the T-cell receptor signalling paradigm. Nature Reviews. Immunology. 4, 301-308 (2004).
- Huse, M., Quann, E. J., Davis, M. M. Shouts, whispers and the kiss of death: directional secretion in T cells. Nature Immunology. 9, 1105-1111 (2008).
- Peters, P. J., et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. The Journal of Experimental Medicine. 173, 1099-1109 (1991).
- Vignaux, F., et al. TCR/CD3 coupling to Fas-based cytotoxicity. The Journal of Experimental Medicine. 181, 781-786 (1995).
- de Saint Basile, G., Menasche, G., Fischer, A. Molecular mechanisms of biogenesis and exocytosis of cytotoxic granules. Nature Reviews. Immunology. 10, 568-579 (2010).
- Huse, M. Microtubule-organizing center polarity and the immunological synapse: protein kinase C and beyond. Frontiers in Immunology. 3, 235 (2012).
- Yi, J., et al. Centrosome repositioning in T cells is biphasic and driven by microtubule end-on capture-shrinkage. The Journal of Cell Biology. 202, 779-792 (2013).
- Jang, J. H., et al. Imaging of Cell-Cell Communication in a Vertical Orientation Reveals High-Resolution Structure of Immunological Synapse and Novel PD-1 Dynamics. Journal of Immunology. 195, 1320-1330 (2015).
- Kupfer, A., Singer, S. J. Cell biology of cytotoxic and helper T cell functions: immunofluorescence microscopic studies of single cells and cell couples. Annual Review of Immunology. 7, 309-337 (1989).
- Dustin, M. L., Depoil, D. New insights into the T cell synapse from single molecule techniques. Nature Reviews. Immunology. 11, 672-684 (2011).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. Journal of Structural Biology. 168, 152-160 (2009).
- Jambrina, E., et al. Calcium influx through receptor-operated channel induces mitochondria-triggered paraptotic cell death. The Journal of Biological Chemistry. 278, 14134-14145 (2003).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Current Protocols in Immunology. , 1 (2009).
- Herranz, G., et al. Protein Kinase C delta Regulates the Depletion of Actin at the Immunological Synapse Required for Polarized Exosome Secretion by T Cells. Frontiers in Immunology. 10, 851 (2019).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42, 864-876 (2015).
- Combs, C. A., Shroff, H. Fluorescence Microscopy: A Concise Guide to Current Imaging Methods. Current Protocols in Neuroscience. 79, (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır