Method Article
Preparazione di sistemi eutettoici profondi binari e ternari
In questo articolo
Riepilogo
Questo protocollo mira a standardizzare la preparazione di sistemi eutechici profondi in tutta la comunità scientifica in modo che questi sistemi possano essere riprodotti.
Abstract
La preparazione di sistemi eutechtici profondi (DES) è a priori una procedura semplice. Per definizione, due o più componenti vengono mescolati insieme a un dato rapporto molare per formare un DES. Tuttavia, dalla nostra esperienza in laboratorio, è necessario standardizzare la procedura per preparare, caratterizzare e riferire le metodologie seguite da diversi ricercatori, in modo che i risultati pubblicati possano essere riprodotti. In questo lavoro, testiamo diversi approcci riportati nella letteratura per preparare i sistemi eutetechi e valutato l'importanza dell'acqua nella preparazione di successo dei sistemi liquidi a temperatura ambiente. Questi sistemi eutettici pubblicati erano composti da acido citrico, glucosio, saccarosio, acido malico, alanineano, acido lartarico e betaina e non tutti i metodi di preparazione descritti potrebbero essere riprodotti. Tuttavia, in alcuni casi, è stato possibile riprodurre i sistemi descritti, con l'inclusione dell'acqua come terza componente della miscela eutetica.
Introduzione
I solventi eutechi profondi sono stati nominati solventi per il XXI secolo e sono considerati una nuova generazione di solventi. Essi sono definiti come una miscela di due o più composti chimici ad un particolare rapporto molare per provocare una diminuzione significativa della temperatura di fusione dei singoli componenti, diventando liquido alla temperatura ambiente1,2, 3. In questo senso, la preparazione dei solventi non richiede alcuna reazione chimica e quindi la resa produttiva è del 100%. Nel 2011, Choi e colleghi hanno riferito la possibilità di DES naturali e li hanno chiamati, solventi euteci naturali profondi (NADES)3,4,5. NADES può essere preparato da diverse combinazioni di zuccheri, aminoacidi, acidi organici e derivati della colina; e questi sistemi preparati da componenti naturali sono intrinsecamente biocompatibili e biodegradabili, presentando una tossicità notevolmente inferiore rispetto ad altri solventi alternativi (ad esempio, liquidi ionici)5,6, 7,8. Dal 2015 il numero di pubblicazioni nel settore è aumentato in modo esponenziale e le possibili applicazioni di NADES sono molto ampie3. Anche se molti manoscritti e recensioni sono stati pubblicati, ci sono domande fondamentali che persistono, e gli scienziati non hanno ancora trovato la risposta a domande intriganti come i meccanismi alla base della formazione del DES. Comprendere il meccanismo di formazione del DES porterebbe a un approccio consolidato verso lo sviluppo di nuovi sistemi, piuttosto che all'attuale approccio di prova ed errore. Inoltre, le opportunità nel settore stanno crescendo ogni giorno, man mano che i consumatori diventano più consapevoli della sostenibilità dei loro prodotti, non solo in termini di fine vita, ma anche in termini di lavorazione stessa8,9, 10. Per guidare importanti innovazioni nel campo dei solventi eutnici profondi, è necessaria la standardizzazione dei metodi di produzione e caratterizzazione. La mancanza di riproducibilità di alcuni dei sistemi riportati nella letteratura è stata la motivazione per sviluppare questo lavoro come abbiamo affrontato questo problema più volte. Qui, dimostriamo la necessità e l'importanza cruciale per descrivere con precisione i materiali e i metodi e dimostrare che, sebbene la preparazione del DES sia una procedura semplice e diretta, ci sono alcuni aspetti chiave (ad esempio, la presenza/quantità di acqua) che deve sempre essere discusso.
Protocollo
NOTA: I NADES studiati erano betaine:L-(')-acido tartarico (2:1), z-alanine:DL-malic acid (3:2), glucose:sucrose (1:1) e acido citrico:glucosio (2:1). Questi sistemi sono stati preparati con diversi metodi: liofilazione (FD), evaporazione sottovuoto (VE), e calore e agitazione (HS) con e senza acqua. Ad esempio, viene fornito il protocollo per il sistema citric acid:glucose (2:1). I NADES sono stati caratterizzati da calorimetria a scansione differenziale (DSC), microscopia ottica polarizzata (POM), contenuto d'acqua e spettroscopia a risonanza magnetica nucleare (NMR).
1. Preparazione NADES
- Asciugare congelare
- In contenitori separati, aggiungere 2 g di acido citrico monoidrato e 0.9530 g di glucosio monoidrato. Aggiungere 10 mL di acqua deionizzata a ciascuno e mescolare fino a quando i composti sono completamente sciolti.
- Mescolare le due soluzioni e garantire l'omogeneizzazione della soluzione finale. Posizionare la soluzione in una fiaschetta inferiore rotonda.
- Congelare utilizzando azoto liquido. Mettere il pallone in un congelatore per 48 h per assicurarsi che tutta l'acqua venga rimossa dal campione.
- Evaporazione sottovuoto
- Pesare 2 g di acido citrico monoidrato e 0.9530 g di glucosio monoidrato in contenitori separati. Aggiungere 10 mL di acqua deionizzata a ciascuno e mescolare fino a quando i composti sono completamente sciolti.
- Mescolare le due soluzioni e garantire l'omogeneizzazione della soluzione. Posizionare la soluzione in una fiaschetta inferiore rotonda.
- Utilizzando un evaporatore rotante, asciugare il campione fino a formare un liquido chiaro e viscoso.
- Riscaldamento e agitazione
- Pesare 2 g di acido citrico monoidrato e 0.9530 g di glucosio monoidrato nella stessa fiala. Aggiungere 278 l'acqua.
- Posizionare la fiala con una barra magnetica di agitazione in un bagno d'acqua di 50 gradi centigradi.
- Lasciare il campione fino a quando non si forma un liquido chiaro e viscoso.
2. Caratterizzazione NADES
- Microscopia ottica polarizzata (POM)
- Posizionare una goccia di NADES su un vetrino di vetro al microscopio per l'osservazione.
- Utilizzando la modalità di trasmissione di un microscopio, eseguire la caratterizzazione ottica del campione a temperatura ambiente.
- Titore di Karl-Fisher
- Raccogliere 100 L di NADES in una siringa, quindi pulire il liquido in eccesso all'esterno.
- Posizionare la siringa su una scala e tare.
- Premere START sull'apparecchiatura KF e aggiungere una piccola goccia del campione alla nave.
- Pesare la siringa, immettere la massa sull'apparecchiatura KF e premere INVIO. Il risultato apparirà sullo schermo in ppm d'acqua.
- Calorimetria di scansione differenziale (DSC)
- Mettere 3-10 mg di ogni campione in una padella di alluminio ermetica con un coperchio di copertura. Chiudere la padella con una pressa campione.
- Analizzare i campioni utilizzando un DSC con un intervallo di temperatura di -90 gradi fino alla temperatura di degradazione, con una velocità di riscaldamento di 10 gradi centigradi/min. Eseguire due cicli con una presa isotermica di 2 min e analizzare sotto un'atmosfera di azoto (50 mL/min).
- Risonanza magnetica nucleare (NMR)
- Preparare un tubo NMR da 5 mm sciogliendo 250 -L di NADES con 250 L di solforosa-d6 (DMSO-d6).
- Acquisire gli spettri da 1H e NOESY a 25 gradi centigradi su uno spettrometro a 400 MHz.
- Utilizzare un software appropriato per analizzare gli spettri e utilizzare lo spostamento chimico del DMSO-d6 (circa 2,50 ppm) per assegnare tutti i segnali di ciascun componente.
Risultati
Dalla preparazione di NADES, i risultati che ci aspettiamo di ottenere sono riportati nella Figura 1. Una descrizione di ogni sistema è fatta di seguito. Utilizzando il metodo di congelamento, il risultato dovrebbe essere un solido o una pasta molto densa poiché tutta l'acqua viene rimossa dal sistema. Utilizzando il metodo di evaporazione, il risultato dovrebbe essere un liquido chiaro e viscoso. Utilizzando il metodo di riscaldamento e agitazione con l'aggiunta di piccole quantità di acqua, il risultato dovrebbe essere un liquido chiaro e molto viscoso.
I risultati ottenuti da POM possono essere visti nella Figura 1. Quando un NADES è completamente formato, ci aspettiamo di vedere un'immagine nera, che indica che il campione è completamente amorfo e che non ci sono cristalli rimanenti nel sistema. I risultati ottenuti dalla titolazione KF sono descritti nella tabella 2. Oltre alla quantità di acqua che viene aggiunta ai sistemi, la percentuale di acqua della miscela finale dipende anche dal contenuto di acqua dei reagenti.
Per quanto riguarda il DSC, l'obiettivo di questa tecnica è anche quello di confermare che il sistema è liquido nell'intervallo di temperatura che verrà applicato, quindi il risultato atteso è quello di avere un termogramma che non mostra eventi termici sull'intervallo di temperatura di interesse(Tabella 2 ). La tecnica NMR viene utilizzata per confermare l'esistenza della formazione di legame di idrogeno, che è la caratteristica principale dei sistemi NADES. Ciò può essere confermato dall'osservazione del cambiamento negli spostamenti chimici di ogni segnale e dall'analisi degli spettri NOESY, che mostra correlazioni spaziali e intermolecolari (Figura 2).
| Componente 1 | Componente 2 | Metodo di preparazione | referenza |
| Betaina (Bet) | Acido tartarico L-()-Tartarico (LTA) | Evaporazione a vuoto (VE) | Dai et al. (2013)5 e Espino et al. (2016)6 |
| Alanineano | Acido DL-Malic (MA) | Evaporazione a vuoto (VE) | Dai et al. (2013)5 e Espino et al. (2016)6 |
| Glucosio (Gluc) | Sucrosi (Suc) | Liofonizzato (FD) | Choi et al. (2011)4 e Espino et al. (2016)6 |
| Acido citrico (CA) | Glucosio (Gluc) | Liofonizzato (FD) | Choi et al. (2011)4 e Espino et al. (2016)6 |
Tabella 1: I sistemi riportati in letteratura e il loro metodo di preparazione.
| NADI | Metodo di preparazione | Contenuto idrico (%) |
| Misura di Karl Fischer | ||
| Bet:LTA (2:1 : 20% di acqua) | Riscaldamento e agitazione, aggiunta di acqua | 19.94 - 1,28 |
| Scommessa:LTA (2:1) | Evaporazione a vuoto | 11,36 - 0,78 |
| A:MA (3:2 - 11% di acqua) | Riscaldamento e agitazione, aggiunta di acqua | 11.45 - 0,25 |
| -A:MA (3:2) | Evaporazione a vuoto | 18,84 x 1,78 |
| Gluc:Suc (1:1 - 21% di acqua) | Riscaldamento e agitazione, aggiunta di acqua | 20.88 - 0,13 |
| Gluc:Suc (1:1) | Evaporazione a vuoto | 22,56 - 0,48 |
| CA:Gluc (2:1 - 17% di acqua) | Riscaldamento e agitazione, aggiunta di acqua | 17,33 x 0,68 |
| CA:Gluc (2:1) | Evaporazione a vuoto | 20.04 - 0,26 |
Tabella 2: Contenuto idrico (%) dei sistemi preparati con metodi diversi.

Figura 1: Risultati rappresentativi del NADES quando preparati da a) congelare, b) evaporazione sottovuoto e c) riscaldamento e agitazione con aggiunta di acqua. L'immagine mostra che quando il sistema è liofilizzato, il risultato ottenuto è un cristallo poiché tutta l'acqua viene rimossa dalla miscela, mentre quando vengono utilizzati i metodi VE e HS, la quantità di acqua necessaria per la formazione del NADES e il risultato ottenuto è un hom liquido ogeno a temperatura ambiente. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: microscopia ottica polarizzata di CA:Glu (2:1) preparata con diversi metodi, con polarizzatori incrociati (immagine sinistra) e polarizzatori paralleli (immagine a destra) – 100 m (amplificazione 10x). Le immagini nere mostrano che il campione è un liquido a temperatura ambiente. Il campione di FD è completamente cristallizzato poiché il risultato ottenuto da questa tecnica non era un liquido. Fare clic qui per visualizzare una versione più grande di questa figura.
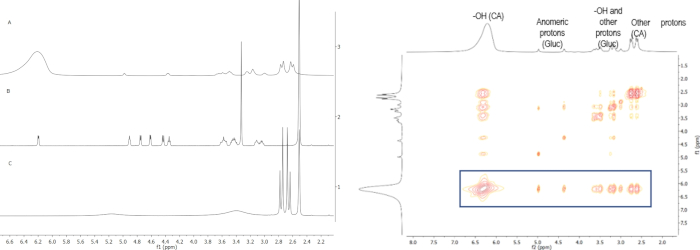
Figura 3: a) Sovrapposizione di 1H spettri NMR dell'acido citrico del sistema NADES (A) NADES: glucosio:acqua (2:1:4), (B) glucosio e (C) acido citrico; b) Spettro NOESY del sistema NADES acido citrico:glucose:acqua (2:1:4). Gli spettri sovrapposti mostrano la differenza negli spostamenti chimici di ogni componente alla formazione DES, originati dalla creazione di legami di idrogeno tra di loro. Lo spettro NOESY mostra l'interazione tra il protone OH dall'acido citrico con i protoni rimanenti di entrambi i componenti. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Le diverse metodologie riportate nella letteratura per la preparazione di NADES sono un metodo di riscaldamento e agitazione (HS), evaporazione sottovuoto (VE) e liofilizzazione (FD). I sistemi che abbiamo preparato in questo lavoro sono descritti da diversi autori nella letteratura4,5,6,10,11. La tabella 1 elenca i componenti di ogni miscela, come riportato nel manoscritto originale e il loro metodo di preparazione.
Dopo le nostre indagini per riprodurre i sistemi descritti, ci siamo resi conto che in alcuni casi non era possibile ottenere un NADES simile, come un campione liquido chiaro, viscoso e a temperatura ambiente. La preparazione di un NADES si basa su molti fattori. Alcuni possono essere facilmente controllati, ma altri sono più difficili da standardizzare. La cosa più importante da considerare è che il prodotto finale non può fare affidamento su fattori esterni come l'apparecchiatura utilizzata.
Sono stati poi caratterizzati i sistemi preparati con diversi metodi. Con la microscopia ottica polarizzata (POM), è stato osservato che con il metodo HS senza acqua, anche a temperature diverse, il NADES non formava un liquido chiaro e viscoso. Tuttavia, un liquido omogeneo e chiaro e viscoso è stato osservato come rappresentato nella Figura 1 quando si applica il metodo HS con piccole quantità di acqua e il metodo VE per la preparazione del NADES.
DSC è stato utilizzato per determinare gli eventi termici della miscela. I risultati hanno mostrato che il sistema è liquido a temperatura ambiente e fino a 130 gradi centigradi, poiché il termogramma non mostra eventi termici. Il contenuto idrico di ciascun campione è stato misurato dalla titolazione di Karl-Fischer e i risultati sono rappresentati nella tabella 2. Il contenuto d'acqua dei sistemi deve essere segnalato, poiché è il parametro che influenza maggiormente le proprietà del liquido ottenuto, come la viscosità e la polarità. Questi cambiamenti hanno un grande impatto sul risultato dell'applicazione per la quale è stato progettato il NADES.
NMR è stato utilizzato anche per confermare la formazione dei sistemi NADES menzionati, attraverso la formazione di legami di idrogeno tra le molecole di ciascun sistema. Un esempio è dato nella Figura 2 per il sistema NADES acido citrico:glucosio (2:1) con 17% di acqua ottenuta da HS dove lo spettro protonico di questo NADES e i materiali di partenza (acido citrico e glucosio) sono sovrapposti(Figura 2a). Da questo, è possibile osservare i cambiamenti negli spostamenti chimici di alcuni protoni da ogni molecola. Il cambiamento principale è lo spostamento del protone OH dall'acido citrico. Originariamente, questo segnale appare a 5,16 ppm, ma questo segnale si sposta a 6,22 ppm a causa della formazione di legami di idrogeno. Ciò è confermato dallo spettro NOESY (Figura 2b), dove è visibile la forte interazione tra l'OH dall'acido citrico e i protoni rimanenti. Un'interazione simile è stata osservata per gli altri sistemi NADES.
In questo studio abbiamo osservato che la descrizione del metodo di preparazione per i sistemi eutnici riportati nella letteratura a volte è incompleta, a causa della mancanza di informazioni riguardanti il contenuto di acqua della maggior parte dei sistemi. Nel metodo VE, l'acqua viene aggiunta preparando soluzioni di diversi componenti e mescolando ad una temperatura che porta alla formazione di sistemi eutnici; tuttavia, non possiamo essere sicuri del minimo contenuto di acqua richiesto. La conoscenza della percentuale di acqua necessaria per formare i sistemi è considerata da qui, un punto cruciale che dovrebbe essere sempre segnalato, per gli altri per essere in grado di riprodurre la preparazione delle diverse miscele euctettiche.
Il metodo migliore da utilizzare è il metodo HS con acqua aggiunta in quanto richiede meno tempo per la preparazione, per i casi in cui il contenuto di acqua è già descritto. Tuttavia, se queste informazioni non sono disponibili, il metodo più semplice è il metodo VE, in cui tutta l'acqua disponibile viene rimossa e solo l'acqua che interagisce con i componenti NADES rimane nel sistema. In ogni caso, i ricercatori dovrebbero lasciare che il sistema evaporaper il tempo sufficiente per garantire che l'acqua libera venga rimossa dal sistema. Questa tempistica dipende dall'apparecchiatura e quindi non è sufficiente descrivere nella sezione dei materiali la durata del metodo VE, ma il contenuto di acqua deve sempre essere segnalato.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo progetto ha ricevuto finanziamenti dal Consiglio europeo della ricerca (CER) nell'ambito del programma di ricerca e innovazione Orizzonte 2020 dell'Unione europea, nell'ambito dell'accordo di sovvenzione No ERC-2016-CoG 725034. Questo lavoro è stato sostenuto anche dal Associate Laboratory for Green Chemistry-LAQV, finanziato da fondi nazionali di FCT/MCTES (UID/QUI/50006/2019) e da FCT/MCTES attraverso il progetto CryoDES (PTDC/EQU-EQU/29851/2017).
Materiali
| Name | Company | Catalog Number | Comments |
| 5 mm NMR tube | Norell | ||
| Acid citric monohydrate | Sigma-Aldrich | ||
| Advance III spectrometer | Bruker | ||
| Deionized water | |||
| dimethyl sulfoxide-d6 | Sigma-Aldrich | ||
| DSC Q200 | TA Instruments, USA | ||
| Freeze-dryer CHRIST ALPHA 1-4 | Braun Biotec International | ||
| Glucose monohydrate | Cmd chemicals | ||
| Karl Fisher Coulometer | Metrohm | ||
| Olympus BX-51 polarized optical microscope | Olympus |
Riferimenti
- Paiva, A., et al. Natural deep eutectic solvents - solvents for the 21st century. ACS Sustainable Chemistry & Engineering. 2, 1063-1071 (2014).
- Abbott, A. P., Capper, G., Davies, D. L., Rasheed, R. K., Tambyrajah, V. Novel solvent properties of choline chloride/urea mixtures. Chemical Communications. , 70-71 (2003).
- Liu, Y., et al. Natural deep eutectic solvents: properties, applications, and perspectives. Journal of Natural Products. 81, 679-690 (2018).
- Choi, Y. H., et al. Are natural deep eutectic solvents the missing link in understanding cellular metabolism and physiology. Plant Physiology. 156, 1701-1705 (2011).
- Dai, Y., Spromsen, J. V., Witkamp, G. -. J., Verpoorte, R., Choi, Y. H. Natural deep eutectic solvents as new potential media for green technology. Analytica Chimica Acta. 766, 61-68 (2013).
- Espino, M., Fernández, M. A., Gomez, F. J. V., Silva, M. F. Natural designer solvents for greening analytical chemistry. Trends in Analytical Chemistry. 76, 126-136 (2016).
- Hayyan, M., et al. Natural deep eutectic solvents: cytotoxic profile. Springer Plus. 5, 913 (2016).
- Dai, Y., Witkamp, G. -. J., Verpoorte, R., Choi, Y. H. Tailoring properties of natural deep eutectic solvents with water to facilitate their applications. Food Chemistry. 187, 14-19 (2015).
- Choi, Y. H., Verpoorte, R. Green solvents for the extraction of bioactive compounds from natural products using ionic liquids and deep eutectic solvents. Current Opinion in Food Science. 26, 87-93 (2019).
- Guitérrez, M. C., Ferrer, M. L., Mateo, C. R., Del Monte, F. Freeze-drying of aqueous solutions of deep eutectic solvents: a suitable approach to deep eutectic suspensions of self-assembled structures. Langmuir. 25, 5509-5515 (2009).
- Gomez, F. J. V., Espino, M., Fernández, M. A., Silva, M. F. A greener approach to prepare natural deep eutectic solvents. Chemistry Select. 3, 6122-6125 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon